电泳相关buffer配置
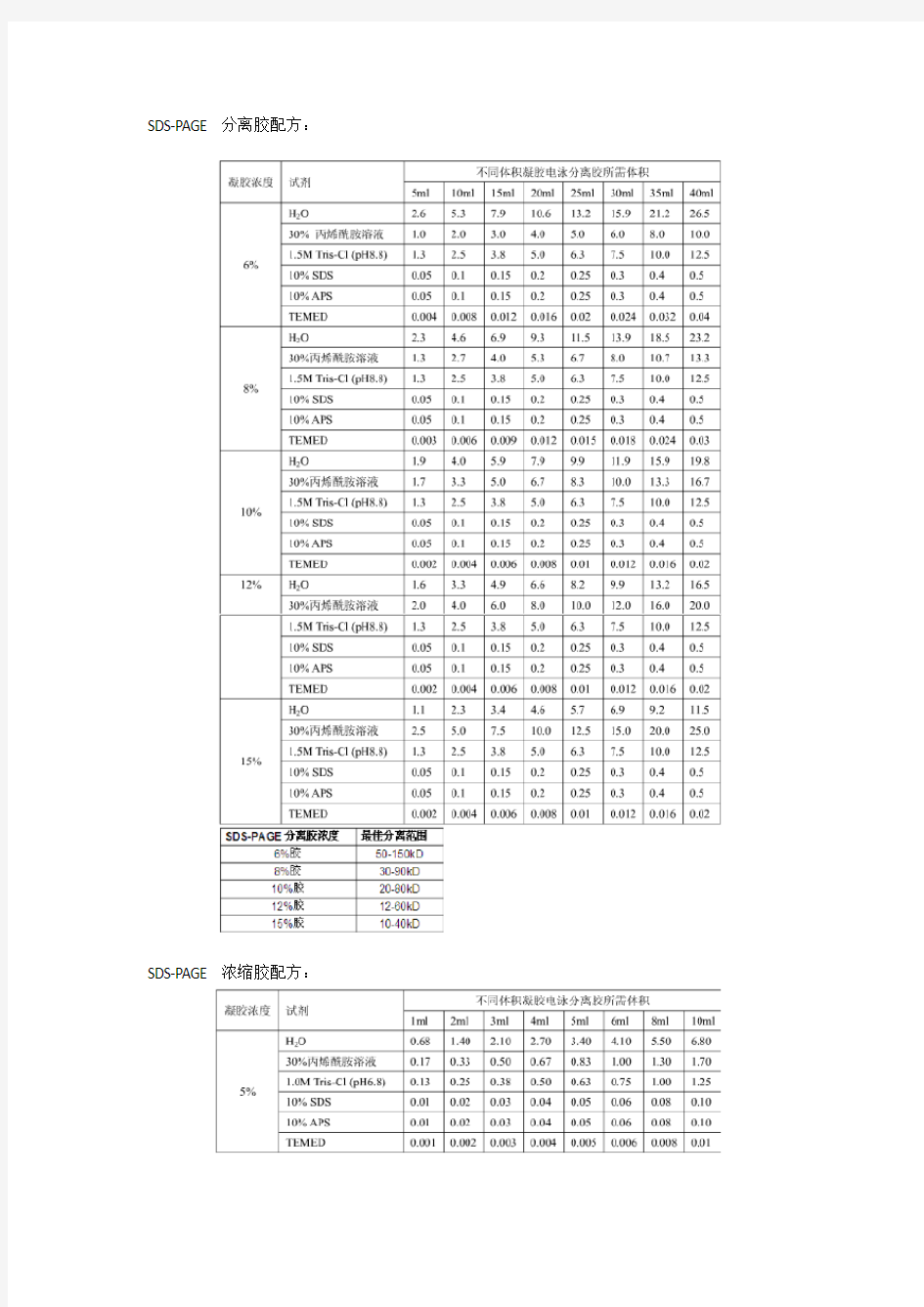

SDS-PAGE 分离胶配方:
SDS-PAGE 浓缩胶配方:
5×Running buffer(SDS-PAGE)配制方法:
125mM Tris
1.25M 甘氨酸
0.5%(w/v)SDS十二烷基磺酸钠
5×SDS-PAGE Loading Buffer配制方法:
250mM Tris-HCl(pH6.8)
10%(W/V) SDS
0.5%(W/V)溴酚兰
50%(V/V)甘油
100mM DTT 二硫苏糖醇
2×SDS-PAGE Loading Buffer配制方法
100mM Tris-HCl(pH6.8)
5% SDS
20%甘油
40mM DTT 二硫苏糖醇
0.2% 溴酚兰
SDS-PAGE染色液配制方法:
25%乙醇, 0.15%考马斯亮蓝R-250,10%醋酸, 剩余加水。SDS-PAGE脱色液配制方法:
25%乙醇,10%醋酸,剩余加水。
30%丙烯酰胺配置方法
配方[1]
丙烯酰胺(Acr)[2]290g
甲叉双丙烯酰胺(Bic)[3]10g
超纯水至1000ml
配置步骤
●取所需体积的DDW于水浴锅或沸水中预热(水温不低于37℃)
●称取所需的丙烯酰胺和甲叉双丙烯酰胺,加入预热的DDW定容至所需体积,
玻璃棒搅拌使其完全溶解
●将上述溶液用定性滤纸过滤,滤后可分装入瓶,4℃保存
注意事项
?丙烯酰胺为有毒化学物,配置时应小心操作,进行必要的防护。操作时应穿
专用实验服,佩戴两层口罩及手套;称量时小心操作,避免试剂粉末飞溅;操
作桌面铺报纸,尽量避免丙烯酰胺接触实验室常用仪器;配置器皿为专用器皿,
不得混用;接触过丙烯酰胺的手套等物品应及时清理,不得污染实验室其他设
施。
?过滤时应勤换滤纸,否则可导致过滤速度缓慢。
?溶液配制完成后,应标记溶液名称(组成)、配制日期、配制人、贮存条件等
必要信息。
?配置好的丙烯酰胺可于4℃长期保存,使用时恢复至室温且无沉淀,若出现沉
淀应及时更换。
注:
[1]试剂位于213天平下方试剂柜中,试剂剩余不多时应及时告知唐老师购买
[2]丙烯酰胺(Acrylamide)
[3] 甲叉双丙烯酰胺,又称亚甲基双丙烯酰胺(Bis-acrylamide)
生物实验常用缓冲液和酶的配制
实验室常用技术参数资料 一、核酸及蛋白质常用数据 1.核苷三磷酸的物理常数 2.常用核酸的长度与分子量
3.常用核酸蛋白换算数据(1)重量换算 1μg=10-6g1pg=10-12g 1ng=10-9g 1fg=10-15g (2)分光光度换算: 1A260双链DNA=50μg/ml 1A260单链DNA=30μg/ml 1A260单链RNA=40μg/ml (3)DNA摩尔换算: 1μg 100bp DNA=1.52pmol=3.03pmol末端 1μg pBR322 DNA=0.36pmol 1pmol 1000bp DNA=0.66μg 1pmol pBR322=2.8μg 1kb双链DNA(钠盐)=6.6×105道尔顿 1kb单链DNA(钠盐)=3.3×105道尔顿 1kb单链RNA(钠盐)=3.4×105道尔顿 (4)蛋白摩尔换算: 100pmol分子量100,000蛋白质=10μg 100pmol分子量50,000蛋白质=5μg
100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿 (5)蛋白质/DNA换算: 1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质 10,000MW蛋白质=270bp DNA 30,000MW蛋白质=810bp DNA 50,000MW蛋白质=1.35kb 100,000MW蛋白质=2.7kb DNA 4.常用蛋白质分子量标准参照物
5.常用DNA分子量标准参照物 续上表
二、常用缓冲液 1.分子克隆常用缓冲液 2.磷酸缓冲液 (1)25℃下0.1mol/L磷酸钾缓冲液的配制※
SDS-PAGE电泳标准操作流程
SDS-PAG电泳标准操作规程(网上) 3. 程序: 端平齐。放于制胶架上夹紧,下端紧贴密封条。 3.1.2分离胶的配置 3.122 灌胶混匀后用移液枪将凝胶溶液沿玻棒小心注入到长、短玻璃板间的狭缝内(胶高度距样品模板 梳齿下缘约1cm)。 3.1 . 2.3液封在凝胶表面沿短玻板边缘轻轻加一层水以隔绝空气,使胶面平整。静置约30min观察胶面 变化,当看到水与凝固的胶面有折射率不同的界限时,表明胶已完全凝固,倒掉上层水,并用滤纸 吸干残留的水液。 3.1.3浓缩胶的配置 混匀后用移液枪将凝胶溶液注入到长、短玻璃板间的狭缝内(分离胶上方),轻轻加入样品模板梳,小心避免气泡的出现。约30分钟,聚合完全。 3.2.1安装电泳槽将制备好的凝胶板取下,小心拔下梳子。两块10%勺凝胶板分别插到U形橡胶框的两边凹 形槽中,可往上提起使凝胶板紧贴橡胶。将装好玻璃板的胶模框平放在仰放的贮槽框上,其下缘与 贮槽框下缘对齐,放入电泳槽内。倒入1X tris-gly 电泳缓冲液。 3.2.2 样品处理对于蛋白样品直接取80 pl的样品,依次加上20Q 5x buffer (加了B-巯基乙醇),混匀。 对于菌体或组织等固体样品,取少量样品加100ul 2x buffer (加了B-巯基乙醇)煮沸10分钟。 3.2.3 加样用移液枪取处理过的样品溶液10 p l,小心地依次加入到各凝胶凹形样品槽内,marker加 入到其中一个槽内,为区别两块板,marker可加在不同的孔槽中。 3.2.4电泳将电泳槽放置电泳仪上,接通电源,正负极对好。电压调至约150v保持恒压。待溴酚蓝标记移 动到凝胶底部时,关电源,把电泳缓冲液倒回瓶中。 3.2.5剥离胶把电泳槽取出,两块板拿下来,用刮片从长短玻片中间翘起,再把浓缩胶刮掉,取下。 3.3. 染色放于加有R250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时, 完成后染液倒掉并用水洗掉染液。 3.4. 脱色取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45r/min,时间 约1小时,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。 3.5. 拍照将脱色后的胶置于透明文件夹中,把胶上面的气泡赶出(用前也可用酒精棉球擦干净文件夹),放到 扫描仪上,拍照。 4. 注意事项 4.1 根据目的蛋白的大小选择合适的胶片浓度。一般为100KD-50KD选用10%交;50KD-30KD选用12%胶; 30KD-10KD选用15%交。4.2 要根据样品浓度来加样品溶解液。每加一个样品后换一支吸头或清洗吸头后再点另一个样品。4.3 制备聚丙烯酰胺凝胶时,倒胶后常漏出胶液,那是因为二块玻璃板与塑料条之间没封紧,留有空隙,所以这步要特别留心操作.4.4 电泳完毕撬板取凝胶时要小心细致不能把胶弄破。 4.5 电泳缓冲液可重复利用,如果胶上出现不正常痕迹,就要及时更换新液。 4.6 分离胶高度控制得当,确保 有大约1cm左右的浓缩胶空间。过长或过短均不能得到理想的电泳结果。 4.7 电泳染色液注意进行回收再利用, 一般可重复使用2-3次。4.8 AP和TEMED是催化剂,加入的量要合适,过少则凝胶聚合很慢甚至不聚合,过多则聚合过
SDSPAGE电泳试剂配制
SDS-PAGE电泳试剂 1) 30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲基双丙烯酰(Bis)1.0g,混匀后加ddH 2 O, 37O C溶解,定容至100 mL,棕色瓶存于4O C; 2) 1.5M Tris-HCl(pH 8.8):Tris 18.17g加ddH 2 O溶解,浓盐酸调pH至8.0,定容至100mL; 3) 1M Tris-HCl(pH 6.8):Tris 12.11g加ddH 2 O溶解,浓盐酸调pH至6.8,定容至100 mL; 4) 4?分离胶缓冲液: 0.4gSDS溶于1.5M Tris-HCl(pH 8.8),定容至100mL; 5) 4?浓缩胶缓冲液: 0.4gSDS溶于1M Tris-HCl(pH 6.8),定容至100mL; 6) 10?电泳缓冲液(pH 8.3): Tris 3.029g,甘氨酸14.415g,SDS 1g加ddH 2 O溶解,定容至100mL; 7) 10%过硫酸铵(Aps,现配):1g AP加ddH 2 O至10mL; 8) 2?SDS电泳上样缓冲液:1M Tris-HCl(pH 6.8)2.5mL,?-巯基乙醇1.0mL,SDS 0.6g, 甘油2.0 mL,0.1%溴酚兰 1.0 mL,ddH 2 O 3.5mL; 9) 考马斯亮兰染色液:考马斯亮兰R 2501.25g,甲醇225 mL,冰醋酸50 mL,ddH 2 O 225mL; 10) 脱色液: 甲醇、冰醋酸、ddH 2 O以2∶1∶7配制而成; 11) 分离胶(12.5%): ddH 2 O 4mL,30%储备胶5 mL, 4?分离胶缓冲液3mL, 10% Aps 0.1mL(现配),TEMED(N,N,N’,N’-四甲基乙二胺)10μL; 12) 浓缩胶(5%):ddH 2 O 2.65mL,30%储备胶0.85mL,4?浓缩胶缓冲液1.25mL, 10%Aps 50μL,TEMED 5μL。 Tricine(三羟甲基氨基甘氨酸)- SDS - PAGE蛋白质电泳 1 Tricine - SDS - PAGE蛋白质电泳溶液准备
5.缓冲液离子强度对电泳速度的影响
缓冲液离子强度对电泳速度的影响 目标:⒈阐述电泳的基本原理及注意事项。 ⒉初步掌握电泳技术(以血清蛋白醋酸纤维薄膜电泳为例)。 ⒊观察并比较不同缓冲液离子强度对电泳速度的影响。 实验用品:电泳仪,电泳槽,醋酸纤维薄膜(2×8cm),点样器(X胶片),滤纸,无齿小镊子,pH8.6(I0.06和0.03)的巴比妥缓冲液等。 试剂:1、I0.06pH8.6的巴比妥缓冲液: 巴比妥钠12.76g 巴比妥 1.66g 蒸馏水1000ml 2、I0.03pH8.6的巴比妥缓冲液: 巴比妥钠 6.38 巴比妥0.83 蒸馏水1000ml 或用I0.06pH8.6的巴比妥缓冲液加蒸馏水稀释一倍即成。 3、氨基黑10B染色液: 氨基黑10B0.5g 冰醋酸10ml 乙醇50ml 蒸馏水40ml 4、漂洗液: 乙醇45ml 冰醋酸 5.0ml 蒸馏水50ml 实验原理: 由于血清中各种蛋白质等电点(pI)不同,所以在同一PH8.6缓冲液中电离程度不同,因而带电荷的多少不同。再则不同蛋白质其分子大小、形状等差异,把它放入同一电场中其电泳的迁移率(是指带电颗粒在单位电场强度下的电泳速度)不同而分离。蛋白质分子大而带电荷少的移动速度慢,如此将血清蛋白从正极到负极依次分为A、α1、α2、β、γ五个区带,经染色、漂洗、脱色,然后计算各蛋白质区带的迁移率,得出电泳缓冲液离子强度对电泳速度是如何影响的。 操作步骤: 1.一般电泳装置:示教 2.电泳操作: ①酸纤维薄膜的准备:在距一端1.5cm处用铅笔画一条细线,然后浸泡于I0.06PH8.6的巴比
妥缓冲液或I0.03PH8.6的巴比妥缓冲液中约20min。 ②取出,用滤纸吸走多余的缓冲液。 ③用点样器蘸取血样点于薄膜上。 ④将点好样的薄膜置于电泳槽上,点样面朝下,点样端置电场中的负极。 ⑤电泳:电压110~160V、时间35~40分钟。 ⑥染色:氨基黑10B或丽春红S染液染色2~3分钟。 ⑦漂洗:3~4次,背景变白,图象清晰。 结果观察与分析: 1.比较用I=0.03和I=0.06的缓冲液进行电泳时的结果,观察图形,判断用哪种离子强度好。 2.利用所记录的电泳电压(V),支持物有效长度(CM),电泳时间(S)和清蛋白移动距离(CM),分别计算用离子强度0.03和0.06的清蛋白迁移率,判断离子强度对电泳速度的影响。 ※迁移率(μ)是指带电颗粒在单位电场强度下的电泳速度(V)。 即:μ=V/E,∵V=d/t (cm/S)(t—时间d—移动距离cm) E=U/L(V/cm) (U—电压L—支持物有效长度) ∴μ=V/E=(d/t)/(U/L)=dL/Ut (cm2/vs) 结论:
SDS-PAGE凝胶配制试剂盒
SDS-PAGE 凝胶配制试剂盒 简介: 聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis , SDS-PAGE),其原理在于聚丙烯酰胺凝胶为网状结构,具有分子筛效应。它有两种形式:非变性聚丙烯酰胺凝胶及SDS-聚丙烯酰胺凝胶(SDS-PAGE);非变性聚丙烯酰胺凝胶,在电泳的过程中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开,主要用于分离蛋白质和寡核苷酸。 SDS-PAGE 凝胶配制试剂盒不仅可用于配制SDS-PAGE 凝胶,也可配制非变性(native)PAGE 凝胶,具体配制的量应根据器具大小决定。 组成: 操作步骤(仅供参考): 1、 配制10%过硫酸铵:直接在Ammonium Persulfate 中加入蒸馏水,充分溶解,分装 成小份储存于-20℃或4℃。注意:一般用1.5mlEP 管分装成0.5-1ml 每支,-20℃保存,每支使用2-3次即弃用。短期使用时,可保存于4℃,1周有效。 2、 根据目的蛋白分子量大小选择合适的凝胶浓度,按照下表配制分离胶(下层胶): 不同浓度的SDS-PAGE 分离胶的最佳分离范围: SDS-PAGE 分离胶浓度 最佳分离范围 6%胶 50-150kD 8%胶 30-90kD 10%胶 20-80kD 12%胶 12-60kD 15%胶 10-40kD 成分 配制不同体积SDS-PAGE 分离胶所需各成分的体积(ml) 编号 名称 PE0018 30T Storage 试剂(A): 30% Acr-Bis(29:1) 100ml 4℃ 避光 试剂(B): 1.5M Tris-HCl(pH8.8) 100ml RT 试剂(C): 10% SDS 5ml RT 试剂(D): Ammonium Persulfate 0.5g RT 试剂(E): TEMED 2×1ml 4℃ 避光 使用说明书 1份
常见缓冲液的配方
一.常用贮液与溶液 1mol/L亚精胺(Spermidine): 溶解2.55g亚精胺于足量的水中,使终体积为10ml。分装成小份贮存于-20℃。 1mol/L精胺(Spermine):溶解3.48g精胺于足量的水中,使终体积为10ml。分装成小份贮存于-20℃。 10mol/L乙酸胺(ammonium acetate):将77.1g乙酸胺溶解于水中,加水定容至1L后,用0.22um孔径的滤膜过滤除菌。 10mg/ml牛血清蛋白(BSA):加100mg的牛血清蛋白(组分V或分子生物学试剂级,无DNA酶)于9.5ml水中(为减少变性, 须将蛋白加入水中,而不是将水加入蛋白),盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。不要涡旋混合。加水定容到10ml,然后分装成小份贮存于-20℃。 1mol/L二硫苏糖醇(DTT):在二硫苏糖醇5g的原装瓶中加32.4ml水,分成小份贮存于-20℃。或转移100mg的二硫苏糖醇至微量离心管,加0.65ml的水配制成1mol/L二硫苏糖醇溶液。 8mol/L乙酸钾(potassium acetate):溶解78.5g乙酸钾于足量的水中,加水定容到100ml。 1mol/L氯化钾(KCl):溶解7.46g氯化钾于足量的水中,加水定容到100ml。3mol/L乙酸钠(sodium acetate):溶解40.8g的三水乙酸钠于约90ml水中,用冰乙酸调溶液的pH至5.2,再加水定容到100ml。 0.5mol/L EDTA:配制等摩尔的Na2EDTA和NaOH溶液(0.5mol/L),混合后形成EDTA的三钠盐。或称取186.1g的Na2EDTA?2H2O和20g的NaOH,
SDS-PAGE试剂配方
SDS-PAGE电泳所用溶液: 30 %聚丙烯酰胺溶液(100 mL) 丙烯酰胺(Arc) 29 g N,N’-亚甲双丙烯酰胺(Bis) 1 g 用双蒸水定容至100mL,过滤备用,4℃存放 丙稀酰胺29.2g,N-N-甲叉双丙稀酰胺0.8g,加入去离子水定容至100mL,pH值不能超过7.0,过滤于棕色玻璃瓶中4℃贮存。 5×Tris-甘氨酸缓冲液(1 L) Tris碱15.1 g 甘氨酸(电泳级) 94 g 10 %SDS 50 mL 使用时稀释5倍使用 2×SDS凝胶加样缓冲液(10mL) 0.5 mol/L Tris-Cl (pH 6.8) 2 mL 10%(W/V)SDS 4 mL 甘油 2 mL β-巯基乙醇 1.0 mL (DTT(二硫苏糖醇)0.31g) 溴酚兰0.02g 双蒸水0.5 mL 室温存放备用 考马斯亮蓝染色液 考马斯亮蓝R-250 (G-250) 1.0 g 甲醇450 mL 冰醋酸100 mL ddH2O 450 mL 0.2g考马斯亮蓝R250+84mL 95%乙醇+20mL冰醋酸,定容至200mL,过滤备用 考马斯亮蓝脱色液(甲醇脱色液效果好,但有毒性) 甲醇100 mL 冰醋酸100 mL ddH2O 800 mL 医用酒精:冰醋酸:水=4.5:0.5:5(V:V:V)
SDS-PAGE所需溶液: A液——30%丙稀酰胺(W/V):丙稀酰胺29.2g,N-N-甲叉双丙稀酰胺0.8g,加入去离子水定容至100mL,pH值不能超过7.0,过滤于棕色玻璃瓶中4℃贮存。 B液——1.5mol/L Tris·HCl,pH8.8:18.17g(9.09g)Tirs碱,溶于80mL(40mL)去离子水中,加入约 3mL(1.5mL)以上的浓盐酸调节pH值至8.8,定容至100mL(50mL)。 C液——1.5mol/L Tris·HCl,pH6.8:12.1g(6.05g)Tirs碱,溶于80mL(40mL)去离子水中,加入约7mL(3.5mL)以上的浓盐酸调节pH值至6.8,定容至100mL(50mL)。 D液——10%SDS:10g (2g)SDS溶于去离子水中,定容至100mL(20mL),加热至68℃助溶。 E液——10%过硫酸铵:5g(0.5g)过硫酸铵,溶于50mL(5mL)去离子水中;现配现用或分装至0.5mL离心管中冷冻备用。 F液——TEMED(N-N-N`-N`-四甲基乙二胺)原液,室温保存。
生物化学常用缓冲液
生物化学常用缓冲液 (一)基本概念 ⑴ Bronsted-Lowry酸碱理论(酸碱质子理论): 1923年由丹麦化学家J.N.Brφnsted和英国化学家T.M.Lowry同时提出了酸碱质子学说,认为凡能释放质子的分子或离子(如:H2O,HCl,NH4+,HSO4- 等)称为酸,凡能接受质子的分子或离子(如:H2O,NH3,Cl-等)称为碱。因此,一种酸释放质子后即成为碱,称为该酸的共轭碱,同样一种碱与质子结合后,形成对应的酸,称为该碱的共轭酸。 如盐酸在水中的解离: HCl Cl- +H+ HCl是酸,Cl-是它的共轭碱。 pH = pKa+log{[质子受体]/[质子供体]} ⑵缓冲体系的设计: 1960年,N.E.Good和他的同事们提出,适合生命科学研究使用的缓冲体系应具有以下特性: ① pKa值在6-8之间; ②在水中的溶解度高; ③不易穿透生物膜; ④盐效应小; ⑤离子浓度、溶液组成和温度对解离的影响小; ⑥不与金属离子生成复合物或沉淀; ⑦该缓冲剂化学稳定; ⑧紫外和可见光波长范围内光吸收小; ⑨易制得高纯度的盐。 (二)生物化学常用缓冲液 ⑴磷酸盐缓冲液: 磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级
解离,有二个pKa值,所以用它们配制的缓冲液,pH范围最宽: NaH2PO4: pKa1=2.12, pKa2=7.21 Na2HPO4: pKa1=7.21, pKa2=12.32 配酸性缓冲液:用NaH2PO4,pH=1-4, 配中性缓冲液:用混合的两种磷酸盐,pH=6-8, 配碱性缓冲液:用Na2HPO4,pH=10-12。 用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。 磷酸盐缓冲液的优点为: ①容易配制成各种浓度的缓冲液; ②适用的pH范围宽; ③pH受温度的影响小; ④缓冲液稀释后pH变化小,如稀释十倍后pH的变化小于0.1。 其缺点为: ①易与常见的钙Ca++离子、镁Mg++离子以及重金属离子缔合生成沉淀; ②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。 ⑵ Tris(三羟甲基氨基甲烷)缓冲液: Tris缓冲液在生物化学研究中使用的越来越多,有超过磷酸盐缓冲液的趋势,如在SDS-聚丙烯酰胺凝胶电泳中已都使用Tris缓冲液,而很少再用磷酸盐。 Tris缓冲液的常用有效pH范围是在“中性”范围,例如: Tris-HCl缓冲液: pH=7.5-8.5 Tris-磷酸盐缓冲液: pH=5.0-9.0 Tris-HCl缓冲液的优点是: ①因为Tris的碱性较强,所以可以只用这一种缓冲体系配制pH范围由
SDSPE电泳试剂配制
S D S P E电泳试剂配制集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
SDS-PAGE电泳试剂 1) 30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲基双丙烯酰(Bis)1.0g,混匀 O,37O C溶解,定容至100 mL,棕色瓶存于4O C; 后加ddH 2 O溶解,浓盐酸调pH至,定容至 2) 1.5M Tris-HCl(pH :Tris 18.17g加ddH 2 100mL; O溶解,浓盐酸调pH至,定容至100 3) 1M Tris-HCl(pH :Tris 12.11g加ddH 2 mL; 4) 4分离胶缓冲液:溶于1.5M Tris-HCl(pH ,定容至100mL; 5) 4浓缩胶缓冲液:溶于1M Tris-HCl(pH ,定容至100mL; O溶解, 6) 10电泳缓冲液(pH : Tris 3.029g,甘氨酸14.415g,SDS 1g加ddH 2 定容至100mL; O至10mL; 7) 10%过硫酸铵(Aps,现配):1g AP加ddH 2 8) 2SDS电泳上样缓冲液:1M Tris-HCl(pH ,-巯基乙醇,SDS 0.6g,甘油mL,%溴酚兰 mL,ddH O ; 2 1.25g,甲醇225 mL,冰醋酸50 mL,9) 考马斯亮兰染色液:考马斯亮兰R 250 ddH O 225mL; 2 O以2∶1∶7配制而成; 10) 脱色液: 甲醇、冰醋酸、ddH 2 11) 分离胶%): ddH O 4mL,30%储备胶5 mL, 4分离胶缓冲液3mL, 10% Aps 2 (现配),TEMED(N,N,N’,N’-四甲基乙二胺)10μL; O ,30%储备胶,4浓缩胶缓冲液, 10%Aps 50μL,12) 浓缩胶(5%):ddH 2 TEMED 5μL。 Tricine(三羟甲基氨基甘氨酸)- SDS - PAGE蛋白质电泳 1 Tricine - SDS - PAGE蛋白质电泳溶液准备
DNA电泳相关试剂及缓冲液的配制
DNA 电泳相关试剂及缓冲液的配制
1. 0.5M EDTA(pH=8.0):在800ml 蒸馏水中加入186.1g 二水乙二胺四乙酸钠(EDTA-Na 2·2H 2O),充分搅拌,这时溶液为乳白色,加NaOH 调解pH 值至8.0,这时溶液颜色逐渐变为澄清。最后 定容至1L 。高压灭菌。 2. 5 X TBE:Tris 碱54g;硼酸27.5g;20ml0.5M EDTA(pH=8.0),加蒸馏水定容至1L 。高压灭菌。(不过我在实验中没有灭菌,实验结果影响不大)。1 X TBE:5 X TBE 缓冲液与蒸馏水按 1: 4 稀释就OK 。 配置方法方法1:1%的溴酚蓝 将托盘天平上称取1g 溴酚蓝定溶于100ml 无水乙醇中,转移入 滴瓶中,贴标签备用。 方法2:0.05% 的溴酚蓝 配western blot 用的2*SDS 上样缓冲液需要用到0.1% 的溴酚蓝,
2-DE中溴酚蓝一般也是配成0.1%母液。实际上,溴酚蓝在水中的溶解度不高,直接将0.1g溴酚蓝溶于100ml水是有困难的。下面是其较合适的配制方法: 0.05%的溴酚蓝配制方法:取溴酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.0ml使溶解,再加水稀释至200ml,即得。变色范围pH2.8~4.6(黄→蓝绿)。只是不知道加入NaOH会不会影响2-DE实验。估计影响不大,因为指示剂用量毕竟很少。 方法3:1%溴酚蓝 加1g水溶性钠型溴酚蓝于100ml水中,搅拌或涡旋混合直到完全溶解。溴酚蓝其钠盐易溶解在水里。 相关词条 甲醇、乙醇、苯、有机化学、氢氧化钠 Western上样缓冲液配制整理
SDS-PAGE电泳实验步骤
垂直板聚丙烯酰胺凝胶电泳分离蛋白质 一、实验目的 学习SDS-聚丙烯酰胺凝胶电泳法(SDS—PAGE)测定蛋白质的分子量的原理和基本操作技术。 二、实验原理 蛋白质是两性电解质,在一定的pH条件下解离而带电荷。当溶液的pH大于蛋白质的等电点(pI)时,蛋白质本身带负电,在电场中将向正极移动;当溶液的pH小于蛋白质的等电点时,蛋白质带正电,在电场中将向负极移动;蛋白质在特定电场中移动的速度取决于其本身所带的净电荷的多少、蛋白质颗粒的大小和分子形状、电场强度等。 聚丙烯酰胺凝胶是由一定量的丙烯酰胺和双丙烯酰胺聚合而成的三维网状孔结构。本实验采用不连续凝胶系统,调整双丙烯酰胺用量的多少,可制成不同孔径的两层凝胶;这样,当含有不同分子量的蛋白质溶液通过这两层凝胶时,受阻滞的程度不同而表现出不同的迁移率。由于上层胶的孔径较大,不同大小的蛋白质分子在通过大孔胶时,受到的阻滞基本相同,因此以相同的速率移动;当进入小孔胶时,分子量大的蛋白质移动速度减慢,因而在两层凝胶的界面处,样品被压缩成很窄的区带。这就是常说的浓缩效应和分子筛效应。同时,在制备上层胶(浓缩胶)和下层胶(分离胶)时,采用两种缓冲体系;上层胶pH=6.7—6.8,下层胶pH=8.9;Tris —HCI缓冲液中的Tris用于维持溶液的电中性及pH,是缓冲配对离子;CI-是前导离子。在pH6.8时,缓冲液中的Gly-为尾随离子,而在pH=8.9时,Gly的解离度增加;这样浓缩胶和分离胶之间pH的不连续性,控制了慢离子的解离度,进而达到控制其有效迁移率之目的。不同蛋白质具有不同的等电点,在进入分离胶后,各种蛋白质由于所带的静电荷不同,而有不同的迁移率。由于在聚丙烯酰胺凝胶电泳中存在的浓缩效应,分子筛效应及电荷效应,使不同的蛋白质在同一电场中达到有效的分离。 如果在聚丙烯酰胺凝胶中加入一定浓度的十二烷基硫酸钠(SDS),由于SDS带有大量的负电荷,且这种阴离子表面活性剂能使蛋白质变性,特别是在强还原剂如巯基乙醇存在下,蛋白质分子内的二硫键被还原,肽链完全伸展,使蛋白质分子与SDS充分结合,形成带负电性的蛋白质—SDS复合物;此时,蛋白质分子上所带的负电荷量远远超过蛋白质分子原有的电荷量,掩盖了不同蛋白质间所带电荷上的差异。蛋白质分子量愈小,在电场中移动得愈快;反之,愈慢。蛋白质的分子量与电泳迁移率之间的关系是: M r =K(10-b·m) logM r =LogK—b·R m , 式中M r ——蛋白质的分子量; logK——截距; b——斜率; R m ——相对迁移率。 实验证明,蛋白质分子量在15,000—200,000的范围内,电泳迁移率与分子量
缓冲液的配制方法
核酸电泳相关试剂、缓冲液的配制方法 50×TAE Buffer (pH8.5) 组份浓度 2 M Tris-醋酸,100 mM EDTA 配制量 1 L 配制方法 3.加入57.1 ml的乙酸,充分搅拌。 4.加去离子水将溶液定容至l L后,室温保存。 10×TBE Buffer (pH8.3) 组份浓度 890 mM Tris-硼酸,20 mM EDTA 配制量 1 L 配制方法 3.加去离子水将溶液定容至l L后,室温保存。 10×MOPS(3-吗啉基丙磺酸)Buffer 组份浓度 200 rnM MOPS,20 mM NaOAc,10 mM EDTA 配制量 1 L 配制方法 1.称41.8 g MOPS,置于1 L烧杯中。 2.加约700 ml DEPC处理水,搅拌溶解。 3.使用2 N NaOH调节pH值至7.0。 6.用0.45 m滤膜过滤除去杂质。 7.室温避光保存。 注:溶液见光或高温灭菌后会变黄。变黄时也可使用,但变黑时不要使用。 溴乙锭 (10 mg/ml) 组份浓度 10 mg/ml溴乙锭 配制量 100 ml 配制方法 1.称量1 g溴乙锭,加入到100 ml容器中。 2.加入去离子水100 ml,充分搅拌数h完全溶解溴乙锭。 3.将溶液转移至棕色瓶中,室温避光保存。 4.溴乙锭的工作浓度为0.5 g/ml。
注意:溴乙锭是一种致癌物质,必须小心操作。 Agarose凝胶 配制方法 1.配制适量的电泳及制胶用的缓冲液(通常是0.5×TBE或1×TAE)。 2.根椐制胶量及凝胶浓度,准确称量琼脂糖粉,加入适当的锥形瓶中。 3.加入一定量的电泳缓冲液(总液体量不宜超过锥形瓶的50%容量)。 注:用于电泳的缓冲液和用于制胶的缓冲液必须统一。 4.在锥形瓶的瓶封上保鲜膜,并在膜上扎些小孔,然后在微波炉中 加热熔化琼脂糖。加热过程中,当溶液沸腾后,请戴上防热手套。 小心摇动锥形瓶。使琼脂糖充分均匀熔化。此操作重复数次,直 至琼脂糖完全熔化。必须注意,在微波炉中加热时间不宜过长, 每次当溶液起泡沸腾时停止加热,否则会引起溶液过热暴沸,造 成琼脂糖凝胶浓度不准,也会损坏微波炉。熔化琼脂糖时,必须 保证琼脂糖充分完全熔化,否则,会造成电泳图像模糊不清。 5.使溶液冷却至60℃左右,如需要可在此时加入溴乙锭溶液(终浓 度0.5 μg/ml)。并充分混匀。 注:溴乙锭是一种致癌物质。使用含有溴乙锭的溶液时,请戴好手套。 6.将琼脂糖溶液倒入制胶模中,然后在适当位置处插上梳子。凝胶 厚度一般在3~5 min之间。 7.在室温下使胶凝固(大约30 min~1 h),然后放置于电泳槽中进行电泳。 注:凝胶不立即使用时,请用保鲜膜将凝胶包好后在4℃下保存, 一般可保存2~5天。 琼脂糖凝胶浓度与线形DNA的最佳分辨范围 6× Loading Buffer(DNA电泳用) 组份浓度
生物化学常用缓冲液
生物化学常用缓冲液 ⑴ 磷酸盐缓冲液 磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由於它们是二级解离,有二个pK a 值,所以用它们配制的缓冲液,pH范围最宽: NaH 2PO 4 : pK a1 =2.12, pK a2 =7.21 Na 2HPO 4 : pK a1 =7.21, pK a2 =12.32 配酸性缓冲液:用 NaH 2PO 4 ,pH=1~4, 配中性缓冲液:用混合的两种磷酸盐,pH=6~8, 配碱性缓冲液:用 Na 2HPO 4 ,pH=10~12。 用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯 酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。 磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH范围宽;③pH受温度的影响小;④缓冲液稀释后pH变化小,如稀释十倍后pH的 变化小于0.1。 其缺点为:①易与常见的钙Ca++离子、镁Mg++离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。 ⑵Tris(三羟甲基氨基甲烷,N-Tris(hydroxymethyl)aminomethane)缓冲 液 Tris缓冲液在生物化学研究中使用的越来越多,有超过磷酸盐缓冲液的趋势,如在SDS-聚丙烯酰胺凝胶电泳中已都使用Tris缓冲液,而很少再用磷酸盐。 Tris缓冲液的常用有效pH范围是在“中性”范围,例如: Tris-HCl缓冲液: pH=7.5~8.5 Tris-磷酸盐缓冲液: pH=5.0~9.0 配制常用的缓冲液的方法有两种:①按书后附录中所列该缓冲液表中的方法,分别配制0.05mol/L Tris和0.05mol/L HCl溶液,然后按表中所列体积混合。由于标准浓度的稀盐酸不易配制,所以常用另一种方法;②若配1L 0.1mol/L 的Tris-HCl缓冲液:先称12.11g Tris碱溶于950mL~970mL 无离子水中,边 搅拌边滴加4N HCl,用pH计测定溶液pH值至所需的pH值,然后再加水补足到1L。 Tris-HCl缓冲液的优点是:①因为Tris碱的碱性较强,所以可以只用这 一种缓冲体系配制pH范围由酸性到碱性的大范围pH值的缓冲液;②对生物化学过程干扰很小,不与钙、镁离子及重金属离子发生沉淀。 其缺点是:①缓冲液的pH值受溶液浓度影响较大,缓冲液稀释十倍,pH值的变化大于0.1;②温度效应大,温度变化对缓冲液pH值的影响很大,即: △pK a /℃=-0.031 ,例如:4℃时缓冲液的pH=8.4,则37℃时的pH=7.4,所以一定要在使用温度下进行配制,室温下配制的Tris-HCl缓冲液不能用于 0℃~4℃。③易吸收空气中的CO 2 ,所以配制的缓冲液要盖严密封。④此缓冲液对某些pH电极发生一定的干扰作用,所以要使用与Tris溶液具有兼容性的电极。
sdspage电泳试剂配制
SDS-PAGE电泳试剂 1)30%储备胶溶液:丙烯酰胺(Acr)29.0g,亚甲基双丙烯酰(Bis)1.0g,混匀后加ddH2O,37O C溶解,定容至100 mL,棕色瓶存于4O C; 2) 1.5M Tris-HCl(pH 8.8):Tris 18.17g加ddH2O溶解,浓盐酸调pH至8.0, 定容至100mL; 3) 1M Tris-HCl(pH 6.8):Tris 12.11g加ddH2O溶解,浓盐酸调pH至6.8,定容至100 mL; 4) 4?分离胶缓冲液:0.4gSDS溶于1.5M Tris-HCl(pH 8.8),定容至100mL; 5) 4?浓缩胶缓冲液:0.4gSDS溶于1M Tris-HCl(pH 6.8),定容至100mL; 6) 10?电泳缓冲液(pH 8.3):Tris 3.029g,甘氨酸14.415g,SDS 1g加ddH2O 溶解,定容至100mL; 7) 10%过硫酸铵(Aps,现配):1g AP加ddH2O至10mL; 8) 2?SDS电泳上样缓冲液:1M Tris-HCl(pH 6.8)2.5mL,β-巯基乙醇1.0mL,SDS 0.6g,甘油2.0 mL,0.1%溴酚兰1.0 mL,ddH2O 3.5mL; 9) 考马斯亮兰染色液:考马斯亮兰R2501.25g,甲醇225 mL,冰醋酸50 mL,ddH2O 225mL; 10) 脱色液: 甲醇、冰醋酸、ddH2O以2∶1∶7配制而成; 11) 分离胶(12.5%): ddH2O 4mL,30%储备胶5 mL,4?分离胶缓冲液3mL, 10% Aps 0.1mL(现配),TEMED(N,N,N’,N’-四甲基乙二胺)10μL; 12) 浓缩胶(5%):ddH2O 2.65mL,30%储备胶0.85mL,4?浓缩胶缓冲液1.25mL,10%Aps 50μL,TEMED 5μL。 Tricine(三羟甲基氨基甘氨酸)- SDS - PAGE蛋白质电泳 1 Tricine - SDS - PAGE蛋白质电泳溶液准备 1)正极缓冲液(10 ×):14g Tris 溶于400mL 重蒸水,用1. 0M HCl 调至pH8. 9 ,定容至500mL。 2)负极缓冲液(10 ×):将60. 55g Tris ,89. 58g Tricine 及5g SDS 溶于400ml 重蒸水中,加水至终体积为500mL。 3)凝胶缓冲液(3 ×):将181. 5g Tris ,1. 5g SDS 溶于400mL 重蒸水中,用1M
凝胶电泳缓冲液的配制
2.测序凝胶加样缓冲液 98%去离子甲酰胺 10mol/L EDTA(pH8.0) 0.025%二甲苯青FF 0.025%溴酚蓝 甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。不过,一旦略呈黄色,则应用在磁力搅拌器上将甲酰胺与Dowex XG8混合床树脂共同搅拌1小时进行去离子处理,并用Whatman 1号滤纸过滤2次,去离子甲酰胺分装成小份,充氮存于-70℃。 3.常用的电泳缓冲液
说明: ①TBE溶液长时间存放后会形成沉淀物,为避免这一问题,可在室温下用玻璃瓶保存5×溶液,出现沉淀后则予以废弃。 以片都以1×TBE作为使用液(即1:5稀释浓贮液)进行琼脂糖凝胶电泳。但0.5×的使用液已具备足够的缓冲容量。目前几乎所有的琼脂糖胶电泳都以1:10稀释的贮存液作为使用液。 进行聚丙烯酰胺凝胶垂直槽的缓冲液槽较小,故通过缓冲液的电流量通常较大,需要使用1×TBE以提供足够的缓冲容量。 ②碱性电泳缓冲液应现用现配。 ③Tris-甘氨酸缓冲液用SDS聚丙烯酰胺凝胶电泳。 4.2×SDS凝胶加样缓冲液 100mmol/L Tris·HCl(6.8) 200mmol/L二硫苏糖醇(DTT) 4%SDS(电泳级) 0.2%溴酚蓝 20%甘油 不含DTT的2×SDS凝胶加样缓冲液可保存于室温,应在临用前取1mol/L 贮存液现加于上述缓冲液中。 5.凝胶加样缓冲液
使用以上凝胶加样缓冲液的目的有三:增大样品密度;以确保DNA均匀进入样品孔内;使样品呈现颜色,从而使加样操作更为便利,含有在电块中能以可预知速率向阳极泳动的染料。溴酚蓝在琼脂糖中移动的速率约为二甲苯青FF的2. 2倍,而与琼脂糖浓度无关。以0.5×TBF作电泳液时,溴酚蓝在琼脂糖中的泳动速率约与长300bp的双链线状DNA相同,而二甲苯青FF的泳动则与长4kb的双链线状DNA相同。在琼脂糖浓度为0.5%~1.4%的范围内,这些对应关系受凝胶浓度变化的影响并不显著。 选用哪一种加样染料纯属个人喜恶。但是,对于碱性凝胶应当使用溴甲酚绿作为示踪染料,因为在碱性pH条件下其显色较溴酚更蓝为鲜明。
电泳缓冲液的作用
电泳缓冲液的作用 缓冲液在电泳过程中的一个作用是维持合适的pH。电泳时正极与负极都会发生电解反应,正极发生的是氧化反应(4OH--4e->2H2O+O2),负极发生的是还原反应(4H++4e->2H2),长时间的电泳将使正极变酸,负极变碱。一个好的缓冲系统应有较强的缓冲能力,是溶液两极的pH保持基本不变。电泳缓冲液的另一个作用是使溶液具有一定的导电性,以利于DNA 分子的迁移,例如,一般电泳缓冲液中应含有0.01-0.04mol/L的Na+离子,Na+离子的浓度太低时电泳速度变慢;太高时就会造成过大的电流使胶发热甚至熔化。电泳缓冲液还有一个组分是EDTA,加入浓度为1-2mmol/L,目的是螯合Mg2+ 等离子,防止电泳时激活DNA 酶,此外还可防止Mg2+离子与核酸生成沉淀。 TAE是使用最广泛的缓冲系统。其特点是超螺旋在其中电泳时更符合实际相对分子质量(TBE中电泳时测出的相对分子质量会大于实际分子质量),且双链线状DNA在其中的迁移率较其他两种缓冲液快约10%,电泳大于13kb的片段时用TAE缓冲液将取得更好的分离效果,此外,回收DNA片段时也易用TAE缓冲系统进行电泳。TAE的缺点是缓冲容量小,长时间电泳(如过夜)不可选用,除非有循环装置使两极的缓冲液得到交换。 TBE的特点是缓冲能力强,长时间电泳时可选用TBE,并且当用于电泳小于1kb的片段时分离效果更好。TBE用于琼脂糖凝胶时易造成高电渗作用,并且因与琼脂糖相互作用生成非共价结合的四羟基硼酸盐复合物而使DNA片段的回收率降低,所以不宜在回收电泳中使用。TPE的缓冲能力也较强,但由于磷酸盐易在乙醇沉淀过程中析出,所以也不宜在回收DNA片段的电泳中使用。
SDS-PAGE所有详细试剂配方
S D S-P A G E 30%聚丙烯酰胺溶液-----30%(w/v)Acrylamide 【组分浓度】 各种组分名称配制不同体积所需各成分的体积(mL)或质量(g) 30%Acr-Bis(29:1) 1000ml 100ml 29%Acrylamide(丙烯酰胺) 290g 29g 1%BIS(N,N’-亚甲丙烯酰胺) 10g 1g 【配制方法】 将29克丙烯酰胺和1克N,N’-亚甲丙烯酰胺溶于总体积为60ml温热(37℃左右)的去离子水中,充分搅拌溶解,补加水至终体积为100ml。0.45μm微孔滤膜过滤除菌和杂质,储于棕色瓶,4℃避光(用铝箔纸包扎起来)保存。严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。使用期不得超过两个月,隔几个月须重新配制。如有沉淀,可以过滤。 【保存条件】 4℃避光(用铝箔纸包扎起来)保存 【注意事项】 丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,其作用具有累积性。称量丙烯酰胺和N,N’-亚甲丙烯酰胺时应戴手套和面具。可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能含有少量未聚合材料。1MTris-HCL(pH6.8)(浓缩胶buffer) 【组分浓度】1MTris-HCL 名称用量备注 Tris 12.1g 去离子水80ml 浓盐酸9ml (36%的浓盐酸)预实验已确定 去离子水加入去离子水定容至100ml后,室温保存 【配制方法】 称量121.1gTris碱溶于800mL的去离子水,充分搅拌溶解,加>0.7mL的浓HCL调节所需要的pH 值(7.4-大约0.7mL,7.6-大约0.6mL,8.0-大约0.42mL),将溶液定容至1L,高温高压灭菌后,室温保存。应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。 【保存条件】 室温保存。 【注意事项】 对人体有刺激性,请注意适当防护。 1.5MTris-HCL(pH8.8)(分离胶buffer) 【组分浓度】1.5MTris-HCL 名称用量备注 Tris 18.17g 去离子水80ml 浓盐酸3ml (36%的浓盐酸)预实验已确定 去离子水加入去离子水定容至100ml后,室温保存 【配制方法】1L
电泳缓冲液TAE的作用
电泳缓冲液TAE起什么作用呢? 缓冲液在电泳过程中的一个作用是维持合适的pH。电泳时正极与负极都会发生电解反应,正极发生的是氧化反应(4OH--4e->2H2O+O2),负极发生的是还原反应(4H++4e->2H2),长时间的电泳将使正极变酸,负极变碱。一个好的缓冲系统应有较强的缓冲能力,是溶液两极的pH保持基本不变。 电泳缓冲液的另一个作用是使溶液具有一定的导电性,以利于DNA分子的迁移,例如,一般电泳缓冲液中应含有0.01-0.04mol/L的Na+离子,Na+离子的浓度太低时电泳速度变慢;太高时就会造成过大的电流使胶发热甚至熔化。 电泳缓冲液还有一个组分是EDTA,加入浓度为1-2mmol/L,目的是螯合Mg2+ 等离子,防止电泳时激活 DNA酶,此外还可防止Mg2+离子与核酸生成沉淀。 TAE是使用最广泛的缓冲系统。其特点是超螺旋在其中电泳时更符合实际相对分子质量(TBE中电泳时测出的相对分子质量会大于实际分子质量),且双链线状DNA在其中的迁移率较其他两种缓冲液快约10%,电泳大于13kb的片段时用TAE 缓冲液将取得更好的分离效果,此外,回收DNA片段时也易用TAE缓冲系统进行电泳。TAE的缺点是缓冲容量小,长时间电泳(如过夜)不可选用,除非有循环装置使两极的缓冲液得到交换。 TBE的特点是缓冲能力强,长时间电泳时可选用TBE,并且当用于电泳小于1kb 的片段时分离效果更好。TBE用于琼脂糖凝胶时易造成高电渗作用,并且因与琼脂糖相互作用生成非共价结合的四羟基硼酸盐复合物而使DNA片段的回收率降低,所以不宜在回收电泳中使用。 TPE的缓冲能力也较强,但由于磷酸盐易在乙醇沉淀过程中析出,所以也不宜在回收DNA片段的电泳中使用。 人外周血单个核细胞总RNA的分离纯化 逆转录聚合酶链反应扩增细胞因子mRNA 琼脂糖凝胶电泳鉴定及DNA的胶回收 PCR扩增产物的克隆 感受态细胞的制备和重组DNA的转化 重组化的筛选和鉴定
三、核酸电泳相关试剂、缓冲液的配制方法
三、核酸电泳相关试剂、缓冲液的配制方法 50×TAE Buffer (pH8.5) 组份浓度 2 M Tris-醋酸,100 mM EDTA 配制量 1 L 配制方法 3.加入57.1 ml的乙酸,充分搅拌。 4.加去离子水将溶液定容至l L后,室温保存。 10×TBE Buffer (pH8.3) 组份浓度890 mM Tris-硼酸,20 mM EDTA 配制量 1 L 配制方法 3.加去离子水将溶液定容至l L后,室温保存。 10×MOPS(3-吗啉基丙磺酸)Buffer 组份浓度200 rnM MOPS,20 mM NaOAc,10 mM EDTA 配制量 1 L 配制方法 1.称41.8 g MOPS,置于1 L烧杯中。 2.加约700 ml DEPC处理水,搅拌溶解。 3.使用2 N NaOH调节pH值至7.0。 6.用0.45 m滤膜过滤除去杂质。 7.室温避光保存。 注:溶液见光或高温灭菌后会变黄。变黄时也可使用,但变黑时不要使用。溴乙锭(10 mg/ml) 组份浓度10 mg/ml溴乙锭 配制量100 ml 配制方法 1.称量1 g溴乙锭,加入到100 ml容器中。 2.加入去离子水100 ml,充分搅拌数h完全溶解溴乙锭。 3.将溶液转移至棕色瓶中,室温避光保存。 4.溴乙锭的工作浓度为0.5 g/ml。
注意:溴乙锭是一种致癌物质,必须小心操作。 Agarose凝胶 配制方法 1.配制适量的电泳及制胶用的缓冲液(通常是0.5×TBE或1×TAE)。 2.根椐制胶量及凝胶浓度,准确称量琼脂糖粉,加入适当的锥形瓶中。 3.加入一定量的电泳缓冲液(总液体量不宜超过锥形瓶的50%容量)。 注:用于电泳的缓冲液和用于制胶的缓冲液必须统一。 4.在锥形瓶的瓶封上保鲜膜,并在膜上扎些小孔,然后在微波炉中 加热熔化琼脂糖。加热过程中,当溶液沸腾后,请戴上防热手套。 小心摇动锥形瓶。使琼脂糖充分均匀熔化。此操作重复数次,直 至琼脂糖完全熔化。必须注意,在微波炉中加热时间不宜过长, 每次当溶液起泡沸腾时停止加热,否则会引起溶液过热暴沸,造 成琼脂糖凝胶浓度不准,也会损坏微波炉。熔化琼脂糖时,必须 保证琼脂糖充分完全熔化,否则,会造成电泳图像模糊不清。 5.使溶液冷却至60℃左右,如需要可在此时加入溴乙锭溶液(终浓 度0.5 μg/ml)。并充分混匀。 注:溴乙锭是一种致癌物质。使用含有溴乙锭的溶液时,请戴好手套。 6.将琼脂糖溶液倒入制胶模中,然后在适当位置处插上梳子。凝胶 厚度一般在3~5 min之间。 7.在室温下使胶凝固(大约30 min~1 h),然后放置于电泳槽中进行电泳。 注:凝胶不立即使用时,请用保鲜膜将凝胶包好后在4℃下保存, 一般可保存2~5天。 琼脂糖凝胶浓度与线形DNA的最佳分辨范围 6× Loading Buffer(DNA电泳用) 组份浓度 配制量 配制方法 1.称量下列试剂,置于500 ml烧杯中。
