Gene5中文操作指南:多块板公用标准曲线
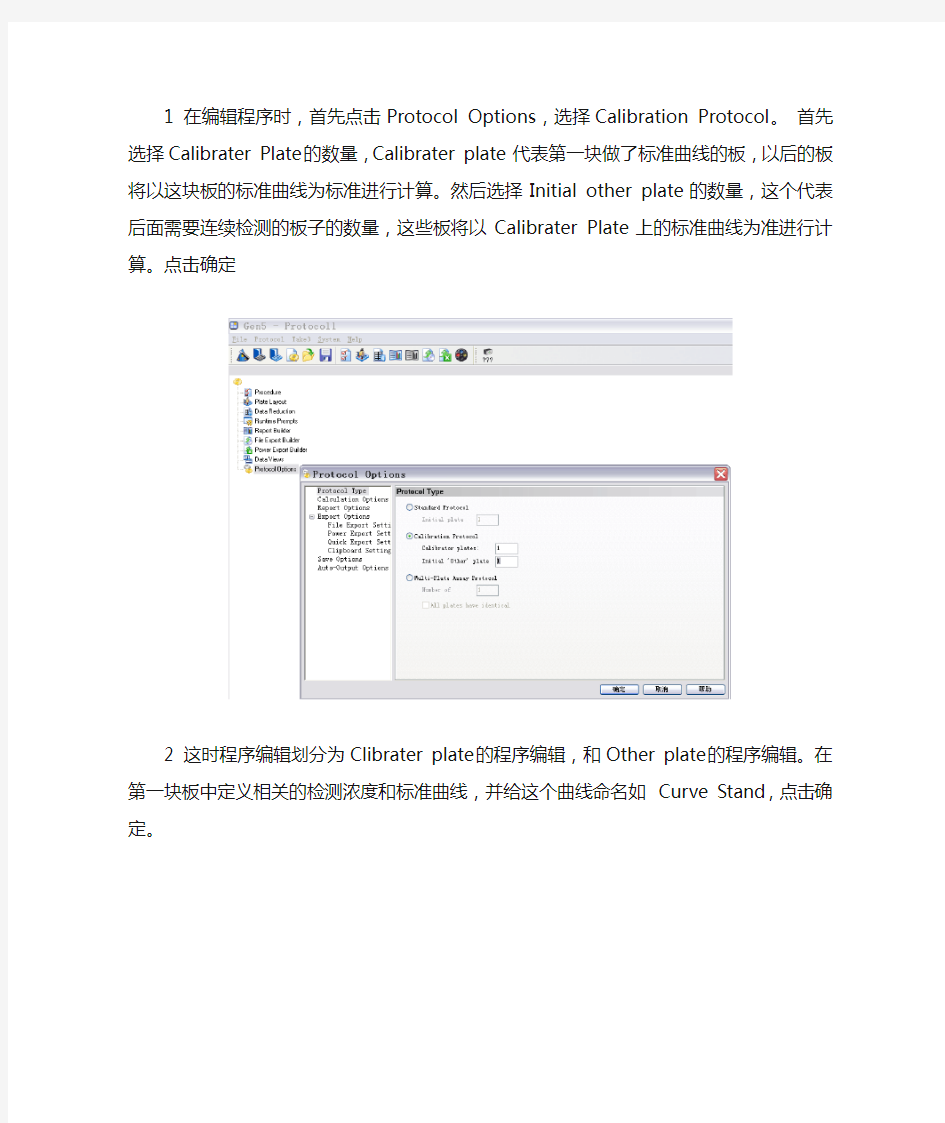
1 在编辑程序时,首先点击Protocol Options,选择Calibration Protocol。首先选择Calibrater Plate的数量,Calibrater plate 代表第一块做了标准曲线的板,以后的板将以这块板的标准曲线为标准进行计算。然后选择Initial other plate的数量,这个代表后面需要连续检测的板子的数量,这些板将以Calibrater Plate上的标准曲线为准进行计算。点击确定
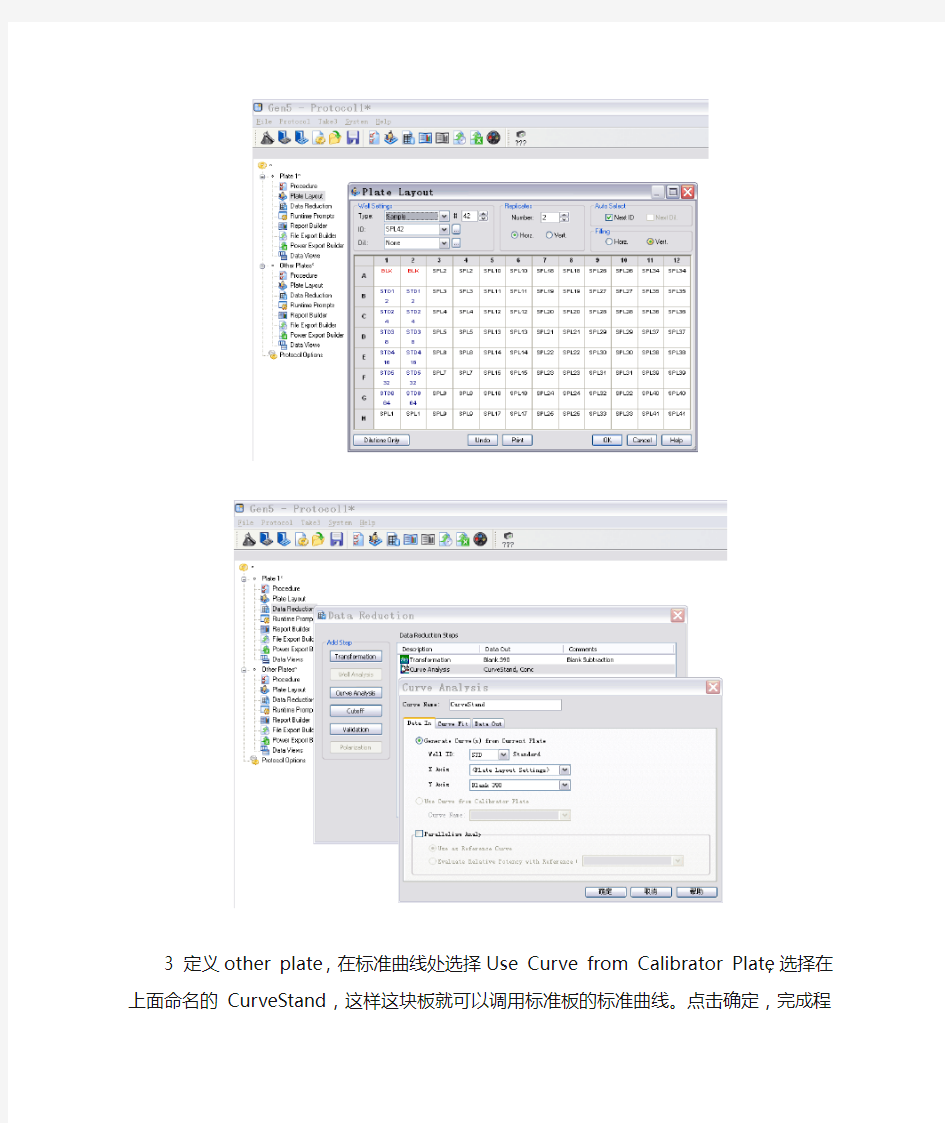
2 这时程序编辑划分为Clibrater plate的程序编辑,和Other plate的程序编辑。在第一块板中定义相关的检测浓度和标准曲线,并给这个曲线命名如Curve Stand,点击确定。
CurveStand,这样这块板就可以调用标准板的标准曲线。点击确定,完成程序编辑。
标准曲线
1、标准曲线的本质 分析检测中的标准曲线是指一系列已知含量(浓度/量)的物质与仪器响应/信号之间的关系,数学处理就是曲线方程,图形表示就是标准曲线(图1)。 标准曲线的目的是可以根据标准曲线查出待测物质的含量。当我们得到一系列已知含量的物质的响应后,就会去建立函数关系,数学上称曲线拟合,由于直线最为简单,所以常常用直线方程加以拟合,当然会用到多项式拟合等其他方式。 标准曲线的核心问题要解决: 1、能找到确切浓度的标准物质或标准品。 2、标准系列和待测物质一定要有相同和一致的基体,因为样品基体可能会干扰仪器的响应,从这个意义上讲,样品的前处理实际就是提供标准和样品同样的基体环境,尽量祛除干扰基体。 所以最好的标准系列应该是样品基体匹配的标准系列。而方法建立过程中首先要考虑的当然是基体干扰的问题,推荐用标准加入曲线和Youden曲线分别考察样品基体所带来的乘积性干扰和加和性干扰。 标准加入曲线就是在样品中加入一系列标准,然后考察该标准加入曲线和标准曲线斜率的统计学差异,若有差异需考虑用标准加入法定量;而Youden曲线就是对样品做一系列稀释,然后用稀释倍数如1/10,1/5,1/2,1对仪器响应做曲线,考察该Youden曲线的截距与0的差别,若有差别则提示有加和性干扰,此时测定值要减去该截距才是真实值。 只有解决了标准曲线与样品基体的匹配问题,我们的定量才可靠。 内标法和替代物的使用则是为了解决仪器和前处理的影响问题。
2、标准曲线的做法 按《基于标准样品的线性校准》推荐: 1、标准曲线的浓度范围应覆盖正常操作条件下的被测量范围; 2、标准样品的组分尽量与被测样品组分一致; 3、标准样品的浓度值应等距离的分布在被测量范围; 4、标准样品的个数至少应有3个浓度; 5、每个标准点至少重复2次,这个重复是指从稀释开始;如果国家标准有相应的浓度系列推荐,尽量按国家标准,如果你要偷懒,比如我要减少标准点,至少要有理论标准支撑,比如至少要3个浓度。 工作中我们经常采用线性校准,因为线性方程最为简洁。 3、标准曲线的检验 标准曲线的检验是实际操作中最大的难点,也是工作中误区和争议最多的话题,比如GB/T 就将标准曲线的检验分为:精密度检验,截距检验和斜率检验,但并未出示具体的检验方法。
标准溶液配制方法
中华人民共和国国家标准 UDC543.06:54—41 GB601—88 化学试剂 滴定分析(容量分析)用标准溶液的制备 Chemicalreagent Preparationsofstandardvolumetriesolutions 1主题内容与适用范围 本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。 本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。 2引用标准 GB603化学试剂试验方法中所用制剂及制品的制备 GB6682实验室用水规格 GB9725化学试剂电位滴定法通则 3一般规定 3.1本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标 准。 3.2本标准中所用试剂的纯度应在分析纯以上。 3.3工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。3.4本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是 所用的试剂为分析纯以上试剂。 3.5本标准中所制备的标准溶液的浓度均指20c时的浓度。在标定和使用时,如 温度有差异,应只能附录A(补充件)补正。 3.6“标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4 平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 3.7本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中 的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。 3.8制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 3.9配制浓度等于或低于0.02mol/L标准溶液时乙二胺四乙酸二钠标准滴定溶液 除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 3.10碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 3.11滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不 得超过两个月。
常用标准溶液的配制和标定
标准溶液的配制与标定 实训一氢氧化钠标准溶液的配制和标定 一、目的要求 1.掌握NaOH标准溶液的配制和标定。 2.掌握碱式滴定管的使用,掌握酚酞指示剂的滴定终点的判断。 二、方法原理 NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。 反应方程式:2NaOH + CO2→Na2CO3+ H2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。 标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH →C6H4COONaCOOK + H2O 计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。 三、仪器和试剂 仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。 试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)、10g/L酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。 四、操作步骤 1.0.1mol/L NaOH标准溶液的配制 用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。 准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。 2.0.1mol/L NaOH标准溶液的标定 将基准邻苯二甲酸氢钾加入干燥的称量瓶,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。同时做空白试验。 要求做三个平行样品。
实验1 高吸光度示差分析法
实验二高吸光度示差分析法 一、目的: 通过标准曲线的绘制及试样溶液的测定,了解高吸光度示差分析法的基本原理,方法优点。掌握721型分光光度计的使用方法。 二、原理: 普通吸光光度法是基于测量试样溶液与试剂空白溶液(或溶剂)相比较的吸光度,从相同条件下所作的标准曲线来计算被测组份的含量,这种方法的准确度一般不会优于1~2%,因此,它不适合于高含量组份的测定。 为了提高吸光光度法测定的准确度,使其适合于高含量组分的测定,可采用高吸光度示差分析法。示差法与普通吸光光度法的不同之处,在于用一个待测组份的标准溶液代替试剂空白溶液作为参比溶液,测量待测量溶液的吸光度。它的测定步骤如下: (1)在仪器没有光线通过时(接受器上无光照射时)调节透光率为0,这与比色法或普通分光光度法相同。 (2)将一个比待测溶液(浓度为C+△C)稍稀的参比溶液(浓度为C)放在仪器光路中,调节透光率为100%。 (3)将待测量溶液(或标准溶液)推入光路中,读取表现吸光度A f。 表观吸光度A f实际上是由△C引起的吸收大小,可表达为: A f=ab△c 上式说明,待测溶液(或标准溶液)与参比溶液的吸光度之差与这两次溶液的浓度差成正比。 无论普通吸光度或高吸光度示差法,只要符合比尔定律,而且测量误差仅仅是由于透光率(或吸光度)读数的不确定所引起的,则可以方便地计算出分析的
误差。 仪器刻度上透光率读数改变数(dT )所引起的浓度误差dc 为绝对误差,它与透光率有关,其关系式容易由比耳定律推得: A f =ab △c=k △c lgT=-A f =-k △c 0.43lnT=-k △c KT dc 43 .0 ·dT 式中k 为标准曲线(A ~C )的斜率。实验中三条曲线的三个k 很接近。根据k 值及上述关系可以计算出实验中各点的绝对误差(假设透光率读数误差为l%,即dT=0.01)。 对于化学工作者来说,更有意义的是浓度的相对误差(c dc ),或者相对百分误差(c dc ×100)。浓度相对百分误差与参比溶液的浓度关系密切。随着有色参比溶液浓度的增加(或A 的增加),相对百分误差也随之减小。当所用参比溶液的A=1.736时,最低的相对百分误差也可减小至0.25%。由此可见了,差示法中高吸光度法可达到容量分析和重量分析的准确度。 三、仪器与试剂 721型分光光度计(附2只1厘米比色皿) 0~10ml 微量滴定管1支(刻度准确至0.005ml ) 25ml 容量瓶×16 0.2500M Cr (NO 3)3 四、实验步骤
原子吸收标准溶液的配制
原子吸收常用的标准溶液配制方法 点击次数:1081 发布时间:2012-5-17 标准溶液的配备方法 钙元素符号-Ca 相对原子量 -40.08 仪器操作条件 波长 422.7nm 狭缝 0.4nm 灯电流 3.0毫安 燃烧器高度 8毫米 空气压力 0.3兆帕 乙炔压力 0.09兆帕 空气流量 7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性兰色焰 钙Ca 标准溶液的配置 钙标准溶液浓度1000微克/毫升 称取经灼烧后的高纯氧化钙1.3992克,置于250毫升烧杯中,加入盐酸20毫升,低温加热溶解,冷却后移入1000毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克Ca。 或购置国家标准GBW(E)080261 1000微克/毫升Ca(基体5%盐酸) 标准系列与线性工作范围 配置每毫升含钙0.0, 1.0, 2.0,3.0,4.0,5.0微克2%盐酸溶液和0.2%氯化锶溶液。 钙标准使用液:吸取1毫升=1000微克钙标准溶液10.0毫升于100毫升容量瓶中,加入2毫升盐酸,用去离子水定容刻度,摇匀。此溶液1毫升=100微克钙。 氯化锶应为GR试剂 在仪器推荐条件下,标准曲线线性范围:0.0-5.0微克/毫升。 特征浓度 在仪器推荐条件下,钙的特征浓度约为:0.080微克/毫升(1%吸收)。 浓度为2微克/毫升的钙标准溶液,通常可获得0.110左右的吸光度值。 其他分析线
波长(nm) 狭缝(nm) 特征浓度之比 422.7 0.4 1.0 239.9 0.4 120 干扰及分析提示 据文献报道,在空气-乙炔焰中,铝、Be、硅、钛、钒、锆、磷酸盐、硫酸盐都会干扰钙的测定。将0.1-1%的镧或锶加进样品和标准中,能抑制上述干扰。硫酸、磷酸干扰钙的测定,测定时,样品和标准中酸的浓度应该一致,同样一份样品,酸的浓度不同所测吸光度值也不相同。要严格控制水和试剂空白,仪器喷雾系统注意防止沾污。钙有轻微的电离干扰。 试验表明,钙的吸光度与燃气和助燃气的比例、燃烧器的高度有关。在开始分析以前,应用该得标准溶液调节吸光度到最大,然后进行分析。 标准溶液的配备方法 镉元素符号-Cd 相对原子量—112.4仪器操作条件 波长228.8 nm 狭缝0.4 nm 灯电流 3.0毫安 燃烧器高度 6.5毫米 空气压力0.3兆帕 乙炔压力0.09兆帕 空气流量7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性蓝色焰 镉 标准溶液的配置 镉标准溶液浓度1000微克/毫升 称取高纯镉(99.9%)0.1000克,置于250毫升烧杯中,加入10毫升盐酸,在低温电热板上加热溶解。移入100毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克镉。或购置国家标准GBW 08612 1000微克/毫升镉 (基体1%硝酸) 标准系列与线性工作范围 配置每毫升含镉0.0,0.2,0.4,0.6,0.8,1.0微克2%盐酸溶液。
常用标准溶液配制方法
常用标准溶液配制方法
1
2一般规定 本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。 本标准中所用试剂的纯度应在分析纯以上。 工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。 本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。 本标准中所制备的标准溶液的浓度均指20c 时的浓度。在标定和使用时,如温度有差异,应只能附录A(补充件)补正。 “标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。
制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。 3标准溶液的制备和标定 4.1 氢氧化钠标准溶液(使用期:2个月) c(NaOH) = 1 mol/L c(NaOH) =0.5 mol/L c(NaOH) =0.1 mol/L 4.1.1 配制 称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。用塑料管吸下述规定体积的上层清夜,用无二氧化碳的水稀释至1000ml,摇匀。 c(NaOH) ,mol/L 氢氧化钠饱和溶
标准溶液的配制方法及基准物质
标准溶液的配制方法及基准物质 标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。不论采用何种滴定方法,都离不开标准溶液。因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。配制标准溶液的方法一般有以下两种: 直接配制法 用分析天平准确地称取一定量的物质,溶于适量水后定量转入容量瓶中,稀释至标线,定容并摇匀。根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。 能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。作为基准物质必须符合下列要求: (1)试剂必须具有足够高的纯度,一般要求其纯度在%以上,所含的杂质应不影响滴定反应的准确度。 (2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na 2B 4 O 7 ?10H2O),其结晶水的数目也应与化学式完全相符。 (3)试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。 (4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的基准物质 有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K 2Cr 2 O 7 ,Na 2 CO 3 , MgO , K BrO 3 等,它们的含量一般在%以上,甚至可达% 。 应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到%,这时就不能用作基准物质。一些常用的基准物质及其应用范围列于表中。
表常用基准物质的干燥条件和应用
紫外可见分光光度计的曲线绘制(特选参考)
一、测定溶液中物质的含量 可见或紫外分光光度法都可用于测定溶液中物质的含量。测定标准溶液(浓度已知的溶液)和未知液(浓度待测定的溶液)的吸光度,进行比较,由于所用吸收池的厚度是一样的。也可以先测出不同浓度的标准液的吸光度,绘制标准曲线,在选定的浓度范围内标准曲线应该是一条直线,然后测定出未知液的吸光度,即可从标准曲线上查到其相对应的浓度。 含量测定时所用波长通常要选择被测物质的最大吸收波长,这样做有两个好处: ⑴灵敏度大,物质在含量上的稍许变化将引起较大的吸光度差异; ⑵可以避免其它物质的干扰。 二、用紫外光谱鉴定化合物 使用分光光度计可以绘制吸收光谱曲线。方法是用各种波长不同的单色光分别通过某一浓度的溶液,测定此溶液对每一种单色光的吸光度,然后以波长为横座标,以吸光度为纵座标绘制吸光度──波长曲线,此曲线即吸收光谱曲线。各种物质有它自己一定的吸收光谱曲线,因此用吸收光谱曲线图可以进行物质种类的鉴定。当一种未知物质的吸收光谱曲线和某一已知物质的吸收光谱曲线开关一样时,则很可能它们是同一物质。一定物质在不同浓度时,其吸收光谱曲线中,峰值的大小不同,但形状相似,即吸收高峰和低峰的波长是一定不变的。紫外线吸收是由不饱和的结构造成的,含有双键的化合物表现出吸收峰。紫外吸收光谱比较简单,同一种物质的紫外吸收光谱应完全一致,但具有相同吸收光谱的化合物其结构不一定相同。除了特殊情况外,单独依靠紫外吸收光谱决定一个未知物结构,必须与其它方法配合。紫外吸收光谱分析主要用于已知物质的定量分析和纯度分析。 选几个体积梯度,然后稀释成相同的体积,得到了不同浓度C的几个标准溶液样组,用紫外分光光度计分别测得相应的吸光度A1、A2、A3……,然后要以浓度为横坐标,吸光度A为纵坐标,绘制曲线。当然有时候根据实际需要,也会有小小的变动。 配制标准溶液,用紫外可见分光光度计测量,得到浓度与吸光度的曲线,并且利用线性拟合得到回归方程,直接利用Origin的线性拟合功能得到的方程往往截距不等于零,即方程的形式为y=A+Bx。那是否需要强制令A=0,再来进行拟合呢?如果y=A+Bx这样的形式可以,那么A需要多小才是可以接受的? 答:如果用样品空白溶液做参比,一般可以设置强制过零点;如果用蒸馏水做参比,一般不能强制过零点。 做曲线时一是要带双空白并减去空白A0, 二是应加0回归。减去A0是希望消除试验方法固定偏倚对校准曲线的影响,当用校准曲线来估计未知样的浓度时,要考虑到试样的测量吸光度也会受到固定偏倚的影响,如果校准曲线和试样测定过程中出现的偏倚一样,偏倚是无需校正的,可有时两者的操作往往不是同时同批进行的,如由于时间或批次不同,固定偏倚有所变化,那么两者的吸光度就要做不同的校正。即在每批分析时带空白,并对相应的信号进行校正。试验证明加零回归的校准曲线与不加零回归校准曲线比较,两者的r和b值均无差异,但加零回归校准曲线截距a的绝对值明显变小,因此在作校准曲线的回归计算时必须加零回归,使回归线接近原点。
标准曲线与工作曲线在不同分析方法中的使用
标准曲线与工作曲线在不同分析方法中的使用 金筱青 (苏州市环境监测中心站,江苏 苏州 215004)中图分类号:X830 5 文献标识码:C 文章编号:10062009(2005)04004501 校准曲线是描述待测物质浓度或量与相应测 量仪器响应值或其他指示量之间的定量关系曲线。 校准曲线包括工作曲线(绘制标准曲线的溶液需 与样品分析步骤完全相同)和标准曲线(标液的分 析步骤有所省略,如不经过前处理等)。至于何时 用标准曲线,何时用工作曲线,须经实验确定。若 标液的某些前处理步骤省略后,所绘制的曲线与工 作曲线经数理统计检验无显著性差异时,则可在测 试中使用标准曲线,否则应用工作曲线。 测定总磷时, 水和废水监测分析方法 (第四 版)要求,标液系列须与水样同时经过硫酸钾氧化并 消解,而对于挥发酚、总氰化物的测定,标液系列则 不要求蒸馏,可直接加显色剂显色,比色,绘制曲线。 现分别绘制总磷、挥发酚和总氰化物测定方法 的标准曲线和工作曲线,其多次测量(n=6)的斜 率均值见表1。 表1 总磷、挥发酚和总氰化物标准曲线和工作曲线的比较 项 目方 法标准曲线 斜率 工作曲线 斜率 总磷钼锑抗分光光度法0 1000 100挥发酚4氨基安替比林分光光度法0 4040 386总氰化物异烟酸比唑啉酮分光光度法0 1480 137 由表1可见,总磷标液经消解和不消解绘制成的曲线,即工作曲线与标准曲线相比,其斜率间无显著性差异。由此看来,总磷标液系列的高温高压消解操作步骤可以省去,即采用钼锑抗分光光度法测定总磷时,可以使用标准曲线代替工作曲线。 对于挥发酚和总氰化物的测定,由于绘制标准曲线简单方便,且标准曲线稳定、灵敏度高,相关性好,实际工作中多采用标准曲线,但实际样品在蒸馏过程中不可避免地有一定损失。由表1可见,测定挥发酚和总氰化物的工作曲线与标准曲线相比,斜率有所下降,使用标准曲线计算,结果偏低。使用工作曲线,则可以保证标液系列与样品处于完全相同的实验条件下,避免引入系统误差。 总之,在经数理统计检验后,若标准曲线与工作曲线之间无显著性差异,可以使用标准曲线,若两者之间存在差异,则应使用工作曲线。 收稿日期:20031111;修订日期:20050517 作者简介:金筱青(1974 ),女,江苏苏州人,工程师,硕士,从事环境监测和环境影响评价工作。 本栏目责任编辑 李延嗣 张启萍 (上接第9页) 件,2002年查处965件,2003年查处1161件;2000年 2003年查处案件数增长近5倍,但2004年查处案件数与2003年基本持平。违法施工行为得到有效遏制。 从环保12369投诉情况看,2000年全年共受理施工噪声污染投诉4900件(次),以后每年以20%~30%的速度递增,至2003年全年达到8940件(次)。但2004年全年受理施工噪声投诉7648件(次),比2003年减少1292件(次),下降了14.5%。南京市施工噪声投诉在近年持续大幅上升的情况下,2004年首次呈现下降态势。 4 结语 南京市通过实行夜间施工噪声总量控制,改变了建设施工单位盲目赶工期、不科学安排施工作业,随意到环保部门申请夜间施工作业的现象,探索出一条可行的缓解噪声扰民问题的新路子,把大量可能产生的环境噪声污染纠纷与矛盾解决在未发之时。这一举措,既维护了市民的环境权益,又保证了施工单位的合法施工权。 本栏目责任编辑 李文峻 45 第17卷 第4期环境监测管理与技术2005年8月
Excell软件绘制ELISA标准曲线
怎么用Excell软件绘制ELISA标准曲线 许多试剂检测都涉及到标准曲线的问题,究竟如何绘制或制作标准曲线呢? 用Excell和SPSS的软件能做出来吗?,怎么操作?能一起求出计算公式吗? 有没有专门的软件来处理呢?介绍几种? 希望有这方面经验的介绍自己的经历,与大家分享,“与众同乐才是真的快了” 的确,标准曲线做的好与坏会直接影响到实验的结果,甚至是关系到实验的成败。 首先,做标准曲线样品检测时有几个问题需要注意: 1、样品的浓度等指标是根据标准曲线计算出来的,所以首先要把做标准曲线看作是比做正式实验还要重要的一件事,否则后面的实验结果无从谈起。 2、设置标准曲线样品的标准浓度范围要有一个比较大的跨度,并且要能涵盖你所要检测实验样品的浓度,即样品的浓度要在标准曲线浓度范围之内,包括上限和下限。而对于呈S型的标准曲线,尽量要使实验样品的浓度在中间坡度最陡段,即曲线几乎成直线的范围内。 3、最好采用倍比稀释法配制标准曲线中的标准样品浓度,这样就能够保证标准样品的浓度不会出现较大的偏离。 4、检测标准样品时,应按浓度递增顺序进行,以减少高浓度对低浓度的影响,提高准确性。 5、标准曲线的样品数一般为7个点,但至少要保证有5个点。 6、做出的标准曲线相关系数因实验要求不同而有所变动,但一般来说,相关系数R至少要大于0.98,对于有些实验,至少要0.99甚至是0.999.
怎样绘制标准曲线? 标准曲线浓度得到后,可通过计算器、Excell或SPSS统计软件进行绘制,并得到相关的回归方程(即计算公式和相关系数(回归系数,个人认为,Excell 软件比较好用一些;SPSS也行,不过是英文的,初学者不是很容易掌握;计算器嘛太麻烦了,所以现在一般不用。 双抗夹心法ELISA拟和曲线: 拟和曲线: 打开EXCEL软件;在工作表中 输入第一行:浓度值,如0 10 50 100 400 输入第二行:该浓度下的调整后的od值,如0 0.586 1.397 1.997 3.42 选择这些输入的数据,用插入里的图表按钮,进入图表向导,在“标准类型”中选择“xy散点图”;在“子图表类型”中选择“折线散点图”,按“下一步”;选择“系列产生在行”,按“下一步”;数据标志,可以填写:如数据y 轴,OD值;数据x轴,浓度;按下一步,点击完成。可得曲线图。 单击曲线,按右键,选择“添加趋势线”,在类型中,选择多项式;在选项中,选择显示公式,选择显示R平方值。得到公式和R平方值。 也可以用上面说的方法,在公司已经提供的图表上,双击图表,把它输入到图表的数据中,就可以拟和新的曲线。 计算浓度: 举例:第一次实验: 标准曲线为:
标准溶液配制和标定
1、氢氧化钠标准滴定溶液 1.1配制 称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。 表1 1.2 标定 按表 2 的规定称取于 105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。同时做空白试验。 表2 氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算: m×1000 c(NaOH)= ------------- ( V1-V2)M 式中 : m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9); V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL);
V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL); M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】 2、硫酸标准滴定溶液 2.1配制 按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。 表3 2.2标定 按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。同时做空白试验。 表4 硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示 m×1000 c(1/2H2SO4)= ------------- ( V1-V2)M 式中: m—无水碳酸钠的质量的准确数值,单位为克(g); V1—硫酸溶液的体积的数值,单位为毫升(mL) ;
标准曲线的制作方法
标准样品的准备 由于你做的是基因表达分析,样品的准备就比较简单了,因为你要知道都是相对的数值(你的对照样品和实验样品中基因表达的比值),这样就不需要知道精确的拷贝数,所以标准品也就无须知道精确的拷贝数,只需知道稀释的倍数就可以了。 你实验中的标准品可以是来源比较丰富的细胞或组织的RNA转录得到的cDNA。将这种cDNA进行梯度的稀释,可以是稀释10倍,100,1000,10000等倍(具体到你的实验要根据具体的情况来调整稀释倍数。最好能作一个预实验来看看什么样的稀释倍数比较适合你的这种基因的扩增)。而对于各个稀释倍数我们要对它的拷贝数进行赋值,这个值当然不是标准品中真实含有的基因数量(在基因表达分析中也不需要),而是我们根据稀释倍数给每一个稀释度人为赋予的拷贝数,这只是为了方便实验最终结果的计算而已。比如我们把前面稀释十倍的样品赋值为10000个拷贝,100倍的赋值为1000个拷贝依次类推把10000倍的赋为10等。要注意,赋值的数目的倍数差异和你稀释的倍数是一样的,比如前面是10稀释,后面赋值也是10倍变化。 如何做标准曲线 在定量实验中标准品是要和你的未知样品一起进行定量实验的,这样在实验结束,无论是标准品还是未知样品都将跑出曲线,获得Ct值。那么我们先可以把未知样品放到一边,对于标准品来说,我们既获得了Ct值,还知道他们的拷贝数(虽然这个拷贝数是我们自己赋予的)。这样我们可以通过标准品的Ct值和拷贝数做一条标准曲线(以拷贝数为横坐标,而Ct值为纵坐标)。一旦作出了标准曲线,而未知样品的Ct值我们知道(通过实验求得的),这时候就在标准曲线上进行定位,就可以得到未知样品的拷贝数了。 事实上,操作起来没有那么复杂,你只需要告诉软件你的哪个孔是标准品,哪个是未知样品,以及标准品的拷贝数等必要信息,软件会自动帮你把标准曲线和未知样品的拷贝数计算出来。 举例来说如何进行设置 先进入软件,在板设置中选择所放样品的位置,并标上unknow或standard等信息。 选择要使用的荧光染料。
标准曲线法与标准加入法的区别
1 标准曲线法 1.1标准曲线法的计算公式 在一定条件下,标准曲线是一条直线,直线的斜率和截距可以用最小二乘法求得。现在好多仪器软件都能自动生成标准曲线,所以一小部分版友不清楚标准曲线的具体计算方法。本人查找了一些资料,找到标准曲线的斜率和截距的计算方法,和大家分享。 工作曲线可以用一元线性方程表示: y=a+bx (1) 式中,x为标准溶液的浓度,y为相应的吸光度。 使用最小二乘法确定的直线称为回归线,a,b称为回归系数。 b 为直线的斜率,可由下式求得:
1.2 灵敏度 灵敏度是指该方法对单位浓度或单位量的待测物质的变化所引起的响应量变化的过程。一般用标准曲线的斜率b为方法的灵敏度,b越大,灵敏度越高。 不要小看灵敏度,用处可大了。灵敏度由于仪器的不同,实验条件等的不同,在不断的变化。但在一定的实验条件下,灵敏度相对还是比较稳定的。所以,建议对灵敏度也做个质量控制图,具体做法见我另一个帖子。 每次标准曲线做好以后,观察灵敏度是否在一定的范围内维持稳定。如果发现灵敏度突然降低,就需要考虑,是否是仪器出问题了。火焰首先考虑雾化器是否堵塞,石墨炉首先考虑石墨管是否是烧坏。解决方法是用通丝清理雾化器,更换石墨管后继续测定标准曲线,带灵敏度稳定后进行样品测定。还有,在打开一瓶新的标准溶液的时候,在仪器进行维修以后,一定要注意灵敏度的变化。 1.3线性范围 线性范围这个大家都比较清楚,主要从相关系数r看,一般要求r大于等于三个九。我在这里和大家分享的是,我想了好久才想开的一个问题。之前看好多书上
后来专门做了好多次实验,还是一直是直线在,只是有时候浓度高时,线性不好,高浓度点不在标准曲线上,而是在标准曲线的下面,而且离拟合的标准曲线比较远。遇到这种情况,标准曲线的线性相关系数就很差,有时候才一个九,如图2所示。最后我终于想明白了,如果自己用手动拟合的话,用平滑的曲线去连接所有点的话,你就会发现,如果在线性范围内,连接起来就是直线,如果超出了线性范围,连接起来就是一条弯曲的曲线。从弯曲的拐点开始,就已经超出了线性范围,如图3所示。 所以,判断是否超出线性范围,个人觉得不是看是否弯曲,软件用最小二乘法拟合的一次曲线,永远是直线。要看你的高浓度点是否在拟合的标准曲线上或离得比较近,相关系数是否在三个九以内。如果不在,从拐点开始的那个点,就超出了线性范围,应该删除,从新拟合。 1.4检出限 检出限是指对某一特定的分析方法在给定的置信水平内可以从样品中检测待测物质的最小浓度或最小量。
常用标准溶液配制方法
中华人民共和国国家标准 UDC 543.06:54 —41 GB 601—2002 化学试剂 滴定分析(容量分析)用标准溶液的制备 Chemical reagent Preparations of standard volumetrie solutions 1主题容与适用围 本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。 本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。 2引用标准 GB 603 化学试剂试验方法中所用制剂及制品的制备 GB 6682 实验室用水规格 GB 9725 化学试剂电位滴定法通则 3一般规定 本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。 本标准中所用试剂的纯度应在分析纯以上。 工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。
本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。 本标准中所制备的标准溶液的浓度均指20c时的浓度。在标定和使用时,如温度有差异,应只能附录A(补充件)补正。 “标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。 制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。 4标准溶液的制备和标定 4.1 氢氧化钠标准溶液(使用期:2个月) c(NaOH) = 1 mol/L c(NaOH) =0.5 mol/L c(NaOH) =0.1 mol/L 4.1.1 配制
常用标准溶液的配制及标定
常用标准溶液的配制及标定 修订:段海报 一、EDTA标准溶液的配制与标定 1、EDTAD的配制 EDTA标准溶液,通常用EDTA二钠盐(乙二胺四乙酸二钠)配制。EDTA二钠盐含有两个结晶水(Na2H2Y·2H2O),在常温度下约为含0.3%的吸附水,在80℃干燥可去吸附水,在104-14℃干燥可失去结晶水,的无水EDTA二钠盐(Na2H2Y),以上统称EDTA。Na2H2Y分子量为336.25,EDTA配制时,通常是经过标定,因此,可直接称量配制。不同浓度的EDTA标准溶液的配制可按下表进行,称取EDTA(含水),溶于5L热水中,冷却后,用脱脂棉过滤,最后稀释至60L,混匀,放置1-3天后,进行标定。 EDTA标准溶液的配制对应表 EDTA标准溶液的浓度(mol)配制60L时需要的量(g)摩尔浓度 (mol) 0.09808 2196.0 0.01 201.6 2、EDTA标准溶液的标定 标定EDTA的基准物质,在可能的情况下,尽量采用采测元素的基准物质进行。在一般情况下,多采用光谱纯金属锌作
为标定的基准。以金属锌做基准物质时,金属表面的氧化层,要用干净的剪刀刮干净,或用3M盐酸洗净,再以二次水,乙醚或丙酮洗净,在100℃烘干5min。 金属锌原子质量=65.38 锌标液的配制 将金属锌粒(99.99%以上),先用1%的硝酸浸泡除去表面上的氧化膜至光亮,然后用水冲洗三次,再用少量无水乙醇洗涤三次,在105℃烘干。(不宜过久,以免又产生氧化膜,保存于磨口瓶中)。 配制0.09808M锌标准溶液 称取12.825g的锌粒于500ml的烧杯中,加水150ml,然后分数次加入120ml(1+1)硝酸,在电热板上低温加热溶解,并彻底赶出NO2,将体积浓缩到150ml,使溶液呈无色透明。取下来冷却,移入2L容量瓶中,稀释至刻度。 Zn标准溶液的配制对应表 Zn标液的浓度(mol) 所需金属锌 的质量 理论消耗硝酸(1+1)的量 (ml) 0.09808 12.825 120.0 0.01 1.308 12.24 按照下表的取样量,移取锌标准溶液于500ml锥形瓶中,加水约80ml,加入溴酚绿指示剂(0.1%)2滴,加氨水(1+1)至溶液刚好呈蓝色,加PH=5.5的HAc-NaAc溶液15ml,二
实验教学典型案例 实验名称:邻二氮菲分光光度法测铁 主讲教师:王
实验教学典型案例 实验名称:邻二氮菲分光光度法测铁 主讲教师:王芬 一、实验目的 1、掌握用邻二氮菲分光光度法测铁的原理和方法。 2、掌握分光光度计的使用方法。 二、实验原理 在 pH=3~9 的溶液中, Fe 2+ 与邻二氮菲反应生成一种稳定的橙红色络合物。 显色前需要用盐酸羟胺将Fe 3+ 全部还原为 Fe 2+ ,然后加入邻二氮菲,并调节溶液 酸度至适宜的显色酸度范围。有关反应如下: Fe N N 3 2+ N N 3 Fe 2+ + 该络合物的最大吸收波长为 508 nm ,可在此波长下测量吸光度,由朗伯-比 耳定律计算铁含量。用分光光度法测定物质的含量,一般采用标准曲线法,即配 制一系列浓度的标准溶液,测定相应吸光度,绘制 A-C 标准曲线。然后测定待 测溶液的吸光度,根据测得吸光度值从标准曲线上查出相应的浓度,即可计算试 样中被测物质的质量浓度。 三、试剂和仪器 1、仪器 V-1100型分光光度计、容量瓶、吸量管 2、试剂 (1)0.1mgl -1 铁标准储备液 准确称取0.7020g NH 4Fe(SO 4)26H 2O 置于烧杯 中,加少量水和20mL 1:1 H 2SO 4 溶液,溶解后,定量转移到1L 容量瓶中,用水 稀释至刻度,摇匀。 (2)10 -3 molL -1 铁标准溶液。 (3)100 mgL -1 盐酸羟胺水溶液 。 2Fe 3+ +2NH 2 OH HCl=2Fe 2+ +N 2 +2H 2 O +2H + +2Cl -
(4)15 mgL -1 邻二氮菲水溶液。 (5)10 mgL -1 乙酸钠溶液。 (6)铁未知液。 四、实验步骤 1、显色标准溶液的配制 在序号为1——6的 6只50mL 容量瓶中,用吸量管分 别人加入 0,0.20,0.40,0.60,0.80 铁准准溶液,分别加入 1mL100gL -1 盐酸羟 胺溶液, 摇匀后放置2min , 再各加入2mL 1.5g?L -1 邻二氮菲溶液、 5 mL1.0 mol?L -1 乙酸钠溶液,以水稀释至刻度,摇匀。 2、标准曲线的测绘 以步骤1中试剂空白溶液(1号)为参比,用1cm 吸收池, 在选定波长下测定 2—6 号各显色标准溶液的吸光度。在坐标纸上,以铁的浓度 为横坐标,相应的吸光度为纵坐标,绘制标准曲线。 3、铁含量的测定 试样溶液按步骤 1 显色后,在相同条件下测量吸光度,由标 准曲线计算试样中微量铁的质量浓度。 五、数据处理 以吸光度为纵坐标, 铁含量为横坐标, 绘制工作曲线。 由工作曲线确定待测溶 液的含量。 六、思考题 1、 根据实验数据,计算在最大吸收波长下,邻二氮菲-Fe(Ⅱ)的摩尔吸收系 数ε。 2、 本次实验中用V-1100型分光光度计基本部件有哪些基本部件。 C x A C A A x x
运用Ecel做标准曲线
E x c e l绘制标准曲线全图片教程 随着计算机的日益普及,越来越多的检验工作者希望能从一些烦琐的工作中解脱出来,如:绘制标准曲线、绘制质控图、计算检测值等等。当然借助检验科办公系统理论上是最方便的,但很多单位是没有检验科办公系统的。其实借助Microsoft的Excel电子表格工具对检验工作也会带来很大的便利。 Excel是Microsoft offices系统的重要组成,它是界于WORD字处理软件与ACCESS数据库软件之间的电子表格工具,功能十分强大,特别适合于日常工作使用。使用得好,完全比目前所有的检验科办公系统优秀。 现就先介绍一下如何使用Excel绘制标准曲线。 首先,将数据整理好输入Excel,并选取完成的数据区,并点击图表向导,如下图所示。 点击图表向导后会运行图表向导如下图,先在图表类型中选“XY散点图”,并选了图表类型的“散点图”(第一个没有连线的)。 点击“下一步”,出现如下图界面。如是输入是如本例横向列表的就不用更改,如果是纵向列表就改选“列”。 如果发现图不理想,就要仔细察看是否数据区选择有问题,如果有误,可以点击“系列”来更改,如下图。 如果是X值错了就点击它文本框右边的小图标,结果如下图:
出现上图后,如图在表上选取正确的数据区域。然后点击“下一步”出现图表选项界面,如下图,上应调整选项,以满足自己想要的效果。 点击“下一步”,现在一张带标准值的完整散点图就已经完成,如下图。 完成了散点图,现在需要根据数据进行回归分析,计算回归方程,绘制出标准曲线。其实这很简单,先点击图上的标准值点,然后按右键,点击“添加趋势线”。如下图。 由于本例是线性关系,在类型中选“线性”如下图 点击“确定”,标准曲线就回归并画好了。 标准曲线是画好了,可是我们怎么知道回归后的方程是什么样呢这了简单,点击趋势线(也就是我们说的标准曲线)然后按右键,选趋势线格式,如下图:在显示公式和显示R平方值(直线相关系数)前点一下,勾上。再点确定。好了,现在公式和相关系数都出来了。如图:呵R的平方达,线性相当好。 可是有时候有的项目是成指数增加的,散点图如下图, 将左下方的对数刻度选中,确定。完整的一个半对数标准曲线就做好了。 利用Excel制作标准曲线简单吧如果认真调整参数可以得到不同的效果,大家多研究一下吧。 有人说标准曲线是拿来用的,要是能输入信号值就可以得出浓度那就好了,其实使用Excel也能很自如的处理。具体请听下回分解。
各种化学试剂标准溶液的配制
常用试剂的配制一、标准溶液的配制 1、硫酸(H 2SO 4 )溶液的配制: 1000mL浓度c(1/2H 2SO 4 )=0.1mol/L,即c(H 2 SO 4 )=0.05mol/L的硫酸溶液的配制: 取3mL左右的浓硫酸缓缓注入1000mL水中,冷却,摇匀。 新配制的硫酸需要标定,其标定方法如下: 称取于270-300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠0.2g,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同时做空白试验(取50mL水,加10滴溴甲酚绿-甲基红指示液,同样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色)。计算公式为: 式中: m:无水碳酸钠的质量,g; V 1 :滴定时所用的硫酸的体积,mL; V 2 :空白滴定时所用的硫酸的体积,mL; M:无水硫酸钠的相对分子质量,g/mol,[M(1/2Na 2CO 3 )=52.994)]。 测定氨氮时,氨氮含量的计算: 式中: 氨氮:氨氮含量,mg/L; V 1 :滴定水样时所用的硫酸的体积,mL; V 2 :空白滴定时所用的硫酸的体积,mL; M:硫酸溶液的浓度,mol/L; V:水样的体积,mL。 2、重铬酸钾(K 2Cr 2 O 7 )溶液的配制 1000mL浓度c(1/6K 2Cr 2 O 7 )=0.2500mol/L,即c(K 2 Cr 2 O 7 )=0.0417mol/L的重铬酸钾溶液的配 制: 称取12.258g于120℃下干燥2h的重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL,摇匀,备用。 3、硫酸亚铁铵标准溶液的配制:
