新化学物质申报表
新药(化学药品)申报资料项目

附件一:新药(化学药品)申报资料项目第一部分综述资料1.新药名称(包括通用名、化学名、英文名、汉语拼音。
凡新制定的名称,应说明依据),选题的目的与依据,国内外有关该品研究现状或生产、使用情况的综述。
2.研制单位研究工作的综述。
3.产品包装、标签设计样稿。
4.使用说明书样稿。
第二部分药学资料5.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
6.确证化学结构或组分的试验资料及文献资料。
7.质量研究工作的试验资料及文献资料。
包括理化性质、纯度检查、溶出度、含量测定等。
8.质量标准草案及起草说明,并提供标准品或对照品。
9.临床研究用的样品及其检验报告书(申请;临床时报送)或生产的样品3~5批及其检验报告书(申请生产时报送)。
10.稳定性研究的试验资料及文献资料。
11.产品包装材料及其选择依据。
第三部分药理毒理资料12.主要药效学试验资料及文献资料。
13.一般药理研究的试验资料及文献资料。
14.急性毒性试验资料及文献资料。
15.长期毒性试验资料及文献资料。
16.局部用药毒性研究的试验资料及文献资料,全身用药的过敏性、溶血性、血管刺激性等试验资料及文献资料。
17.复方制剂中多种组分药效、毒性。
药代动力学相互影响的试验资料及文献资料。
18.致突变试验资料及文献资料。
19.生殖毒性试验资料及文献资料。
20.致癌试验资料及文献资料。
21.依赖性试验资料及文献资料。
22.药代动力学试验资料及文献资料。
第四部分临床资料23.供临床医生参阅的药理、毒理研究及文献的综述。
24.临床研究计划及研究方案。
25.临床研究总结资料(包括知情同意书、伦理委员会批准件)。
说明1.新药(化学药品)申请临床研究时报送附件一项目1~24;申请生产时报送附件一项目1~25。
2.放射性新药申报资料的要求详见所附《放射性新药申报资料项目及说明》,其各类放射性新药参照同类别化学药品的要求报送资料。
3.国内外尚未上市的新药,国外机构在我国申请注册者,可以申报在国外完成的研究资料,但应按我国的研究资料项目要求归类整理。
化妆品申报新原料要提交资料

化妆品申报新原料要提交资料化妆品新原料定义:中华人民共和国《化妆品卫生监督条例》(简称条例)在第二章第九条对化妆品新原料已经给出了决定性的注解,为了化妆品使用安全性,我国卫生行政部门对首次使用与进口的新原料实行卫生行政许可监督管理,(包含进口无国家卫生标准的原料)只有获得国家食品药品监督管理局(简称:SFDA)化妆品新原料卫生许可批件后才可使用或进口。
根据《条例》化妆品新原料是指:在国内首次使用与化妆品产生的天然或人工原料。
申报化妆品新原料应提交的资料:(一)化妆品新原料行政许可申请表;(二)研制报告1、原料研发的背景、过程及相关的技术资料;2、原料的来源、理化特性、化学结构、分子式、分子量;3、原料在化妆品中的使用目的、依据、范围及使用限量。
(三)生产工艺简述及简图;(四)原料质量安全控制要求,包括规格、检测方法、可能存在安全性风险物质及其控制等;(五)毒理学安全性评价资料,包括原料中可能存在安全性风险物质的有关安全性评估资料;(六)代理申报的,应提交已经备案的行政许可在华申报责任单位授权书复印件及行政许可在华申报责任单位营业执照复印件并加盖公章;(七)可能有助于行政许可的其他资料。
另附送审样品1件。
申报产品属于下列情况的,除按以上规定提交资料外,还应当分别提交下列资料:(一)申报产品以委托加工方式生产的,应提交以下资料:1.委托方与被委托方签订的委托加工协议书;2.进口产品应提交被委托生产企业的质量管理体系或良好生产规范的证明文件或符合生产企业所在国(地区)法规要求的化妆品生产资质证明文件;3.境外生产企业委托境内企业生产的国产产品还应对行政许可在华申报责任单位进行备案,提交行政许可在华申报责任单位授权书;4.境内生产企业委托境外企业生产的进口产品可不提交行政许可在华申报责任单位授权书、生产和销售的证明文件及产品原包装,应提交产品包装设计。
(二)实际生产企业与化妆品生产企业(申请人)属于同一集团公司的,应提交实际生产企业与化妆品生产企业(申请人)属于同一集团公司的证明文件和企业集团公司出具的产品质量保证文件。
新旧申报资料2.3.S 原料药汇总表对比
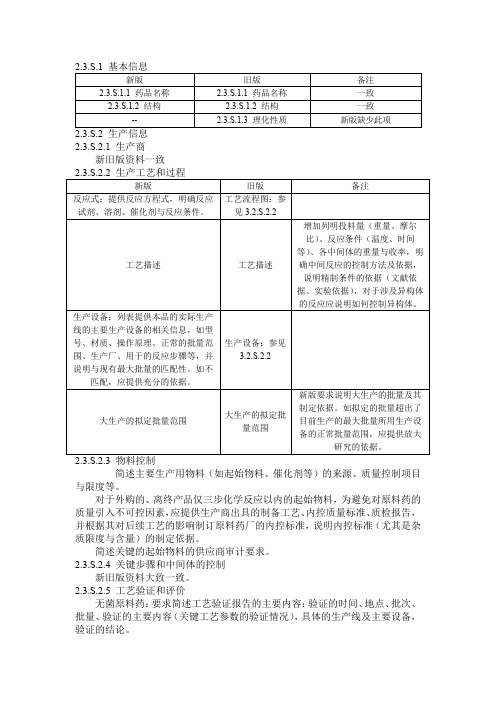
2.3.S.2.1 生产商新旧版资料一致简述主要生产用物料(如起始物料、催化剂等)的来源、质量控制项目与限度等。
对于外购的、离终产品仅三步化学反应以内的起始物料,为避免对原料药的质量引入不可控因素,应提供生产商出具的制备工艺、内控质量标准、质检报告,并根据其对后续工艺的影响制订原料药厂的内控标准,说明内控标准(尤其是杂质限度与含量)的制定依据。
简述关键的起始物料的供应商审计要求。
2.3.S.2.4 关键步骤和中间体的控制新旧版资料大致一致。
2.3.S.2.5 工艺验证和评价无菌原料药:要求简述工艺验证报告的主要内容:验证的时间、地点、批次、批量、验证的主要内容(关键工艺参数的验证情况),具体的生产线及主要设备,验证的结论。
其他原料药:要求简述工艺验证方案的主要内容:拟验证的时间、地点、批次、批量、拟验证的主要内容(关键工艺参数的验证情况),具体的生产线及主要设备,验证的可接受标准。
以附件形式提供验证承诺书及空白的批生产记录样稿(应与今后正常生产本品的SOP保持一致)。
2.3.S.2.6 生产工艺的开发简述在开发阶段对哪些工艺步骤以何质量指标进行了工艺条件的优选与放大研究,并提供相关的综述资料与实验数据的汇总表。
简述工艺开发过程中生产工艺的主要变化(包括批量、设备、关键工艺参数以及工艺路线等的变化),可列表描述(示例见下表)。
并要求列表说明工艺开发新版标题改为杂质谱分析结合起始原料可能引入的杂质、原料药的制备工艺(中间体、副产物)、降解产物等,对可能存在的杂质进行全面的分析和研究。
质所进行的分析和研究结果,并制定合理的控制策略。
明确各杂质对照品的来源、批号、纯度等信息。
2.3.S.4 原料药的质量控制2.3.S.4.1 质量标准新版要求与其他药典标准进行对比,如下:新版资料要求对其他药典收载的主要项目(如,有关物质、异构体、含量)的方法列表进行比较,示例如下:杂质分析方法的验证应采用拟控制的杂质的对照品进行验证,以充分证明该分析方法确实能有效地检出相应的杂质。
新化学物质申报指南(第一版)与(试行)修订对照表

评审委员会讨
的执行标准)”
论意见确定
附录6, 无此内容
增加“和/或该申报物质”
填表要求增加 按 新 化 学 物 质
27. 第13项
内容
评审委员会讨
论意见确定
无此内容 附录 6, 28. 第 2.15
项
增加“提供的光谱数据应该能 反映申报物质的结构。分子结 构与光谱数据必须一致;名称 与分子结构必须一致。”
5款
款的要求
情形二:……., 情形二:…….,并书面通知 简洁描述
通知书只用于
并将《新化学 申报人,登记中心终止审理过
批准
物质免于申报 程。
结果通知书》
(式样见附录 19. 5.2.1
16)发给申报
表中的联系
人,登记中心
中止审理过
程。
情形五:……., 情形五:…….,并书面通知申 简洁描述
通知书只用于
25. 附录 3
accepts all of the contents of the 说明 'authorization statement' in this
理要求
column."
附录6, 无此内容
增加“(当处理处置措施为焚烧 填表要求增加 按 新 化 学 物 质
26. 第12项
或填埋时,应说明焚烧或填埋 补充说明
序 位置
号
(试行)
(第一版)
说明
备注(理由)
增加 4.4.3 标题 中国的供试生物:“中国的供试 增加此标题和 中 国 的 供 试 生
生物”是指在我国境内培育繁 相应内容。 物 的 定 义 经 专
殖、符合技术要求、用于特定
家论证并得到
实验的生物。包括稀有句鲫、
由于篇幅有限

由于篇幅有限,没有列出新化学物质申报表的所有附件,仅以下5个附件为例说明申报材料的准备:1.附件号:1/2.11,2.15/322.附件号:3/6.1,6.2/123.附件号:16/7.1/224.附件号:23/7,8/255.附件号:24/8.1/27附件号:1/2.11,2.15/32结构、纯度测定被测物质名称(代号):XXXXXXX被测物质外观:橙色无味粉末被测物质与申报物质关系:被测物质即是申报物质实验负责机构: XXXXXXX实验机构资质: GLP实验室, 其出具的数据为美国EPA 认可纯度测定:方法:用带紫外检测器的高效液相色谱仪测定(HPLC/UV)® V5000, 容积滴定器水:AQUASTAR甲苯:用火焰电离检测的气相色谱分析法结果:99.1 重量百分比 (范围 98 wt% - 100 wt%)杂质:紫外-可见吸收光谱方法: OECD Test Guideline 101; UV-Vis Absorption Spectra,方法的公认性:此测试方法为EU和美国接受结果:此物质吸收在紫外-可见光谱的紫外区(~200 – 450 nm)的能量, 所以,易受光化降解影响。
红外光谱分析方法:Silverstein, R.N.; Bassler, G.C.; Morrill, T.C. Spectrometric Identification of Organic Compounds, 5th Edition; John Wiley and Sons: New York, 1991 《有机化合物的光谱鉴定》, 第5版 John Wiley and Sons: New York, 1991方法的公认性:此测试方法被EU和美国接受.结果:此物质的红外光谱与已知结构的标准谱图一致。
附件号:3/6.1,6.2/12熔点、沸点被测物质名称(代号):XXXXXXX被测物质外观:橙色无味粉末被测物质与申报物质关系:被测物质即是申报物质实验负责机构: XXXXXXX实验机构资质: GLP实验室, 其出具的数据为美国EPA 认可熔点方法:Annex V, Test A.1; Melting temperature by Differential Scanning Calorimetry (DSC) 差示扫描量热计法方法的公认性:此测试方法为EU 接受结果:在195°C (468 °K) ± 1°C (°K) 熔化并分解沸点方法:Annex V, Test A.2; Boiling temperature by Differential Scanning Calorimetry (DSC) 差示扫描量热计法;方法的公认性:此测试方法为EU 接受结果:在大约6.78 kPa压力下, 196°C ( 469°K) ± 3 °C ( °K) 以上分解附件号:16/7.1/22经口急性毒性研究(固定剂量)(大鼠)被测物质名称(代号):XXXXXXX被测物质外观:橙色无味粉末被测物质与申报物质关系:被测物质即是申报物质实验负责机构: XXXXXXX实验机构资质: GLP实验室, 其出具的数据为美国EPA 认可方法:OECD Guideline for Testing of Chemicals: Guideline 420; Acute Oral Toxicity – Fixed Dose Method )方法的公认性:此测试方法为EU 和美国接受结果:LD50 :>2000 mg/kg观察资料: 4个2000mg/kg雌性动物的异常临床表现仅限于粪便颜色改变(红色)(第0天和1天)和腹泻(第0天),到本研究的第2天,所有大鼠的临床表现正常。
REACH《化学品注册、评估、许可和限制》

REACH 即 Regulation (EC) NO 1907/2023 of the European parliament and of the council of 18 December 2023 concerning the Registration, Evaluation, Authorization and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC。
REACH是欧盟规章《化学品注册、评估、许可和限制》(REGULATION concerning the Registration, Evaluation, Authorization and Restriction of Chemicals)的简称,是欧盟建立的,并于2023年6月1日起实施的化学品监管体系。
这是一个涉及化学品生产、贸易、使用安全的法规提案,法规旨在保护人类健康和环境安全,保持和提高欧盟化学工业的竞争力,以及研发无毒无害化合物的创新能力,防止市场分裂,增加化学品使用透明度,促进非动物试验,追求社会可持续发展等。
REACH 指令要求凡进口和在欧洲境内生产的化学品必需通过注册、评估、授权和限制等一组综合程序,以更好更简单地识别化学品的成分来达到确保环境和人体安全的目的。
ROHS限用物质一览表

(PPM)
化学物质
管理基准
(PPM)
使用禁止物质
/Ⅰ 级管理物质
87
二丁基锡(DBT)化合物/二丁基锡化合物
禁用
1002-53-5
需宣告管理物质
247
其它有机磷化合物
不可有意添加
/
88
三取代有机锡化合物:
三丁基锡类(TBT)/三苯基锡(TPT)
禁用
56573-85-4
668-34-8
248
双酚A(BPA)
48
全氟辛基三磺酰氟(别名PFOSF)
禁止有意添加
208
N-(羥甲基)丙烯醯胺
禁用
49
十氯酮
禁止有意添加
209
氯苯
禁用
50
六溴联苯
禁止有意添加
210
氯甲苯
禁用
51
苯氧基苯类
禁止有意添加
211
单甲基二溴二苯基甲烷;溴苯甲基甲苯,异构体混合物
禁用
52
2-(2'-羟基-3',5'-二叔丁基苯基)-苯并三唑硫丹或硫丹硫酸盐
禁用
212
氯化碳氢化合物
1000
53
五氯苯酚及其化合物(五氯苯酚或其盐或酯)
如含有需申报
含有物质管理
213
三(壬基苯基)亚磷酸酯(TNPP )其中4-壬基苯酚
(支链和直链(4- NP 含量大于等于 0.1%)
不可有意添加
-
54
多氯联苯(PCB类)
禁用
1336-36-3
214
磷化氢
不可有意添加
7803-51-2
55
多氯萘PCN
禁用
中国化学品名录汇总

中国现有化学品名录《中国现有化学物质名录》是为配合《新化学物质环境管理办法》(国家环保总局令第7号)实施而公布的“已在中国生产或者进口的现有化学物质名单”的更新版,其收录范围指自1992年1月1日至2003年10月15日期间,为了商业目的已在中国境内生产、加工、销售、使用或从国外进口的化学物质。
其收录的化学物质指任何有特定分子标识的有机物质或无机物质,包括:①整体或部分地由化学反应的结果产生的物质或者天然存在物质的任何化合物;②任何元素或非化合的原子团。
化学物质包括元素、化合物(含其中的添加剂及杂质)、副产物、反应中间体、聚合物,但不包括混合物、制品(剂)和物品,也不包括下列分属其他有关部门管理的物质:①农药(当作为农药生产、加工进口或销售时)②烟草及烟草制品③放射性物质④军工产品⑤食品、食品添加剂、医药和化妆品(当它们分别作为食品、食品添加剂、医药、化妆品、医药或化妆品生产、加工、进口或销售时)。
本名录数据库收录了环境保护部组织开展的名录收录和增补申报的全部化学物质,包括:1995年核心名录编制(1995年版核心名录);1996~1997年第一次增补申报(正式版《名录》);1999~2000年第二次增补申报(2000年版《名录》);2001~2002年第三次增补申报(2002年版《名录》);2003年第四次增补申报(2003年版《名录》);2003~2004年第五次增补申报(2004年版《名录》);2004~2005年由总局个案处理的补充收录(2005年版《名录》);2006~2007年8月底按总局12号文补充收录的全部物质信息(IECSC 2007版);2007~2008年12月底按总局12号文补充收录的全部物质信息及所有具有化学文摘号的物质结构式图片(IECSC 2008版);2008~2009年10月底按总局12号文补充收录的全部物质信息及所有具有化学文摘号的物质结构式图片(IECSC 2009版);2009~2010年10月底按总局12号文补充收录的全部物质信息及所有具有化学文摘号的物质结构式图片(IECSC 2010版)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新化学物质申报表
申报物质名称:
申报单位名称:
申报提交时间:
国家环境保护总局编制
测试机构资质证明材料可以是:认可认证的复印件
列清各附件。
各附件之间请用彩色纸张或彩色外标签分隔开。
申报
的含量应有一定的限度。
需保密的,应打勾或打叉标注。
2.13
也应办理新化学物质申报。
需保密的,应打勾或打叉标注。
□□
了填表外,各项性质参数均应以附件形式提供尽可能详细的信息。
)
(注:
生物名称,注
意数据计量单
申报表填写的补充说明
申报表填写—填写方式
中文填写,中文申报表上应有原始签章。
为保证申报表电子件和纸张件的内容和格式一致,包括分子结构、“√”
等标注符号在内的申报表各项均应打印填写,不得手写。
申报表各项均应填写,不得有空项。
若某项栏目对申报物质而言没有意义,应填写“不适用”。
若某项栏目信息数据未知,应填写“不详”。
数量信息应用阿拉伯数字填写。
若某项信息数据确为“0”,应填写“0”,不得填写“无”或“零”。
填写选择项时,对选择的项目应标注“X”、“√”或“■”;未标注或以其他形式标注的,视为“不是”或“不选”。
申报表及其附件每页的下方中间都编上页码。
正反面打印的,正反面分别编上页码。
申报表填写—保密
带保密选项的为允许保密项,可以要求保密;要求保密时请标注“X”、“√”
或“■”。
不带保密选项的为不允许保密项,不可要求保密。
未提供信息的项目,不得标注保密。
申报表填写——资料要求
其数量和质量应足以供评审委员会作出客观评估
参照《新化学物质危害评估导则》自我预评估
申报表第I~VIII,第1~14项各项(允许不提供的除外)。
申报物质固有特性—第6、7、8项-数据要求原则
根据下列原则选择提供哪些子项信息:
根据申报物质的特点,选择最能反映申报物质特性及其对环境和健康影响的指标;
选择的指标项数应能充分反映申报物质对环境和健康的影响;
不选择申报物质不具有的属性的指标;
第8项生态毒理学数据,应包括在中国境内用中国的供试生物完成的测试数据。
申报物质固有特性—第6、7、8项-数据来源
数据信息可以来自:
测试结果
文献(原始文献全文, 不能是引文或文摘)
计算结果(仅限于第6项理化性质)
专家判断(仅限于第6项理化性质)
以附件形式提交
联合国六种语言,尽可能中文或英文
申报物质固有特性—第6、7、8项-测试附件
如数据来自测试结果,每个数据来源附件应包括:
测试报告的中文摘要(首页)
测试报告(有测试机构的签章,中间)
测试机构的资质证明材料(末尾)
申报物质固有特性—第6、7、8项-测试报告中文摘要
放在本附件的首页,内容应包括:
被测试物质与申报物质之间的关系,测试物质名称,其中申报物质含量,测试物质的外观。
(注:原则上所有数据应针对申报物质,其中毒理学和生态毒理学数据可以针对申报物质含量最高的上市商品) 测试机构的名称,及关于该机构的资质情况的简要说明
测试方法名称,及关于该方法的公认性的简要说明
国内:《化学品测试导则》(HJ/T153-2004)中规范性引用文件《化学品测试方法》国外:也可使用OECD、ISO等国际通用的方法
测试方法原理条件的简要描述
测试结果。
简化申报—第V、2.8项
申报人填写申报表2.8项申报物质在其他名录收录情况,登记中心将核实。
当登记中心无法核实时,申报人需提交证明申报表2.8项所填写信息的附件(由其他名录相关主管机构签章)。
申报人也可在提交申报材料的同时就提交此附件。
或,申报人以附件形式填写申报表2.9项,说明申报的聚合物的结构、组成信息,及与其相似的《名单》中聚合物的结构、组成信息
系列申报—第V项
只有同时具有分子结构相似、用途相同或者相近、以及测试数据相近的特征的2个或2个以上新化学物质才可申报系列申报。
因此,应以附件形式(同时电子件)列明:①系列中每种新化学物质的名称、CAS号、分子式、分子量、结构式、红外/核磁共振/质谱图等用于鉴别物质的信息;②系列中每种新化学物质的用途及其功能机理;③系列中每种新化学物质的申报表中第6项的相关理化性质数据。
申报表中第7项毒理学和第8项生态毒理学的测试数据可以是该系列中同一种新化学物质的,也可以是该系列中不同种新化学物质的。
联合申报—第V项
相关栏目列明申报人信息。
申报表要求申报人签章的各处都有每个申报人的签章。
依次叠放在申报表相应位置(封面页、第I、IV和1项)
申报材料的提交—材料清单
申报表打印件,A4纸,GB2312
申报表电子件,word,excel格式orWPS
申报附件打印件,3份,A4纸,GB2312
下列附件电子件,word或excel格式(其他附件欢迎提供电子件):
•申报表第2.9项有关聚合物的信息(如果申报物质是聚合物)
•申报表其他栏目的内容(如果表格相应栏目空格不足以填写完全内容) •系列申报中各种物质的相关信息(如果是系列申报)
•联合申报中各申报人相关信息(如果是联合申报
申报材料的提交—附件清单
申报表第2.9项有关聚合物的信息(若申报物质是聚合物)
申报表第2.15项用于申报物质定性的测试方法和谱图
申报表第6、7、8中所列各项测试数据的来源,即测试报告/原始文献全文/计算报告/专家判断报告。
测试报告中文摘要(若测试数据来自测试报告)
测试机构的资质证明(若测试数据来自测试报告,并且所在国实行认证认可制度)
申报表第13项申报物质的MSDS(若提交MSDS)
申报表第14项申报物质的标签样张(若提交标签样张)
申报表其他栏目的内容(若表格相应栏目空格不足以填写完全内容)
简化申报中有关申报物质在其他国家或地区名录中收录的情况(若是简化申报,并且申报人愿意或登记中心要求提交用以证明申报表2.8项所填信息的附件)
系列申报中各种物质的相关信息(若是系列申报)
联合申报中各申报人相关信息(若是联合申报)。
