A. Vector NTI应用
Vector NTI的使用经验交流

Thank you!
4. 加入特征:点击工具栏中的add feature按钮,出现右图框体,可 以选择添加的类型,长度并对其 命名
序列的添加
选中需要添加序列的位置,点击 “ Edit-New-Insert sequence at…”
将需要插入的序列复制进去,点击OK便可以完成序列的插入,随 之再利用之前所说到的add feature功能对其添加特征
图谱显示的变更 右键pMV2614488,选择”Molecule Properties…”
勾选图谱的各项属性,由linear改为circular
数据的保存
存为文件
保存至本地数据库
图谱的导出
在图谱空白处点击右键--camera
可以选择复制到剪贴板(clipboard)然后粘贴到PS或画图进行进一步编辑 或者可以直接输出为图片文件(file),不过只能选择jpg格式
文字窗口
图谱窗口 序列窗口
载体序列的操作
点击File-Open打开如下界面选择从GenBank上下载的文件
该序列的常规信息
以图形+注释的形式显示序列的特征:可编辑
序列信息:默认以双链形式显示,复制时默认复制正链
限制性酶切位点分析
选择工具栏中的Restriction site
选择需要添加或移除的酶切位点
Web of Science
检索高被引文章 检索近期高被引文章
位于页面左侧的筛选方式相较于NCBI更加可视化
文献清晰图片的导出方法ቤተ መጻሕፍቲ ባይዱ
直接去下载文章的官方网站获取图片
找到图片的位置并点击弹出新窗口 点击放大以获取最大的图片
点击download slide会下载一张ppt,其中带有矢量图片
Vector NTI使用介绍(PPT)共62页文档

☼ Importing molecules or sequences ☼ Manually creating new molecules
Constructed DNA/RNA Molecules
☼ Splicing exons of an intron-exon join feature of another molecules ☼ Constructing from compatible component fragments from other molecules ☼ Designing from components of a user-defined fragments list ☼ Back-translating from protein molecules from components of a user-defined fragments list
Constructed Protein Molecules
☼ Translated from a coding sequence of a DNA molecule ☼ Does not receive the Feature map from its parent DNA molecule
Methods of Creating New Molecule in Vector NTI
Restriction sites n required, the methods of terminus modification are defined by users.
Recipient and donor fragments are selected by users.
vector nti 使用教程 多重序列比对
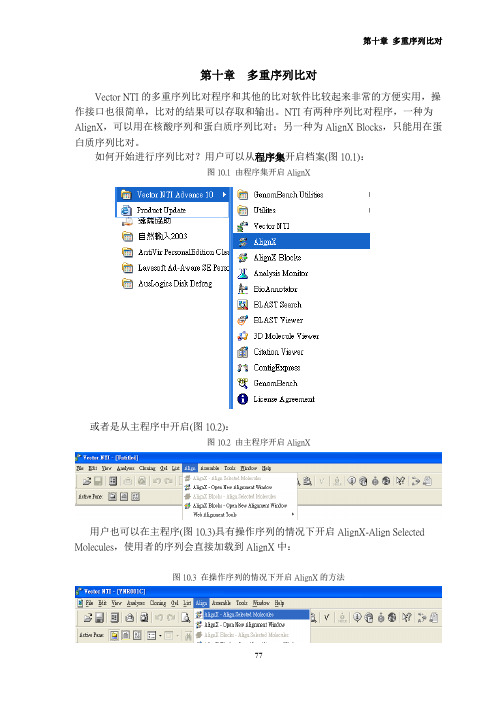
第十章多重序列比对 Vector NTI的多重序列比对程序和其他的比对软件比较起来非常的方便实用,操作接口也很简单,比对的结果可以存取和输出。
NTI有两种序列比对程序,一种为AlignX,可以用在核酸序列和蛋白质序列比对;另一种为AlignX Blocks,只能用在蛋白质序列比对。
如何开始进行序列比对?用户可以从程序集开启档案(图10.1):图10.1 由程序集开启AlignX 或者是从主程序中开启(图10.2):图10.2 由主程序开启AlignX 用户也可以在主程序(图10.3)具有操作序列的情况下开启AlignX-Align Selected Molecules,使用者的序列会直接加载到AlignX中:图10.3 在操作序列的情况下开启AlignX的方法 开启AlignX之后,使用者会见到图10.4的画面:图10.4在操作序列的情况下开启AlignX首先用户要把序列加载Vector NTI程序中,可以点选或者从左上方的Project →Add Files把序列档案加载,请注意文件名不可以过长,檔名过长会造成程序进行比对时无法完全显示文件名(图10.5):图10.5 输入的档名注意不可过长 选取档案后按下开启就可以加载程序中,若比对的序列很多时可以用鼠标圈选欲分析的序列后选择开启。
序列档案加载的时候程序会询问该序列为核酸序列或是蛋白质序列,点选好以后再点选Import就可以了(图10.6):图10.6 载入时,会询问序列的性质,核酸序列或蛋白质序列接下来程序的左上方会出现使用者加载的序列(图10.7),序列加载完成以后就可以开始进行比对的操作:图10.7 成功载入序列的画面进行比对前,先把欲比对的序列用鼠标进行圈选(图10.8):图10.8 选取欲比对之序列只要按下或是从上方Align→Align Selected Sequence(图10.9)就会进行比对运算:图10.9按下Align→Align Selected Sequence进行比对运算好以后就会出现下面的画面(图10.10);图10.10 比对完的结果 分析完成后画面(图10.11)会出现比对的相关结果,最下方是序列比对的图形,左边中间的区块所显示的图形为导引树(Guide tree),用来表示序列之间的关连性。
Vector NTI Suite使用简介

Vector NTI Suite使用简介资料来源:丁香园 Vector NTI Suite是一套功能强大、界面美观而又友好的分子生物学应用软件包。
它主要包括四个组件,分别对DNA、RNA和蛋白质进行各种分析和操作。
一、Vector NTI作为Vector NTI Suite的核心组成部分,它可以在各种分子生物学研究项目的全过程中提供数据组织、编辑和分析支持。
(一)对分子序列的操作我们以一个DNA序列为例,进行一系列的常规分析;最后将此DNA序列翻译成氨基酸序列,并对此氨基酸序列进行各种分析。
A,DNA序列为猪生长激素的cDNA序列,长为761bp。
首先使用Vector NTI的Create New命令将此序列导入到Vector NTI的数据库中:1,第一种方法:如果只知道序列时,点击Molecule才菜单中的Create New——Using Sequence Editor(DNA/RNA……);2,在出现的“New DNA/RNA Molecule”对话框中,首先在General填入导入序列的名称——PGH;3,在DNA/RNA Molecule活页中,选中Linear DNA, Animal/other Eukaryotes,Replicon Type中选Chromosome;4,Description中填入:S.Scrofa Growth hormone mRNA;5,在Sequence and Maps中点击“Edit Sequence”按钮,将DNA序列复制后,点“Paste”按钮-点“OK”-确认后就可以完成序列导入。
B,如果是一个从GenBank上下载的序列文件,则:点击“Molecule”菜单-Open-Molecule files命令,找到序列文件,在File format中选中GenBank Files;点击OK。
(二)常规操作:当序列导入完成后,在桌面出现三个窗口,上左侧的窗口中显示的是该序列的常规信息,上右侧窗口则以图形的格式展示序列的特征区及酶切图谱等。
vector NTI 11 使用教程 第12章 序列串接

第十二章 序列串接 使用Vector NTI中的ContigExpress程序(图12.1)可利用序列相似度,将小片段序列进行串连。
此程序可以将单纯序列文本文件或是由定序出来的讯号档案直接进行分析,串接后的片段称为Contigs,在进行长片段的序列定序或是genomic library定序时非常实用。
图12.1 使用ContigExpress将小片段序列串接将小片段的序列串接成完整大片段序列的方式如下之操作过程。
可以直接开启或是从主程序项目开启ContigExpress 程序(图12.2-3):图12.2 利用程序集开启ContigExpress程序图12.3 利用主程序开启ContigExpress程序开启此程序后会出现一个操作的画面,此画面会分为左右两个区块:图12.4 ContigExpress程序产生的两个区块在此窗口中,用户要先加入序列的档案。
一般序列的文本文件格式都可以加入程序中,而含有定序讯号的序列档案一般都为abi的文件格式,如果没有相关的程序是无法读取进行分析,而ContigExpress 可以读取和分析这种类型的档案。
要将序列档案或是定序的abi档案加载程序中的话,只要选择Project→Add Fragments就可以选择要加载程序的档案了(图12.5):图12.5 选择Project→Add Fragments加载程序的档案用户可以从窗口的左边的Fragments(图12.6)按下右键后选择Add Fragments 加入序列档案:图12.6 在Fragments 右键单击加入序列档案接下来由文件夹中选择欲加入的序列,可按住Ctrl键后用鼠标进行复选(图12.7):图12.7 可利用 Ctrl键,选取多个档案点选开启后,如果程序出现一连串的警告声并出现是否的寻问,那只是文件名一致性的修正询问,使用者可以忽略该状态并持续点选“是”的选项直到所有档案加载全程序为止(图12.8)。
vector nti 11 使用教程 附录A:如何取得序列

附录A 如何取得欲分析之序列透过网络抓取序列范例:首先,我们可以先进入NCBI 网站( /) (图A.1),在首页 “Search”下拉式选单及“for”文字盒中选择及输入适当选项内容,例如Search→Nucleotide;for →cyp1A,然后按下”Go ”按钮进行搜寻。
A.1 NCBI 网站此时 NCBI会传回如下之画面,目前 NCBI Nucleotide database 已经分成三个独立数据库,适当选择所需内容,点选所显示之数字进入适当数据库并进行下一步选择。
三个数据库分别为∙CoreNucleotide contains all Nucleotide records that are not in EST or GSS.They are of interest to most users.∙EST contains only Expressed Sequence Tag records.∙GSS contains only Genome Survey Sequence records.A.2 CoreNucleotide数据库例如点选图A.2中 “81 CoreNucleotide”之选项,可以进入更细部的选择,在CoreNucleotide数据库中总共含有81笔相关记录(图A.3),可依使用者所需进行点选,于此我们选择斑马鱼(zebrafish Danio rerio) 为范例进行说明,所以将点选第4笔数据NM_131879(Danio rerio cytochrome P450, family 1, subfamily A (cyp1a), mRNA)并得到如下图A.4:A.3 得到81笔斑马鱼的相关数据A.4 点选NM_131879得到的结果可以在左上角“Display”下拉式选单中选取“FASTA”,并得到以下仅含序列内容的画面信息(A.5)。
A.5 NM_131879FASTA格式的数据确定为所需之序列内容后,在“Display”下拉式选单右边 “Send to” 的下拉式选单选取“File”,此时系统将启动档案下载对话窗口,按下“储存”进行档案(FASTA格式)下载。
vectornti使用教程第十六章_GenomicAnalysisI

vectornti使用教程第十六章_GenomicAnalysisI第十六章:基因组分析I本章将介绍如何进行基因组分析。
基因组分析是对一个或多个生物体的基因组进行研究和解读的过程。
该过程涉及到收集、整理和解析大量的基因组数据,以了解生物体的遗传信息、基因功能和基因组结构。
以下是一个基因组分析的一般流程:1.数据收集:基因组分析的第一步是收集所需的基因组数据。
这些数据可以是DNA序列、RNA序列、基因组注释信息等。
2.数据整理:收集到的数据需要经过一系列的处理来整理和准备,以便于后续的分析。
这个过程中可能包括数据清洗、去除冗余数据、对数据进行标准化等。
3. 基因组注释:注释是对基因组数据进行功能和结构解读的过程。
通过注释可以了解基因的功能、基因之间的关系以及可能的遗传变异等。
常用的注释工具包括Ensembl、NCBI等。
4.基因功能分析:基因功能分析是对基因组数据进行功能注释的过程。
通过比对已知的基因数据库,可以确定基因的功能以及与其他基因的关联程度。
这个过程中常用的工具有BLAST、HMMER等。
5. 基因组结构分析:基因组结构分析是对基因组序列进行结构解读的过程。
通过分析基因的启动子、外显子以及剪接位点等,可以了解基因组的结构变异以及可能的突变情况。
常用的工具包括Geneious、Cufflinks等。
6. 基因组比较:基因组比较是将不同生物体的基因组数据进行比较的过程。
通过比较不同生物体的基因组,可以了解它们之间的遗传关系、共享的功能基因以及可能的进化路径。
常用的工具包括Mauve、UCSC等。
7. 数据可视化:最后一步是将分析结果进行可视化展示。
通过可视化可以更直观地理解基因组数据,并使得结果更易于解读。
常用的可视化工具包括Cytoscape、UCSC Genome Browser等。
以上是基因组分析的大致流程,实际的分析过程可能因具体的研究目的和数据类型而有所调整。
基因组分析是生物信息学领域的重要研究方向,它对于理解生物体的遗传信息和生命过程有着重要的意义。
vector nti 11 使用教程 第二章_资料库建立和储存序列

第二章 数据库建立和储存序列在了解主程序的样子之后,接下来必须要先了解NTI的数据是如何储存和读取,并且建立自己的序列数据库。
在NTI的程序中会有一个内建好的数据库,同时把存盘的路径预先设定在数据库的位置之中。
我们自身主机的数据库叫做Local Database,同时NTI提供了数据库分享的功能,可以透过网络和其他主机交换或分享序列数据。
如何建立自己的数据库?首先在主程序下点选(Local Database)开启数据库,为分享和交换数据库的指令。
Local Database开启后会看到下面图示(图2.1):图2.1 使用Local Database开启数据库 进入数据库后会先看到右手边的窗口有一大堆数据,那是程序事先内建好的序列数据,可以直接点选开启。
数据库会因为序列的性质不同而有不同的归类,想要看不同的类别可以在左上角选择。
图2.2 建立数据库 接下来要建立属于自己的数据库了,以斑马鱼的基因序列为例,第一步在DNA/RNA Molecules (图2.2)的项目下点选后会在Invitrogen vectors下方出现一个Group1的文件夹,可以自己改名。
在新的文件夹项目下再点选,会跳出一个窗口(图2.3):图2.3 新建数据库 旁边的字段可以输入名称,接着点选DNA/RNA Molecule(图2.4):图2.4 新的DNA/RNA模块 在此项目下可以选择序列的特性,这些项目的选择会影响到主程序的分析和图谱形状,可以依照序列的特性设定。
接着再点选Sequences and Maps:图2.5 编辑斑马鱼海大基因的序列 在此窗口(图2.5)下,我们就将要加载的序列先全选后再按复制,之后在这窗口下点选Paste后就可以贴入序列。
图2.6 贴上斑马鱼海大基因序列 接着按OK后再按确定(图2.6),如此便建立好我们的序列数据了。
之后要开启此数据时,只要进入Local Database后,在自己建立的文件夹下连续点两下该文件名就可以直接开启。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新建子目录
数据输入
3. ORF分析 线形化 分析----线形化 分析
在图形处, 在图形处,右键单击
提取 RRSV-S6-ORF 序列
• • • • (1) Ctrl + C (2) 打开TXT文挡 (3) Ctrl + V (4) 保存
4. ORF 酶谱分析
OK, OK
5.引物设计一 手工设计 引物设计一:手工设计 引物设计一
P-设计 设计
5.引物设计二 自动设计 引物设计二:自动设计 引物设计二
• • (1)选中所有序列 (2) Analyze Find PCR Primers
(3) 检测引物
(4)克隆引物
酶切位点 和
保护碱基
需要手工加上去! 需要手工加上去!
(5)测序引物
• Analyze • sequencing Primers
(6)简并引物设计
• Aligment分析后, 手工设计
6.多重序列联配
Vector-NTI 8.0的使用
邵朝纲
学Байду номын сангаас内容提纲
• • • • • • 1.从GenBank下载目的基因序列 2.Vector NTI 8.0数据输入 3. ORF的分析 4. 基因酶谱分析 5.引物设计 6.同源性分析
1.从GenBank下载目的基因序列
2. Vector NTI 8.0数据输入 数据输入
