2018-2019学年高中化学必修一人教版第三章章末系统总结Word版含答案
2019秋人教版高中化学必修一第三章章末系统总结 课件(共23张PPT)

(2)同学们对实验 a 中产生的气体的组成看法不一, 提出了以下几种假设:①该气体是 CO;②该气体是 H2。 请你推测该气体还可能是什么气体?
提示:O2 (3)设计一个实验,证明你在(2)中的推测(写出简要操 作步骤,反应现象和结论)。
操作步骤 反应现象
结论
提示:操作步骤:收集气体,将带火星的木条靠近 集气瓶口(或试管口);反应现象:带火星的木条复燃;结 论:该气体是氧气。
(2)从脱脂棉的燃烧可以推出关于 Na2O2 与 CO2 反应 的结论是 a.______________,b.______________。
(3)Na2O2 与 CO2 反应的化学方程式是____________ ___________________________________________。 还原剂是________,氧化剂是________。 解析:稀盐酸与碳酸钙反应放出 CO2,CO2 遇 Na2O2 发生反应:2Na2O2+2CO2===2Na2CO3+O2,该反应放 热,使脱脂棉的温度很容易达到其着火点,且生成的 O2 助燃,故脱脂棉会剧烈燃烧起来。在上述反应中只有
_______________。
(2)实验开始时应先将活塞 E________(填“打开”或 “关闭”),其目的是______________________________。
在 C 中收集到的气体主要为________。 (3)简述生成 Fe(OH)2 的操作过程:_______________ ___________________________________________。 (4)拔去装置 B 中的橡皮塞,使空气进入,看到的现 象为 ___________________________________________; 写出有关反应的化学方程式:___________________ ___________________________________________。
人教版2018-2019学年高一化学必修一第三章金属及其化合物非选择题汇总及答案(解析版)

第三章金属及其化合物非选择题1.根据你对金属钠性质的了解,回答下列问题。
(1)下列关于钠的叙述中,正确的是________。
A.钠是银白色金属,密度比水的大B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠C.金属钠在空气中燃烧,生成氧化钠D.金属钠的熔点很高(2)由于金属钠很容易跟空气中的________等物质反应,通常将它保存在________里,以使它与________等隔绝。
解析通过外观和钠与氧气反应的实验现象可知,钠的物理性质有:银白色、密度小、熔沸点低、质软、能导电、导热等,作为活泼的金属,钠易与O2等发生化学反应。
(1)A选项中钠的密度比水的小,错误;C选项中有关钠在空气中燃烧的产物说法有误;D选项中有关金属钠熔点的描述不符合事实。
只有B项正确。
(2)由于金属钠很活泼,很容易跟空气中的氧气等物质反应,因此保存时应隔绝空气,通常保存在煤油里,这是因为钠的密度大于煤油的密度且钠与煤油不反应,钠在煤油中沉在底部而避免了与空气接触。
答案(1)B (2)氧气煤油氧气2.有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。
根据以上信息回答下列问题:(1)写出化学式:A________;B________;C________。
(2)写出化学方程式:①A在空气中燃烧:_____________________________________________________________;②C与水蒸气反应:____________________________________________________________;③A与水反应:_______________________________________________________________。
解析淡黄色固体是过氧化钠,故A是钠;B能在空气中剧烈燃烧,发出耀眼的白光,故B 是镁;金属在一定条件下与水蒸气反应生成H2和一种黑色固体,该金属是铁。
新教材2019高一化学人教版必修一第三章3.1铁及其化合物(知识点+课后习题)

第三章铁金属材料第一节铁及其化合物1.了解单质铁、铁的氧化物的性质及用途。
2.认识铁单质与水蒸气反应的条件,通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
3.掌握Fe、Fe2+、Fe3+相互转化的途径,通过实验探究学会Fe2+、Fe3+的检验方法。
4.掌握实现铁及其化合物之间转化的试剂和条件。
知识点一铁的单质知识点二铁的氧化物和氢氧化物知识点一铁的单质1.铁的存在和冶炼(1)存在铁在自然界中可以以单质形态(如陨铁)存在,但主要以+2价和+3价化合物的形态存在于矿石中,在地壳中的含量居第四位,仅次于氧、硅和铝。
(2)冶炼工业炼铁的原理是利用还原的方法把铁从铁矿石中提炼出来,化学方程式:3CO+Fe2O3=====高温2Fe+3CO2(以Fe2O3为例)。
2.铁的物理性质铁有延展性、导热性。
铁能导电,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点较高。
3.铁的化学性质(1)与某些非金属单质、酸和盐溶液反应①Fe与非金属单质反应②Fe与非氧化性酸反应(稀H2SO4)Fe+2H+===Fe2++H2↑。
③Fe与盐溶液反应(CuSO4)Fe+Cu2+===Cu+Fe2+。
(2)实验探究铁粉与水蒸气的反应实验装置操作现象用火柴点燃肥皂液,听到爆鸣声,证明生成了H 2实验结论在高温下,铁能与水蒸气反应,化学方程式为3Fe +4H 2O(g)=====高温Fe 3O 4+4H 21.下列物质在氧气中燃烧,现象为火星四射,有黑色固体生成的是A .红磷B .木炭C .铁丝D .酒精【答案】C【解析】红磷在氧气中燃烧时会产生大量的白烟,生成白色固体,A 错误;木炭在氧气中燃烧时会发出白光,生成无色气体,B 错误;铁丝在氧气中燃烧时火星四射,生成黑色固体,C 正确;酒精在氧气中燃烧时火焰为淡蓝色,生成无色气体,D 错误。
2.(2023桂林高一检测)下列各项物质间的转化不能通过反应一步完成的是()A .Fe→Fe 3O 4B .3C .Fe→FeCl 2D .Fe→Fe(OH)3【答案】D【解析】Fe 与O 2点燃可得到Fe 3O 4,能一步反应完成,A 不符合题意;Fe 与Cl 2点燃可得到FeCl 3,能一步反应完成,B 不符合题意;Fe 与盐酸反应可得到FeCl 2,能一步反应完成,C 不符合题意;Fe 不能一步反应生成Fe(OH)3,D 符合题意。
人教版化学课件 必修一 第三章第三章课后习题答案

课本53-54页
1、在实验室中,应把金属钠保存在煤油中,这是由于 钠很容易与空气或水反应,钠的密度比煤油的大,沉在 煤油底部,煤油起到隔绝空气的作用。
4Na+O2=2Na2O 2Na+O2△=Na2O2
2Na+2H2O=2NaOH+H2
2、B 3、B 4、D 5、D 6、A △
7、 (1)非3F离e子+反4H应2O(g)= Fe3O4+4H2
54g
6g
m(Al)
6g× m(Al)
m1(H2)=
54g
= m(Al) 9
m1(H2) 2g× m(Mg)
Mg + 2HCl == MgCl2+ H2
24g
2g
m2(H2)=
24g
m(Mg)
m2(H2)
= m(Mg)
(1)当m(Mg)=m(Al), 则m1(H2) > m2(H2) 12
故铝与酸反应放出氢气多
11.(1)设镁的物质的量为n(Mg) mol,铝为n(Al)mol
5.6L
n(H2)= 22.4L/mol =0.25mol
Mg + 2HCl == MgCl2+ H2
1
1
n(Mg) mol
n(H2)1
必修一化学第三章章末总结

20
本章知识总结
本章难点突破
解析 (1)若B是能使品红溶液褪色的有刺激性气味的无色气体,则B是二氧化硫,
C是三氧化硫,D是硫酸。若大量排放二氧化硫,则会形成酸雨。
(2)若C是红棕色气体,则C为二氧化氮,B为一氧化氮,A为氨气,D为硝酸。浓硝
酸能与铜反应,生成硝酸铜、二氧化氮和水,该反应属于氧化还原反应。
23
本章知识总结
本章难点突破
解析 A 与 NaOH 固体加热反应生成能使湿润的红色石蕊试纸变蓝色的无色气体 B, 则 B 是 NH3,A 是铵盐。D 是无色无味气体,由 B+D―→E,E+D―→F 可推测 D 为 O2,则 E 为 NO,F 为 NO2,NO2 与 H2O 反应生成 HNO3(G),在加热条件下 HNO3 与木炭反应生成 NO2 和 CO2,即 C 为 CO2,A 为 NH4HCO3。
本章难点突破
FeO的性质黑 与 F与3Fe色 稀 稀2e+3+ +粉 硫 硝+H末 酸 酸N2O或 反O↑稀 应+盐 :5酸 3HF反e2OO应+:10FHeO+++N2OH-3+======碱性氧化物,既有氧化性又有还原性
铁的氧化物Fe2O3的性质与2与红F氢稀棕e3+碘硫色+酸酸粉3H(或末2OH稀,I盐赤的酸铁水或矿溶稀的液硝主)酸要反反成应应分::FeF2Oe23O+3+6H6+H++=2=I-====碱性氧化物且有氧化性
16
本章知识总结
本章难点突破
2.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关 于C的性质的叙述错误的是( )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱 解析 根据已知信息,可以推断出A为Na,B为Na2O2,C为Na2CO3,D为NaOH。 Na2CO3属于盐,D项错误。 答案 D
人教版高中化学必修1课后习题参考答案

6. 建议从铝的矿产资源、铝的冶炼、铝 燃烧放出的热量、铝燃烧的条件、燃烧 容器等方面去考虑。
返回
1.酸、强碱、两性、两性 2.生成白色沉淀、沉淀不消失;生成 白色沉淀、沉淀消失 3.B 4.C 5.2FeCl3+Cu=2FeCl2+CuCl2 三价铁被 还原为二价铁,铜从0价升高到+2价。 6. 先生成白色絮状 Fe(OH)2 ,而后迅 速变为灰绿色,最后变为红褐色的 Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 FeSO4+2NaOH=Fe(OH)2↓+Na2SO4; 7.Na2CO3,21.2 g
3.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 4.Ca(ClO)2,优点是漂白粉的性质比氯 水稳定,可以长时间放置,便于保存和运 输。 5.观察包装袋是否密封,漂白粉中有 无结块,注意使用期限,现买现用,购买 之后应密闭保存在干燥的地方等。 6.应十分小心,不要吸入氯气,不要 把氯气大量排放到空气中去等。应在通风 厨中进行实验。 7.D 8.C
下一页
4. 在可能含有可溶性硫酸盐、碳酸 盐和硝酸盐的溶液中,加入 BaCl2 溶液 时,生成的沉淀不一定是BaSO4 ,也可 能是BaCO3,或两者均有。可向有沉淀 的液体中加入盐酸(或稀硝酸),振荡。 若沉淀消失,说明该沉淀是BaCO3;若 沉淀不消失,说明该沉淀是BaSO4 ,若 沉淀减少,但不完全消失,则说明两种 沉淀都有。
新课标化学必修(Ⅰ) 习题参考答案 第一章 从实验学化学 第二章 化学物质及其变化 第三章 金属及其化合物 第四章 非金属及其化合物
第一章参考答案 第一节化学实验基本方法 第二节 化学计量在实验中的应用
高一化学必修一第三章知识点总结归纳

高一化学必修一第三章学问点总结归纳其实,不是化学太难,而是你的(学习(方法))出现了严峻的问题。
只要方法得当,你完全可以很快告辞“差生”!今日在这给大家整理了(高一化学)必修一第三章,接下来随着一起来看看吧!高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻挡内部金属接着被氧化。
镁在空气中燃烧,产生刺眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳(总结)金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
1.推断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子实力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
高中化学人教版必修一第三章归纳与整理
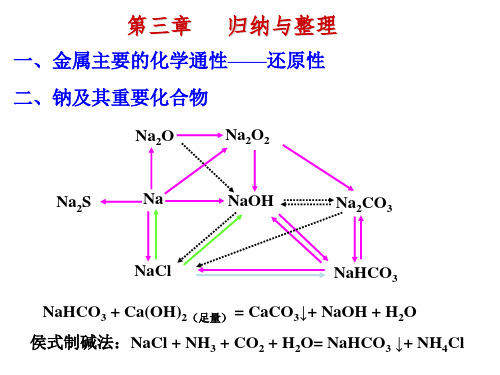
(4)“侯氏制碱法”与“索尔维法”相比较,其优点是 _______N_a_C__l被__充__分__利__用__,__N__H_4_C__l可__作__氮__肥__和__其__它__工__________ _______业___原__料__,__不__产__生__用__途__较__小__的__C_a_C_l_2_等__废__渣__,__降。
C.甲中酸过量、乙中铝过量
D.甲中酸过量、乙中碱过量
从定性和定量的角度理解铝与酸、碱反应的实质
2Al + 6H+ = 2Al3+ + 3H2↑ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
①等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比VVNHaOClHHH22=1∶1。
讨论:比利时人索尔维以NaCl、NH3、CO2、H2O等为原料制 Na2CO3的方法称“索尔维法”。其主要过程为: ①向氨化饱和NaCl溶液中通入足量CO2制得小苏打; ②把小苏打焙烧得到纯碱,分解产生CO2循环使用; ③在析出小苏打后的母液中加入生石灰,产生NH3循环使用。 我国著名化学家侯德榜先生对“索尔维法”进行改变,1943年研
NaCl + NH3 + CO2 + H2O= NaHCO3 ↓+ NH4Cl NH3 +CO2 + H2O = NH4HCO3 NaCl + NH4HCO3 =NaHCO3 ↓ +NH4Cl
也可以写成:
(3)向析出NaHCO3后的母液中加入生石灰的反应方程式为
△ CaO H2O Ca(OH)2 、2NH4Cl Ca(OH)2 CaCl2 2NH3 2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.将少量稀盐酸滴加到盛有碳酸钙的U形管中,可观察到U形管中的脱脂棉剧烈燃烧。
(1)稀盐酸与碳酸钙反应的离子方程式是___________________
______________________________________________________。
(2)从脱脂棉的燃烧可以推出关于Na2O2与CO2反应的结论是a.__________________,b._________ _________。
图甲图乙
即时训练
3.某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如图所示实验方案:
按照图示进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行,最终在________容器中观察到白色沉淀,该实验中涉及的化学方程式有_______________________________________________________
(3)Na2O2与CO2反应的化学方程式是______________________
______________________________________________________。
还原剂是________,氧化剂是________。
解析:稀盐酸与碳酸钙反应放出CO2,CO2遇Na2O2发生反应:2Na2O2+2CO2===2Na2CO3+O2,该反应放热,使脱脂棉的温度很容易达到其着火点,且生成的O2助燃,故脱脂棉会剧烈燃烧起来。在上述反应中只有Na2O2中的氧元素的化合价发生变化,故Na2O2既是氧化剂,又是还原剂。
提示:O2
(3)设计一个实验,证明你在(2)中的推测(写出简要操作步骤,反应现象和结论)。
操作步骤
反应现象
结论
提示:操作步骤:收集气体,将带火星的木条靠近集气瓶口(或试管口);反应现象:带火星的木条复燃;结论:该气体是氧气。
(4)写出该淡黄色固体与稀盐酸反应的离子方程式。
提示:2Na2O2+4H+===4Na++O2↑+2H2O
_____________________________________________________。
(2)实验开始时应先将活塞E________(填“打开”或“关闭”),其目的是____________________________________________。
答案:(1)CaCO3+2HCl===CaCl2+CO2↑+H2O
(2)Na2O2(3)CaCl2或P2O5
(二)氢氧化亚铁的制备方法
教材中有关Fe(OH)2的制备方法,实际上只能观察到瞬间的Fe(OH)2白色沉淀(几乎分辨不出)。要较长时间观察到白色沉淀的生成,关键是降低反应体系中氧气的存在量和操作过程中氧气的引入量。
第三章
(对应学生用书P65)
一、重点知识梳理
二、实验探究
(一)Na2O2的主要性质探究
某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应。例如,它与CO2反应时,只生成了Na2CO3和O2,它与稀盐酸反应时,只生成了NaCl、H2O和O2。上课时,老师做了如下实验:
a.取少量的淡黄色的颗粒状固体投入到盛有少量的试管中,可观察到产生了一种无色无味的气体;
方法1:装置如图甲所示。在试管中加入适量的5% FeSO4溶液,并覆盖一层苯,再用长滴管注入不含O2的1 mol·L-1NaOH溶液。由于苯的液封作用,防止了生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
方法2:装置如图乙所示。实验时,先打开活塞K,再将分液漏斗中的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后闭关K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的Fe(OH)2白色沉淀。若拔去广口瓶上的橡胶塞,则白色沉淀迅速变成灰绿色,最后变成红褐色。
________________________。
解析:依题意,关闭弹簧夹C后,容器A中的反应仍在进行,产生的氢气将A中生成的FeSO4溶液压入容器B中,与容器B中的NaOH溶液接触,生成Fe(OH)2沉淀。
答案:BFe+H2SO4===FeSO4+H2↑FeSO4+2NaOH===Fe(OH)2↓+Na2SO4
4.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的化学方程式为___________________________
b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红。根据实验现象,回答下列问题:
(1)淡黄色的颗粒状固体中一定含有什么元素,依据是什么?
提示:淡黄色的颗粒状固体中一定含有钠和氧两种元素,因为该物质与稀盐酸反应时,生成NaCl、H2O和O2,所以根据质量守恒规律知该固体中一定含有钠和氧两种元素。
(2)同学们对实验a中产生的气体的组成看法不一,提出了以下几种假设:①该气体是CO;②该气体是H2。请你推测该气体还可能是什么气体?
答案:(1)2H++CaCO3===Ca2++CO2↑+H2O
(2)反应生成O2反应放热
(3)2Na2O2+2CO2===2Na2CO3+O2Na2O2Na2O2
2.干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体,并将A、B、C按如图所示连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是_______________________________。
(2)在装置B中的淡黄色粉末是________。
(3)在干燥管C中的白色固体应为________。
解析:此题以蜡烛火焰的明亮和熄灭为突破口。明亮一定是通入了O2,而熄灭一般是CO2。由此可确定B中是Na2O2(淡黄色粉末)和CO2的反应;从而可知A是产生CO2的简易启普发生器,C中是一个不与CO2反应的白色固体,即是中性或酸性的固体干燥剂。
