分析化学 试题A
分析化学试题a卷参考答案

分析化学 期中试题 (A卷) 参考答案环境科学与工程学院(2007.4)姓名班级学号一、选择题(有且只有一个答案正确,将正确答案的序号写在题前的方括号内,每题2分,共60分)[ B ] 1.根据试样的用量,分析方法可以分成常量、半微量、微量和超微量分析,那么用于常量分析的液体取样量为:(A)>100mL;(B)>10mL;(C)1~10 mL;(D)<1 mL.[ A ] 2.实验室常用的化学试剂按其纯度高低分级,二级试剂是分析纯试剂,其英文简写为:(A)AR;(B)CP;(C)GR;(D)BP.[ C ] 3.在SI制中,物质的量浓度单位是:(A)g/mL;(B)mol;(C)mol/m3;(D)mol/L.[ A ] 4.将纯酸加入纯水中制成溶液,则下列表述中正确的是:(A)酸的浓度越低,解离的弱酸的百分数越大;(B)酸的“强”和“弱”与酸的物质的量浓度有关;(C)强酸的解离百分数随浓度而变化;(D)每升含1.0×10-7mol强酸,则该溶液的pH为7.0.[ C ] 5.能有效减小分析中特定偶然误差的方法有:(A)校正分析结果;(B)进行空白试验;(C)选择更精密仪器;(D)应用标准加入回收法.[ B ] 6.在HCl滴定NaOH时,一般选择甲基橙而不是酚酞作为指示剂,主要是由于:(A)甲基橙水溶性较好;(B)甲基橙终点CO2影响小;(C)甲基橙变色范围较狭窄;(D)甲基橙是双色指示剂.[ A ] 7.在定量分析中,分解试样时必须避免:(A)引入干扰测定的杂质;(B)高温加热;(C)使用混合溶剂;(D)干式灰化法.[ B ] 8.浓度为0.1mol/L的某弱酸弱碱盐NH4A溶液pH=7.00,则HA的pK a 最可能为(NH3.H2O K b=1.8×10-5):(A)9.26;(B)4.74;(C)7.00;(D)10.00.[ B ] 9.用HCl溶液滴定某含有NaOH或NaHCO3或 Na2CO3或任意混合物的样品,滴至酚酞变色时,消耗盐酸V1 mL,于反应液中加入甲基橙指示剂连续滴定至橙色,又消耗盐酸V2 mL,且V1>V2>0,则此碱样是:(A)NaOH;(B)NaOH+Na2CO3;(C)NaHCO3+Na2CO3;(D)NaHCO3. [ C ] 10.下列有关偶然误差的正确论述是:(A)偶然误差可以用对照试验消除;(B)偶然误差的正态分布曲线与总体标准偏差σ无关;(C)偶然误差在测定中不可避免;(D)偶然误差具有单向性.[ C ] 11.在分析化学中,原始样品的采集是非常重要的步骤。
无机及分析化学期末考试试卷A及参考答案
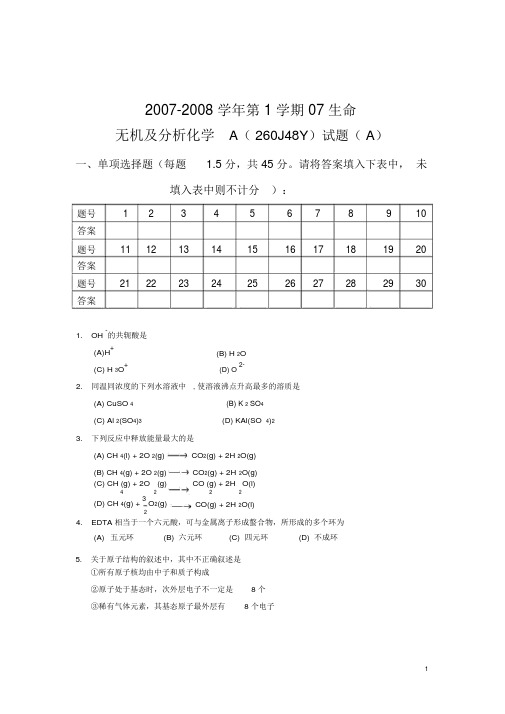
2007-2008 学年第 1 学期 07 生命无机及分析化学A( 260J48Y)试题( A)一、单项选择题(每题 1.5 分,共 45 分。
请将答案填入下表中,未填入表中则不计分):题号12345678910答案题号11121314151617181920答案题号21222324252627282930答案1.OH -的共轭酸是(A)H+(B) H 2O(C) H 3O+(D) O 2-2.同温同浓度的下列水溶液中 , 使溶液沸点升高最多的溶质是(A) CuSO 4(B) K 2 SO4(C) Al 2(SO4)3(D) KAl(SO 4)23.下列反应中释放能量最大的是(A) CH 4(l) + 2O 2(g)CO2(g) + 2H2O(g)(B) CH 4(g) + 2O2(g)CO2(g) + 2H2O(g)(C) CH (g) + 2O2(g)CO (g) + 2H2O(l)42(D) CH 4(g) + 3 O2(g)CO(g) + 2H2O(l)24.EDTA 相当于一个六元酸,可与金属离子形成螯合物,所形成的多个环为(A)五元环(B) 六元环(C) 四元环(D) 不成环5.关于原子结构的叙述中,其中不正确叙述是①所有原子核均由中子和质子构成②原子处于基态时,次外层电子不一定是8 个③稀有气体元素,其基态原子最外层有8 个电子④最外层电子数为 2 的原子一定是金属原子(A) ①②④ (B) ①②③(C) ②③(D) ①③④6. 0.100 mol ·kg-1KCl 溶液在稍高于-0.372℃时结冰 , 对这个现象的解释是 (水的 K f = 1.86K ·kg ·mol -1)(A) KCl 未完全缔合 (B) 离子互吸(C) 离子互斥(D) 溶液蒸气压下降7.Zn(s) + 21O 2(g) = ZnO(s)r Hm -1已知1 = -351.5 kJ mol ·Hg(l) + 12 O 2(g) = HgO(s ,红 )rH m -12 = -90.8 kJ mol ·则 Zn(s) + HgO(s ,红 ) = ZnO(s) + Hg(l) 的 r H m 为 (kJ mol · -1)(A) 442.3(B) 260.7(C) -260.7(D) -442.38. 有一原电池:3+-32+(1 mol dm · -34+-33+-3) │ PtPt │ Fe(1 mol dm · ), Fe )‖Ce (1 mol dm · ), Ce (1 mol dm · 则该电池的电池反应是3+3+4+2+ (A) Ce+ Fe = Ce+ Fe(B) Ce 4+ + Fe 2+ = Ce 3++ Fe 3+(C) Ce 3+ + Fe 2+ = Ce 4+ + Fe(D) Ce 4++ Fe 3+= Ce 3++ Fe 2+9. 电池反应: H 2(g ,100kPa) + 2AgCl(s)2HCl(aq) + 2Ag(s)E = 0.220 V ,当电池的电动势为0.358 V 时,电池溶液的 pH 为E E0.358 0.220(A)(B)pH 20.0590.358 0.220(D) 0(C)0.059210. 体系对环境作20 kJ 的功,并失去 10kJ的热给环境,则体系内能的变化是(A) +30 kJ(B) +10 kJ(C) -10 kJ(D) -30kJ11. 由下列反应设计的电池不需要惰性电极的是(A) H 2 (g) + Cl 2(g) = 2HCl(aq) (B) Ce 4++ Fe 2+= Ce 3++ Fe 3+(C) Zn + Ni 2+= Zn 2++ Ni(D) Cu + Br 2 = Cu 2++ 2Br12. pH = 9.0 的含有 5.0 10 -2 m ol / L NaCN 和 1.0 10-2 mol / L Hg(NO 3)2 的溶液中,叙述 CN -的物料平衡方程式正确的是[ HCN的 pK a = 9.21 , 生成 Hg(CN) 42- 络合物 ]( A ) [ CN - ] + 4[ Hg(CN) 4 2-]=5.0 10-2( B ) [ CN - ] + [ Hg(CN) 42-]=5.0 10-2( C ) [ CN - ] + [ HCN ] + 4[ Hg(CN)4 2-]=5.0 10-2-2--2( D ) [ CN ] + [ HCN ] + [ Hg(CN) 4 ]=5.0 1013. 今有 1L 含 0.1mol H 3PO 4 和 0.3mol Na 2HPO 4 的溶液 ,其 pH 应当是(H 3PO 4 的 pK a1~pK a3 分别为 2.12、 7.20 、12.36)(A) 2.12 (B) (2.12+7.20)/2 (C) 7.20(D) (7.20+12.36)/214. 某铁矿试样含铁约50%左右,现以 0.01667mol/L K 2Cr 2O 7 溶液滴定,欲使滴定时,标准 溶液消耗的体积在 20 mL 至 30 mL ,应称取试样的质量范围是 [A r (Fe)=55.847](A) 0.22 至 0.34g (B) 0.037 至 0.055g (C) 0.074 至 0.11g(D) 0.66 至 0.99g15. 以下产生误差的四种表述中,属于随机误差的是(1) 指示剂变色点与化学计量点不一致 (2) 滴定管读数最后一位估计不准 (3) 称量过程中天平零点稍有变动(4)天平的砝码未经校准( A ) 1,2(B)3,4(C)2,3(D)1,416. 为标定 Na 2S 2O 3 溶液的浓度宜选择的基准物是(A) 分析纯的 H 2O 2(B) 分析纯的 KMnO 4(C) 化学纯的 K 2Cr 2O 7(D) 分析纯的 K 2Cr 2O 717. 某反应在标准态和等温等压条件下,在任何温度都能自发进行的条件是(A) r H m > 0 r S m > 0 (B) r H m < 0 r S m < 0 (C)r H m> 0r S m< 0(D)r H m< 0r S m> 018. 某 1L 含 0.2mol Na 3PO 4 和 0.3mol HCl 的溶液 ,其 pH 应当是(H 3PO 4 的 pK a1~pK a3 分别为 2.12、 7.20 、12.36)(A) 2.12(B) (2.12+7.20)/2(C) 7.20(D) (7.20+12.36)/219. 0.05 mol/L SnCl 2 溶液 10 mL与 0.10 mol/L FeCl 3 溶液 20 mL 相混合 , 平衡时体系的电位是[已知此条件时3+2+4+2+(Fe/Fe )= 0.68 V ,(Sn/Sn )= 0.14 V](A) 0.14 V(B) 0.32 V(C) 0.50 V(D) 0.68 V20.下列表述中 ,最能说明系统误差小的是(A)高精密度(B)与已知的质量分数的试样多次分析结果的平均值一致(C)标准差大(D)仔细校正所用砝码和容量仪器等21.以下物质必须采用间接法配制标准溶液的是(A) K 2Cr2O7(B) Na 2S2O3(C) Zn(D) H 2C2O4·2H 2O22.下列溶液中不能组成缓冲溶液的是(A) NH 3和 NH 4Cl(B) H 2PO4-和 HPO 42-(C) HCl和过量的氨水(D) 氨水和过量的 HCl23. 今有 (a)NaH 2PO4,(b)KH 2PO4和 (c)NH 4H 2PO4三种溶液 ,其浓度 c(NaH 2PO4) = c(KH 2PO4) =c(NH 4H2PO4) = 0.10mol/L, 则三种溶液的 pH 的关系是[已知 H3PO4的 pK a1~pK a3分别是 2.12、 7.20、 12.36;pK a(NH 4+) = 9.26](A) a = b = c(B) a <b <c(C) a = b >c(D) a = b <c24.用铈量法测定铁时 , 滴定至 50% 时的电位是[已知(Ce 4+/Ce3+)= 1.44 V,(Fe3+/Fe2+)= 0.68 V](A) 0.68 V(B) 1.44V(C) 1.06 V(D) 0.86V25.用 Ce4+滴定 Fe2+,当体系电位为 0.68V 时 ,滴定分数为4+3+,3+2+[(Ce/Ce )=1.44V(Fe /Fe)=0.68V](A) 0(B) 50%(C) 100%(D) 200%26. 当两电对的电子转移数均为 2 时,为使反应完全度达到99.9%,两电对的条件电位至少大于(A) 0.09V(B) 0.18V(C) 0.27V(D) 0.36V27.摩尔吸光系数 ( )的单位为(A) mol/(L cm)·(B) L/(mol cm)·(C) mol/(g cm)·(D) g/(mol cm)·2+,采用铬黑3+的存在将导致28. 用 EDTA 滴定 Mg T 为指示剂 ,少量 Fe(A)终点颜色变化不明显以致无法确定终点(B) 在化学计量点前指示剂即开始游离出来,使终点提前(C) 使 EDTA 与指示剂作用缓慢,终点延长(D) 与指示剂形成沉淀,使其失去作用29. 对条件电位无影响的因素是:(A)副反应(B)温度(C)滴定过程(D)离子活度系数30.下列哪个因素不影响氧化还原速度:(A)反应物浓度(B) 溶液温度(C) 催化剂(D) 指示剂的敏感性二、填空题(每空 1.5 分,共 30 分):1.符号“5p”表示电子的主量子数 n 等于 _______ ,角量子数 l 等于 ______ ,该电子亚层最多可以有 ____种空间取向,该电子亚层最多可容纳____ 个电子。
分析化学期末考试试题

2008—2009第一学期分析化学期末试题(A)一、选择题( 每题2分,共40分)1.可以用下列中哪些方法减小分析测定中的偶然误差…( )。
A.进行对照试验B.进行空白试验C.进行仪器校准D.增加平行试验的次数2. 为标定KMnO4溶液的浓度宜选择的基准物是---------- ( )A Na2S2O3B Na2SO3C FeSO4·7H2OD Na2C2O43.已知某标准NaOH溶液在保存过程中吸收了少量CO2,用此溶液标定HCl溶液的浓度,若以酚酞为指示剂,则对所标定的HCl溶液的浓度的影响是()A.偏高B.偏低C.无影响D.难预测4. 0.05 mol/L SnCl2溶液10 mL 与0.10 mol/L FeCl3溶液20 mL 相混合, 平衡时体系的电位是[已知此条件时ϕ' (Fe3+/Fe2+)= 0.68 V,ϕ' (Sn4+/Sn2+)= 0.14 V] ( )A 0.14 VB 0.32 VC 0.50 VD 0.68 V5. 以下溶液稀释10倍时,pH改变最小的是---------------------------- ( )A 0.1mol/L HAcB 0.1mol/L NH4AcC 0.1mol/L NaAcD 0.1mol/L NH4Cl 6.当金属离子M和N共存时,欲以EDTA滴定其中的M,若CM=10CN,TE=0.1%,pM=0.2,则要求lgK为…( )A 5B 6C 4D 77. (1) 用0.02 mol/L KMnO4溶液滴定0.1 mol/L Fe2+溶液(2) 用0.002 mol/L KMnO4溶液滴定0.01 mol/L Fe2+溶液,上述两种情况下其滴定突跃将是------ ( )A 一样大B (1)>(2)C (2)>(1)D 缺电位值, 无法判断8采用BaSO4重量法测Ba2+时,洗涤沉淀用的洗涤剂是()A 稀H2SO4B 稀HClC 冷水D 乙醇9 pH=4时有莫尔法滴定含量,将使结果()A 偏高B 偏低C 忽高忽低D 无影响10用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的()A.氢离子浓度(mol/L下同)相等;B. H2SO4和HAc溶液的浓度相等;C. H2SO4浓度为HAc溶液浓度的1/2;D.两个滴定的pH突跃范围相同。
《分析化学》期末考试试卷及答案(A)

《分析化学》期末考试试卷及答案(A)《分析化学》A考试试卷1.写出下列各体系的质⼦条件式:(1)c1(mol/L) NH4 H2PO4(2)c1(mol/L)NaAc+ c2(mol/L)H3BO32.符合朗伯-⽐尔定律的有⾊溶液,当有⾊物质的浓度增⼤时,其最⼤吸收波长,透射⽐。
3. 准确度⽤表⽰,精密度⽤表⽰。
4.⼆元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δHB-=δB2-, 则H2B的p K a1=,p K a2=。
5.已知EΦ(Fe3+/Fe2+)=0.68V,EΦ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中⽤0.1000mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以⼆甲酚橙(XO)为指⽰剂在六亚甲基四胺缓冲溶液中⽤Zn2+滴定EDTA,终点时溶液颜⾊由_________变为__________。
7.某溶液含Fe3+10mg,⽤等体积的有机溶剂萃取⼀次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配⽐= 。
8.滴定分析法中滴定⽅式有, , 和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最⼤处的波长叫做,可⽤符号表⽰。
11.已知Zn(NH3)42+的各级累积形成常数logβ1—logβ4分别为2.3、4.6、7.0和9.0,则它们的第四级形成常数logK4= 。
12. 分光光度法的基础是,其相对误差⼀般为。
此法适⽤于量组分的测定。
13.在纸⾊谱分离中,是固定相。
14.晶形沉淀的条件述为①在的溶液中进⾏;②在下,加⼊沉淀剂;③在溶液中进⾏;④。
15沉淀滴定法中莫尔法、佛尔哈德法、法扬司法的指⽰剂分别是:、、。
1、试样⽤量为0.1 ~ 10 mg的分析称为:A、常量分析B、半微量分析C、微量分析D、痕量分析2、在分析⼯作中,减⼩偶然差的⽅法是:A、对结果进⾏校正B、采⽤对照实验C、增加平⾏测定次数D、采⽤空⽩实验3、下列各数中,有效数字位数为四位的是:A、[H+]=0.0003mol/LB、pH=10.42C、ω(MgO)=19.96%D、40004、在下列各酸碱组分中,属于共轭酸碱对的是:A、H+-OH-B、H3PO4-Na2HPO4C、H2S-Na2SD、NaHCO3-Na2CO35、下列⼀元弱酸或弱碱(C=0.10mol/L)中,能被直接准确滴定的是:A、HCN(K a=7.2×10-10)B、NH4CI(K bNH3=1.8×10-5)C、(CH2)6N4(K b=1.4×10-9)D、HCOOH(K a=1.8×10-4)6、⽤纯⽔将下列溶液稀释10倍,其中pH 值变化最⼤的是:A、0.1mol/L HClB、0.1mol/L HAcC、1mol/L NH3·H2OD、1mol/L HAc + 1mol/L NaAc7、⽤EDTA滴定M2+时,下列情况能够增⼤滴定突跃的是:A、固定C M使K/MY减⼩B、使K/MY固定减⼩C MC、增⼤C M和K/MYD、减⼩C M和K/MY8、当⾦属离⼦M 和N 共存时,欲以EDTA 滴定其中的M ,若c M =10c N ,TE=0.1%, ΔpM=0.2。
武汉大学度第一学期《分析化学》期末考试试卷 (A)——化学资料资料文档

武汉大学20××-20××学年度第一学期《分析化学》期末考试试卷(A)学号姓名院(系)分数一.填空(每空1分,共28分,答在试卷上)1.定量分析过程包括 , ,和四个步骤.2.根据有效数字计算规则计算: 1.683 + 37.42⨯7.33÷21.4-0.056 = 。
3.某酸H2A的水溶液中,若δH2 A为0.28,δHA-=5δA2-,那么δA2-为。
4.含有Zn2+和Al3+的酸性缓冲溶液,欲在pH=5~5.5的条件下,用EDTA标准溶液滴定其中的Zn2+,加入一定量六亚甲基四胺的作用是;加入NH4F的作用是。
5.NaOH滴定HCl时,浓度增大10倍, 则滴定曲线突跃范围增大个pH单位;若为滴定H3PO4, 则突跃范围增大个pH单位.6.对于实验数据中的异常值的取舍,通常可根据、和方法来判断。
7.莫尔法与佛尔哈德法的指示剂分别为、。
8.紫外可见分光光度计由 , , 和四部分组成.9.检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。
10.吸光物质的摩尔吸光系数与溶液的pH 关,与波长关。
11.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
12.光度法测定某物质,若有干扰,应根据和原则选择波长。
二.简答和名词解释(每题2分,共 16分,答在试卷纸上)1.什么是准确度?什么是精密度?2.用K2Cr2O7溶液滴定Fe2+试液时,常向溶液中加入H3PO4,为什么?3.已知滴定管的读数标准偏差为0.01 mL,若滴定时耗去30.00 mL溶液,则该溶液体积的相对标准偏差为多少?4写出浓度为c mol/L (NH4)2CO3溶液的质子条件式。
5.摩尔吸光系数6.下图是薄层色谱分离物质的色谱图,根据图写出R f值计算式。
7.光度分析中,当浓度较高时,工作曲线逐渐偏离直线,这是什么原因?8 .在螯合物萃取体系中,影响液-液萃取分离的因素有哪些?三.回答问题(每题4分,共24分,答在试卷纸上)1.为满足重量分析的要求,晶型沉淀的沉淀条件是什么,并简述其原因。
(完整版)分析化学试题及答案A卷

f分析化学一、填空题(每空1分,共20分)1、标定NaOH常用的基准物质是草酸和苯二甲酸氢钾。
2、一般情况下,K2Cr2O7标准溶液采用直接法配制,而KMnO7标准溶液采用间接法配制。
3、氧化还原反应中,获得电子的物质是__________剂,自身被_________;失去电子的物质是___________剂,自身被__________。
4、朗伯-比尔定律的物理学意义是:当一束平行______光通过______的、________的、非色散的吸光物质溶液时,溶液的吸光度与溶液的_______和液层_______的乘积成正比。
5、偏离朗伯-比尔定律的主要因素是:________和________。
6、重量分析法的主要操作包括__________、___________、___________、__________、__________。
二、选择题(只有一个正确答案,每题1分,共20分)1、下面有关准确度与精密度的关系表述正确的是()A. 精密度高则准确度高;B. 准确度高则要求精密度一定要高;C. 准确度与精密度没关系;D. 准确度高不要求精密度要高。
2、下列各项叙述中不是滴定分析对化学反应要求的是()。
A. 反应必须有确定的化学计量关系B. 反应必须完全C. 反应速度要快D. 反应物的摩尔质量要大3、重量分析法测定0.5126g Pb3O4试样时,用盐酸溶解样品,最后获得0.4657g PbSO4沉淀,则样品中Pb的百分含量为()。
(已知Pb3O4 = 685.6,PbSO4 = 303.26,Pb = 207.2)。
A. 82.4%B. 93.1%C. 62.07%D. 90.8%4、用K2Cr2O7基准物以置换碘量法标定Na2S2O3溶液浓度,常以淀粉液为指示剂,其加入的适宜时间是滴定至近终点时加入,若滴定开始时加入则会发生()。
A. 标定结果偏高B. 标定结果偏低C. 对标定结果无影响D. 指示剂不变色,无法指示滴定终点。
分析化学试卷A卷及答案

A. 0.010 mol ⋅L -1B. 0.020 mol ⋅L -1C. 0.0010 mol ⋅L -1D. 0.0020 mol ⋅L -18. 在pH=10.0的氨性溶液中, 用EDTA 滴定等浓度的Zn 2+, 到达化学计量点时, 下列关系式中正确的是( ) A. [Zn]=[Y]B. [Zn ' ]=[Y]C. [Zn]= [Y ' ]D. [Zn ' ] = [Y ' ]9 . 用Ce 4+滴定Fe 2+时, 滴定分数0.500处的电位值为( )A. ++34'/21Ce Ce E θB. ++23'/21Fe Fe E θ C. ++34'/Ce Ce E θ D. ++23'/Fe Fe E θ10 氧化还原反应的条件平衡常数越大, 说明( )A.反应速率越快B. 反应速率越慢C. 反应机理越复杂D. 反应的完全程度越高 11. 以SO 42-沉淀Ba 2+时,加入适量过量的SO 42-可以使Ba 2+离子沉淀更完全,这是利用( ) A. 盐效应 B. 同离子效应 C. 配位效应 D. 酸效应12. 含K +、Ba 2+、La 3+、Th 4+的混合溶液,通过强酸性阳离子交换树脂时,最先流出分离柱的离子是( ) A .K +B .Ba 2+C .La 3+D .Th 4+13. 含0. 10 g Fe 3+的强酸溶液, 用乙醚萃取时, 已知其分配比为99, 则用乙醚等体积萃取一次后, 水相中残存的Fe 3+量为( )A .0.10 mgB .1.0 mgC .10.0 mgD .0.01 mg14 以法杨司法测定Cl -, 应选用的指示剂是( )A. K 2CrO 4B. NH 4Fe(SO 4)2C. 曙红D. 荧光黄 15 晶形沉淀的沉淀条件是( )A. 热﹑稀﹑搅﹑慢﹑陈B. 热﹑浓﹑快﹑搅﹑陈C. 浓﹑冷﹑搅﹑慢﹑陈D. 稀﹑热﹑快﹑搅﹑陈二、填空题(15分)1. 用某平均值表示μ的置信区间如下:μ = 0.5678 ± 5,95.0t ⨯n0003.0。
《分析化学》A参考答案

7.系统;相对校准
8.半微量
9.黄色;12.4;< 12
10.Ag2CrO4不易形成,不能确定终点,生成褐色Ag2O,不能进行测定
三、计算题(共4题40分)
1.(1) 1 KI 1 IO3- 3 I2 6 S2O32-
注:1.出题教师负责制订课程考试试题参考答案及评分标准,不够可另附页。
2. 试卷评阅完后,试题参考答案及评分标准随试卷装订在一起,由继续教育学院保管、存档。
(2) 2 KI 1 I2 2 Na2S2O3
2 KBr 1 Br2 1 I2 2 Na2S2O3
n(KBr)= 0.1000×15.00-1/6×0.1000×30.00 = 1.000 (mmol)
2.用冷水洗涤沉淀时,外双电层中带电荷离子被洗掉,使AgCl颗粒带相同电荷,互相排斥,使之均匀分散,故产生胶溶现象,应当选电解质溶液洗。
注:1.出题教师负责制订课程考试试题参考答案及评分标准,不够可另附页。
2. 试卷评阅完后,试题参考答案及评分标准随试卷装订在一起,由继续教育学院保管、存档。
一、选择题(答案请填写在答题栏内,共15题,每题2分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
C
B
A
C
B
B
A
B
题号
11
12
13
14Leabharlann 15答案CC
C
A
B
二、填空题(共10题20分)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学 试题A一、填空题1、用紫外-可见分光光度法测定某样品,在可见光区光源用____________灯,吸收池可选择____________材料的吸收池。
2、原子吸收分光光度法中单色器配置在____________后,原因是_______________________________________________。
3、试分析下列效应对沉淀溶解度的影响(增大、减小或无影响): (1)同离子效应 ; (2)酸效应 ;4、HPLC 的洗脱技术主要有 和 两种。
5、某次测量结果平均值的置信区间表示为:%03.0%79.108,05.0±=±ns t x ,它表示置信度为 ,测量次数为 。
6、在吸附薄层色谱法中,根据Stahl 设计的规则,若分离极性物质,应选择 的吸附剂和 展开剂。
7、紫外吸收光谱主要是反映分子中__________________的特征,而不是整个________的特征。
8、氢核磁共振谱(1H-NMR )主要提供________________________、______ 、_________________________________________ 方面的信息。
9、高锰酸钾法应调整溶液的酸度为___________________,调整酸度时用__________酸。
10、在无干扰的条件下,测定下列离子适宜的滴定方式是,Al 3+:____________;Ag +:___________________。
二、问答题1、Lambert-Beer 定律下列两种数学表达式: (1)A=εLC (2) A=1%1cm E LC 可知:ε=LC A ,1%1cm E = LCA ,由此可得出结论:ε= 1%1cm E ,试问:此结论是否正确?为什么?2、用电位滴定法进行酸碱滴定,写出电极的组成,并写出两种确定终点的方法。
3、为何荧光波长一般总是大于激发光波长?4、简述高效色谱仪主要包括哪几个部分?5、试述等吸收双波长消去法选择两个波长的原则。
6、简述质谱法(MS )在结构解析中的作用。
7、用反相ODS 色谱柱分析一有机酸,流动相未加酸时,其保留时间为t R ,向流动相加入一定的醋酸调节pH ,其保留时间如何变化?为什么?8、在药物分析中,气相色谱法多用内标法进行定量分析,为什么?三、计算题1、0.2000mol/LNaOH滴定0.2000mol/L异丁酸和0.1000mol/L硼酸的混合酸。
⑴能否分步滴定其中的异丁酸?为什么?(异丁酸pKa=4.85,硼酸pKa=9.24)⑵计算等当点时溶液的pH值。
2、某气相色谱柱中流动相体积是固定相体积的20倍,H=0.6mm.两组分在柱中的k2: k1=1.1,后出柱的第二组分的分配系数为120。
问:当两组分达完全分离时柱长是多少?分析化学试题B一、填空题1、按误差来源指出下列情况各引起何种误差(偶然误差或系统误差)(1)滴定分析的终点误差_________________;(2)分析天平未经校准_________________________。
2、分光光度计的主要部件包括___________、____________、____________、____________。
3、色谱分离的前提是各组分的____________或__________不等。
4、消除试剂、蒸馏水等引入的杂质所造成的误差应做______________实验,欲检验所选方法的准确性应做______________实验。
5、BaSO4在0.01mol/L的EDTA溶液中的溶解度比纯水中的溶解度大是由于________________。
6、用紫外-可见分光光度法测定某样品,在紫外光区光源用____________灯,吸收池必须用____________材料的吸收池。
7、分子在离子源中在电子流的轰击下失去一个电子所形成的离子叫做____________。
8、在气相色谱检测器中,是质量型检测器,和是浓度型检测器。
9、能产生核磁共振信号的核其自旋量子数(I)应为__________。
10、在无干扰的条件下,测定下列离子适宜的滴定方式是,Al3+:____________________;Ag+:___________________。
二、问答题1、什么是指示电极?写出一种常用指示电极的组成和电极电位表达式。
2、简述薄层色谱法一般的操作程序。
3、为何说荧光光谱的形状与激发波长无关?4、混合物中x与y两组分的吸收光谱重叠,如何进行x组分的测定?5、在气相色谱中,试用速率理论说明为何载气线速较小时用N2,载气线速较大时用H2或He?6、在原子吸收分光光度法中为何常选共振吸收线作为分析线?7、用反相键合相色谱柱在一定色谱条件下分离2,4-二硝基苯酚和苯酚混合物,试判断两组分的流出色谱柱顺序并阐明其原因?8、为何通常荧光法的灵敏度比紫外分光光度法高?三、计算题1、通过计算,比较0.1mol/L的NaAc溶液和0.1 mol/L的NH4Ac溶液的pH 值是否相同?(已知HAc的Ka=1.8×10-4,NH3•H2O的Kb=1.8×10-5)2、在HPLC柱上分离药物制剂,以甲醇-水为流动相,药物A和B的保留时间分别2min和5min,色谱系统的死时间为1min。
求:(1)药物B在固定相中滞留的时间是药物A的几倍?(2)药物B的分配系数是药物A的几倍?分析化学试题C一、填空题:1.分析化学是____________________________________________。
2.pH = 6.20是_________位有效数字,2.50×10-2是_________位有效数字。
3.根据检测器的输出信号与组分含量间的关系可将检测器分为____________和___________两大类。
按照检测器的适用范围又可分为____________和___________两大类。
4.原子吸收法常用的两种原子化方式为________________和_______________。
5.重量分析法中,一般同离子效应会使沉淀溶解度____________;盐效应会使沉淀溶解度____________。
6.pH玻璃电极的内参比电极为_______________,电极的内充液为一定浓度的_______________。
7.间接碘量法的主要误差来源为和。
8.吸收光度法常用的定量方法有______________、____________。
9.荧光物质的两个特征光谱是______________和______________。
10.区域宽度是色谱峰的重要参数之一,可用于衡量__________。
11.色谱法的分离原理是利用物质在流动相和固定相之间的_______的不同而实现分离。
二、问答题:1.简述准确度与精密度之间的关系。
2.简述质谱仪的主要组成部分。
3.非水溶液中滴定非常弱的碱时为什么常选酸性溶剂?4.在紫外—可见光区范围内,丙酮有几种跃迁类型,其特点是什么?5.试比较原子吸收法和紫外-可见吸收法的异同。
6.用反相ODS色谱柱分析一有机弱酸时,其保留时间为t R,向流动相加入一定的醋酸调节pH,其保留时间如何变化?为什么?7.简述电位滴定法的原理和确定终点的方法。
8.分析纯的NaOH、Na2S2O3可用直接法配制标准溶液吗?为什么?9.根据磁各异向性,试解释乙醛氢的δ值移向低场?10.荧光物质必须具备的两个条件是什么?哪些分子结构的物质具有较强的荧光?三、计算题:1.采用气相色谱法测定曼陀罗酊剂中乙醇的含量。
对照品溶液的配制:准确吸取5 mL无水乙醇及5 mL丙醇(内标),置于100 mL容量瓶中,加水稀释至刻度。
供试品溶液的配制:准确吸取10 mL样品及5 mL丙醇(内标),置于100 mL容量瓶中,加水稀释至刻度。
将对照溶液与样品溶液分别进样3次,每次2μL,测得乙醇和丙醇的峰高比的平均值分别为13.3:6.10及11.4:6.30。
求样品中乙醇含量(%)?2.若试液中含有Fe3+能否干扰碘量法测定硫酸铜的含量。
若向溶液中加入一定量的F-则如何?(计算说明)已知:ф0I2/2I-=0.54v; ф0Cu2+/Cu+=0.16v; ф0Fe3+/Fe2+ = 0.77v[F-]=1mol/L,Fe3+-F-配合物的lgβ1~lgβ3分析化学试题 D 一、填空题:1.分析化学是____________________________________________。
2. 一个组分的色谱峰的________或________用于定量,________用于定性,________用于衡量柱效。
3. 直接电位法测定离子活度常采用的方法有___________和_____________.4. pH = 10.20是_________位有效数字,1.50×10-3是_________位有效数字。
5.滴定弱碱(C b K b<10-8)最常用的溶剂是___________;标准溶液是____________。
6. 根据液液分配色谱法的固定相和流动相的极性相对强度可分为-___________和___________。
7. pH玻璃电极使用的pH范围为____________________________8. 导致原子吸收谱线变宽的主要原因是________________和________________。
9. 苯的主要吸收带为__________、_________ 、______________。
二、问答题:1.举例说明在沉淀重量法中如何利用同离子效应来降低沉淀的溶解度。
2. 试比较紫外分光光度计和荧光光分光光度计的主要区别。
3. 什么是共振吸收线?为什么常选共振线为分析线?4. 用两种方法测定同一样品中某组分,第一法共测8次,第二法共测6次。
如何用统计检验评价这两种方法是否存在显著性差异。
5. 根据色谱过程的分离机制不同,色谱法可以分为哪几种基本类型?6. 某未知物分子式为C8H12O4,在60MHz的仪器上测得,δa =1.31,δb =4.19,J ab ≈ 7 Hz,试判断a,b间偶合是简单偶合还是高级偶合?7. 分光光度法中偏离朗伯比尔定律的主要原因是什么?8. 荧光分析中的测定波长有哪几种,它们是如何测定的?9. 在薄层色谱法中,根据Stahl设计的简图,若分离非极性物质,应如何选择展开剂和吸附剂?10.络合滴定时为何常加入缓冲溶液控制溶液的pH值?三、计算题:1.用0.10mol/LNaOH标准溶液滴定某一弱酸HA溶液(0.10mol/L),计算化学计量点时溶液的pH值,并说明应选择何种指示剂?(Ka=1.8×10-6)2. 一个气相色谱柱中,V s=14.1 mL,F c=43.75 mL/min,分离A、B两组分,两组分的t R分别为1.41 min和2.67 min,死时间为0.24 min,求各组分的t’R,K及 ?(假定检测器和柱接头等体积可以忽略不计)。
