2019-2020学年四川省成都龙泉第二中学新高考化学模拟试卷含解析
成都龙泉第二中学2019-2020学年度2020届化学高考二轮专题《化工及实验流程的无机综合》质量试题( 含解析)

高考第二轮专题《化工及实验流程的无机综合》质量检测试题(时间:45分钟 满分:100分)一、单项选择题:本题包括7小题,每小题6分,共42分。
1.液态N 2O 4是火箭推进系统的有效氧化剂。
实验室制备少量N 2O 4的流程如下:NH 4Cl 固体――→Ca (OH )2固体①NH 3――→催化氧化②NO ――→O 2③NO 2(红棕色) ――→降温④N 2O 4液体(无色)下列分析正确的是( )A.反应①③中氮元素的化合价发生了变化B.反应②利用了NH 3的氧化性C.反应④的颜色变化是由化学平衡移动引起的D.反应①可由图所示装置实现答案 C 解析 A 项,已知这五种化合物NH 4Cl 、NH 3、NO 、NO 2、N 2O 4中N 元素的化合价分别为-3、-3、+2、+4、+4,所以反应①④中N 元素的化合价没有变化,反应②③中N 元素的化合价变化了,错误;B 项,反应②中N 元素从-3价升高为+2价,NH 3表现出还原性,错误;C 项,由于2NO 2(g)N 2O 4(l)是放热反应,则降低温度,平衡正向移动,使NO 2转化为N 2O 4,正确;D 项,反应①是固体加热生成易溶于水的NH 3,所以图示装置中发生装置和收集装置都不合适,错误。
2.工业上利用无机矿物资源生产部分材料的流程示意图如下。
下列说法不正确的是( )A.在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石B.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应C.在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物答案 B解析用铝土矿制备较高纯度Al,首先用NaOH溶液将铝土矿中的氧化铝溶解转化为偏铝酸钠溶液,然后过滤、向滤液中通入CO2气体把偏铝酸钠转化为氢氧化铝沉淀,再过滤得氢氧化铝,接着加热氢氧化铝让其分解为氧化铝,最后用冰晶石作助熔剂,电解熔融的氧化铝得到铝,所以A正确;石英的主要成分是二氧化硅,它属于酸性氧化物不与盐酸反应,玻璃的主要成分有二氧化硅、硅酸钠、硅酸钙,组成中有盐故被称为硅酸盐产品,它也不能与盐酸反应,实验室经常用玻璃瓶盛放盐酸,所以B不正确;在制粗硅时,发生反应SiO2+2C Si+2CO↑,被氧化的物质C与被还原的物质SiO2的物质的量之比为2∶1,C正确;黄铜矿(CuFeS2)与O2反应,铜由+2价降为+1价被还原得到Cu2S、氧由0价降至-2价得到FeO,所以Cu2S、FeO均是还原产物,D正确。
成都龙泉第二中学2019-2020学年度2020届高考模拟考试理科综合试题(化学部分)(二)

成都龙泉第二中学2017级高考模拟考试试题(二)理科综合能力测试(化学部分)本试卷分选择题和非选择题两部分,共40题,满分300分,考试时间150分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ba 137第Ⅰ卷(选择题共126分)一、选择题(每小题6分,本大题共13小题。
每小题给出的四个选项中,只有一项是符合题目要求的。
)7.化学与生产和生活密切相关。
下列有关说法正确的是()A.古代记载文字的器物——甲骨,其主要成分是蛋白质B.工艺装饰材料——天然水晶,属硅酸盐产品C.秸秆经加工处理成吸水性的材料——植物纤维,可用作食品干燥剂D.第五形态的碳单质——“碳纳米泡沫”,与石墨烯互为同分异构体解析:选C A项,古代记载文字的器物——甲骨,其主要成分是钙质物质,错误;B 项,工艺装饰材料——天然水晶,是二氧化硅,错误;C项,秸秆经加工处理成吸水性的材料——植物纤维,无毒、无味、具有吸水性,可用作食品干燥剂,正确;D项,第五形态的碳单质——“碳纳米泡沫”,与石墨烯是不同性质的单质,二者互为同素异形体,错误。
8.下列制备和收集气体的实验装置合理的是()解析:选D 用NH4Cl和Ca(OH)2固体制NH3时有H2O生成,试管口应向下倾斜,A项错误;NO能与空气中的氧气反应生成NO2且和空气密度相近,应用排水法收集,B项错误;H2密度比空气小,收集氢气时导管应“短进长出”,C项错误。
9.短周期元素W、X、Y、Z的原子序数依次增加。
W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。
下列说法正确的是()A.离子半径:W<Y<ZB.W、X、Z三种元素组成的化合物的水溶液可能显碱性C.W、X元素组成的化合物一定只含离子键D.工业上采用电解Y的氧化物冶炼单质Y解析:选B 短周期元素W、X、Y、Z的原子序数依次增加,W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大,则X为钠元素;W的简单氢化物常温下呈液态,则W为氧元素;Y的氧化物和氯化物熔融时都能导电且Y的原子序数大于钠,则Y为镁元素;X、Y和Z原子的最外层电子数之和为10,则Z的最外层电子数为10-1-2=7,Z为氯元素。
成都龙泉第二中学2019-2020学年度2020届化学高考二轮专题《非金属及其化合物》复习过关检测试题(含解析)

高考第二轮专题《非金属及其化合物》过关检测试题(时间:50分钟满分:100分)一、单项选择题:本题包括7小题,每小题6分,共42分。
1.下列推断正确的是A.绿色化学的核心是应用化学原理对环境污染进行治理B.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2C.加碘食盐中加人的是碘单质,可防止甲状腺肿大疾病D.要除去衣服上的顽固污渍,均可将衣服泡在漂白液中【答案】B【解析】 A.绿色化学的核心是:利用化学原理从源头上减少和消除工业生产对环境的污染。
错误。
B.硅在地壳中含量位居第二,玛瑙、光导纤维的主要成分都是SiO2。
正确。
C.为了预防碘缺乏引起的疾病——甲状腺肿大,在食盐中要加碘。
但加入的是碘的化合物,通常加KIO3。
D.漂白液有强氧化性,即漂白性。
但是要除去衣服上的顽固污渍,应该根据污渍种类的不同选择不同的去污剂。
错误。
2.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( )A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键的个数之比为1∶2【答案】D【解析】二氧化硅晶体中,一个硅原子可形成4个硅氧单键,故硅原子和硅氧单键的个数之比为1∶4,故D错误。
3.下列叙述正确的是A.Fe分别与氯气和稀盐酸反应所得氯化物相同B.某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I-C.CO2、NO2、SO2都能与H2O反应,其反应原理相同D.C、N、S三种单质直接与O2反应都能生成两种氧化物【答案】B【解析】A项,铁和氯气反应生成氯化铁,和盐酸反应生成氯化亚铁,故错误;B项,淀粉遇碘变蓝色,淀粉溶液变蓝色,说明含有碘单质,碘溶于水呈黄色,原溶液呈无色,说明原溶液中不含碘单质,所以碘单质只能是氯气和碘离子反应生成的,所以原溶液中含有碘离子,故正确;C项,二氧化碳和二氧化硫与水反应是化合反应且不是氧化还原反应,二氧化氮和水反应生成硝酸和一氧化氮,属于氧化还原反应,所以反应原理不同,故错误;D项,碳单质直接和氧气反应能生成一氧化碳和二氧化碳,氮气直接和氧气反应只生成一氧化氮,硫和氧气直接反应只生成二氧化硫,故错误。
四川省成都龙泉第二中学2019_2020学年高二化学上学期入学考试试题(含解析)

四川省成都龙泉第二中学2019-2020学年高二化学上学期入学考试试题(含解析)第Ⅰ卷(选择题,共44分)一、单项选择题:本题包括22小题,每小题2分,共44分。
1. 对下列物质分类全部正确的是①纯碱②食盐水③石灰水④NaOH ⑤液态氨⑥KClO3A. 碱①④B. 纯净物③④⑤C. 盐①⑥D. 混合物②⑤【答案】C【解析】A、碱--①④不正确,因①纯碱为碳酸钠,是由金属离子和酸根离子构成的,则属于盐类,故A错误;B、纯净物--③④⑤不正确,因③石灰水中含氢氧化钙和水,属于混合物,故B错误;C、盐--①⑥正确,因①纯碱和⑥氯酸钾都是由金属离子和酸根离子构成的,则属于盐类,故C正确;D、混合物--②⑤不正确,因⑤液态氧是一种只有氧元素组成的物质,则属于单质,故D错误;故选C。
点睛:在物质的分类中,要特别注意:纯碱为碳酸钠,属于盐类;盐酸为氯化氢的水溶液,属于混合物;液氨中只含有一种分子,属于纯净物;氨水是氨气的水溶液,属于混合物;碱石灰、水玻璃等属于混合物,等等。
2.除去下列物质中的杂质,所用试剂和方法不正确的是()A. AB. BC. CD. D【答案】A【解析】【详解】A.酒精与水互溶,不能用作萃取剂,可以改为四氯化碳或苯等,A错误;B.加入适量的Ba(NO3)2溶液,杂质K2SO4会发生反应:K2SO4+ Ba(NO3)2=BaSO4↓+2KNO3,然后过滤,就得到纯净的KNO3,B正确;C.CuO与盐酸反应产生可溶性的CuCl2和水,然后过滤,洗涤,就得到纯净的Cu单质,C正确;D. CaO与水反应产生可溶性的Ca(OH)2,然后过滤,洗涤,就得到纯净的CaCO3,D正确;故合理选项是A。
3.为确定某溶液的离子组成,进行如下实验:①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀根据实验,以下推测不正确的是()A. 一定有SO42-B. 一定有CO32-C. 不能确定Cl-是否存在D. 不能确定SO42-是否存在【答案】D【解析】【详解】①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀,说明溶液中可能含有CO32-、SO42-等离子,向①中生成的白色沉淀中继续滴加过量稀盐酸时,白色沉淀部分溶解,且产生CO2气体,证明原溶液中一定含有SO42-和CO32-。
2020年四川省成都市龙泉二中高考化学模拟试卷(一) (含答案解析)

2020年四川省成都市龙泉二中高考化学模拟试卷(一)一、单选题(本大题共7小题,共42.0分)1.央视栏目《国家宝藏》不仅介绍了历史文化知识,彰显了民族自信、文化自信,历史文物本身也蕴含着许多化学知识。
下列说法错误的是()A. 南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是二氧化硅B. 战国·曾侯乙编钟属于青铜制品,青铜是一种铜锡合金C. 清·乾隆“瓷母”—各种釉彩大瓶中的红色窑变釉的主要成分可能是氧化亚铜D. 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜2.已知N A是阿伏加德罗常数的值,下列说法不正确的是A. 4.6g14CO2与N218O的混合物中所含中子数为2.4N AB. 将0.1mol CH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO−数目等于0.1N AC. 1mol HI被氧化为I2时转移的电子数为N AD. 常温下电解饱和食盐水,当溶液pH由7变为13时,电路中转移的电子数为0.1N A3.下列有关实验的操作、原理和现象的叙述正确的是()A. 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗B. 检验某溶液是否含有SO42−时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸C. 向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖D. 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值4.下图是氮及其化合物的“价一类”二维图,结合二维图及氧化还原反应的基本规律,下列相关分析或预测错误的是A. 硝酸具有较强的氧化性,可用稀硝酸清洗“银镜实验”后的试管B. NO、NO2和NH3在一定条件下均能反应,可用氨气处理氮氧化物C. 可用加热NH4NO3的方法制取氨气D. 联氨(N2H4)可能被亚硝酸(HNO2)氧化生成氢叠氮酸HN35.A,B,C,D,E为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,B,C,D同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。
2019-2020学年四川省成都龙泉中学新高考化学模拟试卷含解析
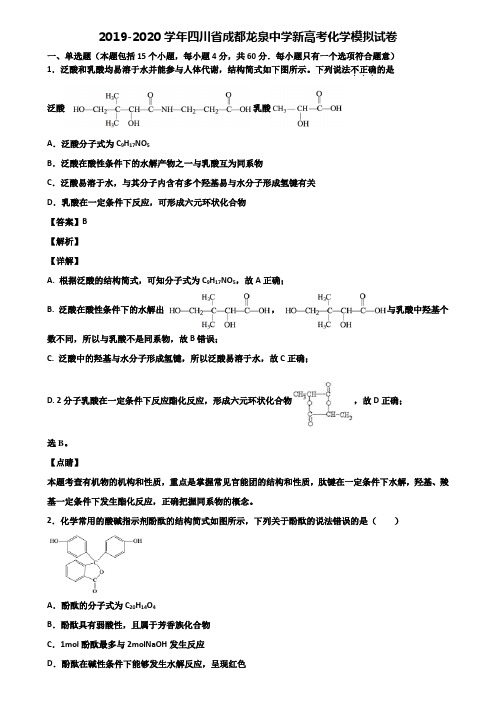
2019-2020学年四川省成都龙泉中学新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.泛酸和乳酸均易溶于水并能参与人体代谢,结构简式如下图所示。
下列说法不正确...的是泛酸乳酸A.泛酸分子式为C9H17NO5B.泛酸在酸性条件下的水解产物之一与乳酸互为同系物C.泛酸易溶于水,与其分子内含有多个羟基易与水分子形成氢键有关D.乳酸在一定条件下反应,可形成六元环状化合物【答案】B【解析】【详解】A. 根据泛酸的结构简式,可知分子式为C9H17NO5,故A正确;B. 泛酸在酸性条件下的水解出,与乳酸中羟基个数不同,所以与乳酸不是同系物,故B错误;C. 泛酸中的羟基与水分子形成氢键,所以泛酸易溶于水,故C正确;D. 2分子乳酸在一定条件下反应酯化反应,形成六元环状化合物,故D正确;选B。
【点睛】本题考查有机物的机构和性质,重点是掌握常见官能团的结构和性质,肽键在一定条件下水解,羟基、羧基一定条件下发生酯化反应,正确把握同系物的概念。
2.化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法错误的是()A.酚酞的分子式为C20H14O4B.酚酞具有弱酸性,且属于芳香族化合物C.1mol酚酞最多与2molNaOH发生反应D.酚酞在碱性条件下能够发生水解反应,呈现红色【解析】【分析】【详解】A.根据其结构简式可知,酚酞的分子式为C20H14O4,故A不符合题意;B.酚酞中含有酚羟基,具有弱酸性,该有机物中含有苯环,因此属于芳香族化合物,故B不符合题意;C.1mol该有机物中含有2mol酚羟基,1mol酯基(该酯基为醇羟基与羧基形成),因此1mol酚酞最多与3molNaOH发生反应,故C符合题意;D.酚酞中含有酯基,在碱性条件下能够发生水解反应,生成物呈现红色,故D不符合题意;故答案为:C。
【点睛】酯类物质与NaOH溶液反应相关量的计算:有机物中能够与NaOH反应的有酚羟基、羧基、酯基等,其中酯基与NaOH反应的比例关系需注意,若该酯基为酚羟基与羧基生成的酯基,则1mol该酯基能够消耗2molNaOH。
成都龙泉中学2019-2020学年度2020届高考模拟考试理科综合试题(二)(化学部分)(Word版含解析)

成都龙泉中学2020届高考模拟考试试题(二)理科综合能力测试(化学部分)本试卷分选择题和非选择题两部分,共40题,满分300分,考试时间150分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32第Ⅰ卷(选择题共126分)一、选择题(每小题6分,本大题共13小题。
每小题给出的四个选项中,只有一项是符合题目要求的。
)7.中华传统文化蕴含着很多科学知识,下列说法错误的是()A.“含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴B.“水声冰下咽,沙路雪中平”未涉及化学变化C.“霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应D.“丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是可逆反应答案:D解析:A项,“含浆似注甘露钵,好与文园止消渴”说明的是柑橘糖浆有甜味,可以止渴,正确;B项,“水声冰下咽,沙路雪中平”是水的三态变化,过程中未涉及化学变化,正确;C项,霾尘中有气溶胶,气溶胶属于胶体,具有丁达尔效应,正确;D项,丹砂(HgS)烧之成水银,即HgS发生分解反应生成水银;积变又还成丹砂,即常温下两者又可以重新化合为硫化汞。
由于两个过程的反应条件不同,故其不是可逆反应,错误。
8.有机物是制备镇痛剂的中间体。
下列关于该有机物的说法错误的是() A.与环己烷互为同分异构体B.一氯代物有五种(不考虑立体异构)C.所有碳原子可处于同一平面D.能与酸性高锰酸钾溶液发生氧化反应答案:B解析:A项,该有机物的结构简式为,分子式为C6H12,环己烷的结构简式为,分子式为C6H12,二者互为同分异构体,正确;B项,该有机物含有4种类型的氢原子,故其一氯代物有4种,错误;C项,该有机物可看做2个—CH3、1个—CH2CH3取代乙烯分子中的3个氢原子,由于乙烯分子中6个原子共平面,故形成碳碳双键的碳原子及与其直接相连的碳原子一定共平面,结合甲烷的结构,知—CH2—中碳原子可与相连的2个碳原子共平面,故该有机物中所有碳原子可处于同一平面,正确;D项,该有机物中含有碳碳双键,能被酸性高锰酸钾溶液氧化,正确。
成都龙泉第二中学2019-2020学年2020届高考压轴化学试题(一)(16页)

成都龙泉第二中学2019-2020学年2020届高考压轴化学试题(一)理科综合能力测试(化学部分)本试卷分选择题和非选择题两部分,共40题,满分300分,考试时间150分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32第Ⅰ卷(选择题共126分)一、选择题(每小题6分,本大题共13小题。
每小题给出的四个选项中,只有一项是符合题目要求的。
)7.《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”。
下列说法错误的是A.鸡屎矾中主要成分属于碱式盐B.碱式碳酸铜不稳定,受热易分解C.“涂铁皆作铜色”发生反应为置换反应D.“内质不变”说明出现了钝化现象答案 D解析A.鸡屎矾中主要成分是Cu2(OH)2CO3,含有未被中和的OH−,因此属于碱式盐,A正确;B.碱式碳酸铜受热易分解产生CuO、CO2、H2O,因此不稳定,B正确;C.Fe与铜的化合物反应产生单质铜,Fe变为相应的盐,发生反应为置换反应,C正确;D.铁的表面与铜的化合物反应生成单质铜,铁表面有一层铜,阻隔了反应的继续进行,并未发生钝化,D错误;故合理选项是D。
8.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。
a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。
下列叙述正确的是()A.a元素的三种核素的氧化物互为同素异形体B .a 和其他3种元素均能形成共价化合物C .d 和其他3种元素均能形成离子化合物D .元素a 与b 、c 、d 均能形成18电子微粒 答案 C解析 根据a -与氦具有相同电子层结构可确定a 为H ,结合b 、c 次外层均为8个电子,且最外层电子数分别为6和7,可确定b 、c 分别为S 和Cl ,因c -和d +的电子层结构相同,可确定d 为K 。
H 的三种核素分别是1H 、2H 、3H ,三种核素的氧化物是化合物,同素异形体是单质,A 项错误;H 与K 形成的KH 是离子化合物,B 项错误;K 与S 、Cl 、H 均形成离子化合物,C 项正确;H 与K 、S 、Cl 形成KH 、H 2S 、HCl ,KH 为20电子微粒,H 2S 、HCl 为18电子微粒,D 项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019-2020学年四川省成都龙泉第二中学新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.下列实验中根据现象得出的结论错误的是A.A B.B C.C D.D【答案】C【解析】【详解】A.在强酸性环境中,H+、NO3-、Cu会发生氧化还原反应产生NO气体,一氧化氮易被氧化为二氧化氮,因此会看到试管口有红棕色气体产生,A正确;B.酸性K2Cr2O7具有强的氧化性,会将乙醇氧化,K2Cr2O7被还原为Cr2(SO4)3,因此管中固体逐渐由橙色变为绿色,B正确;C.在酸性条件下,H+、NO3-、SO2会发生氧化还原反应产生SO42-,因此滴入BaCl2溶液,会产生BaSO4白色沉淀,可以证明氧化性:HNO3>H2SO4,C错误;D.向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,由于Mg(OH)2、Cu(OH)2构型相同,因此可以证明溶度积常数:Ksp[Mg(OH)2]>Ksp[Cu(OH)2],D正确;故合理选项是C。
2.下列叙述正确的是()A.合成氨反应放热,采用低温可以提高氨的生成速率B.常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低C.反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0D.在一容积可变的密闭容器中反应2SO2(g)+O2(g)垐?噲?2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,23222c (SO )c (SO )c(O )的值增大【答案】C 【解析】 【详解】A 、降低温度,会减慢氨的生成速率,选项A 错误;B 、常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由c (OH -)=()WK c H +可知氢氧根离子的浓度增大,选项B 错误;C 、反应4Fe(OH)2(s)+2H 2O(l)+O 2(g)=4Fe(OH)3(s),△S <0,常温下能自发进行,说明△H-T•△S <0,因此可知△H <0,选项C 正确;D 、23222c (SO )c (SO )c(O )可看作该反应的平衡常数的倒数,温度不变,平衡常数不变,则该值不变,选项D 错误。
答案选C 。
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A .1.0 mol·L -1的KNO 3溶液中:H +、Fe 2+、Cl -、24SO -B .使紫色石蕊溶液变红的溶液中:+4NH 、Ba 2+、2AlO -、Cl - C .pH =12的溶液中:K +、Na +、CH 3COO -、Br -D .滴加几滴KSCN 溶液显血红色的溶液中:+4NH 、Mg 2+、I -、Cl - 【答案】C 【解析】 【详解】A. H +、Fe 2+、NO 3—之间能够发生氧化还原反应,不能大量共存,故A 错误;B. 使紫色石蕊溶液变红的溶液为酸性溶液,溶液中存在大量H +,H +与AlO 2—在溶液中能够反应,且NH 4+与AlO 2—会发生双水解,不能大量共存,故B 错误;C. pH =12的溶液显碱性,OH -与K +、Na +、CH 3COO -、Br -不反应,且K +、Na +、CH 3COO -、Br -之间也不反应,可大量共存,故C 正确;D. 滴加几滴KSCN 溶液显血红色的溶液中含有Fe 3+,Fe 3+、I -能够发生氧化还原反应,不能大量共存,故D 错误; 故选C 。
4.利用有机物X 在一定条件下可合成植物生长所需的“平衡因子”Y(部分产物未写出)。
已知含有“手性碳原子”的分子可形成对映异构体。
下列有关说法中正确的是()A.X,Y分子都不存在对映异构体B.X分子中所有碳原子可能都在同一平面C.Y分子可以发生取代、酯化、消去、加成、氧化等反应D.未写出的产物可能有2种,且都具有两性化合物的特性【答案】D【解析】【分析】【详解】A.连有四个不同基团的碳原子称为手性碳原子,X、Y分子中都存在手性碳原子,则都存在对映异构体,故A错误;B.X分子中同时连接两个甲基的碳原子为四面体构型,则X分子中所有碳原子不可能都在同一平面上,故B错误;C.Y分子中与羟基相连的碳原子的邻碳原子上无氢原子,则Y分子不能发生消去反应,故C错误;D.因为X分子结构中有肽键和酯基,则X生成Y的反应可能是发生了水解反应,生成的另外两种产物分别为HOOCCH2NH2、,都具有两性化合物的特性,故D正确;综上所述,答案为D。
5.下列实验中,所采取的分离方法与对应原理都正确的是()。
选项目的分离方法原理A 分离溶于水中的碘乙醇萃取碘在乙醇中的溶解度较大B 分离乙酸乙酯和乙醇分液乙酸乙酯和乙醇的密度不同C 除去丁醇中的乙醚蒸馏丁醇与乙醚互溶且沸点相差较大D 除去KNO3固体中混杂的NaCl 重结晶NaCl在水中的溶解度受温度影响大A.A B.B C.C D.D【答案】C【解析】A.乙醇和水混溶,不能用作萃取剂,应用四氯化碳或苯萃取,A错误;B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,可用蒸馏的方法或加入饱和碳酸钠溶液分离,B错误;C.丁醇和乙醚混溶,但二者的沸点不同且相差较大,可用蒸馏的方法分离,C正确;D.根据二者在水中随温度升高而溶解度不同,利用重结晶法。
NaCl随温度升高溶解度变化不大,KNO3随温度升高溶解度变化大,D错误;故合理选项是C。
【点睛】本题考查物质的分离提纯,注意相关物质性质的异同,掌握常见物质的分离方法和操作原理是解题的关键,题目难度不大,D项为易错点,注意NaCl和KNO3在水中溶解度的差异。
6.根据下列实验操作和现象所得出的结论正确的是()A.A B.B C.C D.D【答案】D【解析】【详解】A.若X为氨气,生成白色沉淀为亚硫酸钡,若X为氯气,生成白色沉淀为硫酸钡,则X可能为氨气或Cl2等,不一定具有强氧化性,选项A错误;B.由现象可知,生成硅酸,则盐酸的酸性大于硅酸,但不能利用无氧酸与含氧酸的酸性强弱比较非金属性,方案不合理,选项B错误;C、常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大,说明ClO-的水解程度大,则酸性HF>HClO,选项C错误;D.卤代烃中卤元素的检验时,先将卤元素转化为卤离子,然后加入稀硝酸中和未反应的NaOH,最后用硝酸银检验卤离子,则卤代烃Y与NaOH水溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子,选项D正确;【点睛】本题考查化学实验方案评价,明确实验操作步骤、元素化合物性质是解本题关键,注意卤素离子与卤素原子检验的不同,题目难度不大。
7.下列有关实验原理或实验操作正确的是()A.用pH试纸测量Ca(ClO)2溶液的pHB.向稀盐酸中加入锌粒,将生成的气体通过NaOH溶液,制取并纯化氢气C.向NaBr溶液中滴入少量氯水和四氯化碳,振荡、静置,溶液下层呈橙红色,说明Br﹣还原性强于Cl﹣D.称取K2SO4固体0.174 g,放入100 mL容量瓶中,加水溶解并稀释至刻度,可配制浓度为0.010 mol/L的K2SO4溶液【答案】C【解析】【详解】A.Ca(ClO)2溶液具有漂白性,可使pH试纸褪色,应选pH计测定,故A错误;B.NaOH可吸收挥发的HCl,氢气中混有水蒸气,还需浓硫酸干燥纯化氢气,故B错误;C.由操作和现象可知,氯气与NaBr反应生成溴,则Br﹣还原性强于Cl﹣,故C正确;D.不能在容量瓶中溶解固体,应在烧杯中溶解、冷却后转移到容量瓶中定容,故D错误;故选:C。
8.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图.下列关于M的说法正确的是()A.属于芳香烃B.遇FeCl3溶液显紫色C.能使酸性高锰酸钾溶液褪色D.1 mol M完全水解生成2 mol醇【答案】C【解析】【详解】A. 含有C. H、O元素且含有苯环,属于芳香族化合物,不属于芳香烃,故A错误;B. 不含酚羟基,所以不能和氯化铁溶液发生显色反应,故B错误;C. 含有碳碳双键且连接苯环的碳原子上含有氢原子,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C正确;D. 含有3个酯基,所以1 mol M完全水解生成3mol醇,故D错误;故选:C。
【点睛】该物质中含有酯基、氨基、苯环、碳碳双键,具有酯、胺、苯、烯烃的性质,能发生水解反应、中和反应、加成反应、取代反应、加聚反应等,据此分析解答.9.由下列“实验操作和现象”与“结论”均正确的()A.A B.B C.C D.D【答案】C【解析】【详解】A.酸性KMnO4溶液有强氧化性,能氧化溶液中的Cl-,则溶液褪色无法判断溶液中一定含有Fe2+,故A错误;B.常温下,Na2CO3溶解度大于NaHCO3,要比较两种钠盐水解程度相对大小时钠盐溶液浓度必须相同,因为两种钠盐饱和溶液浓度不等,所以不能根据溶液pH判断常温下水解程度:CO32->HCO3-,故B错误;C.向少量AgNO3溶液中滴加足量NaCl溶液,再滴加KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,说明碘化银更难溶,说明碘化银的溶度积较小,即Ksp(AgI)<Ksp(AgCl),故C正确;D.Cl2通入到含有酚酞的NaOH溶液中,红色褪去,是因氯气与NaOH反应生成NaCl和NaClO,导致溶液碱性减弱,而不是漂白性,故D错误;故答案为C。
10.环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。
下列说法正确的是A.n分子中所有原子都在同一个平面上B.n和:CBr2生成p的反应属于加成反应C.p分子中极性键和非极性键数目之比为2:9D.m分子同分异构体中属于芳香族化合物的共有四种【答案】B【解析】【分析】【详解】A.n中有饱和的C原子—CH2—,其结构类似于CH4,所有的原子不可能共平面,A项错误;B.n中的碳碳双键打开与:CBr2相连,发生加成反应,B项正确;C.p分子中的非极性键只有C—C键,1个p分子中有9根C-C键,极性键有C-H键和C—Br键,分别为8根和2根,所以极性键和非极性键的比例为10:9,C项错误;D.m的化学式为C7H8O,属于芳香族化合物的同分异构体,如果取代基是—OH和-CH3,则有邻间对3种,如果取代基为—CH2OH,只有1种,取代基还可为—OCH3,1种,则共5种,D项错误;本题答案选B。
11.下列有关说法中正确的是A.纳米Fe3O4分散到适当的分散剂中可得到胶体,能产生丁达尔效应B.加热条件下金属单质在空气中均可表现出还原性C.不能导电的化合物均不是电解质D.电解质溶液导电过程中,离子仅仅发生了定向移动【答案】A【解析】【详解】A. 纳米Fe3O4分散到适当的分散剂中可得到胶体,胶体能产生丁达尔效应,A项正确;B. 某些金属单质化学性质不活泼如金、铂等金属,在加热条件下不会发生化学反应,不会表现还原性,B 项错误;C. 在水溶液中或熔融状态下能够导电的化合物属于电解质,与自身是否导电无关,电解质在固态时不导电,C项错误;D. 电解质溶液导电过程中,会有离子在电极表面放电而发生化学变化,D项错误;【点睛】C项是学生的易错点,不能片面地认为能导电的物质就是电解质。
