2019湖北省人教版高一化学必修一:3.2几种重要的金属化合物-铁及其化合物限时训练
人教版化学必修一3.2几种重要的金属化合物----铁的重要化合物

氯水,振荡
溶液变成红色
金属铜也能将Fe3+还原:
反应的离子方程式 2Fe3+ + Fe = 3Fe2+ 2Fe2+ + Cl2 = 2Fe3+ +2Cl¯
2FeCl3 + Cu == 2FeCl2+CuCl2 (氧化剂)(还原剂)
【本讲小结】
1.铁的三种氧化物 2.铁的两种氢氧化物的制备和性质 3. Fe2+和Fe3+在一定条件下相互转化
不溶
Fe3O4+8H+=Fe2++ 2Fe3++4H2O
铁的氧化物的用途
Ⅰ.作为冶炼金属的原料,如 赤铁矿
高温
Fe2O3+3CO ═ 2 Fe+3CO2
Ⅱ.氧化铁常用于制造红色油漆 和涂料 Ⅲ、特制的磁性氧化铁可做录 音磁带和电信器材。
2.铁的氢氧化物
Fe(OH)3 可溶性铁盐+可溶性碱
Fe(OH)2 可溶性亚铁盐+可溶性碱
4.有些机会,因瞬间犹豫,擦肩而过;有些缘分,因一时任性,指间滑落;有些感情,因一时冲动,遗憾终生;凡事好好珍惜莫轻易言弃,愿 体味愉悦完美人生。
总结:Fe2+
+氧化剂(Cl2,Br2,O2,HNO3,KMnO4(H+))
+还原剂(Fe,Cu,I-,SO2等)
还原剂
Fe3+ 氧化剂
4.掌握Fe3+的检验方法:Fe3+遇SCN-显红色。
作业: 课本P63 习题
76.身如流水,日夜不停流去,使人在闪灭中老去。心如流水,没有片刻静止,使人在散乱中活着。 86.如果有天我们淹没在人潮中,庸碌一生,那是因为我们没有努力要活得丰盛。 62.正当壮年,怎能暮气沉沉;台风口上,何不迎风飞翔。 24.现实逼我去选择,就算还是很迷茫,未来的路我还是要自己扛。 97.要成功,先发疯,头脑简单向前冲。 27.年代的人要跟年代的人去竞争。 8.成功的秘诀在于永不改变既定的目标,成功的秘密在于始终如一地忠于目标。 90.我从不把安逸和快乐看作是生活的本身--这种伦理基础,我叫它猪栏的理想。 73.每当疲惫的时候,那就停下脚步,遥想追逐的远方,恢复力量再上路。 95.忍别人所不能忍的痛,吃别人所不能吃的苦,是为了收获得不到的收获。 3.有希望的地方,痛苦也成快乐。 98.哪怕此刻的生活有多糟糕,也总会有好转的一天。走过的生活并不完美,太完美的也就不是生活了!每人每天都在做一件事情:为了未来 而奋斗!固然结果不同,皆因我们平时的努力,每个今天我们都尽十分的努力,未来的成功就是必然!
人教高中化学必修一3.2几种重要的化合物 铁的重要化合物教案
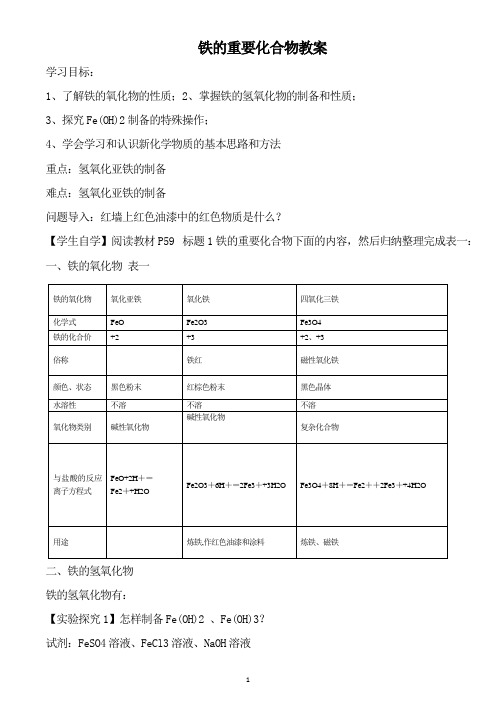
铁的重要化合物教案学习目标:1、了解铁的氧化物的性质;2、掌握铁的氢氧化物的制备和性质;3、探究Fe(OH)2制备的特殊操作;4、学会学习和认识新化学物质的基本思路和方法重点:氢氧化亚铁的制备难点:氢氧化亚铁的制备问题导入:红墙上红色油漆中的红色物质是什么?【学生自学】阅读教材P59 标题1铁的重要化合物下面的内容,然后归纳整理完成表一:一、铁的氧化物表一二、铁的氢氧化物铁的氢氧化物有:【实验探究1】怎样制备Fe(OH)2 、Fe(OH)3?试剂:FeSO4溶液、FeCl3溶液、NaOH溶液方法:两支洁净的试管各取少量FeCl3、FeSO4溶液,然后向两支试管分别滴加NaOH溶液观察现象。
学生操作、记录现象表二【提出问题1】为什么在实际操作中几乎看不到白色Fe(OH)2沉淀而只看到灰绿色?学生小组分析原因:这是因为白色的Fe(OH)2在空气中易被氧气氧化成红褐色的Fe(OH)3( 4Fe(OH)2+ O2+2H2O = 4Fe(OH)3 )【小结】所以Fe(OH)2应该是什么颜色呢?(白色),而灰绿色只是Fe(OH)2向Fe(OH)3转化的中间过渡阶段。
【提出问题2】能不能通过实验改进,使生成的Fe(OH) 2沉淀能较长时间保持白色?学生小组讨论分析:Fe(OH)2易被氧化的原因:1.反应的溶液与空气接触 2.反应试剂溶有氧气实验改进的目的:隔绝氧气与反应物和生成物接触【实验探究2】利用现有试剂固体FeSO4、固体NaOH、溶液FeSO4、溶液NaOH、蒸馏水、植物油,仪器试管、烧杯、长的胶头滴管、酒精灯,讨论制备Fe(OH)2的改进实验方案学生小组讨论改进方案:方案:1、使用新配制的FeSO4溶液和NaOH溶液。
2、把配制溶液用的蒸馏水事先加热煮沸一下。
3、用长滴管吸取NaOH溶液,其尖端插入FeSO4溶液液面以下,再挤出NaOH溶液。
4、在试管中FeSO4溶液液面上预先注入一层保护层(例如植物油),则生成的Fe(OH)2保存的时间会更长一些。
铁的重要化合物课件-高一上学期化学人教版(2019)必修第一册

——
红色油漆和涂
料、炼铁原料
制录音磁带和电讯器 材,打印机或复印机 的墨粉
例1下列关于铁的氧化物说法错误的是 ( C ) A.铁的氧化物在通常状况下都是有色固体 B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶
液 中同时存在Fe2+和Fe3+ C.FeO在空气中加热生成Fe2O3 D解.析工:铁业的上氧常化使物用在铁通常的状氧况化下物都作是原有色料固冶体炼,铁如氧化铁是红棕色固体,
氧化亚铁和四氧化三铁都是黑色固体,故A正确;四氧化三铁是一种复杂的
铁的氧化物,可看作是由FeO、Fe2O3组成的化合物,它与盐酸反应后的溶 液中同时存在Fe2+和Fe3+,B正确;FeO在空气中加热生成Fe3O4,故C错误; 工业上常使用铁的氧化物作原料,用一氧化碳冶炼铁,故D正确。
例2关于铁的三种氧化物(FeO、Fe2O3、Fe3O4),下列叙述中 正确的是( C ) A.铁的三种氧化物中铁元素的化合价完全相同 B.都是碱性氧化物,都能与盐酸反应生成氯化铁和水 C.铁的三种氧化物在高温条件下都能被CO还原为Fe D.四氧化三铁中铁元素有+2价和+3价,它是一种混合物
Fe3O4。制造阿尔法磁谱仪的核心部件的材料是一种具有磁性的物质,在 铁的各种化合物中,只有Fe3O4是具有磁性的物质,其他均不具有磁性。
2.“秦砖汉瓦”是我国传统建筑文化的一个缩影。都是由黏土烧制的 砖瓦(黏土中含有铁元素),有的是黑色的,有的却是红色的,请分析其 颜色不同的原因?
砖瓦显黑色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成黑色 的FeO与Fe3O4。 砖瓦显红色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成红棕 色的Fe2O3。
3.1.2 铁的重要化合物-高一化学(人教版2019必修第一册)

。
(3)向B溶液中加入A的有关离子反应方程式:
。
(4)写出A在一定条件下与水反应的化学方程式:
。
答案 (1)Fe(OH)3 AgCl
(2)4Fe(OH)2+O2+2H2O === 4Fe(OH)3 (3)2H++Fe === Fe2++H2↑
(4)3Fe+4H2O(g)
Fe3O4+4H2
解析 据框图转化可知,D溶液与硝酸酸化的硝酸银反应后的溶液中含有K+,
久起销,用刀刮其销,....所刮下之销末,名铁线粉”。这 里的“铁线粉”是指( D )
A.Fe
B.FeCl3
C. FeO
D.Fe2O3
4.铁的常见化合价有+2价和+3价。据研究,铁在浓硝酸中发生钝化时,可生成一种化
学式为Fe8O11的化合物,它可以看作由FeO和 Fe2O3组成的复杂氧化物。该化合物可
新制FeCl2溶液 蒸馏水煮沸后配制溶液(除去水中溶解的O2)
思考4:上述实验还能进一步改进吗?
【改进一】亚铁盐溶液上面加保护层
有机覆盖层法 如图,若向盛有FeSO4溶液的试管里加入少量 煤油或苯,再将吸有NaOH溶液的长滴管伸入到
植物油
FeSO4溶液的液面下,挤出NaOH溶液。显然加入 煤油或苯,则隔绝空气的效果会更好。
FeO
Fe2O3
Fe3O4
黑色粉末
用作色素,应用于瓷器 制作中使釉呈现绿色
红棕色粉末
用作油漆、涂料、油墨 的红色颜料
黑色晶体(具有磁性) 常用的磁性材料
NO.1
思考与讨论 (1)铁元素可以形成三种氧化物——FeO 、Fe2O3和Fe3O4。观察 三者的外观,并对其作出描述。
人教版高一化学必修一:3.2几种重要的金属化合物-铁及其化合物导学提纲

学生课堂导学提纲(高一化学)铁及其化合物班级: 姓名: 小组: 评价:【学习目标】2. 学生通过演示实验,能准确描述实验现象并正确写出反应方程式。
3. 学生通过小组讨论,掌握铁的化学性质并正确书写化学方程式。
【核心素养】素养1 宏观辨识与微观探析素养2 变化观念与平衡思想认识铁的重要化合物的化学性质。
素养3 证据推理与模型认知具有证据意识,能基于假设进行分析推理并得出正确结论。
素养4 科学探究与创新意识通过氢氧化铁和氢氧化亚铁的制备,探究其性质。
素养5 科学精神与社会责任【导学流程】一、知识链接二、基础感知一、铁的获取1.存在(1)含量:铁元素在地壳中的含量居第____位。
(2)形态:主要以________形式存在,铁单质只有在_________中存在。
2.铁的冶炼(1)设备:_______________。
(2)原料:___________、___________、_____________、_____________等。
(3)原理:高温下,用__________把铁从铁矿石中还原出来。
(4)主要反应:①还原剂的生成:________________________,__________________。
②铁矿石的还原:_______________________________________________________。
③炉渣的形成:______________________________,__________________________。
(5)铁合金:含C__________的为生铁,含C____________的为钢。
二.铁的性质及应用(1)物理性质:________色有________光泽的固体,熔点____,具有良好的________性、________性、________性,可以被________吸引。
(2)化学性质:①与非金属单质的反应(如Cl2、O2):________________________________、____________________________________。
人教版高中化学必修一教案-3.2几种重要的金属化合物13

板书设计
三、铁的重要化合物:
1、铁的氧化物:
(1)物理性质:
(2) 化学性质:
①与盐酸的反应
②与CO的反应
2、铁的氢氧化物的制备
引导学生从化学反应原理出发,选择适当角度正确分析问题,将所学知识用于实验中,多角度思考解决方案,选择易于操作的实验方法进行验证,锻炼学生独立思考问题、合作的进行实验等能力。
课堂总结
从本节课所学习的铁的化合物(铁的氧化物和氢氧化物)出发,对这些物质的性质以及相互转化的角度引导学生进行总结。
对铁的氧化物和氢氧化物的性质及其之间的相互进行归纳总结。
教学流程
新课引入——观看联系生活的图片引入铁的化合物的学习;
学习氧化物——对比法学习三种氧化物的主要性质;
实验探究氢氧化物的制备——教师讲解、演示,学生观察实验现象并分析成因,学生正确反应方程式。
学生小组讨论探究--Fe(OH)2的制备操作中需注意什么;
课堂总结——教师引导,学生回忆、巩固本节课的主要内容。
学生通过实物与理论知识的对照,完善化学用语的使用、强化某些重要反应的记忆。
Fe(OH)2和Fe(OH)3的制备方法;
引导学生分析两种氢氧化物的制备方法,准确描述实验现象;对Fe(OH)2的制备中出现的现象进行分析,介绍Fe(OH)2在溶液中转为Fe(OH)3的原理
正确描述实验现象,积极思考,与课本中所描述的实验现象对比,学习Fe(OH)2在溶液中转化为Fe(OH)3的原理以及对应现象。
课标要求
1.知道铁的氧化物的俗名及主要性质;
2.掌握氢氧化物的制备,探究Fe(OH)2的制备条件;
3.掌握Fe(OH)2与Fe(OH)3的沉淀转化的现象及原理
人教版高中化学必修一教案-3.2几种重要的金属化合物《铁的重要化合物》

第二节几种重要的金属化合物第三课时铁的重要化合物【教课目的】:1、铁的氧化物的性质与比较2、铁的氢氧化物的性质与比较3、Fe3+离子的查验4、“铁三角”(即Fe、Fe2+、Fe3+之间的转变)【教课方案思路】:1、由铁的化学性质(+2、+3)引入课题。
2、经过学生自学、对照,概括出铁的氧化物的性质。
3、学生议论:怎样制备氢氧化铁和氢氧化亚铁?并着手制取氢氧化铁和氢氧化亚铁。
4、查验三价铁离子,并进行二价、三价铁离子查验的小结。
5、教师指引、学生议论“铁三角”之间的互相转变6、讲堂练习【教课方法、手段】:教课方法:经过议论、发现问题、实验研究、类比、建立思想导图等方法教课手段:多媒体协助,魔术表演(沾KSCN溶液的白花)【课前准备】:1.实验药品:铁粉、铜粉、氯水(Cl2的水溶液)、KMnO4溶液、 Vc、KSCN溶液、 NaOH溶液、 FeCl 溶液、 FeSO 溶液(带铁粉)3 42.实验仪器:试管10 个,药匙,擦纸,胶头滴管 2 支,喷壶( FeCl3 溶液)3.要修业生仔细预习铁的有关内容并提出需要解决的问题。
【教课过程设计】:教课过程学生活动设计企图[引] 铁的单质与其余物质反响时,既可回想旧知识,复习回首已以失掉二个电子,也能够失掉三个电子,激起学习新学旧知识,也就是在化合物中铁有 +2 和+3 两种化知识的兴趣引入课题合价,那么它的氧化物也应当是有多种的,我们今日就来学习这些知识。
[过渡 ] 请同学们翻开课本第 59 页,先自学、思虑、培育学生自自学铁的氧化物一段的内容,并思虑讨对照学,对照,论填写下表:(多媒体投影)概括的能力FeO Fe2O Fe3O43化学名培育学生逐俗名小组沟通讨步思虑研究色态论,代表发能力,互相溶解性言,互相增补合作精神与盐酸反响完美与复原剂反应[问题与议论 ] 铁的氢氧化物有哪些?学生思虑,讨让学生依据应当怎样制取呢?论课题进行思[演示实验 ] [ 实验 3-9]制取氢氧化铁和氢氧化亚铁。
人教版化学必修1,第三章几种重要的金属化合物铁的重要化合物

铁的重要化合物1水溶解性2、铁的氢氧化物3、铁盐和亚铁盐(1)Fe 3+的检验方法:含有Fe 3+的盐溶液遇到KSCN 溶液时变成 ,可用于Fe 3+的检验。
(2)Fe 3+和Fe 2+的转化:根据课本P61相关内容,完成下列两个反应的化学方程式和离子方程式。
①FeCl 3溶液中加入铁粉 , ②FeCl 2溶液中滴加氯水 , (2)Fe 2+和Fe 3+以及Fe 的互相转化:1、 2、 3、 4、 5、 6、〖课堂练习〗1、下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是( ) A .FeCl 3、AlCl 3 B .NaCl 、BaCl 2 C .MgCl2、CuCl 2 D .FeCl 2、FeCl 32、硫酸亚铁溶液中含有杂质硫酸铁,为除去杂,提纯硫酸亚铁,应该加入下列哪种物质( ) A .锌粉 B .镁粉 C .铁粉 D . 铝粉3、要证明某溶液中不含Fe 3+而可能含有Fe 2+。
进行如下实验操作时,最佳顺序为( ) ① 加入足量氯水 ② 加入足量酸性KMnO 4溶液 ③ 加入少量NH 4SCN A .①③ B .③② C .③① D .①②③4、为了检验某FeCl 2溶液是否变质,可向溶液中加入( )A .NaOH 溶液B .铁片C .KSCN 溶液D .石蕊溶液 5、下列离子方程式书写正确..的是( ) A .铁与盐酸反应:2 Fe+6H +==2 Fe 3++3H 2↑ B .氯气与氯化亚铁溶液反应:2 FeCl 2+Cl 2=2 FeCl 3 C .氯化铁溶液中加入铁粉:++=+232Fe Fe FeD .氯化铁溶液与NaOH 溶液反应: Fe 3++3OH -== Fe(OH)3↓6、把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( ) A .稀硫酸 B .CuSO 4溶液 C .Fe 2(SO 4)3溶液 D .AgNO 3溶液7、把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成,过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁及其化合物班级: 姓名: 小组: 分数:
A卷基础题(30分)
1.我国古代的湿法冶金术世界闻名,我国在世界上最先应用湿法冶金术的金属是( ) A.Fe B.Cu C.Ag D.Hg
2.在下列矿石中,其主要成分属于氧化物的是()
A.菱铁矿B.黄铜矿C.铝土矿D.黄铁矿
3.能解释“古代铁制品保存至今的很少”的理由是()
A.铁元素在地壳中含量少B.冶炼铁的原料少,且冶炼困难
C.铁易置换出其他金属D.铁易生锈,且铁锈对铁制品无保护作用
4.炼铁的原料是()
①焦炭;②生石灰;③石灰石;④空气;⑤铁矿石;⑥一氧化碳。
A.②④⑥B.①②④⑤C.①③④⑥D.①③④⑤
5.炼铁时,加入石灰石的作用是()
A.石灰石能降低铁矿石的熔点B.石灰石能改变生铁的性能
C.石灰石能促进氧化铁的还原D.石灰石用于除去铁矿石中的二氧化硅
B卷拓展题(40分)
6.下列关于Fe2+和Fe3+的叙述中,错误的是()
A.Fe2+的水溶液为浅绿色B.Fe3+的水溶液为棕黄色
C.Fe3+具有氧化性,Fe2+既具有氧化性又具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即出现血红色沉淀
7.高炉炼铁用于还原氧化铁的还原剂是()
A.一氧化碳B.焦炭C.石灰石D.空气
8.下列说法错误的是()
A.地壳中的铁都以化合物形式存在B.生铁和钢都不能完全溶解在盐酸中
C.锯条上的烤蓝是一层致密的氧化膜D.钢是由生铁炼制而成的,因而钢不会生锈9.生铁和足量的稀盐酸充分反应后,总会有一些残渣剩余,残渣的成分主要是() A.铁B.氯化铁C.氯化亚铁D.炭和一些杂质
C卷挑战题(30分)
10.CO在高温下还原a g氧化铁,得到b g铁,则铁的相对原子质量是() A.24b/(a-b) B.48b/(a-b)
C.(a-b)/24b D.48b/(a-2b)
11.依据反应:X+C===2Y和Fe2O3+3Y===2Fe+3X,推断X和Y各表示() A.CO和CO2 B.H2O和CO C.CO2和CO D.CO2和H2
12.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是()
A.Fe3+B.Mg2+C.Fe2+D.Al3+
13.要证明某溶液中不含Fe3+,而可能含Fe2+,进行如下实验操作时,最佳顺序是()
①加足量新制氯水②加足量KMnO4溶液③加少量KSCN溶液
A.①②B.③②C.③①D.①②③。
