6.2.1盐的分类
各种PH值磷酸盐缓冲液配制

各种PH值的磷酸盐缓冲液配制2014-06-27 10:33:48 来源:生物秀知道浏览次数:24342磷酸盐取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐(pH2.0)甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5)取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0)取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8)取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6)取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8)取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8)取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
磷酸盐缓冲液(pH7.0)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH7.2)取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。
磷酸盐缓冲液(pH7.3)取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。
6.2.1 盐的分类和性质(3)

6.2.1 盐的分类和性质(3)【前知回顾】1分子是保持物质的一种微粒,原子是中的最小微粒。
2.从分子、原子的角度认识化学反应是化学研究的基本方法,如图是某密闭容器中物质变化过程的微观示意图(“●”表示氧原子,“○”表示氢原子):A B C请回答:①图A中的物质是:____________(填“混合物”或“单质”或“化合物”);②变化Ⅰ的过程中,没有发生变化的最小微粒是____________(填微粒名称);③下列关于变化Ⅱ的说法中,正确的是____________(填写序号);A.分子的化学性质没有改变B.分子变小了C.分子间的距离变小了D.分子的种类发生了改变④从变化Ⅱ的微观过程可分析出,该变化过程属于____________变化。
【新知检测】3~6题为单项选择题,每题只有1个正确选项3.属于盐的是()A.H2SO4B.CaCO3C.NaOHD.MgO4.水溶液呈碱性且遇酸有气泡的物质是()A.碳酸钙B.氢氧化钠C.碳酸钠D.氯化钠5.能用稀硫酸一次性鉴别的一组是()A. NaCl、Na2SO4、BaCl2B.C、CuO、FeC.Na2CO3、K2CO3、NaClD.BaCl2、Ba(NO3)2、Na2CO36.现有碳酸钾、碳酸钙、硫酸铜三种白色的固体粉末,用最经济、简便、现象明显的方法鉴别,应选用试剂中的()A.蒸馏水B.紫色石蕊试液C.稀盐酸D.烧碱溶液7.分离CaCl2、KCl的固体混合物,可选用的一组试剂是()A.水、硝酸银、盐酸B.水、碳酸钠、盐酸C.水、碳酸钾、硫酸D.水、碳酸钾、盐酸8~9题为不定项选择题,每题有1-2个正确选项8.鉴别盐酸和硫酸,可加入下列试剂中的()A.氯化钡溶液B.硝酸银溶液C.碳酸钠溶液D.石蕊试剂9.向无色溶液中滴入氯化钡溶液后,有白色沉淀生成,则该溶液可能是()A.硝酸银B.硫酸钠C.氯化钠D.硝酸钙10.物质的性质决定其用途。
有关物质的用途正确的是()A.烧碱用于治疗胃酸过多B.食盐水用于清洗伤口C.氯气用作水的消毒剂D.氦气用作火箭燃料11.向稀盐酸中滴加硝酸银溶液,看到的现象是__________________,反应的化学方程式是___________________________。
常见的盐

农业
生活 交通 人的生理活动
(3)氯化钠的存在: 氯化钠在自然界中分布很广,如:海水、盐湖、盐井和盐矿 中蕴藏着丰富的氯化钠。
讨论:1、如何从海水中提取氯化钠呢?
将海水蒸发,除去其中的水分就可以得到粗盐。 2、粗盐中含常有泥沙等不溶性杂质,如何除去?也常含有 氯化镁、氯化钙等可溶性杂质又该如何除去? 向盐溶液中先加入足量的氢氧化钠溶液,以除去其中的镁离 子。再加足量的纯碱溶液以除去其中的钙离子,最后加入适 量的盐酸溶液,以除去其中的氢氧化钠溶液和纯碱溶液。 3、如何确定盐酸的量是适量的?
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
SO42-
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微
CO32-
溶、挥 溶 溶 溶 不 不 微 一 不 不 不 一 不 不
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
碳酸钠 氢氧化钙三种无色溶液,这种试剂是_____。
2、复分解反应的条件: NaOH+HCl=NaCl+H2O CaCO3+2HCl=CaCL2+H2O+CO2↑
Ca(OH)2+Na2CO3=CaCO3↓+H2O
有水生成 复分解反应的条件: 或有气体生成 生成物中必须有 或有沉淀生成 复分解反应有以下几种:
(1)品尝味道,有碱味的是酱油,有酸味的是黑醋。
(2)各取少量,分别向其中加入少量纯碱(或小苏打)粉末, 冒气泡的是黑醋,无气泡产生的是酱油。
(3)在两个玻璃杯中分别放入废旧电池的锌皮两小片或擦去 氧化膜后的铝导线两小段,再分别倒入特测液少许,有气泡产 生的原溶液是黑醋,无现象的原溶液是酱油。
6.2盐的分类

SO4
CaSO4 Na2SO4 K2SO4 (NH4)2SO4
NO3
Ca(NO3)2 NaNO3 KNO3 NH4NO3
CO3
CaCO3 Na2CO3 K2CO3 (NH4)2CO3
HCO3
Ca(HCO3)2 NaHCO3 KHCO3 NH4HCO3
NH4
前四列盐的化学式在酸根组成上与第五列有什么不同?
新课讲授
四、焰色反应
金属或它们的化合物在灼烧时,使火焰呈特殊的颜 色,在化学上叫做焰色反应。
新课讲授
钠元素焰色反应的颜色: 黄色
钾元素焰色反应的颜色: (透过蓝色钴玻璃)
紫色
[巩固性练习四]:
总结
完成诊断性练习
布置作业
新课讲授
二、盐的分类 1、按酸根部分是否有氢元素可分为: 酸根无氢元素 正盐
酸根有氢元素
酸式盐
[形成性练习二]:
Cl Ca Na K NH4
CaCl2 NaCl KCl NH4Cl
SO4
CaSO4 Na2SO4 K2SO4 (NH4)2SO4
NO3
Ca(NO3)2 NaNO3 KNO3 NH4NO3
[形成性练习一]:
1、CuSO4 和 Na2CO3是否属于盐? 2、那么CuSO4 · 2O和 Na2CO3· 2O 5H 10H 是否属于盐?分析判断
新课讲授
2、硫酸铜晶体CuSO4 · 2O和碳酸钠晶体 5H
Na2CO3· 2O是含有结晶水的盐。 10H
[巩固性练习一 ]
答案交流
Cl
Ca Na K
表格一中第一横行的盐在组成上有什么共同点?
新课讲授
3、按正价部分不同可分为: (初中阶段常见) 钠盐 钾盐 钙盐 铵盐 例如:NaCl 例如:KNO3 例如:CaCO3 例如:NH4NO3
盐 -九年级第二学期化学知识精讲

6.2(1) 盐知识精讲一说起“盐”,大家往往首先想到的是家里的食盐。
其实食盐只是盐类物质的一种,我们化学上所讲的盐是指组成里含有金属离子和酸根离子的化合物。
【课前复习】※会做了,学习新课有保障1.根据氯化钠的溶解度曲线,可以看出氯化钠的溶解度变化有何特点?2.将难溶于液体的固体与液体分离可采用__________的操作,在该操作中要注意一__________,二__________,三__________。
3.金属和盐的反应需要哪些条件?属于哪种反应类型?4.实验室制二氧化碳的原料是__________和__________,反应原理是_________________________________________________________________________ __________________。
答案:1.氯化钠的溶解度曲线比较平缓,说明氯化钠的溶解度受温度影响变化不大。
2.过滤;贴;低;靠。
3.金属和盐的反应需要两个条件才能发生,一是盐必须可溶,能配成溶液;二是金属的活动性必须比盐中金属元素的活动性强,即在金属活动顺序表中,排在前面的金属才能置换排在它后面的金属,金属和盐的反应属于置换反应。
4.原料是大理石(或石灰石)和稀盐酸,反应原理为CaCO3+2HCl CaCl2+H2O+CO2↑。
※先看书,再来做一做1.举例说明氯化钠的重要用途。
2.粗盐提纯的过程可分为哪几步?3.复分解反应是指_____________________________________________________。
4.复分解反应的发生条件是_____________________________________________。
【学习目标】1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙等盐在生活生产中的广泛用途。
2.掌握复分解反应发生的条件,会判断两物质间能否发生复分解反应。
3.了解碳酸盐的一般性质,即能与盐酸反应放出二氧化碳气体。
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定

火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定
6.1分析步骤
按4.2.1步骤进行,用盐酸选择溶解法分别测定水泥和掺入水泥的火山灰质混合材料或粉煤灰中的不溶渣的含量。
6.2结果的计算
6.2.1盐酸选择溶解后不溶渣含量的计算
盐酸选择溶解后火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥的不溶渣含量(R11)掺入水泥的火山灰质混合材料或粉煤灰中的不溶渣的含量(R2)以及硅酸盐水泥(P·I )中不溶渣的含量(R3)均按式(3)计算。
6.2.2火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的计算
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中火山灰质或粉煤灰组分含量的计算 P 10001.1201.111⨯--=R R --------------------------------(23)
式中:
P —火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中火山灰质混合材料或粉煤灰组分的质量百分数,%;
R2——盐酸溶液选择溶解后火山灰质混合材料或粉煤灰组分的质量百分数,%;
1.07——校正系数。
6.3火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中石膏组分含量的测定
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定按第一章进行。
食用盐国家标准GB5462000
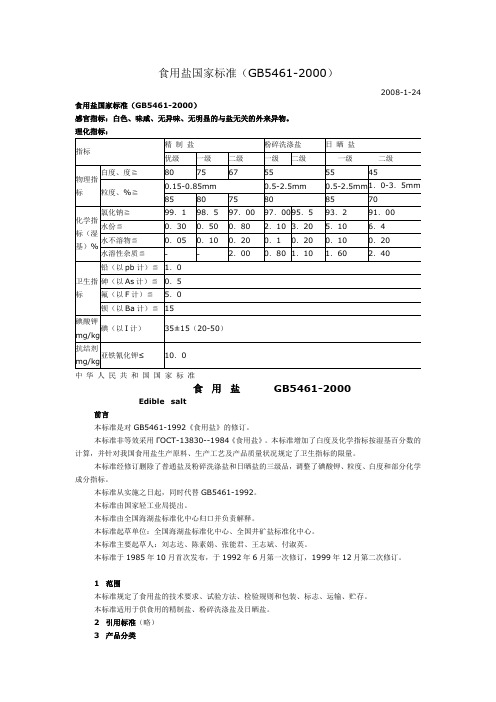
食用盐国家标准(GB5461-2000)2008-1-24 食用盐国家标准(GB5461-2000)感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
理化指标:中华人民共和国国家标准食用盐GB5461-2000Edible salt前言本标准是对GB5461-1992《食用盐》的修订。
本标准非等效采用ΓOCT-13830--1984《食用盐》。
本标准增加了白度及化学指标按湿基百分数的计算,并针对我国食用盐生产原料、生产工艺及产品质量状况规定了卫生指标的限量。
本标准经修订删除了普通盐及粉碎洗涤盐和日晒盐的三级品,调整了碘酸钾、粒度、白度和部分化学成分指标。
本标准从实施之日起,同时代替GB5461-1992。
本标准由国家轻工业局提出。
本标准由全国海湖盐标准化中心归口并负责解释。
本标准起草单位:全国海湖盐标准化中心、全国井矿盐标准化中心。
本标准主要起草人:刘志达、陈素娟、张能君、王志斌、付淑英。
本标准于1985年10月首次发布,于1992年6月第一次修订,1999年12月第二次修订。
1 范围本标准规定了食用盐的技术要求、试验方法、检验规则和包装、标志、运输、贮存。
本标准适用于供食用的精制盐、粉碎洗涤盐及日晒盐。
2 引用标准(略)3 产品分类食用盐为晶体氯化钠,用于食用。
食用盐按其生产和加工方法可分为:精制盐、粉碎洗涤盐、日晒盐。
按其等级可分为:优级、一级、二级。
分子式:NaC1分子量:58.444 技术要求4.1 感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
4.2 理化指标应符合表一规定:5 试验方法本方法所用试剂和水,在没有注明其他要求时,均指分析纯试剂和GB/T6682中规定的三级水。
试验中所需要标准溶液、杂质标准溶液、制剂和制品,在没有注明其他要求时,均按GB/T601、GB/T602、GB/T603之规定。
5.1 粒度的测定按GB/T13025.1规定执行5.2 白度的测定按GB/T13025.2规定执行5.3 水分含量的测定按GB/T13025.3规定执行5.4 水不溶物含量的测定按GB/T13025.4规定执行5.5 氯离子含量的测定按GB/T13025.5规定执行5.6 钙离子含量的测定按GB/T13025.6规定执行5.7 镁离子含量的测定按GB/T13025.6规定执行5.8 硫酸根离子含量的测定按GB/T13025.8规定执行5.9 碘离子含量的测定按GB/T13025.7规定执行5.10 铅离子限量的测定按GB/T13025.9规定执行5.11 砷离子限量的测定按GB/T13025.13规定执行5.12 钡离子限量的测定按GB/T13025.12规定执行5.13 氟离子限量的测定按GB/T13025.11规定执行5.14 亚铁氰化钾限量的测定按GB/T13025.10规定执行5.15 氯化钠及水溶性杂质成分的计算和检验结果的检查由上述各项检验结果得出食用盐样品所含单项离子的百份含量,然后按表2中所注顺序号计算化合物成分。
6.2(1)盐的组成和命名 食盐

4、化学性质 、 不能使指示剂变色, 不能使指示剂变色,呈中性 NaCl + AgNO3→ AgCl↓+NaNO3
检验盐酸盐的方法
滴加硝酸银溶液和稀硝 白色沉淀不消失。 酸,白色沉淀不消失。
下列盐可以统称为什么盐? 下列盐可以统称为什么盐?
钠盐
NaCl Na2SO4 NaNO3 Na2CO3
硫酸盐
K2SO4 Na2SO4 BaSO4 CuSO4
思考与讨论:H2CO3 思考与讨论 Na2CO3 Na被 取代 正盐 中的氢全部被Na取代 取代---正盐 正盐的酸根不含氢 H2CO3中的氢部分被 取代,碳酸 中的氢部分被Na取代 取代, 失去部分氢原子而形成的---酸式盐 失去部分氢原子而形成的 酸式盐 • 酸式盐的酸根含氢 • 碱式盐:Cu2(OH)2CO3 碱式盐: )
判断以下方程式是否正确
CuSO4 + 2NaOH→ Cu(OH)2 ↓ + Na2SO4 BaCO3 + Ca(OH)2→ CaCO3↓ + Ba(OH)2 难溶 可溶性的盐和碱才可能发生反应
二、盐的溶解性
盐:K、Na、 NH4、 NO3盐全溶 、 、 盐酸盐除AgCl不溶,其余全溶 不溶, 盐酸盐除 不溶 硫酸盐除BaSO4不溶,CaSO4、 不溶, 硫酸盐除 Ag2SO4 微溶,其余全溶 微溶, 碳酸盐K、 碳酸盐 、Na 、NH4、溶,其余不 溶
判断以下物质的溶解性
Ba(NO3)2 NH4Cl BaSO4 AgCl Ba(OH)2 Ag2CO3 Na2SO4
三、氯化钠
1、化学式:NaCl 、化学式: 俗名: 俗名:食盐 2、用途:人体中维持正常的生理功 、用途: 杀菌,制氢气、氯气、 能,杀菌,制氢气、氯气、 氢氧化钠、 氢氧化钠、纯碱
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复习引入5min 【复习】帮助老师解决问题,并且用化学方程式表示
1、精炼石油时,我们用什么来中和过量的硫酸?
2、中和由酸雨引起的土壤酸性时,我们用什么试剂?
【问题】以上反应属于什么反应?
通过联系生活中的
事物,让学生感受到
化学运用于生活中,
通过化学方程式的
书写,为认识盐的组
成埋下伏笔
盐的组成、分类及命名
8min 【过渡】中和反应是酸跟盐反应生成盐和水的反应。
那么其
中的盐跟我们生活中的盐有什么不同?那么,盐是由什么组
成的呢?(举例)
【板书】盐:由金属元素(或铵根)和酸根组成的化合物
【介绍】一、盐的分类方法
1、根据所含的酸根
2、根据所含的金属元素
3、根据盐的组成,又可分为正盐、酸式盐、碱式盐
4、根据盐的组成中是否含有氧元素,可以分为含氧酸盐和
无氧酸盐
二、盐的命名
1无氧酸盐称为:从右向左读做:某化某
含氧酸盐称为:从右向左读做:某酸某
通过举例,培养学生
分析和归纳的能力
通过教师的介绍,培
养学生记忆和理解
的能力
盐的溶解性规律
8min 【过渡】食盐,纯碱,碳酸钙的溶解性如何?那么硝酸钙的
如何判断?
【阅读】溶解性表
【问题】1min记住:若不能。
在30S内找出常见盐的溶解
性规律
【归纳】钾钠铵盐全都溶
硝酸盐类个个溶
盐酸盐除氯化银
硫酸盐除硫酸钡
其他盐类都不溶
通过观察、分析和归
纳,培养学生的思维
能力。
焰色反应5min 【过渡】炒菜时,不慎将食盐或食醋溅到煤气火焰上,有什
么现象?
【讲述】金属或金属化合物在灼烧时,使火焰呈特殊颜色叫
焰色反应
【实验】用碳酸钠,碳酸钾,氯化钾进行实验
归纳金属元素的焰色反应
通过实验。
增加学
生的学习兴趣并
且知道实验的操
作,及颜色反应的
应用。
