常见弱电解质电离平衡常数表1
常见弱电解质电离平衡常数表
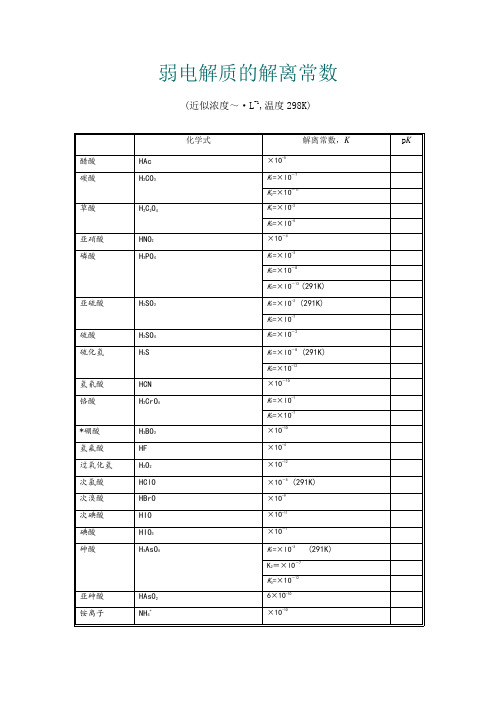
弱电解质的解离常数(近似浓度~·L-1,温度298K)化学式解离常数,K p K 醋酸HAc×1O-5碳酸H2CO3K1=×lO-7K2=×1O-11草酸H2C2O4K1=×lO-2K2=×lO-5亚硝酸HNO2×1O-4磷酸H3PO4K1=×lO-3K2=×1O-8K3=×lO-13 (291K)亚硫酸H2SO3 K1=×lO-2 (291K)K2=×lO-7硫酸H2SO4K2=×lO-2硫化氢H2S K1=×lO-8 (291K)K2=×1O-12氢氰酸HCN×1O-1O铬酸H2CrO4K1=×lO-1K2=×1O-7*硼酸H3BO3×1O-1O氢氟酸HF×1O-4过氧化氢H2O2×1O-12次氯酸HClO×1O-5 (291K)次溴酸HBrO×1O-9次碘酸HIO×1O-11碘酸HIO3×1O-1砷酸H3AsO4 K1=×lO-3 (291K)K2=×lO-7K3=×1O-12亚砷酸HAsO26×1O-1O铵离子NH4+×1O-1O氨水NH3·H2O×1O-5联胺N2H4×1O-7羟氨NH2OH×1O-9氢氧化铅Pb(OH)2×1O-4氢氧化锂LiOH×1O-1氢氧化铍Be(OH)2×1O-6BeOH+×1O-9氢氧化铝A1(OH)3×1O-9Al(OH)2+×1O-1O氢氧化锌Zn(OH)2×1O-7氢氧化镉Cd(OH)2×1O-11*乙二胺H2NC2H4NH2K1=×lO-5K2=×lO-8*六亚甲基四胺(CH2)6N4×1O-9*尿素CO(NH2)2×1O-14*质子化六亚甲基四胺(CH2)6N4H+×1O-6甲酸HCOOH ×1O-4 (293K)氯乙酸ClCH2COOH×1O-3氨基乙酸NH2CH2COOH×1O-1O*邻苯二甲酸C6H4(COOH)2K1=×1O-3K2=×1O-6柠檬酸(HOOCCH2)2C(OH)COOH K1=×1O-4K2=×1O-5 (293K)K3=×1O-7 -酒石酸(CH(OH)COOH)2K1=×1O-3K2=×1O-5*8-羟基喹啉C9H6NOH K1=8×lO-6K2=1×1O-9苯酚C6H5OH ×1O-1O (293K)*对氨基苯磺酸H2NC6H4SO3H K l=×lO-lK2=×1O-4*乙二胺四乙酸(EDTA) (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=×1O-7K6=×1O-11。
【知识解析】电离常数

电离常数1 概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。
对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数叫做电离平衡常数,简称电离常数。
弱酸、弱碱的电离常数通常分别用K a 、K b 表示。
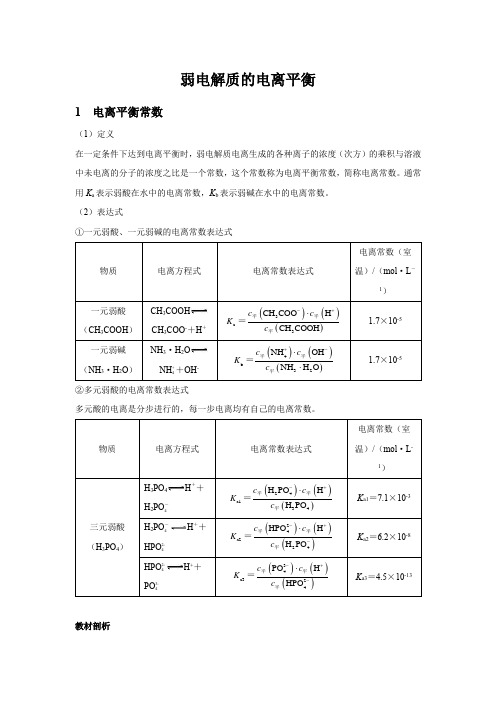
2 表示方法ABA ++B -K =()()()A B AB c c c +-⋅(1)一元弱酸、一元弱碱的电离常数 CH 3COOHCH 3COO -+H +()()()3a 3CH COO H CH COOH c c K c -+⋅=NH 3·H 2ONH + 4+OH -()()()4b 32NH OH NH H O c c K c +-⋅⋅=(2)多元弱酸、多元弱碱的电离常数多元弱酸的电离分步进行,各步的电离常数通常分别用K a1、K a2、K a3等来表示。
如: H 3PO 4H ++24H PO -()()()24a134H PO H H PO c c K c -+⋅=24H PO -H ++HPO 2- 4 ()()()24a224HPO H H PO c c K c -+-⋅=HPO 2- 4H ++PO 3- 4 ()()()34a324PO H HPOc c K c -+-⋅=一般多元弱酸各步电离常数的大小为K a1>>K a2>>K a3,因此,多元弱酸的酸性主要由第一步电离决定(八字口诀:分步进行,一步定性)。
多元弱碱的电离比较复杂,因此,一般不讨论多元弱碱的一级电离常数、二级电离常数等。
3 影响因素影响因素————⎧⎨⎩内因(决定因素)弱电解质本身的性质外因温度(随温度升高而增大)同化学平衡常数一样,对于同一弱电解质的稀溶液来说,电离常数只与温度有关,而不受粒子浓度的影响。
由于电解质的电离过程吸热,故电离常数随着温度的升高而增大。
4 意义教材P59·实验3-2 CH3COOH的K a和H2CO3的K a1的大小比较如图3-1-4所示,向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液实验操作图3-1-4实验现象有气泡产生反应生成了CO2,化学方程式为2CH3COOH+Na2CO3===2CH3COONa+H2O+解释CO2↑实验结论CH3COOH的酸性比H2CO3的强,K a(CH3COOH)>K a1(H2CO3)总结:(1)相同温度下,等浓度的弱酸(或弱碱)的电离常数[对于多元弱酸(或弱碱)来说,通常只考虑第一步电离的电离常数]越大,其酸性(或碱性)越强;同样,相同温度下,弱酸(或弱碱)的酸性(或碱性)越强,其电离常数或第一步电离的电离常数越大。
常见弱电解质电离平衡常数表1
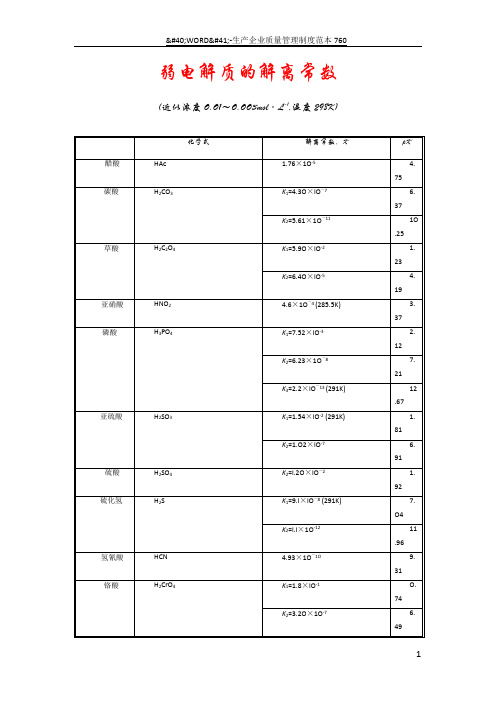
弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)化学式解离常数,K p K醋酸HAc 1.76×1O-5 4.75碳酸H2CO3K1=4.3O×lO-7 6.37K2=5.61×1O-111O.25草酸H2C2O4K1=5.9O×lO-2 1.23K2=6.4O×lO-5 4.19亚硝酸HNO2 4.6×1O-4 (285.5K) 3.37磷酸H3PO4K1=7.52×lO-3 2.12K2=6.23×1O-87.21K3=2.2×lO-13 (291K) 12.67亚硫酸H2SO3 K1=1.54×lO-2 (291K) 1.81K2=1.O2×lO-7 6.91硫酸H2SO4K2=l.2O×lO-2 1.92硫化氢H2S K1=9.l×lO-8 (291K) 7.O4K2=l.l×1O-1211.96氢氰酸HCN 4.93×1O-1O9.31铬酸H2CrO4K1=1.8×lO-1O.74K2=3.2O×1O-7 6.49*硼酸H3BO3 5.8×1O-1O9.24氢氟酸HF 3.53×1O-4 3.45过氧化氢H2O2 2.4×1O-1211.62次氯酸HClO 2.95×1O-5 (291K) 4.53次溴酸HBrO 2.O6×1O-98.69次碘酸HIO 2.3×1O-111O.64碘酸HIO3 1.69×1O-1O.77砷酸H3AsO4 K1=5.62×lO-3 (291K) 2.25K2=l.7O×lO-7 6.77K3=3.95×1O-1211.4O亚砷酸HAsO26×1O-1O9.22铵离子NH4+ 5.56×1O-1O9.25氨水NH3·H2O 1.79×1O-5 4.75联胺N2H48.91×1O-7 6.O5羟氨NH2OH9.12×1O-98.O4氢氧化铅Pb(OH)29.6×1O-4 3.O2氢氧化锂LiOH 6.31×1O-1O.2氢氧化铍Be(OH)2 1.78×1O-6 5.75 BeOH+ 2.51×1O-98.6氢氧化铝A1(OH)3 5.O1×1O-98.3 Al(OH)2+ 1.99×1O-1O9.氢氧化锌Zn(OH)27.94×1O-7 6.1氢氧化镉Cd(OH)2 5.O1×1O-111O.3*乙二胺H2NC2H4NH2K1=8.5×lO-5 4.O7K2=7.l×lO-87.15*六亚甲基四胺(CH2)6N4 1.35×1O-98.87*尿素CO(NH2)2 1.3×1O-1413.89*质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.15甲酸HCOOH 1.77×1O-4 (293K) 3.75氯乙酸ClCH2COOH 1.4O×1O-3 2.85氨基乙酸NH2CH2COOH 1.67×1O-1O9.78*邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.95K2=3.91×1O-6 5.41柠檬酸(HOOCCH2)2C(OH)COOH K1=7.l×1O-4 3.14K2=1.68×1O-5 (293K) 4.77K3=4.1×1O-7 6.39-酒石酸(CH(OH)COOH)2K1=1.O4×1O-3 2.98K2=4.55×1O-5 4.34*8-羟基喹啉C9H6NOH K1=8×lO-6 5.1K2=1×1O-99.O苯酚C6H5OH 1.28×1O-1O (293K)9.青年人首先要树雄心,立大志,其次就要决心作一个有用的人才。
常见弱电解质电离平衡常数表
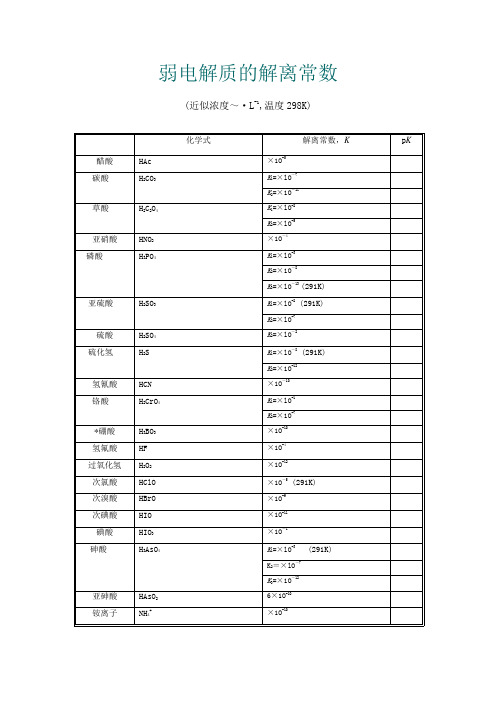
弱电解质的解离常数(近似浓度~·L-1,温度298K)名称化学式解离常数,K p K 醋酸HAc×1O-5碳酸H2CO3K1=×lO-7K2=×1O-11草酸H2C2O4K1=×lO-2K2=×lO-5亚硝酸HNO2×1O-4磷酸H3PO4K1=×lO-3K2=×1O-8K3=×lO-13 (291K)亚硫酸H2SO3 K1=×lO-2 (291K)K2=×lO-7硫酸H2SO4K2=×lO-2硫化氢H2S K1=×lO-8 (291K)K2=×1O-12氢氰酸HCN×1O-1O铬酸H2CrO4K1=×lO-1K2=×1O-7*硼酸H3BO3×1O-1O氢氟酸HF×1O-4过氧化氢H2O2×1O-12次氯酸HClO×1O-5 (291K)次溴酸HBrO×1O-9次碘酸HIO×1O-11碘酸HIO3×1O-1砷酸H3AsO4 K1=×lO-3 (291K)K2=×lO-7K3=×1O-12亚砷酸HAsO26×1O-1O铵离子NH4+×1O-1O氨水NH3·H2O×1O-5联胺N2H4×1O-7羟氨NH2OH×1O-9氢氧化铅Pb(OH)2×1O-4氢氧化锂LiOH×1O-1氢氧化铍Be(OH)2×1O-6BeOH+×1O-9氢氧化铝A1(OH)3×1O-9Al(OH)2+×1O-1O氢氧化锌Zn(OH)2×1O-7氢氧化镉Cd(OH)2×1O-11*乙二胺H2NC2H4NH2K1=×lO-5K2=×lO-8*六亚甲基四胺(CH2)6N4×1O-9 *尿素CO(NH2)2×1O-14*质子化六亚甲基四胺(CH2)6N4H+×1O-6甲酸HCOOH ×1O-4 (293K)氯乙酸ClCH2COOH×1O-3氨基乙酸NH2CH2COOH×1O-1O*邻苯二甲酸C6H4(COOH)2K1=×1O-3K2=×1O-6柠檬酸(HOOCCH2)2C(OH)COOH K1=×1O-4K2=×1O-5 (293K)K3=×1O-7-酒石酸(CH(OH)COOH)2K1=×1O-3K2=×1O-5*8-羟基喹啉C9H6NOH K1=8×lO-6K2=1×1O-9苯酚C6H5OH ×1O-1O (293K)*对氨基苯磺酸H2NC6H4SO3H K l=×lO-lK2=×1O-4*乙二胺四乙酸(EDTA) (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=×1O-7K6=×1O-11。
电离平衡常数

B.盐酸<醋酸
C.一样多
D.无法确定
此时C(醋酸)远大于C(HCl),最终产生H+多 与盐酸
结论:等体积等H+浓度的一元强酸与一元弱酸中和碱的能力: 弱酸>强酸
补充知识:
一.等体积等浓度的一元强酸与一元弱酸对比(以HCl和CH3COOH为例)
1.C(H+)大小: HCl>CH3COOH 2.酸性强弱: HCl>CH3COOH 3.中和碱的能力:(相同)
4.与同一金属反应的起始速率: 相同
5.与足量金属反应产生H2的总量: CH3COOH>HCl
思考: 将等体积,H+浓度均为1mol/L的盐酸和醋酸加水稀释100倍 之后, 它们的H+浓度还相等吗?若不想等,谁的H+浓度更大?
不相等 CH3COOH>HCl CH3COOH是弱电解质,加水会继续电离产生H+
若H+浓度相同,则酸性相同
1L 1mol/LHCl溶液与 1L 1mol/LCH3COOH溶液与足量等浓度的
NaOH溶液发生酸碱中和反应,消耗的NaOH体积 ( C )
A.盐酸>醋酸
B.盐酸<醋酸
C.一样多
D.无法确定
中和反应的本质是H++OH-=H2O
即H+与OH-的物质的量1:1反应试写出化学方程式分析:
醋酸
C C 思考(H:Cl此)时盐<酸的(浓C度H3与CO醋OH酸)的浓度谁大谁小?
原因:醋酸是弱电解质电离很微弱,若醋酸要和盐酸H+浓度相等, 则醋酸浓度必然大于盐酸
等体积 等H+浓度的HCl溶液与CH3COOH溶液与足量等浓度的 NaOH溶液发生酸碱中和反应,消耗的NaOH体积 ( B )
电离平衡常数

H++A-,平衡时
M++OH-,平衡时
c ( M+).c( OH- )
例:CH3COOH
CH3COO- + H+
c(CH 3COO ) c(H ) K c(CH 3COOH)
练习: 写出 HF NH3· H2O Fe(OH)3 的电 离平衡常数的表达式
多元弱酸的电离: H 2S HS-
c(HS ) c(H ) - + HS + H K 1 1.3 107 c(H 2S)
S2-
+
H+
c(S ) c(H ) 15 K2 7.1 10 - c(HS )
2
K1 》K2 ,因此一般只考虑第一步。
(2)电离平衡常数意义:
在相同条件下,K值越大,弱电解质的电离 程度越大,相应酸 (或碱)的酸(或碱)性越强。 (3)影响电离平衡常数大小的因素: A.电离平衡常数大小是由物质的本性决定 的,在同一温度下,不同弱电解质的电离常数 不同。 B.与化学平衡常数一样,同一弱电解质的 电离平衡常数只受温度影响,不受浓度影响。
弱电解质分子总数
(2)电离度的意义: 在同温同浓度的条件下,电离度越大, 弱电解质电离能力相对较强。 (3)影响电离度大小的因素: 内因:与弱电解质的本性有关 外因: ①温度越高,弱电解质的电离度越大; ②浓度越稀,弱电解质的电离度越大; ③加入影响电离的其他物质。 (同离子效应、离子反应效应)
填空: (1)K只于温度有关,当温度升高时,K 值 增大 。 (2)在温度相同时,各弱酸的K值不同,K 值越大酸的酸性越强 。 (3)多元弱酸是分步电离的,每一步都有相 应的电离平衡常数,对于同一种多元弱 酸的K1、K2 、K3之间存在着数量上的规律 是: K1》K2 》K3 。
常见弱电解质电离平衡常数表

×10-5(291K)
次溴酸
HBrO
×10-9
次碘酸
HIO
×10-11
碘酸
HIO3
×10-1
砷酸
H3AsO4
K1=×l0-3(291K)
K2=×l0-7
K3=×10-12
亚砷酸
HAsO2
6×10-10
铵离子
NH4+
×10-10
氨水
NH3·H2O
ቤተ መጻሕፍቲ ባይዱ×10-5
联胺
N2H4
×10-7
羟氨
NH2OH
×10-9
K1=×10-4
K2=×10-5(293K)
K3=×10-7
-酒石酸
(CH(OH)COOH)2
K1=×10-3
K2=×10-5
*8-羟基喹啉
C9H6NOH
K1=8×l0-6
K2=1×10-9
苯酚
C6H5OH
×10-10(293K)
*对氨基苯磺酸
H2NC6H4SO3H
Kl=×l0-l
K2=×10-4
*乙二胺四乙酸(EDTA)
常见弱电解质电离平衡常数表
弱电解质的解离常数
(近似浓度~·L-1,温度298K)
化学式
解离常数,K
pK
醋酸
HAc
×10-5
碳酸
H2CO3
K1=×l0-7
K2=×10-11
草酸
H2C2O4
K1=×l0-2
K2=×l0-5
亚硝酸
HNO2
×10-4
磷酸
H3PO4
K1=×l0-3
K2=×10-8
K3=×l0-13(291K)
【知识解析】弱电解质的电离平衡
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
弱电解质的解离常数(近似浓度O.O1~O.OO3mol·L-1,温度298K)
化学式解离常数,K p K
醋酸HAc 1.76×1O-5 4.
75
碳酸H2CO3K1=4.3O×lO-7 6.
37
K2=5.61×1O-111O
.25
草酸H2C2O4K1=5.9O×lO-2 1.
23
K2=6.4O×lO-5 4.
19
亚硝酸HNO2 4.6×1O-4 (285.5K) 3.
37
磷酸H3PO4K1=7.52×lO-3 2.
12
K2=6.23×1O-87.
21
K3=2.2×lO-13 (291K) 12
.67
亚硫酸H2SO3 K1=1.54×lO-2 (291K) 1.
81
K2=1.O2×lO-7 6.
91
硫酸H2SO4K2=l.2O×lO-2 1.
92
硫化氢H2S K1=9.l×lO-8 (291K) 7.
O4
K2=l.l×1O-1211
.96
氢氰酸HCN 4.93×1O-1O9.
31
铬酸H2CrO4K1=1.8×lO-1O.
74
K2=3.2O×1O-7 6.
49
*硼酸H3BO3 5.8×1O-1O9.
24
氢氟酸HF 3.53×1O-4 3.
45
过氧化氢H2O2 2.4×1O-1211
.62
次氯酸HClO 2.95×1O-5 (291K) 4.
53
次溴酸HBrO 2.O6×1O-98.
69
次碘酸HIO 2.3×1O-111O
.64碘酸HIO3 1.69×1O-1O.
77
砷酸H3AsO4 K1=5.62×lO-3 (291K) 2.
25
K2=l.7O×lO-7 6.
77
K3=3.95×1O-1211
.4O
亚砷酸HAsO26×1O-1O9.
22
铵离子NH4+ 5.56×1O-1O9.
25氨水NH3·H2O 1.79×1O-5 4.
75联胺N2H48.91×1O-7 6.
O5羟氨NH2OH9.12×1O-98.
O4
氢氧化铅Pb(OH)29.6×1O-4 3.
O2
氢氧化锂LiOH 6.31×1O-1O.
2
氢氧化铍Be(OH)2 1.78×1O-6 5.
75 BeOH+ 2.51×1O-98.
6
氢氧化铝A1(OH)3 5.O1×1O-98.
3 Al(OH)2+ 1.99×1O-1O9.
7
氢氧化锌Zn(OH)27.94×1O-7 6.
1
氢氧化镉Cd(OH)2 5.O1×1O-111O
.3
*乙二胺H2NC2H4NH2K1=8.5×lO-5 4.
O7
K2=7.l×lO-87.
15
*六亚甲基四胺(CH2)6N4 1.35×1O-98.
87
*尿素CO(NH2)2 1.3×1O-1413
.89
*质子化六亚甲基四胺(CH2)6N4H+7.1×1O-6 5.
15
甲酸HCOOH 1.77×1O-4 (293K) 3.
75
氯乙酸ClCH2COOH 1.4O×1O-3 2.
85
氨基乙酸NH2CH2COOH 1.67×1O-1O9.
78
*邻苯二甲酸C6H4(COOH)2K1=1.12×1O-3 2.
95
K2=3.91×1O-6 5.
41
柠檬酸(HOOCCH2)2C(OH)COOH K1=7.l×1O-4 3.
14
K2=1.68×1O-5 (293K) 4.
77
K3=4.1×1O-7 6.
39
-酒石酸(CH(OH)COOH)2K1=1.O4×1O-3 2.
98
K2=4.55×1O-5 4.
34
*8-羟基喹啉C9H6NOH K1=8×lO-6 5.
1
K2=1×1O-99.
O
苯酚C6H5OH 1.28×1O-1O (293K)9.
89
精品文档word文档可以编辑!谢谢下载!。
