进口饲料中牛、羊源成分的PCR同时检测方法
食品中动物源成分牛肉成分PCR鉴别实验标准操作程序

食品中动物源成分牛肉成分PCR鉴别实验标准操作程序1 目的:保证食品中动物源成分牛肉成分PCR检测结果准确、可靠。
2 适应范围:食品中动物源牛肉成分PCR定性,样本类型生、熟肉制品。
3 试剂、耗材来源:商品试剂盒,PCR专用耗材;质控物:ddHO做空白,阴性、阳性对照来源于试剂盒。
24 仪器:BIO-RAD T-100 PCR仪;BIO-RAD电泳装置;BIO-RAD凝胶分析成像系统;生物安全柜;高速离心机(≤16,000g);微量移液枪(0.5-10μL、10-20μL、20-200μL、1000μL);5 标准操作:5.1样本的处理:取样应尽量采取肌肉组织。
对于同一批样品,应多点采集合并后,作为一份样品进行均质,提取DNA。
采样过程应快速完成,将采取的样品迅速放入组织捣碎机中进行均质成糜状,充分混匀。
取适量充分混匀的样品,放入研钵中,液氮研磨。
研磨时应间断加入液氮以防止材料融化5.2试剂配制0.5xTBE:取10ML50x的TBE加灭菌超纯水稀释至1000ML,摇匀备用。
DNA提取、PCR反应体系、上样缓冲液等试剂均为商品试剂5.3、DNA提取DNA提取试剂盒操作标准说明a.取20-50㎎动物组织,液氮研磨成细分,转入有180μL组织裂解液的1.5ml离心管。
大口径枪头吹打混匀。
b.加入20μ蛋白酶K(20㎎/ml)立即漩涡混匀,c.55℃水浴3小时或至组织完全消化,期间轻柔振荡几次帮助裂解。
加入20μL RNase A(25㎎/ml)溶液去除RNA。
d.用一个1ml不带针头的一次性注射器抽打裂解物2-3次。
e.加入200μL结合液CB和100μL异丙醇,立即漩涡混匀。
f.13,000rpm离心5分钟,将上清转入吸附柱AC中,13,000rpm离心30秒,倒掉收集管中的废液。
g.加入500μL抑制物去除液IR,12,000rpm离心30秒,弃废液。
h.加入700μL漂洗液WB,12,000rpm离心30秒,弃废液。
利用荧光定量PCR进行饲料中牛羊源性成分检测的快速筛选

利用荧光定量PCR进行饲料中牛羊源性成分检测的快速筛选姜艳彬;王海;李颖;侯东军;杨红菊;金秀娥;于雷
【期刊名称】《中国畜牧兽医》
【年(卷),期】2010(0)6
【摘要】通过荧光定量PCR进行饲料中牛羊源性成分的快速筛选研究,其可以快速的检测饲料中是否含有牛羊源性成分,避免了常规检测中大量阴性样品造成的巨大工作量,并首次对饲料中牛羊源性成分进行定量分析,推导出定量计算公式,且灵敏度比常规的PCR检测方法高100倍以上.
【总页数】4页(P36-39)
【作者】姜艳彬;王海;李颖;侯东军;杨红菊;金秀娥;于雷
【作者单位】中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;湖北兽药监察所,武汉,430064;中国动物疫病预防控制中心,北京,100125
【正文语种】中文
【中图分类】S813.3
【相关文献】
1.饲料中牛羊源成分的快速筛选 [J], 杨红菊;姜艳彬;王海;李颖;侯东军;于雷
2.饲料中牛羊源性成分的定性检测——定性聚合酶链式反应法(PCR)法 [J], 王小林;薛静
3.反刍动物饲料中牛羊源性成分检测污染控制及应对措施 [J], 宫玲玲;李俊玲;李会荣;张芸;强莉;张玮
4.荧光定量PCR法的优化及其在牛羊源性成分检测中的应用研究 [J], 于雷;姜艳彬;王海;李颖;侯东军;杨红菊
5.用分子生物学方法鉴别检测动物源性饲料中的牛羊源性成分 [J], 杨宝华;宗卉;林庆燕;俞火
因版权原因,仅展示原文概要,查看原文内容请购买。
畜禽肉及肉制品中牛羊猪鸡鸭源性成分定性PCR检测方法湖北标准2020版

畜禽肉及肉制品中牛羊猪鸡鸭源性成分定性PCR检测方法湖北标准2020版FORMTEXT FORMTEXT DB42/T 1591 — FORMTEXT 20201畜禽肉及肉制品中牛羊猪鸡鸭源性成分定性PCR 检测方法1范围本文件规定了牛(普通牛、瘤牛、牦牛和水牛)、羊(绵羊和山羊)、猪(家猪和野猪)、鸡、鸭源性成分的定性PCR检测方法。
本文件适用于牛(普通牛、瘤牛、牦牛和水牛)、羊(绵羊和山羊)、猪(家猪和野猪)、鸡、鸭的肉及肉制品中源性成分的定性PCR检测。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682分析实验室用水规格和试验方法GB/T 19495.2转基因产品检测实验室技术要求GB/T 27403-2008实验室质量控制规范食品分子生物学检测3术语和定义本文件没有需要界定的术语和定义。
4原理根据牛、羊、猪、鸡和鸭的物种特异性序列,设计特异性引物,对待检样品提取的DNA进行PCR扩增,依据扩增特异性片段的结果,判断待检样品中是否含有牛、羊、猪、鸡和鸭源性成分。
5试剂和材料5.1除另有规定外,试剂为分析纯或生化试剂。
实验用水符合GB/T 6682的要求。
5.2琼脂糖。
5.3GelRed 核酸染料。
注:根据需要可选择其他效果相当的核酸染料作为核酸电泳的染色剂。
5.410mol/L 氢氧化钠溶液:在160mL 水中加入80.0g 氢氧化钠(NaOH),溶解后,冷却至室温,再加水定容至200mL。
5.50.5mol/L 乙二铵四乙酸二钠溶液(pH 8.0):称取18.6g 乙二铵四乙酸二钠(EDTA-Na 2),加入70mL 水中,再加入适量氢氧化钠溶液(5.4),加热至完全溶解后,冷却至室温,用氢氧化钠溶液(5.4)调pH 至8.0,加水定容至100mL。
浅析饲料中牛、羊源性成分的检测技术

制品以及牛脑、 脊髓、 扁桃 体、 小肠等就会感染致命 检 测是 防止疯 牛病 传人 我 国的 一个 重 要 措施 , 行 进
的新 变异型克 雅 氏病 。
饲料 中牛羊源性成分检测 , 对于保障国内饲料安全
我 国把疯 牛 病列 为 一 类动 物 疫病 。根据 《 中华 以及 加强 饲料 的进 出 口监 督 管理 , 而 保 障人 民的 从
人 民共 和 国动 物防疫 法 》 中华人 民共 和 国进 出境 生命 健康具 有重要 意义 。 和《
动植物 检疫法 》 以及 《 饲料 和 饲料 添 加 剂 管理 条 例 》 等有关法 律法规 的规定 , 格 禁 止从 发 生 疯 牛病 的 严 国家进 口牛及 其 产 品 。为 了 防 止 该 病 的 传 人 和 发
致疯牛病和羊痒病的传播 , 是引起疯牛病发 生 的最初原 因。目前 , 用于 检测饲料 中牛 、 羊源 性成分 的主要方 法
有: 以检测骨头为基础的显微镜方法 ; 以检测蛋 白质为基础 的免疫学方法 和以检测 D NA为基础 的检测方法 ; 其 它方法还包括近红外光谱法等 。 关键词 疯 牛病 ; 、 牛 羊源性成分 ; 检测方法
1 牛 、 源性 成 分 检 测 方 法 羊
目前 , 于检测 饲料 中牛 、 用 羊源性 成分 的主要方
生 , 业部采 取 了一 系 列 有效 措 施 。农 业部 多 次 在 法 有 : 农 以检测 骨头 为基础 的显微 镜方法 ; 以检 测蛋 白 “ 饲料 质量安 全监 测工作 会议” 上对 牛羊养殖 和反 刍 质 为基础 的免 疫学方 法 和 以检测 D NA 为基 础 的检 动物 饲料生产 比较 集 中的地 区 , 点 开展 反 刍 动 物 测 方法 ; 重 其它方 法还 包括 近红外光 谱法 等 。
羊乳中动物源性成分的实时荧光PCR检测
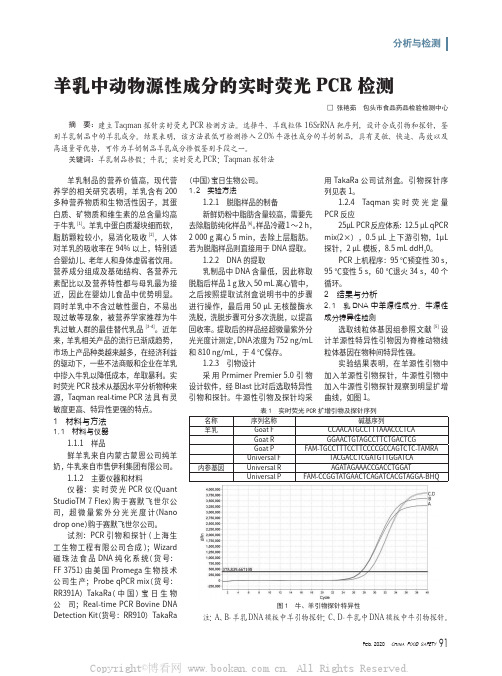
分析与检测羊乳制品的营养价值高,现代营养学的相关研究表明,羊乳含有200多种营养物质和生物活性因子,其蛋白质、矿物质和维生素的总含量均高于牛乳[1]。
羊乳中蛋白质凝块细而软,脂肪颗粒较小,易消化吸收[2],人体对羊乳的吸收率在94%以上,特别适合婴幼儿、老年人和身体虚弱者饮用。
营养成分组成及基础结构、各营养元素配比以及营养特性都与母乳最为接近,因此在婴幼儿食品中优势明显。
同时羊乳中不含过敏性蛋白,不易出现过敏等现象,被营养学家推荐为牛乳过敏人群的最佳替代乳品[3-4]。
近年来,羊乳相关产品的流行已渐成趋势,市场上产品种类越来越多,在经济利益的驱动下,一些不法商贩和企业在羊乳中掺入牛乳以降低成本,牟取暴利。
实时荧光PCR技术从基因水平分析物种来源,Taqman real-time PCR法具有灵敏度更高、特异性更强的特点。
1 材料与方法1.1 材料与仪器1.1.1 样品鲜羊乳来自内蒙古蒙恩公司纯羊奶,牛乳来自市售伊利集团有限公司。
1.1.2 主要仪器和材料仪器:实时荧光PCR仪(Quant StudioTM 7 Flex)购于赛默飞世尔公司,超微量紫外分光光度计(Nano drop one)购于赛默飞世尔公司。
试剂:PCR引物和探针(上海生工生物工程有限公司合成);Wizard 磁珠法食品DNA纯化系统(货号:FF 3751)由美国Promega生物技术公司生产;Probe qPCR mix(货号:RR391A)TakaRa(中国)宝日生物公司;Real-time PCR Bovine DNA Detection Kit(货号:RR910)TakaRa (中国)宝日生物公司。
1.2 实验方法1.2.1 脱脂样品的制备新鲜奶粉中脂肪含量较高,需要先去除脂肪纯化样品[6]。
样品冷藏1~2 h,2 000 g离心5 min,去除上层脂肪。
若为脱脂样品则直接用于DNA提取。
1.2.2 DNA的提取乳制品中DNA含量低,因此称取脱脂后样品1 g放入50 mL离心管中,之后按照提取试剂盒说明书中的步骤进行操作,最后用50 μL无核酸酶水洗脱,洗脱步骤可分多次洗脱,以提高回收率。
肉及肉制品中猪、牛、羊、马、驴、鸡、鸭、鹅、兔源性成分的快速鉴定 实时PCR法 编制说明

肉及肉制品中猪、牛、羊、马、驴、鸡、鸭、鹅、兔源性成分的快速鉴定实时PCR法编制说明一、任务来源本标准由中华人民共和国商务部提出并归口,由商务部流通产业促进中心实验室生物检测室研究小组完成方法的建立优化、标准的起草制定工作。
二、编制依据本标准遵循GB/T1.1-2009《标准化工作导则第1部分:标准的结构和编写》、GB/T20001.4-2001《标准编写规则第4部分:化学分析方法》的编写规则、GB/T6379《测量方法与结果的准确度(正确度与精密度》第2部分:确定标准测量方法重复性与再现性的方法》。
三、目的和意义随着市场经济的不断深入发展,部分不法商贩为了谋求不正当利益,在肉(制)品中掺杂其他价格便宜的肉种,在肉(制)品市场出现了一种“以次充好、以假乱真”的现象。
通过实验室前期大量的调查研究分析,我们发现肉(制)品中掺杂、掺假的现象已经十分普遍,大部分肉(制)品中掺有标称以外的其他价格便宜的动物源性成分,有的甚至全部为标称以外的其他价格便宜的动物源性成分。
这极大地损害了消费者的利益,扰乱了流通市场秩序和健康发展,同时也对民族宗教信仰造成一定的潜在冲突。
但目前,相应的检测鉴定方法标准的缺失,使得检测监测机构对此无标可依,无法可循,难于判断和裁决。
为了规范国内市场流通秩序,保证市场的正当竞争,保护消费者的经济利益和对所购买商品的选择权、知情权及宗教信仰归属,制定本检测标准。
四、编制过程《肉及肉制品中猪、牛、羊、马、驴、鸡、鸭、鹅、兔源性成分的快速鉴定实时PCR法》该方法标准由商务部流通产业促进中心起草编写。
经过中国科学院微生物研究所、中国农业科学院饲料研究所、中国农业大学食品科学与营养工程学院三家单位进行了方法的复核验证实验,并提交了具体的复核验证报告。
根据国家有关标准制定和修订工作的要求,商务部流通产业促进中心在《肉及肉制品中猪、牛、羊、马、驴、鸡、鸭、鹅、兔源性成分的快速鉴定实时PCR法》的起草编制过程中,主要工作包括以下几个方面:1、详细查阅了国内、国外有关标准和相关专业期刊上发表过的参考文献等技术资料,如食品、化妆品和饲料中牛、羊、猪源性成分检测方法及动物源性饲料中哺乳动物源性成分定性检测方法等国内已申请的相关检验报告,并对这些资料进行了详细的对比,从方法的先进性、可靠性和实用性等几个方面考虑,选取了几个代表性的参考资料作为标准起草中的主要技术参考文本。
DNA为基础的方法检测饲料中的动物源性成分

DNA为基础的方法检测饲料中的动物源性成分点击次数:39 发布时间:2011-2-16以检测DNA为基础的方法主要有核酸探针杂交、DNA指纹分析、PCR-RFLP分析、PCR特异扩增(常规PCR方法和Real-time PCR方法)。
其主要原理都是对各物种内特异的核酸序列进行提取、鉴定,从而判定饲料内有无该物种的成分,只是结果判别的信号条件不同。
核酸探针杂交方法的原理是碱基配对,即一条DNA链能与它的特异互补链配对形成双链DNA。
因此,用一个荧光物质或放射性物质标记的单链核苷酸探针能够很快地从许多其他DNA分子的混合物中检测出它的互补单链。
由于杂交探针需要用荧光物质或放射性物质进行标记,所以该法在实际检测中很少应用。
动物基因组中存在大量的分散重复序列(interspersedrepeat sequence,IRS),并且是种间高度特异的,DNA指纹分析就是通过用哺乳动物中广泛存在的分散重复序列的特异引物进行PCR扩增,建立从牛到鸵鸟的30多种哺乳动物的DNA指纹图谱,来对饲料中的动物源性成分的DNA进行鉴定。
由于DNA指纹有一定难度,所以该法在实际检测中也较少应用。
PCRRFLP(限制性内切酶多态性分析)方法是用引物进行扩增,然后对扩增片段用限制性内切进行酶切,利用限制性内切酶的多态性进行检测。
由于使用的限制性内切酶对PCR产物进行限制性内切酶切分析不方便,所以该法在实际检测中应用较少。
PCR特异扩增方法由于其简单、快速、特异性强成为目前最广泛应用的方法,特别是荧光PCR(或称为Real-timePCR)的应用使得检测的特异性和敏感性更高。
Tartaglia第一次设计了PCR试验,将其用于肉骨粉以及饲料中的反刍动物源性成分的检测。
他所选的目标片断是线粒体DNA中编码tRNAlys和ATP合成酶8亚基和6亚基的片段,高等植物中未发现其同源序列,采用异硫氰酸胍和二氧化硅方法提取DNA,肉骨粉的检出的含量的最低限为0.125%,我国的出入境检验检疫系统根据该方法制定了检测肉骨粉中牛源性、羊源性成分的行业标准。
利用荧光定量PCR进行饲料中牛羊源性成分检测的快速筛选

利用荧光定量PCR进行饲料中牛羊源性成分检测的快速筛选姜艳彬;王海;李颖;侯东军;杨红菊;金秀娥;于雷【摘要】通过荧光定量PCR进行饲料中牛羊源性成分的快速筛选研究,其可以快速的检测饲料中是否含有牛羊源性成分,避免了常规检测中大量阴性样品造成的巨大工作量,并首次对饲料中牛羊源性成分进行定量分析,推导出定量计算公式,且灵敏度比常规的PCR检测方法高100倍以上.【期刊名称】《中国畜牧兽医》【年(卷),期】2010(037)006【总页数】4页(P36-39)【关键词】牛羊源成分;饲料;荧光定量PCR;快速筛选【作者】姜艳彬;王海;李颖;侯东军;杨红菊;金秀娥;于雷【作者单位】中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;中国动物疫病预防控制中心,北京,100125;湖北兽药监察所,武汉,430064;中国动物疫病预防控制中心,北京,100125【正文语种】中文【中图分类】S813.3疯牛病又称为牛海绵状脑病(bovine spongiform encephalopathy,BSE),是牛的一种神经性、渐进性、致死性疾病,最早在1985年英国的阿什福特农场发现可疑病例(张春扬等,2001)。
疯牛病的主要传播途径是饲喂被羊痒病阮病毒(p rion)污染的肉骨粉,世界上至今没有有效治疗疯牛病的方法,目前防范的唯一措施是切断传播途径。
为了防止疯牛病的蔓延,各国政府纷纷出台相关法规禁止牛羊源性饲料的使用(汤文利等,2007)。
目前,饲料中牛羊源性成分的检测方法主要有显微镜法、近红外光镜法、酶联免疫吸附反应(ELISA)和聚合酶链式反应(PCR)方法。
PCR是一种体外模拟自然DNA复制过程的核酸扩增技术,即无细胞扩增技术,它能把微量的遗传物质迅速而简便的扩增百万倍,被广泛应用于饲料中动物源性成分的检测中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*基金项目:宁波局重大科技项目(No.K01-2002)。闻伟刚:男,1975生,博士。E-mail:.收稿日期:2003-04-28接受日期:2003-06-09
农业生物技术学报JournalofAgriculturalBiotechnology2004,12(2):167~169·研究论文·
进口饲料中牛、羊源成分的PCR同时检测方法*闻伟刚赵秀玲贺水山杜华宏黄绍棠(宁波出入境检验检疫局,宁波315012)
摘要:为防止疯牛病和痒病的传入,研究提供了一种利用Chelex-100快速提取动物基因组DNA的方法,并依据牛、羊线粒体基因的同源性序列片段,设计1对通用引物,通过PCR扩增,实现了对进境饲料中牛、羊源成分的同时检测。该方法简单、快捷,在口岸检疫部门中有一定的推广价值。关键词:Chelex-100;PCR;通用引物;牛、羊源成分;同时检测
SimultaneousDetectionofBovineandSheepDerivedMaterialsfromImportedFeedstuffbyPCR
WENWei-GangZHAOXiu-LingHEShui-ShanDUHua-HongHUANGShao-Tang(NingboEntry-exitInspectionandQuarantineBureau,Ningbo315012,China)
Inordertocontrolthespreadofbovinespongiformencephalopathyandscrapie,amethodhasbeendevelopedforsimultaneousdetectionofthebovineandsheepderivedmaterialsfromimportedfeedstuff,inwhichChelex-100asmatrixforfastextractfionofanimalgenomicDNAwasadoptedandapairofcommonprimersdesignedonthehomologicalsequenceofbovineandsheepmitochondrialDNAwereusedforPCR.Thismethodisofgreatvaluetoquarantinedepartmentforitssimpleandrapiddetection.Chelex-100;PCR;commonprimers;bovineandsheepderivedmaterials;simultaneousdetection
由于疯牛病和痒病的朊病毒能够通过肉骨粉等动物源性饲料传播[1],因此,对进口饲料中牛、羊源成分的检测是防止疯牛病和痒病传入我国的一个重要措施。目前,国内外对饲料中牛、羊源成分的检测方法主要有显微镜观察法、ELISA方法和PCR方法[2]。Tartaglia等[3]对牛源成分检测以及Herman[2]对羊源成分检测分别做了研究;国内检验检疫系统在参照Tartaglia方法的基础上制订了饲料中牛、羊源成分PCR检测的行业标准[4]。本研究在依据该标准进行日常检测的基础上,对该标准方法作了全新的改进,使之更具有简单和快捷,供检测工作者参考和应用。1材料和方法1.1材料牛(黄牛、水牛、奶牛)和羊(绵羊、山羊)的肉骨头由宁波市农业局提供,猪、狗、鸡等动物的肉骨头均购自宁波当地的超市,经120℃高温烘烤5h,在研钵中磨成细粉。鱼粉为日常检测的进口样品,来自美国、智利、俄罗斯和日本等国。牛、羊肉骨粉分别按重量百分比与鱼粉混合成1%、0.1%和0.01%的样品,用于灵敏度测试。PCR引物由上海生工合成。Chelex-100由宁波市公安局刑事科学技术研究所惠赠。DNA聚合酶和dNTP等试剂购自上海博亚生物技术公司。1.2牛、羊成分的PCR同时检测1.2.1基因组DNA提取取磨碎的肉骨粉30mg,加入200滋LChelex-100(5%),同时加入蛋白酶K至终浓度为0.5mg/mL,于56益水浴30min,然后100益水浴8min,12000r/min离心5min,此时上清液即可作为PCR模板。1.2.2PCR扩增牛、羊通用引物序列为:
PDF 文件使用 "pdfFactory Pro" 试用版本创建 www.fineprint.cn农业生物技术学报2004年BS1:5忆-ATGCGGTTATATAAGATTGCT-3忆;BS2:5忆-GATCTATTATAGAATTCTCAATATGATA-3忆。其预扩增产物大小为233bp。PCR反应体系包括:4滋L模板,引物BS1(10mmol/L)与BS2(10mmol/L)各1滋L,dNTP(10mmol/L)1滋L,10伊
PCRbuffer(Mg2+plus)5滋L,DNA聚合酶(5U/滋蕴)0.4滋L,重蒸水37.6滋L,总体积为50滋L。PCR反应条件如下:95益预变性3min;95益变性30s,56益复性30s,72益延伸45s,35个循环;最后72益延伸5min。同时,设立阳性对照和空白对照,阳性对照为牛特异性引物和羊特异性引物分别扩增牛和羊的产物[4]。1.3PCR结果分析1.3.1PCR产物电泳检测PCR反应结束后,取20滋L扩增产物进行1.2%琼脂糖凝胶电泳,在SX-300凝胶成像系统上观察并记录结果。1.3.2PCR产物的酶切验证PCR产物可以直接选用限制性内切酶Ⅰ进行酶切分析,该酶可将羊的PCR扩增产物酶切为168bp和65bp2个片段,而不能酶切牛的PCR产物。也可以通过简单纯化获得更好的图谱效果。纯化方法如下:100μLPCR产物经氯仿抽提1次,取上清液,加入2倍体积的无水乙醇,原20℃沉淀过夜;12000r/min离心10min,70%乙醇洗1遍,沉淀最后溶于20μL重蒸水中。酶切反应体系包括:10μLPCR产物,2μL内切酶(5U/μL),2μL酶切缓冲液,6μL重蒸水,总反应体积为20滋L。37℃温育4h以上,1.5%琼脂糖凝胶电泳检测酶切结果。1.3.3PCR产物的测序PCR产物纯化后,其核苷酸序列由上海博亚生物技术有限公司进行单向测定,序列分析采用BioEdit软件,同源性比较在GenBank(http://www.ncbi.nlm.nih.gov)中通过Blast程序进行。2结果和分析2.1引物设计选择牛Y染色体基因上的保守区域作为PCR检测的目标序列[5,6]。通过网上检索,获得牛线粒体基因部分核甘酸序列,并应用Blast程序比较了该序列与其它动物的基因组DNA序列之间的同源性,结果发现,它与羊的线粒体部分基因有一定的同源性。比较结果如图1。选择同源性较高的29位点到49位点(BS1)和244位点到266位点(BS2)处的两条序列作为扩增牛、羊成分的通用引物。2.2PCR扩增结果PCR扩增结束后,经1.2%琼脂糖凝胶电泳显示,以牛、羊基因组DNA为模板的样品都能够特异性扩增得到分子量为233bp大小的条带,而猪、狗、鸡、鱼等均没有特异性条带产生,说明这对引物对牛、羊有很好的特异性,也符合同源性检索结果。同时,从图中可以看到,牛特异性引物和羊特异性引物也都扩增得到各自的特异性条带,分子量分别为271和294bp,这表明PCR结果准确可靠。2.3PCR结果的验证通过限制性内切酶Ⅰ的酶切,牛的PCR产物未被酶切,羊的PCR产物被酶切成168和65bp两个不同大小的片段,符合预期的结果(图3)。PCR产物经过测序和同源性比较后发现,黄牛、水牛和奶牛的核苷酸序列与目标基因序列的同源性分别为93.6%、90.1%和98.7%,绵羊和山羊的核苷酸序列与目标基因序列的同源性分别为97.9%和90.1%。排除品种之间的碱基差异以及PCR扩增和测序中的碱基错配等因素,可以完全确证PCR扩增产物是牛、羊的特异性产物。
图1.牛和羊线粒体基因部分序列的比较Fig.1.ComparisonofpartialnucleotidesequencesofmitochondrialDNAofbovineandsheep下划线代表PCR引物位置;.代表相同的碱基;-代表缺失的碱基。Theprimers忆sequencesareunderlined;Theidenticalbasesaremarkedas.;Thebasedeletionsaremarkedas-.
168PDF 文件使用 "pdfFactory Pro" 试用版本创建 www.fineprint.cn第2期闻伟刚等:进口饲料中牛、羊源成分的PCR同时检测方法
图2.牛、羊及其它动物源成分的PCR结果Fig.2.PCRresultsofbovine,sheepandotheranimalsderivedmaterialsM,分子量标准;1,牛/牛特异引物;2,羊/羊特异引物;3,黄牛/BS引物;4,水牛/BS引物;5,奶牛/BS引物;6,绵羊/BS引物;7,山羊/BS引物;8,空白对照;9,猪/BS引物;10,狗/BS引物;11,鸡/BS引物;12,鱼/BS引物。M,DL-2000;1,bovine/bovinespecialprimer;2,sheep/sheepspecialprimer;3,scalper/BS;4,buffalo/BS;5,milchcow/BS;6,sheep/BS;7,goat/BS;8,control;9,pig/BS;10,dog/BS;11,chicken/BS;12,fish/BS.
图3.牛和羊PCR产物的Ⅰ酶切结果Fig.3.ResultsofPCRproductsofbovineandsheepdigestedwithⅠ1,羊;2,牛;M,分子量标准。1,sheep;2,bovine;M,DL-2000.3结论和讨论Chelex-100是一种化学螯合树脂,对多价金属离子有螯合作用,可防止DNA在煮沸加热时被降解。同时,在高温低离子强度下有催化DNA释放的作用,这样可减少DNA的损失,又可消除扩增中的一些抑制因素[7]。该方法应用于动物基因组DNA提取非常简便、快速,无需接触酚、氯仿等有毒试剂,大大优于异硫氰酸胍法[4]和SDS法[8]。同时,Chelex-100法用于饲料中牛、羊成分的检测灵敏度也非常高,可以达到0.1%的检测限,与其它两种方法相当。作者在依据标准进行饲料中牛、羊成分的检测中,由于分别要用牛、羊两对不同引物进行检测,且PCR扩增条件因引物不同而有所差异,所以常感不便与繁琐。考虑到牛和羊成分均为检测对象,因此探索设计一对牛、羊通用引物用于两种成分的检测,再经酶切与测序来区分鉴别牛或羊成分。该方法的建立,包括基因组DNA的提取和通用引物的设计都具有全新和实用意义,对口岸检测工作者具有参考价值。参考文献1AndersonRM,DonnellyCA,FergusonNM,etal.TransmissiondynamicsandepidemiologyofBSEin.1996,Nature,382:778~7792PanL-W(潘良文),ChenJ-H(陈家华).Developmentondetectionofanimalderivedmaterialsinfoodandfeedstuff.InspectionQuarantineSci(检验检疫科学),2002,12(2):45~47(inChinese)3TartagliaM,SaulleE,PestalozzaS,etal.DetectionofbovinemitochondrialDNAinruminantfeeds:Amolecularapproachtotestforthepresenceofbovine-derivedmaterials.JFoodProtection,1998,61:513~5184XuB-L(徐宝梁),YangB-H(杨宝华),WangQ(王静),etal.IdentificationofBovine,SheepandGoatDerivedMaterialsinImportedAnimalDerivedFeedstuff.SN/T1119~2002.Beijing:ChinaStandardPress,2002.(inChinese)5MichaelsGS,HauswirthWW,LaipisPJ,etal.MitochondrialDNAcopynumberinbovineoocytesandsomaticcells.DevBiol,1988,94:246~2516RobinED,WongR.MitochondrialDNAmoleculesandvirtualnumberofmitochondriapercellinmammaliancells.JCellPhysiol,1988,136:507~5137ZhengX-F(郑秀芬).LeagalMedicalExpertDNAAnalyse.Beijing:ChinaPoliceUniversityPress.2002.(inChinese)8SambrookJ,FritschEF,ManiatisT.MolecularCloning:ALaboratoryManual.2nded.Beijing:SciencePress,1999.(inChinese)
