2003全国中学生化学竞赛初赛模拟题(1)
2003年全国初中化学竞赛试题与答案

2003年全国初中化学竞赛试题试题说明:⒈本试卷共8页,满分100分。
⒉考试时间:2小时。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32Cl:35.5 Ca:40 Cu:63.5 Zn:65一、选择题(本题包括14个题,每小题2分,共28分。
每小题有1个或2个选项符合题意。
若有两个答案的,错1个不得分,漏选1个扣1分。
)⒈种植下面几种农作物对pH的要求是:大豆6~7,茶5~5.5,甜菜7~7.5,西瓜6。
如果某地区经常降酸雨,则上述农作物最不适合种植的是A.大豆B.茶C.甜菜D.西瓜⒉一种“即食即热型快餐”适合外出旅行时使用。
其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是独立包装的两包化学物质,使用时拉动预留在外的拉线,使这两包化学物质混合,此时便可对食物进行加热,这两包化学物质最合适的选择是A.浓硫酸与水B.生石灰与水C.熟石灰与水D.氯化钠与水根据以下提供的材料,解答第3~5题。
材料1:据2002年4月30日报道,某化工厂排放的污水,使某市一条长约50公里的河水受到严重污染,对工农业生产及人民的生活造成严重危害。
经环保部门测定,被污染的河水pH在1~4之间,其他水质指标也严重超标。
材料2:2002年6月1日,对地表水质量作了明确规定,部分指标如下(除pH外,各项目的单位:mg/L):Ⅰ类Ⅱ类Ⅲ类Ⅳ类Ⅴ类磷(P)≤0.02 0.1 0.2 0.3 0.4氮(N)≤0.2 0.5 1.0 1.5 2.0锌(Zn)≤0.05 1.0 1.0 2.0 2.0铅(Pb)≤0.01 0.01 0.05 0.05 0.1pH 6~9 6~9 6~9 6~9 6~9⒊如果让你测定该河水样的酸碱度,可选用A.石蕊试液B.酚酞试液C. pH试纸D.碳酸钠溶液⒋材料2中所指出的“氮”、“磷”、“锌”、“铅”,是指A.单质B.元素C.离子D.分子⒌经测定,该化工厂排放的污水中铅的质量分数为(1×10-5)%。
全国化学竞赛初赛模拟试卷

全国化学竞赛初赛模拟试卷(时间:3小时满分:100分)一.(4分)黄绿色ClO2具有漂白、消毒作用,沸点9.90℃,制备ClO2的方法是:将湿润的KClO3和草酸(固体)混合加热到60℃即得。
1.ClO2的分子构型为;2.制备反应方程式为3.用此法制备获得的ClO2和其它生成物分离的方法是二.(12分)传统合成冰晶石(Na3AlF6)的方法是使用萤石(CaF2)为原料,萤石作为一种重要的战略物资需要加以保护,使用磷肥副产氟硅酸钠(Na2SiF6)为原料的方法成为一条合理利用资源、提高经济效益的新方法。
冰晶石的生产合成主要由晶种生成、氨解、偏铝酸钠的制备和冰晶石合成四个工段组成。
工艺流程如下图所示:使用这种方法可以得到大量副产品白炭黑。
为了提高副产品白炭黑的质量,可以采用外加晶种法,得到的白炭黑用于丁苯橡胶中,拉伸强度可以达到21Mpa,而外加晶种法对冰晶石质量也有影响。
1.冰晶石的化学名称为,主要用途是。
2.副产品白碳黑的化学成分是,丁苯橡胶的结构简式是3.氨解反应方程式是4.偏铝酸钠的制备反应是5.冰晶石合成反应方程式是6.晶种制备的原料为硫酸或氢氟酸、水玻璃、水。
分别使用HF和H2SO4合成晶种,生成的冰晶石检验结果如下:制备晶种用酸对冰晶石质量的影响从实验结果看,使用 制晶种,合成的冰晶石质量较好,简述你的理由。
三.(20分)能源是当今社会发展的三大支柱之一,是制约国家经济发展的瓶颈。
目前,我国的能源结构主要是煤,还有石油、天然气、核能等,这些能源都是一次不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。
科学家预测“氢能”将是未来21世纪最理想的新能源。
氢能是利用氢气的燃烧反应放热提供能量,即H 2+1/2O 2=H 2O +284 kJ 。
1.当今社会发展的三大支柱除能源外,还包括 和 。
2.试分析为什么“氢能”将是未来21世纪最理想的新能源?3.目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。
2003全国化学竞赛初赛模拟试卷(二)

2003年全国化学竞赛初赛模拟试卷(二)(时间:3小时满分:100分)第一题(8分)目前,科学家正在设法探寻“反物质”。
所谓“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量和相同的电量,但电荷的符号相反。
试回答:1.若有反α粒子,它的质量数为,电荷数为。
2.如果有该反α粒子轰击反12C原子,得到反H原子,写出该核反应方程式:3.一对正、负电子相遇发生湮灭,转化为一对频率相同的光子,已知电子质量为0.9×10-30kg,那么这两个光子的频率约为Hz(保留2位有效数字)。
4.反物质酸碱中和反应的实质可表示为。
第二题(12分)N2H4在一定条件下热分解,产生NH3、N2和H2,设反应后混合气体密度为原来的x(同温同压下)。
1.如果产生NH3和N2物质的量比为2︰1,写出N2H4分解的化学方程式;2.如果x=7/13,写出N2H4分解的化学方程式;3.确定x的取值范围:;4.计算产生的混合气体中NH3、N2和H2的体积含量。
(给出推理、计算过程)第三题(14分)含氮化合物广泛用于工业,如肥料和炸药。
现有两种无色晶体状离子化合物X、Y,在隔绝空气条件下引爆,都得到气体单质A和B,且气体B的百分含量分别是6.71%和26.46%。
1.写出A、B、X、Y的化学式;2.画出X、Y的电子式。
3.确定化合物X、Y中A原子的杂化类型。
第四题(12分)1.某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。
该化合物具有如下性质:①在25℃时,电离常数K1=3.99×10-4,K2=5.5×10-6②A+RCOOH(或ROH)−−−−→−∆ 浓42SOH有香味的产物③A具有光学活性④A在一定温度下的脱水产物可和溴水发生加成反应试回答:1.写出A的结构简式:2.用*标出有机物A中的手性碳原子;3.A在一定温度下的脱水产物和溴水反应的化学方程式:4.A的两个同类别的无光学活性的同分异构体的结构简式;5.判断A的酸式盐的水溶液的酸碱性。
(精品)全国高中化学竞赛(初赛)模拟试题20套
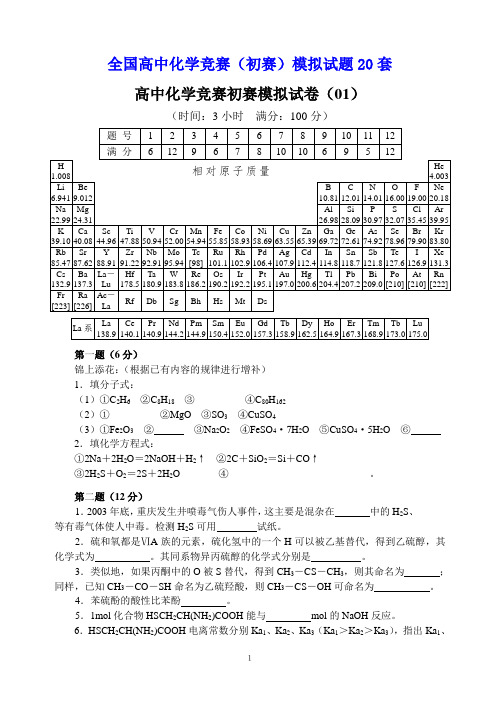
全国高中化学竞赛(初赛)模拟试题20套高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)第一题(6分)锦上添花:(根据已有内容的规律进行增补)1.填分子式:(1)①C2H6②C8H18③________ ④C80H162(2)①________ ②MgO ③SO3④CuSO4(3)①Fe2O3②③Na2O2④FeSO4·7H2O ⑤CuSO4·5H2O ⑥2.填化学方程式:①2Na+2H2O=2NaOH+H2↑②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。
第二题(12分)1.2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在中的H2S、______等有毒气体使人中毒。
检测H2S可用试纸。
2.硫和氧都是ⅥA族的元素,硫化氢中的一个H可以被乙基替代,得到乙硫醇,其化学式为。
其同系物异丙硫醇的化学式分别是。
3.类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为。
4.苯硫酚的酸性比苯酚。
5.1mol化合物HSCH2CH(NH2)COOH能与mol的NaOH反应。
6.HSCH2CH(NH2)COOH电离常数分别Ka1、Ka2、Ka3(Ka1>Ka2>Ka3),指出Ka1、1Ka2、Ka3相对应的基团各是哪个?第三题(9分)完成下列各步反应的化学反应式1.由AgCl制备AgNO3:将gCl溶解在氨水中,电解,所得产物溶于硝酸;2.由Hg2Cl2得到Hg:浓硝酸氧化,加热至干,溶于热水后电解;3.由Pb5(VO4)3Cl得到V:盐酸加热溶解(无气体产生),金属铝还原。
第四题(6分)某溶液含Fe 10.0mg,现将它苹取入某有机溶剂中,其分配比为D=99。
1.当用等体积的该溶剂萃取两次后,水相中剩余的Fe是多少mg?2.若用等体积水将上述合并后的有机相洗一次,将损失多少mg的Fe?3.若将洗后分出的水相以适当的方法显色后,定容至50.00mL,然后用1.0cm的比色皿测其吸光度,设摩尔吸光系数ε为2.0×104L·mol-1·cm-1,计算其吸光度。
国初中化学竞赛初赛试题精选含答案

2003全国初中化学竞赛初赛试题精选(2)一.单选题:(每小题有1个正确答案)(每小题2分,共8分)1.同温同压下,气体体积之比等于气体所含的分子个数之比。
某混合气体中可能含有N2、HCl和CO,将其依次通过NaHCO3溶液和灼热的CuO后,气体体积均无变化,但有红色物质生成(设各步反应均充分),再通过足量的NaOH溶液,气体体积明显减小,将燃着的木条伸入盛有剩余气体的集气瓶中,木条熄灭(已知:NaHCO3+HCl→NaCl+CO2↑+H2O忽略此反应产生的二氧化碳在溶液中的溶解)。
则该混合气体中……………………………………………………………………………………………()A.一定有N2和CO,肯定无HCl B.一定有CO、HCl和N2C.一定有N2和CO,可能有HCl D.一定有C0,可能有N2和HCl2.橡胶是一类在很宽的温度范围内具有弹性的高分子化合物,橡胶制品是工农业生产、交通运输、国防建设和日常生活不可缺少的物质。
无论天然橡胶和合成橡胶,都需要经过硫化处理增加其强度后才能使用,硫化程度越高,其强度越大,而弹性越低。
下列橡胶制品中,橡胶硫化程度最高的是……() A.橡皮筋 B.汽车用外轮胎 C.普通气球 D.医用或生活用乳胶手套3.把4.1g铁和锌的混合物放在稀硫酸中完全溶解,制得0.14g氢气。
混合物中锌的质量分数约是()A.32% B.68% C.16%D.35%4.欲确保含有盐酸的氯化钙溶液被中和至中性,在不用指示剂的条件下,应加入的试剂是……()A.生石灰B.熟石灰C.石灰石粉末D.纯碱二.复选题:(每小题有1~2个正确答案)(每小题3分,共24分)5.下面关于右图所示实验装置的使用方法中叙述正确的………………………………………()①用于排水集气:充满水,B进气,A排放水②用于收集密度比空气大的气体:B进气,A排放空气③用于收集密度比空气小的气体:B进气,A排放空气④用于洗气:装入洗液,A进气,B出气⑤用于测量气体的体积:充满水,B进气,A出水,计算溢出水的体积A.全正确 B.②③④⑤C.①③④⑤D.①②③④6.在密闭容器内有4种物质,通过电火花引燃后发生充分反应,测得反应前后各物质的质量如下表:甲乙丙丁反应前的质量/g 4 10 l 25反应后的质量/g 未测定21 10 9 已知丁的相对分子质量为甲的2倍,则该反应的化学方程式中甲与丁的化学计量数(旧称系数)的比为…………………………………………………………………………………………………………() A.1∶1 B. l∶2 C. l∶3 D.2∶17.下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的是………………………………………………………………………………………()A.NaCl、BaCl2、CuSO4、NaOH、KNO3 B.Ba(NO3)2、NaCl、Na2SO4、H2SO4、HClC.NaOH,FeCl3、MgSO4,BaCl2、KCl D.AgNO3、HCl、Na2CO3、KCl、CaCl28.锌和稀硫酸反应生成氢气,几次实验的锌用量不同,但硫酸用量相同。
2003年全国高中学生化学竞赛决赛理论试题参考答案
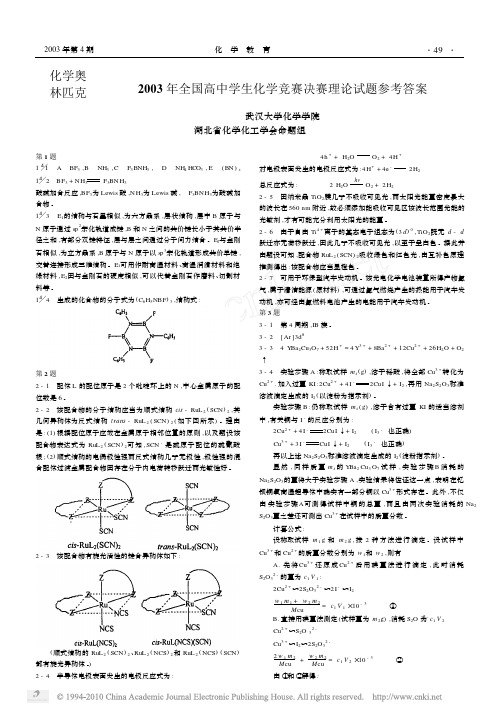
4h + + H2O
hv
O2 + 4 H + 2 H2
对电极表面发生的电极反应式为 :4 H + + 4e 总反应式为 :
2 H2O O 2 + 2 H2
酸碱加合反应 ,BF3为 Lewis 酸 ,N H3为 Lewis 碱 , F3BN H3为酸碱加 合物 。
1% 3 E1的结构与石墨相似 ,为六方晶系 , 层状结构 , 层中 B 原子与 N 原子通过 sp 2杂化轨道成键 ,B 和 N 之间的共价键长小于其共价半
2003 年第 4 期 化 学 教 育
・4 9 ・
化学奥 林匹克
2003 年全国高中学生化学竞赛决赛理论试题参考答案
武汉大学化学学院 湖北省化学化工学会命题组
第1题
1% 1 A BF3 ,B NH3 , C F3 BNH3 , D NH4 HCO3 , E ( BN ) x 1% 2 BF3 + N H3 F3BN H3
θ θ (353. 15 K) = exp [ - Δr ቤተ መጻሕፍቲ ባይዱ m K p / RT]
( NH4 ) 2 SO3 ( s ) (NH4 ) 2 SO4 (s)
θ
(1) (2)
SO2(g) + 2NH3 (g) + H2 O (g) + 1/ 2O2 (g)
4- 2 298. 15 K 下 ,反应的Δr H m 和Δr S m 可由题给数据求出 :
Σvi [Δf H m , θ 反应 (1) :Δr H mθ =Σvi [Δf H m , θ i ] 产物 — i ] 反应物 = - 885. 33 kJ ・ mol - 1 - [ - 296. 83 kJ ・ mol - 1 - 241. - 1 - 1 82 kJ ・ mol - 2 × 45. 90 kJ ・ mol ] = - 254. 88 kJ ・ mol - 1 θ θ θ Δr S m =Σvi [ S m , i ] 产物 — Σvi [ S m , i ] 反应物 = 240. 64 J ・ K- 1・ mol - 1 - [ 248. 11 J ・ K - 1・ mol - 1 + - 1 - 1 - 1 - 1 188. 72 J ・ K ・ mol + 2 × 192. 77 J ・ K ・ mol ] = - 581. 73 J ・ K - 1・ mol - 1 Σvi [Δf H m , θ 反应 (2) :Δr H mθ =Σvi [Δf H m , θ i ] 产物 — i ] 反应物 = - 1180. 85 kJ ・ mol - 1 - [ - 296. 83 kJ ・ mol - 1 - 241.
全国化学竞赛(初赛)模拟试卷

全国化学竞赛(初赛)模拟试卷时刻:3小时总分值:100分一.(14分)1.(2分)1999年4月,美国劳仑斯—柏克莱国家实验室的领导人,核化学家Kenneth E.Gregorich宣布,在该实验室的88英寸回旋加速器上,研究者用高能Kr8636离子轰击Pb20882靶,氪核与铅核融合,放出1个中子,形成了一种新元素A。
写出合成新元素A的反映方程式:2.(2分)试比较邻羟基苯甲醛和对羟基苯甲醛的沸点和酸性:3.(2分)把NaOH滴入同浓度的CuSO4溶液中即有沉淀生成。
由实验得知:当NaOH和CuSO4溶液的体积比为:1时,残留在溶液中的Cu2+极小。
现在生成沉淀的化学式是4.(3分)某烃C10H X中只含有仲、叔两种碳原子,且分子高度对称,那么该烃的二氯取代物的种数为5.(3分)聚1,3—异戊二烯是天然橡胶的要紧成份,它经臭氧氧化,再在锌粉和稀硫酸作用下水解,水解产物能发生碘仿反映。
写出水解产物的结构简式和发生碘仿反映的方程式6.(4分)写出二种定量测定H2O2水溶液中H2O2含量的化学方程式和简要实验步骤二.(10分)1.(2分)HCN为剧毒物质,受热水解为甲酰胺,后者进一步水解为甲酸铵。
写出这二步反映式。
你以为酸性仍是碱性有利于水解反映的进行。
2.(3分)1993年湖南浏阳某地域金矿遭本地村民非法开采,造成水域污染。
从金矿中提取金的要紧化学进程是以NaCN溶液浸取金砂,然后以锌粉处置浸取液。
写出并配平该进程的化学方程式。
3.(3分)检查水中HCN的方式是:往被疑心有HCN的溶液中加适量KOH、FeSO4及FeCl3。
写出反映式及实验现象。
4.(2分)含CN-的弱碱性污染水可用漂白粉处置,处置后水体逸出少量刺激性气体,写出并配平这一消毒进程的化学反映式。
三.(9分)氯化亚砜(SOCl2)是一种很重要的化学试剂,能够作为氯化剂和脱水剂。
1.(2分)氯化亚砜分子的几何构型是;中心原子采取杂方式,是(等性、不等性)杂化。
2003年全国化学竞赛初赛模拟试卷05

2003年全国化学竞赛初赛模拟试卷(五)第一题(8分)阅读如下信息后回答问题:元素M是仅次于铁而在生物细胞中大量存在的金属元素,是必需元素之一;M用于制合金、白铁、干电池、烟火等;其粉末为强还原剂,可用于有机合成、染料制备以及金、银的冶炼;其氧化物一种白色颜料。
1.M的元素符号是,核外电子排布是。
2.M的最重要的两种矿物的化学式是和。
3.M的最重要的一种“矾”的名称是,化学式是。
4.M能否与强酸(HCl)或强碱(NaOH)反应。
如果能,写出离子方程式。
第二题(6分)下面是一种有机物A的合成路线,请回答有关问题:写出a~f的结构简式:第三题(6分)低标号普通水泥,由于烧结温度不够,致使其中掺杂了一些原料成分。
某化工厂用这种水泥修筑了一个贮酸池贮存盐酸,池的内部涂以耐酸涂料,再加上施工质量不理想,贮酸一定时间后,出现了涂料膜与水泥壁之间充满气体,该气体的主要成分是,该气体的来源是。
一段时间后测定池内盐酸的浓度降低了但溶液的密度却升高了,取出部分贮存液用氢氧化钠溶液中和至碱性后通入CO2出现大量白色沉淀,试分析贮后酸液密度升高的原因。
第四题(11分)近年来,西方各国由于几起重大火灾、焚烧塑料造成的二次污染、二恶英问题的出现,而且塑料燃烧过程中产生的酸性及腐蚀性气体(SO2、NO2、CO2等)的危害较大,以及对环境保护的日趋严格,迫使塑料工业转向使用无毒、无公害、抑烟的无机阻燃剂,而占市场份额较大的溴系阻燃剂逐渐受到限制;1997年在美国召开了第八届世界阻燃剂会议,会议指出今后阻燃剂的发展方向集中为高效、低毒、低烟的阻燃剂。
1.会议报告中有相当一部分内容涉及到Mg(OH)2和Al(OH)3阻燃剂,这都表明无机类阻燃剂(特别是Mg(OH)2和Al(OH)3)具有广阔的发展空间。
请说出此种无机阻燃剂的特点。
2.溴系阻燃剂是目前世界上产量最大的有机阻燃剂。
其主要品种之一“八溴醚”广泛用于聚乙烯、聚丙烯等聚烯烃类高聚物的阻燃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2003全国中学生化学竞赛初赛模拟题
(时间3小时,满分100分)
第一题 天然氟矿主要有萤石、氟磷灰石等。
由萤石矿制
F 2的方法是先用浓硫酸与萤石反
应,生成HF ,再电解得F 2。
1、请写出由萤石矿制F 2的主要化学反应的方程式。
3、F 对人体的危害是很严重的。
人体中若含有过多的F ,F 会与人体内一种重要
的金属阳离子形成难溶物,而带给人体严重的伤害与痛苦。
这种阳离子是:
-
第二题 原子核的壳层模型指出:包含2、8、20、28、50和82个质子或中子以及126个中
子的核具有特殊的稳定性。
写出21685At 经α或β衰变直到稳定核的核化学方程式,并说明为什么此核为稳定核。
第三题 臭氧层的保护是当今的一个迫在眉睫的任务。
由于人类的生产生活,臭氧层已经变
得伤痕累累。
NO 和CF 2Cl 2都是破坏臭氧层的罪犯。
请分别写出它们在光照下破坏臭氧层的机理(有氧原子参与或生成):
第四题
要的物质
(它们的结构分别相似)。
请分别写出三种同素异形体所对应的三类物质:
金刚石对应 族化合物; 石墨对应 族化合物; 富勒烯对应 族化合物。
第五题 化学家们自19世纪以后陆续发现,有一些化学反应中的某些组分或中间产物的浓
度能够随时间发生有序的周期性变化,即所谓的化学振荡现象。
苏联化学家Belousov B P 和Zhabotinsky A M 最早发现了均相条件下的化学振荡现象,后人称他们发现的化学振荡为B -Z 振荡。
下面是一种B -Z 振荡:
在含有硫酸铈(III )催化剂和Br -的溶液中,用BrO 3-氧化丙二酸,可以看到溶液
由无色变黄,一会儿又变为无色,如此振荡。
反应机理为:
第一阶段:当溶液中Br -溶度较高时,Br -与BrO 3-在酸性条件下生成Br 2,后者立
即与丙二酸发生一取代反应。
第二阶段:当Br -溶液较小时,反应切换到此阶段,即BrO 3-氧化Ce 3+到Ce 4+,本
身被还原为HOBr 。
第三阶段:Br -再生,并把丙二酸彻底氧化。
反应究竟在哪个阶段,是由 决定的。
使溶液呈现现黄色的物质是:
第六题 今有一金属卤化物A ,在水溶液中完全电离,生成一种阴离子和一种阳离子,个数
比为4∶1。
取4.004g A 溶于水,加入过量AgNO 3溶液,生成2.294g 白色沉淀。
经测定,阳离子由X 和Y 两种元素构成,结构呈正方体状,十分对称。
任意两个相离最远的X 原子的连线为此离子的三重轴,任意两个相离最远的Y 原子的连线为此离子的四重轴(n 重轴表示某物质绕此轴旋转360°/n 的角度,不能察觉其是否旋转过)。
1、写出A 的化学式 (阴阳离子分开写)
第七题 某无色溶液,其中可能存在Na +、Ba 2+、AlO 2-、S 2-、SO 32-、SO 42-。
取该溶液进
行有关实验,实验结果如下图所示:
请回答:
1、沉淀甲的化学式为 。
2、由溶液甲生成沉淀乙的离子方程式为 。
3、沉淀丙中一定含有 可能含有 。
4、综合上述信息,该溶液中肯定存在的离子有: 。
第八题
有一气体有机物X ,有三种同分异构体。
取3.0g X 充分燃烧后,把生成物依次通过盛有浓硫酸和碱石灰的两个试剂瓶,分别增重3.8g 和8.8g 。
1、写出X 的分子式 。
3、若X 上的一个H 被D 取代之后,成为Y ,请写出Y 的分子式 。
4、Y 有 种异构体。
第九题 羟醛缩合在有机合成中是一个极重要的反应,在下框中画出化合物
进行分子内羟醛缩合所形成的不同产物的结构式:(不考
2003全国中学生化学竞赛初赛模拟题答案
(时间3小时,满分100分)
第一题 天然氟矿主要有萤石、氟磷灰石等。
由萤石矿制F 2的方法是先用浓硫酸与萤石反
应,生成HF ,再电解得F
2。
1、请写出由萤石矿制F 2的主要化学反应的方程式。
CaF 2 +H 2SO 4(浓)
===CaSO 4+2HF(g) 2HF=电解
=H 2(g)+F 2(g) (各2分)
3、F -对人体的危害是很严重的。
人体中若含有过多的F -,F -会与人体内一种重要
的金属阳离子形成难溶物,而带给人体严重的伤害与痛苦。
这种阳离子是:Ca 2+
-
第二题 原子核的壳层模型指出:包含2、8、20、28、50和82个质子或中子以及126个中
子的核具有特殊的稳定性。
写出21685At 经α或β衰变直到稳定核的核化学方程式,并说明为什么此核为稳定核。
第三题 臭氧层的保护是当今的一个迫在眉睫的任务。
由于人类的生产生活,臭氧层已经变
得伤痕累累。
NO 和CF 2Cl 2都是破坏臭氧层的罪犯。
请分别写出它们在光照下破坏臭氧层的机理(有氧原子参与或生成):
第四题
要的物质(它们的结构分别相似)。
请分别写出三种同素异形体所对应的三类物质:
金刚石对应 脂肪 族化合物; 石墨对应 芳香 族化合物; 富勒烯对应 球碳 族化合物。
第五题 化学家们自19世纪以后陆续发现,有一些化学反应中的某些组分或中间产物的浓
度能够随时间发生有序的周期性变化,即所谓的化学振荡现象。
苏联化学家Belousov B P
和Zhabotinsky A M 最早发现了均相条件下的化学振荡现象,后人称他们发现的化学振荡为B -Z 振荡。
下面是一种B -Z 振荡:
在含有硫酸铈(III )催化剂和Br -的溶液中,用BrO 3-氧化丙二酸,可以看到溶液
由无色变黄,一会儿又变为无色,如此振荡。
反应机理为:
第一阶段:当溶液中Br -溶度较高时,Br -与BrO 3-在酸性条件下生成Br 2,后者立
即与丙二酸发生一取代反应。
第二阶段:当Br -溶液较小时,反应切换到此阶段,即BrO 3-氧化
Ce 3+到Ce 4+,本
身被还原为HOBr 。
第三阶段:Br -再生,并把丙二酸彻底氧化。
反应究竟在哪个阶段,是由Br -的浓度(2分,不点出浓度扣1分)决定的。
使溶液呈现黄色的物质是:Ce 4+(1分)
第六题 今有一金属卤化物A ,在水溶液中完全电离,生成一种阴离子和一种阳离子,个数
比为4∶1。
取4.004g A 溶于水,加入过量AgNO 3溶液,生成2.294g 白色沉淀。
经测定,阳离子由X 和Y 两种元素构成,结构呈正方体状,十分对称。
任意两个相离最远的X 原子的连线为此离子的三重轴,任意两个相离最远的Y 原子的连线为此离子的四重轴(n 重轴表示某物质绕此轴旋转360°/n 的角度,不能察觉其是否旋转过)。
1、写出A 的化学式[Mo 6Cl 8]Cl 4(4分)(阴阳离子分开写)
2、写出X 和Y 的元素符号Cl 、Mo (各1分)
3、在右框中画出A 溶液中阳离子的结构:(4分)
4、小明把一种常见含X 的二元化合物的晶胞去掉所
有的X 原子,发现剩余部分与A 溶液中阳离子的结 构竟十分相似。
这种常见二元化合物是NaCl (2分)。
5、你认为A 溶液中阳离子中,同种原子间存在着什
么样的作用力,并简略说明你的依据:
第七题 某无色溶液,其中可能存在Na +、Ba 2+、AlO 2-、S 2-、SO 32-、SO 42-。
取该溶液进
行有关实验,实验结果如下图所示:
请回答:
1、沉淀甲的化学式为S (2分)。
2、由溶液甲生成沉淀乙的离子方程式为Al 3++3HCO 3-==Al(OH)3(s)+3CO 2(g)(2分)。
3、沉淀丙中一定含有BaCO 3(1分)可能含有BaSO 4(1分)。
4、综合上述信息,该溶液中肯定存在的离子有: Na +、AlO 2-、S 2-、SO 32-(Na +3分,其它离子一个1分,因溶液中不可能只有阴离子)。
第八题 有一气体有机物X ,有三种同分异构体。
取3.0g X 充分燃烧后,把生成物依次通
过盛有浓硫酸和碱石灰的两个试剂瓶,分别增重3.8g 和8.8g 。
1、写出X 的分子式C 2H 2D 2(4分)。
3、若X 上的一个H 被D 取代之后,成为Y ,请写出Y 的分子式C 2HD 3(2分)。
4、Y 有1(2分)种异构体。
第九题 羟醛缩合在有机合成中是一个极重要的反应,在下框中画出化合物
进行分子内羟醛缩合所形成的不同产物的结构式:(不考。
