(完整版)初中化学第十单元方程式
初中化学各单元(1-6单元)反应方程式总结

绪言1.电解食盐水:2NaCl+2H2O2NaOH+Cl2↑+H2↑2.孔雀石上燃烧炭火:Cu2(OH)2CO32CuO+H2O+CO2↑C+2CuO2Cu+CO2↑注意:(1)孔雀石为绿色固体;(2)氧化铜为黑色固体;(3)氧化铜可与炭反应生成红色固体和无色无味气体。
第一单元1.硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4CuSO4:白色固体,溶于水后所形成的溶液为蓝色(所述性质为常温常压下,下同),可利用CuSO4的这一性质检验水蒸气的存在。
2.大理石与盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑3.二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O注意:气体发生装置的选择:本实验为固液不加热反应,不需要酒精灯;第二单元1.空气中加热汞:2Hg+O22HgO2.氧化汞加热分解:2HgO2Hg+O2↑3.磷在空气中燃烧:4P+5O22P2O5现象:(1)发出白光;(2)放出热量;(3)生成大量白烟注意:(1)是白烟,不是白雾,也不是白色烟雾(2)可用此反应原理测定空气中氧气的体积含量;(3)初中化学推断题中,见到“燃烧”,想到“氧气”;(4)反应条件为“点燃”,不可写“燃烧”,也不可写“加热”。
4.硫在空气中燃烧:S+O 2SO2现象:在氧气中:(1)发出明亮的蓝紫色火焰;(2)放出热量;(3)生成一种有刺激性气味的气体在空气中:(1)发出淡蓝色火焰;(2)放出热量;(3)生成一种有刺激性气味的气体5.炭在空气中充分燃烧:C+O2CO2现象:在氧气中:(1)发出白光;(2)放出热量;(3)生成无色无味可以使澄清石灰水变浑浊的气体在空气中:(1)发出红光;(2)放出热量;(3)生成无色无味可以使澄清石灰水变浑浊的气体注意:(1)此反应中涉及到的三种物质均为中考考查重点,注意其物理性质和化学性质,并多关注与这三种物质相关的物质转化。
九年级化学第10、11单元化学方程式总结

九年级化学第10、11单元化学方程式总结第十、十一单元主要化学方程式总结一、酸的化学性质:(一)酸+活泼金属→盐+H2↑(置换反应)1. 锌和稀硫酸:Zn + H2SO4= ZnSO4+ H2↑2. 铁和稀硫酸:Fe + H2SO4= FeSO4+ H2↑3. 镁和稀硫酸:Mg + H2SO4= MgSO4+ H2↑4. 铝和稀硫酸:2Al + 3H2SO4= Al2(SO4)3+3H2↑5. 锌和稀盐酸:Zn + 2HCl = ZnCl2+ H2↑6. 铁和稀盐酸:Fe + 2HCl = FeCl2+ H2↑7. 镁和稀盐酸:Mg + 2HCl = MgCl2+ H2↑8. 铝和稀盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑(二)酸+金属氧化物→盐+水(复分解反应)9. 用稀盐酸除铁锈:Fe2O3+ 6HCl = 2FeCl3+ 3H2O10. 用稀硫酸除铁锈:Fe2O3+ 3H2SO4=Fe2(SO4)3+ 3H2O11. 氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2+ H2O12. 氧化铜和稀硫酸反应:CuO + H2SO4= CuSO4+ H2O13. 氧化镁和稀硫酸反应:MgO + H2SO4= MgSO4+ H2O14. 氧化钙和稀盐酸反应:CaO + 2HCl = CaCl2+ H2O(三)酸+碱→盐+水(复分解反应)15.盐酸和烧碱溶液反应:HCl + NaOH = NaCl + H2O16.盐酸和氢氧化钾反应:HCl + KOH = KCl + H2O17.盐酸和氢氧化铜反应:2HCl + Cu(OH)2= CuCl2+ 2H2O18.盐酸和石灰水反应:2HCl + Ca(OH)2= CaCl2+ 2H2O19.盐酸和氢氧化铁反应:3HCl + Fe(OH)3= FeCl3+ 3H2O20.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3= AlCl3+ 3H2O21.硫酸和烧碱反应:H2SO4+ 2NaOH = Na2SO4+ 2H2O22.硫酸和氢氧化钾反应:H2SO4+ 2KOH = K2SO4+ 2H2O23.硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2= CuSO4+ 2H2O24.硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3= Fe2(SO4)3+ 6H2O25.硝酸和烧碱反应:HNO3+ NaOH = NaNO3+ H2O(四)酸+盐→新酸+新盐(复分解反应)26.碳酸钙与稀盐酸反应:CaCO3+ 2HCl = CaCl2+ H2O + CO2↑27.碳酸钠与稀盐酸反应: Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑28.碳酸氢钠与稀盐酸反应:NaHCO3+ HCl = NaCl + H2O + CO2↑29.碳酸镁与稀盐酸反应: MgCO3+ 2HCl = MgCl2+ H2O + CO2↑30.盐酸和硝酸银溶液反应:HCl + AgNO3= AgCl↓ + HNO331.硫酸和碳酸钠反应:Na2CO3+ H2SO4= Na2SO4+ H2O + CO2↑32.硫酸和氯化钡溶液反应:H2SO4+ BaCl2= BaSO4↓+ 2HCl二、碱的化学性质:(一)碱溶液+非金属氧化物→盐+水33.苛性钠暴露在空气中变质:2NaOH + CO2= Na2CO3+ H2O34.苛性钠吸收二氧化硫气体:2NaOH + SO2= Na2SO3+ H2O35.氢氧化钠溶液吸收三氧化硫气体:2NaOH + SO3= Na2SO4+ H2O36.熟石灰放在空气中变质(或用石灰乳粉刷墙壁变硬、或二氧化碳使石灰水变浑浊):Ca(OH)2+ CO2= CaCO3↓+ H2O37.熟石灰吸收二氧化硫:Ca(OH)2+ SO2= CaSO3↓+ H2O(二)碱+酸→盐+水(复分解反应)(见酸的化学性质15-25)(三)碱溶液+盐溶液→新碱+新盐(复分解反应)38.氢氧化钠与硫酸铜:2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4 39.氢氧化钠与氯化铁:3NaOH + FeCl3= Fe(OH)3↓ +3NaCl40.氢氧化钠与氯化镁:2NaOH + MgCl2= Mg(OH)2↓ + 2NaCl41.氢氧化钠与氯化铜:2NaOH + CuCl2= Cu(OH)2↓ + 2NaCl 42.氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3= CaCO3↓+ 2NaOH43.农药波尔多液中反应:Ca(OH)2+ CuSO4= CaSO4+ Cu(OH)2↓三、盐的化学性质:(一)盐溶液+金属→新金属+新盐(置换反应)44. 铁和硫酸铜溶液反应:Fe + CuSO4= FeSO4+ Cu45. 锌和硫酸铜溶液反应:Zn + CuSO4= ZnSO4+ Cu46. 铜和硝酸银溶液反应:Cu + 2AgNO3= Cu(NO3)2+ 2Ag47. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2+ Hg48. 铝和硫酸铜溶液反应:2Al + 3CuSO4= Al2(SO4)3+ 3Cu(二)酸+盐→新酸+新盐(复分解反应)(见酸的化学性质26-32) (三)碱溶液+盐溶液→新碱+新盐(复分解反应)(见碱的化学性质38-43)(四)盐溶液+另一种盐溶液→两种新盐(复分解反应)49.氯化钠溶液和硝酸银溶液:NaCl + AgNO3= AgCl↓ + NaNO3 50.硫酸钠溶液和氯化钡溶液:Na2SO4+ BaCl2= BaSO4↓ + 2NaCl 51.硫酸钠溶液和硝酸钡溶液:Na2SO4+ Ba(NO3)2= BaSO4↓ + 2NaNO3 52.碳酸钠溶液和氯化钡溶液:Na2CO3+ BaCl2= BaCO3↓ + 2NaCl 53.碳酸钠溶液和氯化钙溶液:Na2CO3+ CaCl2= CaCO3↓ + 2NaCl 四、其它反应:54.生石灰溶于水:CaO + H2O = Ca(OH)2。
初中化学人教第十单元 常见的酸和碱 知识点整理(全面,带答案)
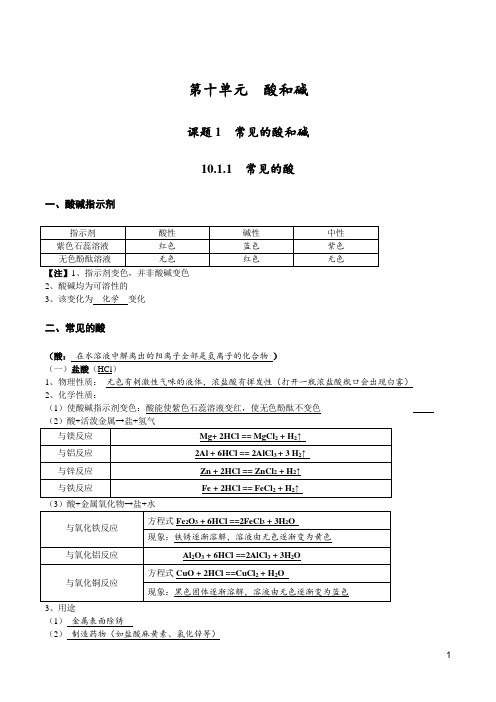
第十单元酸和碱课题1 常见的酸和碱10.1.1 常见的酸一、酸碱指示剂2、酸碱均为可溶性的3、该变化为化学变化二、常见的酸(酸:在水溶液中解离出的阳离子全部是氢离子的化合物)(一)盐酸(HCl)1、物理性质:无色有刺激性气味的液体,浓盐酸有挥发性(打开一瓶浓盐酸瓶口会出现白雾)2、化学性质:(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色(1)金属表面除锈(2)制造药物(如盐酸麻黄素、氯化锌等)(3)人体胃液中的含有盐酸,可帮助消化(二)硫酸(H2SO4)1、浓硫酸(1)物理性质:无色粘稠油状液体,无气味,浓硫酸具有吸水性(2)化学性质:腐蚀性(3)浓硫酸的稀释:将浓硫酸沿着烧杯壁慢慢注入水中,并用玻璃棒不断搅拌(4)浓硫酸的事故处理:先用大量的水冲洗,再涂3%-5%的碳酸氢钠溶液。
2、稀硫酸的化学性质(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色3、用途(1)用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油(2)金属除锈(3)汽车铅酸蓄电池中含有硫酸(4)浓硫酸在实验室常用作干燥剂三、酸的通性1、酸能与指示剂作用2、酸能与活泼金属反应3、酸能与金属氧化物反应4、酸能与碱反应5、酸能与盐反应注:酸溶液具有相似化学性质的原因:酸溶液中都含有H+四、复分解反应1、定义:两种化合物相互交换成分生成另外两种化合物的反应。
2、表达式:AB+CD=AD+CB3、反应前后各元素化合价不变(“变”或“不变”),属于基本反应类型。
4、10.1.2 常见的碱一、氢氧化钠(NaOH)1、俗称:烧碱、火碱、苛性钠2、物理性质:白色固体,易溶于水,溶解时放出大量的热。
3、化学性质(1)与酸碱指示剂反应:碱溶液能使紫色石蕊溶液变蓝,使无色酚酞变红、事故处理:先用大量的水冲洗,再涂上硼酸溶液5、制取:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (化学方程式)6、密封保存的原因:(1)NaOH固体容易吸收空气中的水分发生潮解。
第十单元酸和碱的化学方程式

第十单元酸和碱的化学方程式(祝同学们在理解的基础上早日记会化学方程式)一、金属单质 + 酸 --------盐 +氢气(置换反应)锌和稀硫酸反应生成硫酸锌和氢气:Zn + H 2 SO4= ZnSO4+H2↑铁和稀硫酸反应生成硫酸亚铁和氢气:Fe + H 2SO4 = FeSO4 + H 2↑镁和稀硫酸反应生成硫酸镁和氢气:Mg + H SO = MgSO + H ↑2442铝和稀硫酸反应生成硫酸铝和氢气:2Al +3H2SO = Al2(SO)3+3H ↑442锌和稀盐酸反应生成氯化锌和氢气:Zn + 2HCl === ZnCl2+H2↑铁和稀盐酸反应生成氯化亚铁和氢气:Fe + 2HCl === FeCl2+H2↑镁和稀盐酸反应生成氯化镁和氢气:Mg+ 2HCl === MgCl2 + H 2↑铝和稀盐酸反应生成氯化铝和氢气:2Al + 6HCl == 2AlCl3+3H ↑2铁和硫酸铜溶液反应生成铜和硫酸亚铁: Fe + CuSO == FeSO + Cu44二、金属氧化物 + 酸 --------盐 + 水氧化铁和稀盐酸反应: Fe2O3+ 6HCl === 2FeCl3+3H2O氧化铁和稀硫酸反应: Fe2O3+ 3H 2SO4 === Fe 2(SO4) 3 + 3H 2O氧化铜和稀盐酸反应: CuO + 2HCl ==== CuCl2+ H O2氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H 2O 氧化镁和稀硫酸反应: MgO + HSO ==== MgSO + H O2442氧化钙和稀盐酸反应: CaO + 2HCl ==== CaCl2+ H O2三、非金属氧化物 + 碱 --------盐 +水苛性钠裸露在空气中变质:2NaOH + CO2 ==== Na 2CO3 + H 2O火碱溶液吸取二氧化硫气体:2NaOH + SO2 = Na 2SO3(硫酸钠) + H2O 烧碱吸取三氧化硫气体:2NaOH + SO3 == Na 2SO4(硫酸钠) + H 2O熟石灰(石灰水)放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 消石灰吸取二氧化硫:Ca(OH)2+ SO2==CaSO3↓(亚硫酸钙) + H2O 四、(中和反应)酸+ 碱--------盐+水盐酸和烧碱起反应: HCl + NaOH ==== NaCl +H 2O氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) 3 ==== AlCl 3 + 3H 2 O硫酸和烧碱反应: H2SO4 + 2NaOH ==== Na2SO4 + 2H 2O盐酸和氢氧化钙反应:2HCl + Ca(OH) 2 ==== CaCl 2 + 2H 2O盐酸和氢氧化铜反应:2HCl + Cu(OH) 2 ==== CuCl 2 + 2H 2O??盐酸和氢氧化镁反应:2HCl + Mg(OH) 2 ==== Mg Cl 2 +H2O(下面的不要求)硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K 2SO4 + 2H2 O硫酸和氢氧化铜反应:H2SO4 + Cu(OH) 2 ==== CuSO4 + 2H 2O五、其他的反应:大理石与稀盐酸反应:CaCO3+ 2HCl === CaCl 2 + H2O + CO2↑碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑二氧化碳溶解于水: CO2 + H 2O === H2CO3生石灰溶于水: CaO + H2O === Ca(OH)2三氧化硫溶于水: SO3 + H 2O ==== H2SO4高温煅烧石灰石: CaCO3高温 CaO + CO2↑二氧化硫溶于水: SO2 + H 2O ==== H2SO3(亚硫酸)。
九年级化学各单元化学方程式汇总

化学方程式是描述化学反应的符号式表示方法,可以表示反应物和生成物之间的关系。
九年级化学主要包括酸碱中和、金属与非金属的反应、氧化与还原反应、浓度溶液的配制和稀释等单元。
以下是九年级化学各单元的化学方程式汇总。
一、酸碱中和反应1.酸和碱的中和反应HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)2.酸性氧化物和碱性氧化物的反应SO2(g) + 2NaOH(aq) → Na2SO3(aq) + H2O(l)CO2(g) + 2NaOH(aq) → Na2CO3(aq) + H2O(l)二、金属与非金属的反应1.金属与酸的反应2HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)2HNO3(aq) + 3Cu(s) → 3Cu(NO3)2(aq) + 2NO(g) + H2O(l)2.金属与非金属氧化物的反应Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s)Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)三、氧化与还原反应1.金属的氧化反应2Mg(s)+O2(g)→2MgO(s)4Al(s)+3O2(g)→2Al2O3(s)2.金属的还原反应2Ag2O(s)→4Ag(s)+O2(g)CuO(s)+H2(g)→Cu(s)+H2O(l)四、浓度溶液的配制和稀释1.溶质的质量计算C1V1=C2V22.液体体积和浓度的计算C=n/V3.溶质溶解效应的计算m1V1+m2V2=(m1+m2)V'以上几个单元的化学方程式只是其中的一部分,涵盖了九年级化学的主要内容。
通过学习这些方程式,我们可以理解化学反应的基本原理和变化过程,掌握化学方程式的书写和计算方法。
同时,需要注意的是,化学方程式在实际应用中还有很多其他的变化和反应方式,不同的实验条件和反应物也会影响方程式的形式和系数。
初三化学十二个方程式

初三化学十二个方程式
以下是一些初三化学中常见的12个化学方程式:
1.酸碱中和反应:
o HCl + NaOH → NaCl + H2O
o H2SO4 + 2NaOH → Na2SO4 + 2H2O
2.金属与酸反应:
o2HCl + Mg → MgCl2 + H2
o H2SO4 + Zn → ZnSO4 + H2
3.金属和非金属氧化物反应:
o2Mg + O2 → 2MgO
o CuO + H2 → Cu + H2O
4.酸与金属碱反应:
o HNO3 + KOH → KNO3 + H2O
o H2SO4 + 2KOH → K2SO4 + 2H2O
5.碳酸银的分解反应:
o2Ag2CO3 → 4Ag + 2CO2 + O2
6.水的电解反应:
o2H2O(l) → 2H2(g) + O2(g)
7.燃烧反应:
o CH4 + 2O2 → CO2 + 2H2O
o C3H8 + 5O2 → 3CO2 + 4H2O
8.蒸发结晶反应:
o NaCl(aq) → NaCl(s) + H2O
9.高锰酸钾的分解反应:
o2KMnO4 → K2MnO4 + MnO2 + O2
10.酸性碳酸氢钠的分解反应:
o2NaHCO3 → Na2CO3 + H2O + CO2
11.硫酸铜脱水反应:
o CuSO4 · 5H2O → CuSO4 + 5H2O
12.铁与硫反应:
o Fe + S → FeS
这些方程式是初中化学中常见的一些例子,旨在帮助在学习和巩固化学知识时进行概念理解和实践应用。
请牢记,化学方程式的编写和理解需要深入学习相关的化学概念和原理。
人教版九年级化学各单元化学方程式汇总

九年级化学方程式总汇第一单元 走进化学世界(1) 2 NaOH + CuSO 4 ==== Na 2SO 4 + Cu(OH)2↓(2) CaCO 3 + 2HCl ===CaCl 2 + CO 2↑ + H 2O(3) CO 2 + Ca(OH)2 ===CaCO 3↓+ H 2(4) Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2 ↑第二单元 我们周围的空气⑴ S + O 2SO 2⑵ 4 P + 5 O 22 P 2O 5⑶ C + O 2CO 2⑷ 3 Fe + 2 O 2Fe 3O 4⑸ 2 H 2O 2O 2↑ + 2 H 2O⑹ 2 KClO 3 2KCl + 3O 2↑⑺ 2 KMnO 4 K 2MnO 4 + MnO 2 + O 2↑⑻ 2 H 2O 2 H 2 ↑+ O 2 ↑⑼ 2 H 2 + O 2 2H 2O⑽ C 2H 5OH + 3 O 2 2 CO 2 + 3 H 2O⑾ 2 HgO 2 Hg + O 2↑⑿ CO 2 + Ca(OH)2 CaCO 3↓+ H 2OMnO 2△ MnO 2△△第三单元 自然界的水⑴ 2 H 2O 2 H 2 ↑+ O 2 ↑⑵ 2 HgO 2 Hg + O 2↑⑶ 2 H 2 + O 22 H 2O⑷ H 2 + Cl 22 HCl⑸2 KMnO 4 K 2MnO 4 + MnO 2 + O 2↑第四单元 物质构成的奥秘⑴2 H 2O 2 H 2 ↑+ O 2 ↑⑵S + O 2SO 2第五单元 化学方程式⑴ 2 Mg + O 22 MgO⑵ Fe + CuSO 4 FeSO 4 + Cu⑶ Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2 ↑⑷ 2 NaOH + CuSO 4 Na 2SO 4 + Cu(OH)2↓⑸ CaCO 3 CaO + CO 2↑⑹ H 2 + CuO Cu + H 2O⑺ Fe 2O 3 + 3 H 2 2 Fe + 3 H 2 O⑻ Fe 2O 3 + 3CO 2Fe + 3CO 2⑼C 2H 4 + 3 O 2 2 H 2O + 2 CO 2△ △ 高温 高温高温△⑽ CH 4 + 2 O2 CO 2 + 2 H 2O⑾ Zn + H 2SO 4 ZnSO 4 + H 2↑⑿ Zn + 2HCl ZnCl 2 + H 2↑⒀ H 2 +Cl 22HCl第六单元 碳和碳的氧化物⑴ 2 C + O 2 (不足)2 CO⑵ 2 CuO + C 2 Cu + CO 2↑⑶ 2 Fe 2O 3 + 3 C 4 Fe + 3 CO 2↑⑷ CaCO 3 + 2HCl CaCl 2 + CO 2↑ + H 2O⑸ H 2CO 3 H 2O + CO 2↑⑹ H 2O + CO 2 H 2CO 3⑺ CO 2 + Ca(OH)2 CaCO 3↓+ H 2O⑻ 2CO+O 22CO 2⑼ CO + CuO Cu + CO 2⑽ CaCO 3 CaO + CO 2↑第七单元 燃料及其利用⑴ CH 4 + 2 O2 CO 2 + 2 H 2O⑵ C 2H 5OH + 3 O2 2 CO 2 +3 H 2O⑶ Mg + 2HCl MgCl 2 + H 2↑高温 高温△ 高温 高温⑷ Zn + H 2SO 4 ZnSO 4 + H 2↑⑸ H 2O + SO 2 H 2SO 3⑹ Zn + H 2SO 3 ZnSO 3 + H 2↑⑺ Mg + H 2SO 3 MgSO 3 + H 2↑⑻ CaCO 3 + H 2SO 3 CaSO 3↓ + H 2O + CO 2↑⑼ Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2 ↑⑽ 2 H 2 + O 22 H 2O第八单元 金属和金属材料⑴ 4 Al + 2 O 2 2 Al 2O 3⑵ Zn + 2HCl ZnCl 2 + H 2↑⑶ Fe + 2HCl FeCl 2 + H 2↑⑷ Fe + H 2SO 4 Fe SO 4 + H 2↑⑸ 2 Al + 3 H 2SO 4 Al 2(SO 4)3 + 3 H 2↑⑹ 2 Cu + O 2 2 CuO⑺ Fe 2O 3 + 3CO 2 Fe +3CO 2⑻ Mg + H 2SO 4 MgSO 4 + H 2↑⑼ Zn + CuSO 4 ZnSO 4 + 3 Cu⑽ Al + 3AgNO 3 3Ag + Al (NO 3)3⑾ Fe + CuCl 2 Fe Cl 2 + Cu△ 高温⑿ C + CO 2 2 CO⒀ Fe + CuSO 4 FeSO 4 + Cu⒁ ZnCO 3 ZnO + CO 2↑⒂ ZnO + CO Zn + CO 2↑⒃ CuO +CO 2Cu + CO 2 ↑⒄ Mg + 2HCl MgCl 2 + H 2↑⒅ Zn + H 2SO 4 ZnSO 4 + H 2↑第九单元 溶液⑴ Zn + H 2SO 4 ZnSO 4 + H 2↑⑵ CaCO 3 + 2HCl CaCl 2 + CO 2↑ + H 2O第十单元 酸和碱⑴ Fe 2O 3 + 6 HCl 2 FeCl 3 + 3 H 2O⑵ Fe 2O 3 + 3 H 2SO 4 Fe 2(SO 4)3 + 3 H 2O⑶ CaO + H 2O Ca(OH)2⑷ 2 NaOH + SO 3 Na 2SO 4 + H 2O⑸ CO 2 + 2 NaOH Na 2CO 3 + 2 H 2O⑹ HCl + NaOH NaCl + H 2O⑺ Ca(OH)2 + 2 HCl CaCl 2 + 2 H 2O⑻ 2 NaOH + H 2SO 4 Na 2SO 4 + 2 H 2O高温 高温 高温 高温⑼ Ca(OH)2 + H 2SO 4 CaSO 4 + 2 H 2O⑽ Mg(OH)2 + 2 HCl MgCl 2 + 2 H 2O⑾ Al(OH)3 + 6 HCl 2 AlCl 3 + 3 H 2O⑿ Fe + H 2SO 4 Fe SO 4 + H 2↑⒀CaCO 3 + 2HCl CaCl 2 + CO 2↑ + H 2O第十一单元 盐 化肥⑴ NaHCO 3 + HCl == NaCl + H 2O + CO 2 ↑⑵ Na 2CO 3 + Ca(OH)2 2 NaOH + CaCO 3↓⑶ K 2CO 3 + Ba(NO 3)2 2 KNO 3 + BaCO 3↓⑷ H 2SO 4 + Ba(NO 3)2 2 HNO 3 + BaSO 4↓⑸ K 2CO 3 + H 2SO 4 K 2SO 4 + H 2O + CO 2 ↑⑹ CaCO 3 + H 2O + CO 2 Ca(HCO 3)2⑺ Ca(HCO 3)2 CaCO 3↓ + H 2O + CO 2 ↑⑻ H 2SO 4 + BaCl 2 2HCl + BaSO 4↓⑼ 2 NH 4Cl + Ca(OH)2 CaCl 2 + 2 NH 3 ↑ + 2 H 2O⑽ (NH 4)2SO 4 + Ca(OH)2 CaSO 4 ↓+ 2 NH 3 ↑ + 2 H 2O⑾ K 2SO 4 + Ca(OH)2 K 2SO 4 + 2 NH 3 ↑ + 2 H 2O⑿ (NH 4)2SO 4 + 2 NaOH Na 2SO 4 + 2 NH 3 ↑ + 2 H 2O⒀ NH 4Cl + NaOH NaCl + NH 3 ↑ + H 2O△⒁NH4NO3 + NaOH NaNO3 + NH3↑ + H2O⒂(NH4)2SO4 + Ba(NO3)2 2 NH4NO3 + BaSO4↓⒃AgNO3 + NH4Cl == NH4NO3+ AgCl↓⒄Na2CO3 + CaCl2CaCO3↓ + 2 NaCl⒅K2CO3 + 2HCl == 2KCl + H2O + CO2 ↑⒆CuSO4 + BaCl2CuCl2 + BaSO4↓⒇HCl + NaOH NaCl + H2O(21) CaCO3 + 2HCl CaCl2 + CO2↑ + H2O(22) NH3 + CO2 + H2O +NaCl NH4Cl + NaHCO3↓第十二单元化学与生活⑴C6H12O6 +6 O26 CO2 + 6 H2O化学方程式分类汇总一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O22CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O35. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧:4P + 5O2 2P2O5酶△7. 硫粉在空气中燃烧: S + O2SO28. 碳在氧气中充分燃烧:C + O2CO29. 碳在氧气中不充分燃烧:2C + O22CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O22CO211. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO32CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ====2KCl + 3O2↑16. 加热高锰酸钾:2KMnO4 === K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3==CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO ===Cu + H2O20.木炭还原氧化铜:C+ 2CuO ===2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 ===3Fe + 2CO2↑高温23.一氧化碳还原氧化铜:CO+ CuO === Cu + CO224.氧化碳还原氧化铁:3CO+ Fe2O3 === 2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 ===3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26.锌和稀硫酸: Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸: Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸: Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸: 2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸: Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸: Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸: Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸: 2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐(置换反应)34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水(复分解反应)37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水(非复分解反应)43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水(复分解反应)48. 盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50. 盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54. 硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55. 硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56. 硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐(复分解反应)59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(7)碱 + 盐 -----另一种碱 + 另一种盐(复分解反应,且两种反应物均可溶)65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 新盐1+新盐2(复分解反应,且两种反应物均可溶)70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O ==== CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O1、默写1—18号元素的符号和名称:(P59)符号:名称:2、默写常见元素的化合价:+1K、Na、Ag、H ;+2Ca、Mg、Ba、Zn、Hg ;+3 Al ;+4 Si ;+1、+2 Cu ;+2、+3 Fe ;+2、+4 C ;+4、+6 S ;-1 F、Cl ;-2 O、S ;-3 N、P 。
初中化学常见方程式

初中化学常见方程式
1. 燃烧反应方程式:
- 碳与氧气燃烧: C + O2 → CO2
- 氢气与氧气燃烧: 2H2 + O2 → 2H2O
2. 氧化还原反应方程式:
- 铁生锈: 4Fe + 3O2 → 2Fe2O3
- 铜生绿锈: 2Cu + O2 + 2H2O → 2Cu(OH)2
3. 酸碱中和反应方程式:
- 盐酸与氢氧化钠: HCl + NaOH → NaCl + H2O
- 硫酸与氢氧化钙: H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
4. 置换反应方程式:
- 铁与铜sulfate溶液: Fe + CuSO4 → FeSO4 + Cu
- 锌与盐酸: Zn + 2HCl → ZnCl2 + H2
5. 分解反应方程式:
- 电解水: 2H2O → 2H2 + O2
- 加热碳酸钙: CaCO3 → CaO + CO2
6. 合成反应方程式:
- 氢气与氧气合成水: 2H2 + O2 → 2H2O
- 碳与氧气合成二氧化碳: C + O2 → CO2
这些是初中化学课程中常见的一些化学反应方程式,包括燃烧、氧化还原、酸碱中和、置换、分解和合成等反应类型。
掌握这些基本方程式有助于学生理解化学变化过程。
