发酵过程优化讲义与控制
发酵过程优化与控制技术研究课件

利用代谢通量分析方法,计算得
出胞内各条代谢途径的通量变化。
发酵过程优化与控制技术研究
目的
分析不同发酵产品合成途径中主要代谢节点的性质, 结合发酵过程中胞内能量代谢情况,提出一系列发酵 优化策略。
发酵过程优化与控制技术研究
发酵优 5 基于环境胁迫条件下微生物生理应答的过程 化技术 优化技术
环境压力或胁迫 饥饿、高温、高压、机械剪切、冷冻、强酸、强碱、
如何提高丙酮酸发酵的转化率和生产强度?--分阶段溶氧控制
动力学分析
0.8
0.6
1
2
m / h-1
0.4
3
D
高溶氧下,丙酮酸转
0.2
-1
化率较高,但生产强
度(0葡萄糖消耗速度)较
低2.0
qs / h-1
低1溶.6 氧下,3 葡t 萄糖消 耗酮01速酸..82 度产加率快却21 ,明然显而下丙降E
0.4
vo lu m e
O2 analyzer
C ell conc.
CO2 analyzer
CO2 pressure
pH
pH
m eter
Thermom eter
Te m p .
DO sensor
DO conc.
C ell sensor
C ell conc.
Control signal
Interface
相关:微生物反应动力学和系统优化 发酵过程优化与控制技术研究
•u = umax s/(Km + s + s2/Ki) •Y x/s = Y0
•u = umax s (1 -– T. s)/(K m + s + s2/Ki) •Y x/s = Y0 (1 -– T. s)/(1 + R. s + G. s2)
发酵优化与控制
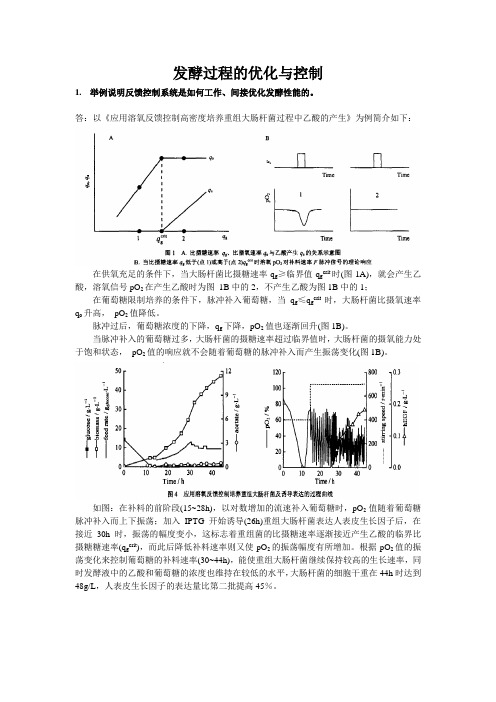
发酵过程的优化与控制1.举例说明反馈控制系统是如何工作、间接优化发酵性能的。
答:以《应用溶氧反馈控制高密度培养重组大肠杆菌过程中乙酸的产生》为例简介如下:在供氧充足的条件下,当大肠杆菌比摄糖速率q g≥临界值q g crit时(图1A),就会产生乙酸,溶氧信号pO2在产生乙酸时为图1B中的2,不产生乙酸为图1B中的1;在葡萄糖限制培养的条件下,脉冲补入葡萄糖,当q g≤q g crit时,大肠杆菌比摄氧速率q o升高,pO2值降低。
脉冲过后,葡萄糖浓度的下降,q g下降,pO2值也逐渐回升(图1B)。
当脉冲补入的葡萄糖过多,大肠杆菌的摄糖速率超过临界值时,大肠杆菌的摄氧能力处于饱和状态,pO2值的响应就不会随着葡萄糖的脉冲补入而产生振荡变化(图1B)。
如图:在补料的前阶段(15~28h),以对数增加的流速补入葡萄糖时,pO2值随着葡萄糖脉冲补入而上下振荡;加入IPTG开始诱导(26h)重组大肠杆菌表达人表皮生长因子后,在接近30h时,振荡的幅度变小,这标志着重组菌的比摄糖速率逐渐接近产生乙酸的临界比摄糖糖速率(q g crit),而此后降低补料速率则又使pO2的振荡幅度有所增加。
根据pO2值的振荡变化来控制葡萄糖的补料速率(30~44h),能使重组大肠杆菌继续保持较高的生长速率,同时发酵液中的乙酸和葡萄糖的浓度也维持在较低的水平,大肠杆菌的细胞干重在44h时达到48g/L,人表皮生长因子的表达量比第二批提高45%。
2、实现发酵过程优化的目标有哪些?如何根据发酵过程的特点实现这些目标的相对统一?举一例进行表述。
答:⑴实现发酵过程优化的目标:使细胞生理调节、细胞环境、反应器特性、工艺操作条件与反应器控制之间这种复杂的相互作用尽可能的简化,并对这些条件和相互关系进行优化,使之最适于特定发酵过程的进行,以达到高产量(提高设备利用率;降低产品提取费用),高转化率(降低原料成本;减少环境污染),高生产强度(缩短生产周期;降低设备投资)的目的。
发酵过程优化与控制

菌种突变:
工业用菌株通常是经过改造的菌株,回复突变的倾向性很大, 发酵时不够稳定。如果突变的结果使细胞获得高速生长能力,但 失去生长能力,则最终低产突变株将取代高产突变株。 连续培养时间越长,形成的突变株数目越多,发酵过程失败 的可能性越大。 解决方案:建立一种不利于低产突变株的选择性生产条件。 如,L-苏氨酸产生菌:多重遗传缺陷的异亮氨酸渗漏高产菌 株,可使补入的培养基中不含异亮氨酸。
溶氧的控制:搅拌、通气、加糖或补料速率 (粘度)、发酵温度等 工业上,在关键时刻,采用富氧气体以改善供 氧状况。
加糖、补料对发酵的影响
补料: 消除底物抑制; 防止细胞生长过旺造成供氧不足。 补料方式: 一次性大量;多次少量; 连续流加(快速、恒速、 指数和变速流加) 补料的时机: 菌的形态、DO浓度、尾气中的O2和CO2含量; 残糖浓度(对于次级代谢产物,还原糖浓度一般控 制在5g/L); 产物形成(现代酵母发酵借助自动测量尾气中的微 量乙醇控制糖蜜的流加)
产酶的影响更大。
种子质量
发酵期间生产菌种生长的快慢和产物合成的多
寡在很大程度上取决于种子的质量。 (1)种龄 (2)接种量5-10%
温度
温度对产物合成的影响: 温度高,生长速率快,生产期提前,但菌体容易衰 老,影响产量; 温度亦影响生物合成方向:金色链霉菌低于30C时 主要合成金霉素,而35C下只产生四环素。 分阶段控温
泡沫对发酵的影响
泡沫的副作用: 降低了发酵罐的装料系数 增加了菌群的非专一性 增加了染菌的几率 引起“逃液”,产物流失 消泡剂的加入有时会影响发酵或给提炼工序带来麻烦。
染菌的防治
染菌的途径
种子包括进罐前菌种室出现问题 培养基配制和灭菌不彻底 空气除菌不彻底 设备过程操作疏漏
发酵过程优化与控(第四章、赖氨酸发酵过程优化)课件

一、发酵法生产赖氨酸技术的发展 1、赖氨酸的生产方法 水解法(已淘汰)、合成法、酶法和直接发酵法。 合成法:以己内酰胺、二氢吡喃、环己酮、呱啶为原料合 成L-赖氨酸已有报道,但还没有大规模的生产报道,主要是合 成法制成的中间体DL-赖氨酸进一步的分离工艺很复杂。 酶法(3种):①合成ε-苯甲酰-α-乙酰-DL-赖氨酸,采用消 旋酶处理制成ε-苯甲酰-L-赖氨酸,经酸水解得产品;②合成 DL-4-氨基丁基乙内酰脲,采用微生物酶使其转变为L-赖氨酸; ③由环己烯合成DL-氨基己内酰胺,采用水解酶和消旋酶共同作 用使其变成L-赖氨酸。
赖氨酸分支途径的其它酶,如第一个专一性酶——二氢吡 啶二羧酸合成酶,末端产物如赖氨酸或其它氨基酸单独或组合 对该酶无抑制作用,且该酶也不受赖氨酸的反馈阻遏。
④赖氨酸亮氨酸的生物合成之间存在着代谢互锁,赖氨酸 分支途径的初始酶二氢吡啶二羧酸合成酶为亮氨酸所阻遏。
⑤蛋氨酸比苏氨酸优先合成,蛋氨酸合成的过剩就会阻遏 高丝氨酸-O-转乙酰酶,使得生物合成的代谢流转向苏氨酸。 苏氨酸比赖氨酸优先合成,苏氨酸的过剩会反馈抑制高丝氨酸 脱羧酶的活性,使得生物合成转向赖氨酸。
70年代后期,上海、黑龙江、广西和江苏等地积极开 展赖氨酸菌种筛选工作。如上海天厨味精厂得到AECr和 高丝氨酸缺陷双突变株,产酸36~37g/L;中科院微生物所 和常州味精厂合作筛选得到产酸48~53g/L的钝齿棒杆菌, 通过发酵中试技术鉴定。上海工业微生物研究所从黄色短 杆菌2030出发经诱变筛选得到抗性和营养缺陷型双突变株, 其中的FH-128菌株在16L小罐发酵70h产酸130g/L以上, 5m3罐中试发酵65~69h,产酸92.2~95g/L,转化率为 40.2%左右,达到国际先进水平,但至今未有工业化报道。
发酵过程优化与控控制

为了便于讨论,本课程对底物、 为了便于讨论,本课程对底物、代谢产物和细胞 质成分规定如下: 质成分规定如下: 底物:一种存在于初始非生物相或者摄入物中起 底物: 作用的可交换的化合物; 作用的可交换的化合物; 代谢产物: 代谢产物:是一种作为代谢物产生于某代谢途径 进入非生物相的化合物; 进入非生物相的化合物; 细胞质成分: 细胞质成分:是一种细胞利用底物产生的不可交 换的化合物。 换的化合物。 下面分别讨论运输过程( 下面分别讨论运输过程(底物的摄入和产物的分 泌)和胞内反应过程。 和胞内反应过程。
1、自由扩散 、 底物以自由扩散方式通过脂膜包括3个步骤:①底物从胞 底物以自由扩散方式通过脂膜包括 个步骤: 个步骤 外培养基运输到脂膜; 分子在脂膜中扩散; 外培养基运输到脂膜;②分子在脂膜中扩散;③从脂膜进入细 胞质。 胞质。 一般情况下,脂膜具有和胞外基质相似的物化性质, 一般情况下,脂膜具有和胞外基质相似的物化性质,因 此步骤① 此步骤①和③相似。脂膜层内的传递过程可认为处于平衡,即 相似。脂膜层内的传递过程可认为处于平衡, 这些过程的特征时间比分子扩散通过脂膜层的特征时间短得多。 这些过程的特征时间比分子扩散通过脂膜层的特征时间短得多。 界面上脂膜层物质的浓度一般指水相中底物的浓度, 界面上脂膜层物质的浓度一般指水相中底物的浓度,分 配系数K 配系数 par就是化合物在脂膜层的溶解速率和在水中溶解速率 的比值。分子扩散的质量通量遵守 第一定律, 的比值。分子扩散的质量通量遵守Fick第一定律,化合物通过 第一定律 厚度为d 的脂膜进入细胞的传质速率可用方程表示为: 厚度为 mem的脂膜进入细胞的传质速率可用方程表示为:
如果定义a 为细胞的比表面积(干细胞, ),那么化 如果定义 cell为细胞的比表面积(干细胞,m2/g),那么化 ), 合物的比运输速率为: 合物的比运输速率为: r=J. acell= P. acell(ca-cb) (2-3) ) 对于直径为d 的球形细胞来说,含水率为w(g/g),细胞密 对于直径为 cell的球形细胞来说,含水率为 , 度为ρ(g/m3),则比表面积为: 度为 ,则比表面积为: acell= 6/[dcell(1-w)ρcell] 通过自由扩散进行运输的化学物质主要有氧气、二氧化碳、 通过自由扩散进行运输的化学物质主要有氧气、二氧化碳、 有机酸和乙醇等。 水、有机酸和乙醇等。 在电离状态下,小分子有机酸在脂膜中实际上是不溶的, 在电离状态下,小分子有机酸在脂膜中实际上是不溶的, 非电离有机酸的浓度来代替式 此时应当用膜两边的非电离有机酸的浓度来代替式( ) 此时应当用膜两边的非电离有机酸的浓度来代替式(2-1)中的 总浓度c 这些浓度可以通过式( )计算得到。 总浓度 a和cb,这些浓度可以通过式(2-4)计算得到。
发酵过程控制与优化ppt课件

产菌而不利于杂菌的生长,如降低发酵温度等。加人某些 抑制杂菌的化合物也不失为一种急办法,条件是这种化合 物对生产菌无害对生产影响不大和在下游精制阶段能被完 全去除。中后期染菌除非是噬菌体,通常后果不会那么严 重,这时发酵液中己产生一定浓度的抗生素,对杂菌已有 一定抑制作用。实际生产中常采用大接种量的原因之一是 即使不慎污染了极少量杂菌,生产菌也能很快占优势。
• 补料-分批发酵:是在
分批发酵过程中补入 新鲜料液,以克服由 于养分的不足,导致 发酵过早结束。
• 半连续发酵:在补料-
分批发酵的基础上加 上间歇放掉部分发酵 液便可称为半连续发 酵。
• 连续发酵: 是指发酵
过程中一面补入新鲜 的料液,一面以相同 的流速放料,维持发 酵液原来的体积。
5.2发酵条件的影响及其控制
生产方法
• 胰岛素的生产方法主要有两种,一种是从
动物脏器中生化提取的动物胰岛素,如猪 胰岛素、牛胰岛素等,动物脏器中生化提 取产量低、成本高(100公斤动物胰腺只 能提取4-5克胰岛素,一个病人所需胰岛 素要从40头牛或50头猪的胰腺中提取)、 纯度低,疗效差;一种是通过基因工程手 段的人胰岛素,基因重组人胰岛素纯度高、 疗效好.
5.4.发酵终点的判断与自溶的监测
• 5.4.1发酵终点的判断 • 发酵类型的不同,要求达到的目标也不同,因而
对发酵终点的判断标准也应有所不同。
• 判断放罐的指标主要有产物浓度、过滤速度、菌
丝形态、氨基氮、pH、DO、发酵液的粘度和外 观等。
• 对抗生素发酵,老品种抗生素发酵放罐时间一般
都按作业计划进行。但在发酵异常情况下,放罐 时间就需当机立断,以免倒罐。新品种发酵更需 探索合理的放罐时间。
发酵过程控制与优化

可编辑ppt
26
大型发酵罐 搅拌装置
可编辑ppt
27
温度传感器、耐高温pH和溶氧(DO)传感 器
可编辑ppt
28
第五节 泡沫的形成与控制
一、泡沫产生的原因
1.通风搅拌程度及菌体新陈代谢产生的CO2。 2.培养基性质
可编辑ppt
29
二、泡沫的危害
1.降低生产能力(装料系数减少)
(2)氮代谢 氨基酸中的-NH2被利用,pH下降; 尿素被分解成NH3,pH上升。
(3)生理酸碱性物质利用后,pH上升或下降。
2.产物形成 3.菌体自溶 影响
1.影响酶的活性。 2.影响微生物细胞的结构。 3.影响微生物对基质的利用速率。 4.影响代谢方向。
1.概念:根据菌体生长和初始培养基的特点,在 分批培养的某些阶段适当补加培养基,使菌体或 其代谢产物的生产时间延长。
可编辑ppt
9
2.补料分批培养的优缺点 优点: 与分批培养相比
(1)解除底物抑制和葡萄糖的分解阻遏效应。 (2)延长次级代谢产物的生产时间。
可编辑ppt
10
与连续培养相比 (1)降低了染菌,避免了遗传不稳定性。 (2)最终产物浓度较高,有利于产物的分离。 (3)使用范围广。
如:味精厂普遍采用流加尿素,有两个作用: • 调节pH值 • 补充氮源
可编辑ppt
23
第四节 溶解氧及其控制
一、溶解氧(dissolved oxygen,DO)对发酵的影响 溶氧要适量,大小与产物的生物合成途径有关。
(1)最适氧浓度(optimal oxygen concentration): ——菌体生长或产物合成最适浓度范围。
葡萄糖、氨水、苯乙酸
2013年发酵工程实验讲义
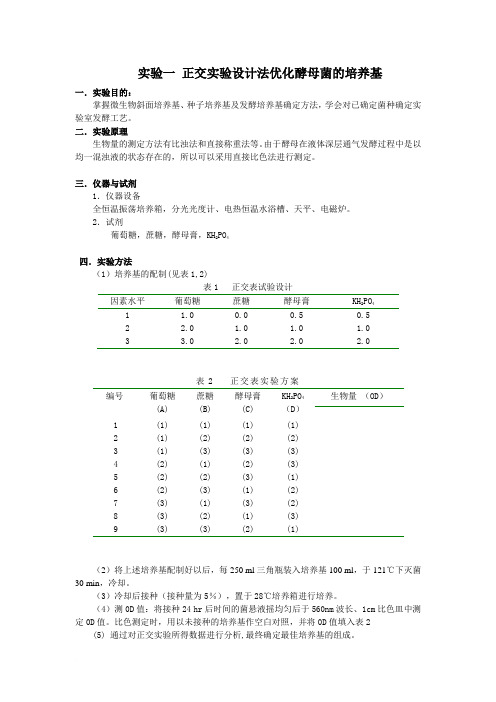
实验一正交实验设计法优化酵母菌的培养基一.实验目的:掌握微生物斜面培养基、种子培养基及发酵培养基确定方法,学会对已确定菌种确定实验室发酵工艺。
二.实验原理生物量的测定方法有比浊法和直接称重法等。
由于酵母在液体深层通气发酵过程中是以均一混浊液的状态存在的,所以可以采用直接比色法进行测定。
三.仪器与试剂1.仪器设备全恒温振荡培养箱,分光光度计、电热恒温水浴槽、天平、电磁炉。
2.试剂葡萄糖,蔗糖,酵母膏,KH2PO4四.实验方法(1)培养基的配制(见表1,2)表1 正交表试验设计因素水平葡萄糖蔗糖酵母膏KH2PO41 1.0 0.0 0.5 0.52 2.0 1.0 1.0 1.03 3.0 2.0 2.0 2.0表2 正交表实验方案编号葡萄糖(A) 蔗糖(B)酵母膏(C)KH2PO4(D)生物量(OD)1 (1) (1) (1) (1)2 (1) (2) (2) (2)3 (1) (3) (3) (3)4 (2) (1) (2) (3)5 (2) (2) (3) (1)6 (2) (3) (1) (2)7 (3) (1) (3) (2)8 (3) (2) (1) (3)9 (3) (3) (2) (1)(2)将上述培养基配制好以后,每250 ml三角瓶装入培养基100 ml,于121℃下灭菌30 min,冷却。
(3)冷却后接种(接种量为5%),置于28℃培养箱进行培养。
(4)测0D值:将接种24 hr后时间的菌悬液摇均匀后于560nm波长、1cm比色皿中测定0D值。
比色测定时,用以未接种的培养基作空白对照,并将0D值填入表2(5) 通过对正交实验所得数据进行分析,最终确定最佳培养基的组成。
五.思考题(1)比浊计数在生产实践中有何应用价值?(2)本实验为什么采用560nm波长测定酵母菌悬液的光密度?如果你在实验中需要测定大肠杆菌生长的0D值,你将如何选择波长?实验二淀粉酶的固态发酵实验一.实验目的了解和掌握微生物在发酵过程中淀粉酶活力、还原糖和蛋白质浓度的时间变化曲线和测定方法。
