蕲春一中2009秋高一化学寒假作业(一)
蕲春一中2009秋高一化学寒假作业(一)

蕲春一中2009秋高一化学寒假作业(一)蕲春一中2009秋高一化学寒假作业(一)试卷内容:从实验学化学命题人:余亚裕一、选择题(16×3分18分,每题只有一个最佳选项符合题意。
)1、有下列实验操作:①把鼻孔凑到容器口去闻药品的气味②将取液后的滴管平放在实验台上③将浓硫酸倒入盛有水的量筒中使其溶解④托盘天平称量时左盘放称量物,右盘放砝码⑤向燃着的酒精灯里添加酒精⑥给试管中的液体加热,试管口对着自己正确的为()A、全部B、④C、①②③⑤⑥D、③④2、按下列添加试剂的先后顺序,即可将盐酸、硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色透明溶液鉴别开来的是()A、石蕊试液、AgNO3溶液、稀HNO3B、BaCl2溶液、酚酞试液、AgNO3溶液C、石蕊试液、BaCl2溶液D、酚酞试液、BaCl2溶液、AgNO3溶液3、对于某些离子的检验及结论一定正确的是()A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO23-B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO2-4C、加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+D、加入Na2CO3溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+4、安全生活离不开化学,下列说法错误的是( )A、工业酒精中含有甲醇等有毒物质,不能饮用B、工业用盐亚硝酸钠对人体有害,不能用于烹调C、进入久未开启的菜窑、干涸的深井和深洞前,要做灯火试验D、发现煤气泄漏,应立即打开排气扇排气5、下列溶液中的Cl-浓度与50mL1mol·L-1的AlCl3溶液中Cl-的浓度相等的是()A、150mL1mol·L-1的NaClB、75mL2mol·L-1的NH4ClC、150mL2mol·L-1的KClD、75mL1.5mol·L -1的CaCl26、遇到下列情况,采用的措施正确的是()A、浓硫酸不慎滴在手上,立即用大量的碱液冲洗B、酒精灯不慎打翻起火,立即用水浇灭C、炒菜时油锅着火,立即盖上锅盖D、发现家中天然气泄漏,立即打开抽油烟机7、有下列实验操作:①过滤;②蒸发;③溶解;④取液体试剂;⑤取固体试剂。
(word完整版)高一化学必修一上学期寒假作业及答案
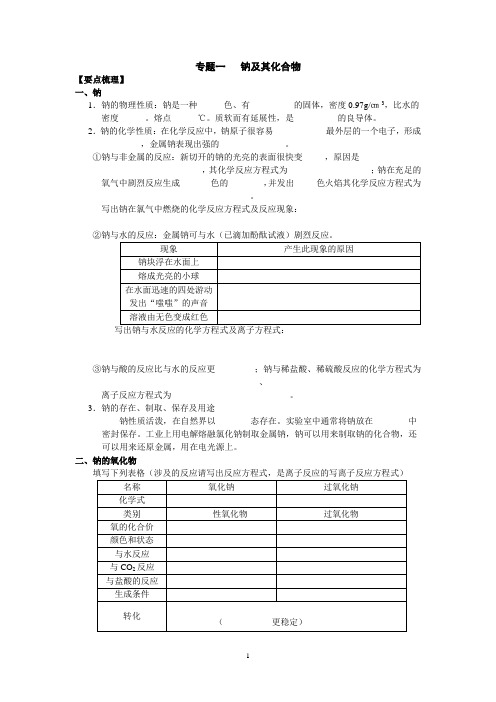
专题一钠及其化合物【要点梳理】一、钠1.钠的物理性质:钠是一种______色、有__________的固体,密度0.97g/㎝3,比水的密度______。
熔点______℃。
质软而有延展性,是__________的良导体。
2.钠的化学性质:在化学反应中,钠原子很容易____________最外层的一个电子,形成_________,金属钠表现出强的_______________。
①钠与非金属的反应:新切开的钠的光亮的表面很快变_____,原因是____________________________________,其化学反应方程式为___________________;钠在充足的氧气中剧烈反应生成_______色的________,并发出____ 色火焰其化学反应方程式为__________________________________。
写出钠在氯气中燃烧的化学反应方程式及反应现象:___________________________ ________________________________②钠与水的反应:金属钠可与水(已滴加酚酞试液)剧烈反应。
写出钠与水反应的化学方程式及离子方程式:③钠与酸的反应比与水的反应更_________;钠与稀盐酸、稀硫酸反应的化学方程式为____________________________________、____________________________________离子反应方程式为___________________________。
3.钠的存在、制取、保存及用途钠性质活泼,在自然界以________态存在。
实验室中通常将钠放在________中密封保存。
工业上用电解熔融氯化钠制取金属钠,钠可以用来制取钠的化合物,还可以用来还原金属,用在电光源上。
二、钠的氧化物填写下列表格(涉及的反应请写出反应方程式,是离子反应的写离子反应方程式)1、物理性质:氢氧化钠俗名________、_________、________,是一种_____色固体,易吸收空气中的水分而________,___溶于水并放热,水溶液有涩味,有强________性。
人教版高中化学必修一高一化学寒假作业1.docx

高中化学学习材料(灿若寒星**整理制作)高一化学寒假作业1(满分:100分)可能用到的相对原子质量: Na:23 Mg:24 Al:27 K:39 Zn:65 O:16 Cu:64C:12 Cl:35.5 Mn:55 Fe:56 H:1 S:32一、选择题(共30小题,每小题2分,共60分。
每小题只有一个选项符合题意)1、下列各组物质,按化合物、单质、混合物顺序排列的是()A、烧碱、液态氧、碘酒B、生石灰、白磷、熟石灰C、干冰、铁、氯化氢D、空气、氮气、胆矾2.下列仪器:①容量瓶②蒸镏烧瓶③漏斗④燃烧匙⑤天平⑥分液漏斗⑦胶头滴管,常用于物质分离的是()A.①③⑤ B.②④⑦ C.①②⑥ D.②③⑥3.下列化学反应的离子方程式,书写不正确...的是A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO42-= BaSO4↓+2H2O B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO2C.氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl—D.向碳酸钙固体中加入稀盐酸:CaCO3+2H+=Ca2+ +CO2↑+H2O4.下列叙述正确的是 ( ) A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32gD.标准状况下,1 mol任何物质体积均为22.4L5.下列说法或做法正确的是()A CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性弱于碳酸B 金属钠着火燃烧时,用泡沫灭火器灭火C 铝比铁活泼,所以铝比铁更容易被腐蚀D 正常雨水PH 等于7,酸雨的PH 小于76、在强酸性溶液中能大量共存,且溶液为无色透明的离子组( )A 、K +、Fe 2+、AlO 2-、NO 3-B 、NH 4+、Al 3+、NO 3-、SO 42-C 、K +、NH 4+、CO 32-、S 2-D 、Cu 2+、Ag +、NO 3-、CI -7.用N A 表示阿伏德罗常数,下列叙述正确的是( )A .标准状况下,22.4L H 2O 含有的分子数为 N AB .常温常压下,1.06g Na 2CO 3含有的Na +离子数为0.02 N AC .通常状况下,N A 个CO 2分子占有的体积为22.4LD .物质的量浓度为0.5 mol/L 的MgCl 2溶液中,含有Cl - 个数为N A8.下列物质的水溶液能导电,但属于非电解质的是 ( )A.HClO B .Cl 2 C .NaHCO 3 D .CO 29.用特殊方法把固体物质加工到纳米级(1nm-100nm )的超细粉末粒子,然后制得纳米材料。
高一化学寒假作业试卷(有答案)

高一化学寒假作业试卷(有答案)世界由物质组成,化学那么是人类用以看法和改造物质世界的主要方法和手腕之一。
小编预备了高一化学暑假作业试卷,详细请看以下内容。
本试卷分两局部,共4页,总分值100分,考试用时90分钟。
本卷须知:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卡上。
2.选择题每题选出答案后,用2B铅笔把答题卡上对应标题的答案标号涂黑;如需改动,用橡皮擦洁净后,再选涂其它答案;不能答在试卷上。
3.非选择题必需用黑色字迹的钢笔或签字笔作答,答案必需写在另发的答题卷各标题指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准运用铅笔和涂改液.不按以上要求作答的答案有效。
4.考生必需坚持答题卡的整洁。
能够用到的相对原子质量:H-1 O-16 C-12 Al-27 Cu-64 Fe-56 S-32 Na-23第一卷(32分)一、单项选择题(每题4分,共32分)1.以下各组混合物中,能用分液漏斗停止分别的是A.酒精和水B.碘和四氯化碳C.水和四氯化碳D.汽油和植物油2.以下说法中,正确的选项是( )A.CO2的摩尔质量是44 gB.18 g H2O在规范状况下的体积是22.4 LC.在规范状况下,20 mL NH3 与60 mL O2所含的分子数比为1:3。
D.将40 g NaOH溶于1 L水中,所得溶液的物质的量浓度为1 mol/L3.以下物质中,与盐酸、氢氧化钠溶液均能反响,且都生成氢气的是A.Al2O3B.Al(OH)3C.AlD.(NH4)2CO34.称取两份铝粉,第一份中参与足量的盐酸,第二份中参与足量的烧碱,假定同温同压下放出相反体积的气体,那么两份铝粉的质量比为A.2:3B.1:6C.3:2D.1:15.以下反响的产物中,一定不含有+ 2价铁元素的是A.铁与盐酸B.铁与氯气C.铁与氯化铁溶液D.铁与硝酸6.以下关于硅元素的说法,不正确的选项是:A.光导纤维的主要成分是二氧化硅B.二氧化硅可以和水直接反响来制取硅酸C.硅可用作太阳能电池D.硅酸钠是制备硅胶和木材防火剂等的原料7.以下离子方程式书写正确的选项是A.向稀氯化铵稀溶液中参与稀烧碱溶液NH4+ + OH-=NH3+ H2OB.氨水和硫酸反响 H+ + OH-=H2OC.钠和水反响 Na+ 2H2O= Na+ + 2OH-+ H2D.氯气与烧碱溶液反响 Cl2+ 2OH-=Cl-+ ClO-+ H2O8.以下有关实验的描画中,正确的选项是①钠放入水中后,沉在水下渐渐冒出气体②Na2CO3和NaHCO3的溶液都可以使无色酚酞试液变红③氢气在氧气或氯气中熄灭,都能观察到淡蓝色火焰④将某气体通入品红溶液中,白色褪去,说明该气体一定是SO2⑤向某溶液中参与烧碱溶液,加热后生成使湿润红石蕊试纸变蓝的气体,说明原溶液中有NH4+。
【高一】上学期高一化学寒假作业试题

【高一】?上学期高一化学寒假作业试题世界由物质组成,化学则是人类用以认识和改造物质世界的主要方法和手段之一。
化学网为大家推荐了上学期高一化学寒假作业试题,请大家仔细阅读,希望你喜欢。
可能用到的相对原子质量:C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Ba:137Ⅰ卷(58分)一、单项选择题(每小题只有一个选项符合题意,每小题2分,共40分)1.节能减排,保护环境已经深入人心,下列举措与这一主题不吻合的是( )A.用绿色化学工艺,使原料完全转化为产物B.推广燃煤脱硫技术,防治SO2污染C.推广垃圾的分类存放、回收、处理D.大量使用农药化肥提高粮食产量2.下列各组物质分类正确的是( )酸碱盐氧化物A硫酸纯碱硅酸钠铁红B氢硫酸烧碱纯碱生石灰C碳酸石膏小苏打二氧化硫D二氧化碳苛性钠食盐石灰石3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A.标准状况下,22.4LH2O含有的分子数为NAB.常温常压下,1.06g Na2CO3含有的Na+数为0.02NAC.通常状况下,NA个CO2分子占有的体积为22.4LD.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-数为NA4.下列实验能达到实验目的且符合安全要求的是( )编号实验操作A钠与水反应用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中。
B制备并检验氢气的可燃性锌粒与稀硫酸反应产生气体,立即点燃。
C用浓硫酸配制稀硫酸把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃棒不断搅拌。
D一氧化碳还原氧化铜用石灰水检验气体产物,实验结束时先从水槽中取出导管,再熄灭酒精灯。
5.配制一定体积、一定物质的量浓度溶液时,下列操作会使所配溶液浓度偏小的是( )A.容量瓶中原有少量蒸馏水B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯C.定容时俯视观察液面D.胶头滴管加水时,有少量水滴到容量瓶外6.实验室保存下列试剂方法错误的是( )A.过氧化钠密封保存在广口瓶中B.氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中C.少量的钠保存在煤油中D.氯水保存在棕色试剂瓶中,并贮放在阴暗处7.氢氧化铁胶体稳定存在的主要原因是( )A.胶粒直径小于1nmB.胶粒作布朗运动C.胶粒带正电荷D.胶粒不受重力作用8.下列离子在溶液中能大量共存的是( )A.Na+、CO32-、SO42-、H+B.K+、AlO2-、H+、Cl-C.Fe2+、K+、H+、NO3-D.Al3+、H+、NO3-、SO42-9.区别二氧化硫和二氧化碳气体的最佳方法是( )A.通入澄清的石灰水B.用湿润的蓝色石蕊试纸C.通入品红溶液D.通入CaCl2溶液10.氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )A.KSCNB.BaCl2C.NaOHD.HCl11.检验干燥氯化氢气体中是否混有氯气可采用的方法是( )A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸12.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )A.烧碱B.硫酸氢钠C.氢氧化钡D.过氧化钠13.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )①NaHCO3 ②Al2O3 ③Al(OH)3 ④AlA.③④B.②③④C.①③④D.全部14.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )A.锌粉B.镁粉C.铁粉D. 铝粉15.将等物质的量的SO2和Cl2混合后通入含有品红和Ba(NO3)2的混合溶液里,产生的现象是( )①溶液很快褪色②溶液不褪色③有沉淀生成④溶液仍然澄清A.仅①和④B.仅①和③C.仅②和③D.仅②和④16.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。
高一化学寒假作业含答案(DOC)

高一化学寒假作业含答案、选择题1、下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()①过滤②蒸发③溶解④向容量瓶转移液体A .①和②B .①和③C.③和④ D .①和④2、实验中的下列操作正确的是()A .用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中B . Ba(NO 3)2溶于水,可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道C.用蒸发方法使NaCI从溶液中析出时,应将蒸发皿中NaCI溶液全部蒸干才停止加热。
D •用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中3、下列事故处理方法正确的是()A. 汽油失火时,立即用水灭火B. 电线短路失火时,要用泡沫灭火器灭火C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液D. 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤4、萃取碘水中的碘,可用的萃取剂是()①四氯化碳②汽油③酒精A. 只有①B.①和②C.①和③D.①②③5、从碘的四氯化碳溶液中分离出碘、并回收四氯化碳,所采用的方法是()A. 蒸发B.蒸馏C.过滤D.分液6、在蒸馏实验中,下列叙述不正确的是()1A. 在蒸馏烧瓶中盛约133 体积的自来水,并放入几粒沸石B. 将温度计水银球插入自来水中C. 冷水从冷凝管下口入,上口出D. 收集蒸馏水时,应弃去开始馏出的部分7 .下列化合物与小苏打溶液反应,没有气体或沉淀生成的是()A •烧碱B •硫酸氢钠C.氢氧化钡 D •过氧化钠8、用托盘天平称取10.1g NaOH试样,下列操作中,正确的是()A. 将NaOH放在天平左边托盘中的纸片上B. 将NaOH放入烧杯中(烧杯事先已称重),并放在天平右边托盘上C. 用镊子取出标定为10.1g的砝码放在天平右边的托盘上D. 用镊子取出标定为10g的砝码放在天平右边的托盘上,并将游码向右移到0.1g位置上9、某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中()A. 一定有SO42-B.可能有SO42-或Ag +C. 一定无Ag+D.还可能有CO3?10、下列叙述正确的是()A. 1 mol CO 2 的质量为44g/molB. CO 2的摩尔质量为44gC. CO 2的摩尔质量等于CO2的相对分子质量D. N A个CO2的质量与CO2的相对分子质量在数值上相同2311、已知1.505 X 10个X气体分子的质量为8g,则X气体的摩尔质量是()A . 16g B. 32g C. 64g /mol D. 32g /mol12、科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是()A .原子数B .分子数C.体积D .物质的量13、欲配制100ml 1.0 mol/L W2SO4溶液,正确的方法是()①将14.2 g Na2SO4溶于100ml水中② 将32.2g Na2SO4 • IOH2O溶于少量水中,再用水稀释至100 ml③ 将20 ml 5.0 mol/L Na 2SO4溶液用水稀释至100 mlA .①② B.②③ C.①③ D .①②③14、用N A表示阿伏加德罗常数,下列叙述正确的是()A. 64g SO 2含有氧原子数为1N AB. 物质的量浓度为0.5mol/L Mg Cl 2溶液,含有Cl-离子数为1N AC. 标准状况下,22..4L H2O的分子数为1N AD. 常温常压下,14g N2含有分子数为0.5N A二、非选择题15、(1)有两瓶C Cl4和水都是无色液体,只用试管,不用任何其它试剂,如何鉴别?简要写出实验方案_______________________________________________________ ;(2)有一小块外表不规则且质地坚实的碳酸钙,设计一个实验方案用以测定这种碳酸钙的密度,提供的仪器有:托盘天平,100ml量筒,要用到的试剂可任意取用_______________________16、用18mol/L浓硫酸配制90ml 3.0mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀回答下列问题:(1)所需浓硫酸的体积是___________________ ,量取浓硫酸所用的量筒的规格是____________(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml)(2)第③步实验的操作是____________________________________________________________________________ (3)第⑤步实验的操作是____________________________________________________________________________ (4 )下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)A. 所用的浓硫酸长时间放置在密封不好的容器中____________________B. 容量瓶用蒸馏洗涤后残留有少量的水___________________C. 所用过的烧杯、玻璃棒未洗涤____________________D. 定容时俯视溶液的液凹面________________________17. 计算题取1.43g Na2CO3 • XH2O溶于水配成10ml溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0ml,并收集到112ml CO2(标况)。
高一化学寒假作业试题(一)高一全册化学试题

象对市爱好阳光实验学校高一年级化学寒假作业(1)作业范围:必修一第一章<从学化学>一、选择题1.以下是一些常用的危险品标志,装运乙醇的包装箱贴的图标是( )A B C D2.以下仪器可以直接加热的是( )A.烧杯B.烧瓶C.锥形瓶D.试管3.以下操作错误的选项是( )A.蒸馏时,使温度计水银球靠近蒸馏烧瓶支管口B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出C.用酒精萃取碘水中的碘D.配制浓H2SO4和浓HNO3的混酸时,将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却4.以下根据操作和现象所得出的结论正确的选项是〔〕5.用以下装置进行相,能到达目的的是〔〕A.用图1所示装置除去Cl2中含有的少量HClB.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体C.用图3所示装置制取少量纯洁的CO2气体D.用图4所示装置别离CCl4萃取碘水后已分层的有机层和水层6.以下或操作,现象与结论都正确,且二者有因果关系的是( )选项操作现象结论A在溶液中参加少量制氯水,再滴几滴KSCN溶液溶液变红原溶液中一含有Fe2+B 将外表打磨过的铝丝置于浓硝酸中无现象铝与浓硝酸不反C将鲜艳的红玫瑰置于盛有氯气的集气瓶中玫瑰花褪色氯气有漂白性D用洁净的铁丝蘸取某溶液进行焰色反,并透过蓝色钴玻璃片观察火焰呈紫色原溶液中有K+,无法确是否有Na+7.以下中,对的现象以及目的都正确的选项是( )8.为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯洁的NaCl,可将粗盐溶于水,然后以下操作中选取必要的步骤和正确的操作顺序①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液A.④②⑤ B.④①②⑤③C.①④②⑤③ D.②⑤④①③ 9.用四氯化碳萃取碘的饱和水溶液中的碘,以下说法不正确的选项是〔〕A.使用的主要仪器是分液漏斗B.碘在四氯化碳中的溶解度比在水中的溶解度大C.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出D.碘的四氯化碳溶液呈紫10.为到达以下目的,所采用的方法合理的是〔〕A.溴水中提取溴:分液B.别离水和汽油的混合物:蒸馏C.别离饱和食盐水和沙子的混合物:过滤D.从硝酸钾和氯化钠混合液中获取硝酸钾:萃取11.以下说法正确的选项是〔〕A.分子数不同的CO与N2的体积一不B.体积相同的CO与N2的质量一相C.质量不同、密度相同的CO与N2所含分子数可能相同D.质量相同、密度不同的CO与N2所含的原子数目一相12.由CH4和O2组成的混合气体,状况下的密度为1g•L﹣1,那么该混合气体中CH4和O2的体积比为〔〕A.2∶1 B.3∶2 C.2∶3 D.1∶2 13.将30 mL 0.5 mol·L-1的NaCl溶液加水稀释到500 mL,稀释后溶液中NaCl 的物质的量浓度为〔〕A.0.03 mol·L-1 B.0.3 mol·L-1 C.0.05 mol·L-1 D.0.04 mol·L-114.中需0.2mol/L的Na2CO3溶液950mL,配制时选用的容量瓶的规格和称取Na2CO3的质量分别是〔〕A.950mL,20.14g B.1000mL,21.2gC.任意规格,21.2g D.500mL,10.6g15.用N A表示阿伏德罗常数,以下表达正确的选项是( ) A.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N AB.状况下,2LH2O含有的分子数为 N AC.通常状况下,N A个CO2分子占有的体积为22.4LD.物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 N A16.设N A为阿伏加罗常数的值,以下说法正确的选项是( ) A.298K、101kPa时,22.4L CO2所含的原子数为3N AB.1mol Cl2与足量的Fe完全反,转移的电子数为2N AC.0.5mol C2H2和C6H6的气态混合物中所含原子总数为2N AD.2L 1mol/L的盐酸中所含HCl分子数约为2NA17.将质量的甲、乙两种气体分别充入两个密闭容器中,假设两容器的温度和压强均相同,且甲的密度大于乙的密度,那么以下说法正确的选项是〔〕A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小18.用N A表示阿伏加德罗常数。
高一化学上学期寒假作业试题精编

2021高一化学上学期寒假作业试题精编世界由物质组成,化学则是人类用以认识和改造物质世界的主要方法和手段之一。
查字典化学网为大家推荐了高一化学上学期寒假作业试题,请大家仔细阅读,希望你喜欢。
一、选择题(本题包括8个小题,每小题3分,共24分)1.将一小块钠投入滴有紫色石蕊试液的水中,下列有关现象的叙述错误的是()A.钠浮在液面上B.有无色无味的气体产生C.水溶液变为蓝色D.有爆鸣声解析:将钠投入滴有紫色石蕊试液的水中,钠先与水反应,反应方程式为:2Na+2H2O===2NaOH+H2。
生成的NaOH可使石蕊变蓝;可观察到的实验现象还有:钠浮在液面上、有无色无味的气体产生等;一小块金属钠与水反应发出嘶嘶的响声,而不是爆鸣声。
答案:D2.300 mL 0.1 molL1的AlCl3溶液与200 mL 0.3 molL1的NaCl溶液的c(Cl)(氯离子的物质的量浓度)之比为()A.1∶1B.1∶2C.1∶3D.3∶2解析:溶质的物质的量浓度与所取溶液的体积无关。
答案:A3.下列叙述正确的是()A.48 g O3气体含有6.021023个O3分子B.常温常压下,4.6 gNO2气体含有1.811023个NO2分子C.0.5 molL1CuCl2溶液中含有3.011023个Cu2+D.标准状况下,33.6 L H2O含有9.031023个H2O分子解析:NO2的分子数为:4.6 g46 gmol1NA=6.021022个,B 错误;0.5 molL1CuCl2溶液中的离子数与体积有关,C错误;标准状况下,水为液体,33.6 L水所含的分子数并不是9.031023个,D错误。
答案:A4.下列有关气体的叙述中,错误的是()A.不同的气体,若体积不同,则它们所含的分子数肯定不同B.在标准状况下,气体的摩尔体积约为22.4 Lmol1C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离D.气态物质没有固定的形状,且容易被压缩解析:不同温度、压强下,尽管气体体积不同,也有可能物质的量(分子数)相同,故A错。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蕲春一中2009秋高一化学寒假作业(一)试卷内容:从实验学化学命题人:余亚裕一、选择题(16×3分18分,每题只有一个最佳选项符合题意。
)1、有下列实验操作:①把鼻孔凑到容器口去闻药品的气味②将取液后的滴管平放在实验台上③将浓硫酸倒入盛有水的量筒中使其溶解④托盘天平称量时左盘放称量物,右盘放砝码⑤向燃着的酒精灯里添加酒精⑥给试管中的液体加热,试管口对着自己正确的为()A、全部B、④C、①②③⑤⑥D、③④2、按下列添加试剂的先后顺序,即可将盐酸、硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色透明溶液鉴别开来的是()A、石蕊试液、AgNO3溶液、稀HNO3B、BaCl2溶液、酚酞试液、AgNO3溶液C、石蕊试液、BaCl2溶液D、酚酞试液、BaCl2溶液、AgNO3溶液3、对于某些离子的检验及结论一定正确的是()A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO23-B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO2-4C、加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+D、加入Na2CO3溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+4、安全生活离不开化学,下列说法错误的是( )A、工业酒精中含有甲醇等有毒物质,不能饮用B、工业用盐亚硝酸钠对人体有害,不能用于烹调C、进入久未开启的菜窑、干涸的深井和深洞前,要做灯火试验D、发现煤气泄漏,应立即打开排气扇排气5、下列溶液中的Cl-浓度与50mL1mol·L-1的AlCl3溶液中Cl-的浓度相等的是()A、150mL1mol·L-1的NaClB、75mL2mol·L-1的NH4ClC、150mL2mol·L-1的KClD、75mL1.5mol·L-1的CaCl26、遇到下列情况,采用的措施正确的是()A、浓硫酸不慎滴在手上,立即用大量的碱液冲洗B、酒精灯不慎打翻起火,立即用水浇灭C、炒菜时油锅着火,立即盖上锅盖D、发现家中天然气泄漏,立即打开抽油烟机7、有下列实验操作:①过滤;②蒸发;③溶解;④取液体试剂;⑤取固体试剂。
一定要用到玻璃棒的是()A、①②③B、④⑤C、①④D、①③⑤8、在实验室中将浑浊的自来水制成蒸馏水,最好的方法是()A、过滤B、蒸馏C、蒸发D、先过滤后蒸馏9、下列说法不正确的是()A、物质的量就是物质的质量B、物质的量是含有一定数目的粒子集体C、阿伏加德罗常数就是12g12C所含碳原子数D、任何一种微观粒子的摩尔质量以g·mol-1为单位时,其数值与该种粒子的相对分子(或原子)质量相同10、设N A为阿伏加德罗常数,下列有关0.3mol/L硫酸钾溶液的说法中,错误的是()A、1L溶液中含有0.6 N A个K+B、1L 溶液中含有K+和SO24-的总数为0.9N AC、2L溶液中K+的物质的量浓度为1.2mol/LD、2L溶液中含有0.6 N A个SO24-11、下列关于实验操作的叙述中正确的是()①从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶②可燃性气体点燃之前必须验纯③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中④用托盘天平称量固体药品时,应左物右码⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却⑥选用100mL的量筒取4.5mL的稀硫酸A、①③④⑤B、①③④⑥C、②④⑤D、以上答案均不正确12、已知阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子(分子或原子)。
在两个容积相同的容器中,一个盛有HC1气体,另一个盛有H2和C12的混合气体。
在同温同压下,两容器内的气体一定具有相同的()A、分子总数B、质子总数C、质量D、密度13、下列关于化学学习和研究的说法错误的是()A、化学模型有助于解释一些化学现象B、质量守恒定律是大量实验事实的总结C、化学家提出的假设都能被实验证实D、化学基本原理的应用是有一定条件的14、在实验室里,保存在棕色试剂瓶中的药品是()A、浓盐酸B、浓硝酸C、浓硫酸D、氢氧化钠15、下列操作方法或实验装置正确的()16、设阿伏加德罗常数(N A)的数值为n A,下列说法正确的是()A、1molCl2与足量Fe反应,转移的电子数为3n AB、1.5molNO2与足量H2O反应,转移的电子数为0.10 n AC、常温常压下,22.4L的NO2和N2O4混合气体含有的原子数为3n AD、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10 n A班级:________ 姓名:___________ 分数:__________二、填空题.17、(3分)在实验室制取蒸馏水的装置中,温度计的水球应位于 ;烧瓶中应放几粒沸石(或碎瓷片),其作用是 ;冷凝管中,冷凝水的流向应当是 。
18、(4分)某溶液由NaOH 溶液、HC1、稀H 2SO 4和MgC12溶液中的一种或几种组成。
向该溶液中滴加Ba (OH )2溶液,产生沉淀的质量与加入Ba (OH )2溶液体积的关系如图4所示。
该溶液中不可能存在的物质是 和 ,肯定存在的物质是和 ,其理由是。
19、(6分)欲验证某溶液中含有大量的C1-、CO 32-、SO 42-三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每一种试剂能够检验出一种离子),假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式) 、 、20、(8分)为了除去粗盐中含有的可溶性杂质CaCl 2、MgCl 2和Na 2SO 4,需进行下列实验操作,请在( )中填写所使用除杂试剂的化学式,在□填写实验操作名称。
21、有下列化学仪粗盐②+( ) 除Mg 2+ ③+( ) 除SO 42- ④+( )溶液 除Ca 2+、Ba 2+ ⑥+适量( ) 纯净的NaCl 溶液除CO 32-、OH -NaCl 晶体溶液⑦2/mL器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸。
(1)现需要配制500mL1mol·L-1的硫酸溶液,需用质量分数为98%、密度为1.84g·cm-3的浓硫酸mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是。
(3)容量瓶使用前检验漏水的方法是_______________________________________________________________________________________________________________________________________________________________________________________________________________。
(4)、若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(均填“偏高”、“偏低”或“不变”)①用以稀释硫酸的烧杯未洗涤,。
②未经冷却趁热将溶液注入容量瓶中,。
③摇匀后发现液面低于刻线再加水,。
④容量瓶中原有少量蒸馏水,。
⑤定容时观察液面俯视,。
22、将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10gKNO3固体均达到饱和。
试计算:(1)该温度下KNO3的溶解度:克。
(2)原来不饱和KNO3溶液中溶质的质量分数。
(3)如果溶液的密度为1.1g/cm3,求溶质的物质的量浓度。
蕲春一中2009秋高一化学寒假作业(二)试卷内容:化学物质及其变化命题人:王天明一、选择题(16×3分18分,每题只有一个最佳选项符合题意。
)1、有同学将NaOH固体、P2O5、固体无水CaCl2固体划分为一类。
据此分类,下列能与这三种物质归为一类的是()A、CaOB、浓流酸C、NaClD、碱石灰2、下列现象或应用中,不涉及胶体性质的是()A、在饱和氯化铁溶液中逐滴入NaOH溶液,产生红褐色沉淀B、清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱C、用半透膜分离淀粉和食盐的混合液D、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗3、下列关于胶体的叙述,不正确的是()A、布朗运动是胶体微粒特有的运动方式,可以据此把胶体、溶液和悬浊液区别开来B、光线透过胶体时,胶体发生丁达尔效应C、用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过D、胶体微粒有较大的表面积,能吸附阳离子或阴离子,且同种胶体微粒吸附同种电荷4、我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。
那么,这种做法的化学原理是()A、胶体的电泳B、血液的氧化还原反应C、血液中发生复分解反应D、胶体的凝聚5、下列四项都能导电,其中一项与其他三项导电原理不同的是()A、氯化钠熔化导电B、液态汞导电C、H2SO4溶液导电D、熔融态的KOH导电6、下列离子方程式中正确的是()A、向NaHSO4溶液中滴加Ba(OH)2至SO24-沉定完全2H++SO24-+Ba2++2OH-BaSO4↓+2H2OB、碳酸钠溶液与醋酸反应CO23-+2H+ CO2↑+H2OC、氢氧化亚铁与硝酸混合Fe(OH)2+2H+Fe2++2H2OD、将2ml氯化铁饱和溶液加到20ml沸水中Fe3++3H2O(沸水)Fe(OH)3(胶体)+3H+7、有一瓶无色溶液,可能含有K+、Al3+、Mg2+、NH+4、Cl-、SO2-4、HCO-3、MnO-4中的几种。
为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量和NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。
下列推断中正确的是()A、肯定有Al3+、Mg2+、NH+4、Cl-B、肯定有Al3+、Mg2+、HCO-3C、肯定有K+、HCO-3、MnO-4D、肯定有Al3+、Mg2+、SO2-48、在溶液导电性装置中(烧杯、电极、电源、灯泡组成),若向某一电解质溶液中加入另一溶液,灯泡能由亮变暗,至熄灭后又逐渐变亮的一组是()A、盐酸中逐滴加入食盐水B、硫酸中逐滴加入氢氧化钠溶液C、硫酸中逐滴加入氢氧化钡溶液D、醋酸中加入氨水9、下列各组离子一定能大量共存的是()A、在含有大量Fe3+的溶液中:NH+4、Na+、Cl-、SCN-B、在强碱溶液中:Na+、K+、AlO-2、CO23-C、在pH=13的溶液中:NH+4、Al3+、SO24-、NO-3D、在pH=1的溶液中:K+、Fe2+、Cl-、NO-310、已知重金属离子有毒。
