土壤对铜的吸附2.0
污染土壤中铜离子的吸附行为研究

污染土壤中铜离子的吸附行为研究近几年来,人类对于环境保护的意识日益增强。
其中,污染土壤的问题一直备受关注。
污染土壤中的重金属离子,如铜离子,会对生态环境和人体健康造成极大的威胁。
因此,对于污染土壤中铜离子的吸附行为进行深入研究,有助于制定科学的环境治理措施。
1. 什么是铜离子的吸附?铜离子的吸附是指铜离子与土壤中的微粒子表面发生电化学反应,从而固定在土壤颗粒上的过程。
常见的土壤吸附剂有矿物质、有机物质、氧化物等。
铜离子与土壤吸附剂之间的交互作用,是影响吸附的关键因素。
2. 吸附过程的影响因素是什么?在实际操作中,铜离子的吸附行为受到许多影响因素的制约。
其中,土壤pH 值、土壤粒径、土壤结构、铜离子浓度等因素都会在不同程度上影响铜离子的吸附过程。
(1)土壤pH值:土壤pH值决定了离子在土壤中的电性,从而影响离子与土壤颗粒之间的电化学吸附作用。
一般来说,当土壤pH值低于6.5时,铜离子的吸附能力会增强。
但当pH值过低或过高时,吸附能力会下降。
(2)土壤粒径:土壤颗粒的大小也会影响铜离子的吸附。
一般来说,当土壤颗粒越小,吸附能力也越强。
(3)土壤结构:土壤结构的稳定性会影响铜离子在土壤中的迁移行为。
当土壤结构不稳定时,铜离子会更容易溶解在水中并发生迁移。
(4)铜离子浓度:铜离子浓度越高,越容易与土壤颗粒发生物理化学反应。
但高浓度铜离子会阻碍土壤颗粒的吸附功能,导致铜离子进一步污染。
3. 如何控制铜离子的吸附?对于铜离子的吸附控制,需要从多个角度考虑。
(1)改变土壤pH值:在实战中可以采用如添加钙粉、石灰等方式,改变土壤pH值,从而调整铜离子的吸附能力。
(2)增加土壤有机物质含量:土壤有机质的加入可以增加铜离子的吸附速率,从而达到降低铜离子污染的作用。
(3)选择适合的吸附剂:根据不同种类的污染物,选用合适的土壤吸附剂,可以更好地控制污染物的扩散和迁移。
4. 结语铜离子是一种常见的重金属污染物之一,对环境和人体健康造成不可忽视的影响。
实验二土壤对铜的吸附
土壤对铜的平衡时
0.7574 89.48 2.63 1.95 0.42 0.01 0.38
0.8449 100.11 4.97 2.00 0.70 0.01 0.20
60 80 反应时间min 4 5 100.00 120.00 — — 0.6733 0.7959 79.26 94.16 5.19 6.46 1.90 1.97 0.71 0.81 0.01 0.01 0.19 0.15
pH=2.5 pH=5.5
浓度/(mg/L) lgQ——lgc作图 F型 1.00 0.50
logQ
pH=2.5 pH=5.5
0.00 0.00 -0.50 -1.00 logc 0.50 1.00 1.50 2.00 2.50
pH=2.5 pH=5.5
�
系列1
y = 0.082x + 0.021 R = 0.994
吸光度A 线性 (吸光度A)
反应时间的关系曲线
10.00
15.00
土壤中铜离子的浓度/(mg/L)
20 30 40 60 80 100 120 振荡时间/min
浓度mg/L
不同pH条件土壤对铜的吸附等温线 100 120 140 8 6 吸附量/(mg/g) 4 2 0 -2 0 50 100 150
3 80.00 — 0.5409 63.17 4.21 1.80 0.62 0.02 0.24 20 3 80.00 — 0.5348 62.43 4.39 1.80 0.64 0.02 0.23 40
1.5000 1.0000 铜浓度对反应时间的关系曲线 4 5 0.5000 100.00 120.00 0.0000 — — 10 20
1 0.50 0.0414
实验五 土壤中铜的测定 (1)

实验五土壤中铜的测定一、实验目的和要求(1)掌握原子吸收分光光度法原理及测定铜的技术。
(2)预习第二章金属测定的有关内容及第五章土壤质量监测的有关内容。
二、实验原理土壤样品用HNO3-HF-HClO4或HCl-HNO3-HF-HClO4混酸体系消化后,将消化液直接喷入空气-乙炔火焰。
在火焰中形成的Cu基态原子蒸汽对光源发射的特征电磁辐射产生吸收。
测得试液吸光度扣除全程序空白吸光度,从标准曲线查得Cu含量。
计算土壤中Cu含量。
该方法适用于高背景土壤(必要时应消除基体元素干扰)和受污染土壤中Cu的测定。
方法检出限范围为0.05—5mg/kg。
三、实验仪器(1)原子吸收分光光度计,空气-乙炔火焰原子化器,铜空心阴极灯。
(2)仪器工作条件:测定波长324.7nm ,通带宽度0.2nm ,空气-乙炔的氧化型火焰类型,蓝色火焰。
四、实验试剂(1)盐酸:特级纯。
(2)硝酸:特级纯。
(3)氢氟酸:优级纯。
(4)高氯酸:优级纯。
(5)铜标准贮备液:1000mg/L(6)铜标准使用液:吸取5.0mL铜标准贮备液于100mL容量瓶中,用水稀至标线,摇匀备用。
即得每毫升含50μg铜的标准使用液。
(7)5%HNO3溶液:(8)0.2% HNO3溶液(9)采集土壤样品,并干燥,磨细过80目,备用。
五、测定步骤(1)土样试液的制备:称取0.500g土样于25mL聚四氟乙烯坩埚中,用少许水润湿,加入10mLHCl,在电热板上加热(<450℃)消解2小时,然后加入15mLHNO3,继续加热至溶解物剩余约5mL时,再加入5mLHF并加热分解除去硅化合物,最后加入5mLHClO4加热至消解物呈淡黄色时,打开盖,蒸至近干。
取下冷却,加入5%HNO31mL微热溶解残渣,移入50mL容量瓶中,定容。
同时进行全程序试剂空白实验。
(2)标准曲线的绘制:吸取相应体积的铜标准使用液,分别于6个50mL容量瓶中,用0.2%HNO3溶液定容、摇匀。
分别测其吸光度,绘制标准曲线。
不同配比水泥土对铜离子的吸附性能研究

2.1试验材料
部清液离心,并用 0.22m 滤膜过滤,滤
水泥土自行制备,取水泥若干,按照 液稀释 100倍后,测定清液中的浓度,的
水泥量占土样的 5%,9%,12%与土样、 浓度由同济大学环境科学与工程学院重
水掺和,并将它们用拌棒在容器中充分 点实验室利用电感耦合等离子发射光谱
搅拌,混合均匀,制备成不同配比的水泥 仪测得。
(g)。
3 水泥土吸附效果分析
3.1不同配比水泥土对吸附的动力学特 征
5%、9%和 12% 水泥土各测定 7个 吸附时间点溶液中的浓度,百分吸附率 一时间曲线见图 1。由图可知:这三种水 泥土对的吸附过程是很快的,在 0-3h 内溶液中浓度降低较快,分别达 35.19% (5% 水 泥 土),39.67%(9% 水 泥 土), 50.28%(12%水泥土),此后速度减慢, 72h后基本达到吸附平衡状态。随着水 泥掺量的增多,水泥土对的吸附能力也 相应增加,9%和 12%的水泥土对的吸 附能力相当,平衡吸附率为 94.88%和 99.65%,较大于 5%水泥土,其平衡吸附 率为 76.73%。
本文研究了不同配比的复合建筑材 中的重金属离子浓度)。
料水泥土 (水泥掺量占土样 5%、9%、 2.3动态吸附试验方法
12%)对铜吸附的动力学特征、吸附等温 线型式,探讨复合型材料水泥土对铜的
使 用 CuSO4 配 制 了 浓,5%、9%、12% 配比
吸附能力,与之前国内外研究较单一的 水泥土分别称重 0.5g,各 7份置于 7个
型模拟实验分析了水泥土墙屏障厚度和 在表 1中。
水泥掺量对重金属离子隔离效果的影 2.2试剂和仪器
响,同时应用数值模拟方法求解了锌离
主要试剂:无水硫酸铜(CuSO4),分
不同林分类型土壤对铜的吸附及其影响因素

采取土壤样品 2 kg左右, 置于带封条塑料袋中, 并 粘贴识别标签, 风干、碾磨、过 2 mm 筛待用。 1. 2 土壤理化性质的测定
用重铬酸钾容量法 ( 稀释热法 ) [ 10] 测定土壤有 机质含量; 用乙酸铵交换法测定土壤阳离子交换量 ( CEC ): 先按 GB 7863 87 森林 土壤阳离子交换 量测定方法进行 前期处理, 然后用 FOSS2300 定氮 仪测定氨含量, 再换算成 CEC; 按 GB 7859 87 森 林土壤 pH 值的测定方法用 pH S- 2C pH /mV 计测定 土壤 pH 值 ( 20 ) , m (土 ) V ( 水 ) = 1 2. 5; 按 GB 7845 87 森林土壤颗粒组成的测定方法采用比重 计法测定土壤颗粒组成。 1. 3 土样对 Cu2+ 吸附量的测定
图 3为不同林 分类型、不同 层次土 壤 CEC 对 Cu2+ 吸附量的影响。
60
生态与农村环境学报
第 22卷
H 1: 0 10 cm; H 2: 10 20 cm; H 3: 20 40 cm; H 4: 40 60 cm; S1: 茶园; S2: 毛竹林; S3: 湿地松林; S4: 灌木林; S5: 落叶栎林; S6: 常绿苦槠-青冈混交林。
S6: 常绿苦槠-青冈混交林。
图 1 不同林分类型、不同层次土壤对 Cu2+ 吸附的影响 Fig. 1 E ffects of d ifferen t typ es of forests and d ifferent soil layers on Cu2+ ad sorption
2. 2. 1 土壤有机质含量对重金属吸附的影响 图 2为不同土壤样品有机质含量对 Cu2+ 吸附
实验 土壤铜的测定方法

实验八土壤对铜的吸附一、实验目的学会土壤对铜的吸附平衡时间的测定学会土壤对铜的吸附量的测定二、仪器和试剂1. 仪器(1) 原子吸收分光光度计。
(2) 恒温振荡器。
(3) 离心机。
(4) 酸度计。
(5) 复合电极。
(6) 容量瓶:50 mL,250 mL,500 mL。
(7) 聚乙烯塑料瓶:50 mL。
2. 试剂(1) 二氯化钙溶液(0.01 mol/L):称取1.5 g CaC12 · 2H2O溶于1L水中。
(2) 铜标准溶液(1000 mg/L):将0.5000 g金属铜(99.9%)溶解于30 mL l:1HNO3中,用水定容至500 mL。
(3) 50 mg/L铜标准溶液:吸取25 mL 1000 mg/L铜标准溶液于500 mL容量瓶中,加水定至刻度。
(4) 硫酸溶液:0.5 mol/L。
(5) 氢氧化钠溶液:1 mol/L。
(6) 铜标准系列溶液(pH=2.5):分别吸取10.00、15.00、20.00、25.00、30.00 mL的铜标准溶液于250 mL烧杯中,加0.01 mol/L CaCl2溶液,稀释至240 mL,先用0.5 mol/L H2SO4调节pH=2,再以1 mol/L NaOH溶液调节pH=2.5,将此溶液移入250 mL容量瓶中,用0.01 mol/L CaCl2溶液定容。
该标准系列溶液浓度为40.00、60.00、80.00、100.00、120.00 mg/L。
按同样方法,配制pH= 5.5的铜标准系列溶液。
(7) 土壤样品:将新采集的土壤样品经过风干、磨碎,过0.15 mm (100目)筛后装瓶备用。
三、实验步骤1. 标准曲线的绘制吸取50 mg/L的铜标准溶液0.00、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mL分别置于50 mL容量瓶中,加2滴0.5 mol/L的H2SO4,用水定容,其浓度分别为0、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/L。
土壤对重金属离子的吸附

土壤对重金属离子的吸附土壤对重金属离子的吸附是环境污染和生态修复领域的重要研究内容。
重金属离子如铜、铅、锌、镉等在环境中含量过高时,会对人类和生态系统产生危害。
土壤作为环境中重金属离子的重要“过滤器”和“储存库”,对其吸附行为的研究有助于深入理解重金属离子的环境行为和生态风险。
首先,土壤对重金属离子的吸附主要取决于土壤的理化性质。
土壤的有机质、pH值、阳离子交换容量(CEC)等都是影响其吸附重金属离子的关键因素。
有机质可以通过配位作用与重金属离子形成络合物,增强土壤对重金属的吸附能力。
pH 值则通过影响土壤表面的电负性来影响吸附,而CEC则反映了土壤对阳离子的吸附能力。
其次,重金属离子的性质如离子半径、电荷数和极化率等也对其在土壤中的吸附有影响。
一般来说,离子半径小、电荷数高、极化率低的重金属离子更易被土壤吸附。
此外,重金属离子的浓度、吸附时间、温度等也会影响其在土壤中的吸附行为。
关于土壤对重金属离子的吸附机制,主要有离子交换、专性吸附和表面络合等。
离子交换是土壤表面离子与重金属离子在静电作用下的交换,专性吸附则是土壤表面的特定基团与重金属离子形成配位键的吸附。
表面络合则是土壤表面的配位基团与重金属离子形成稳定的络合物的吸附。
在实际的环境中,土壤对重金属离子的吸附还受到许多环境因素的影响。
例如,土壤中的水分含量会影响土壤表面的湿润程度,从而影响其吸附能力。
土壤中的氧化还原状态会影响重金属离子的溶解度和化学形态,从而影响其吸附行为。
此外,土壤中的生物活动和微生物群落也会影响其对重金属离子的吸附。
土壤对重金属离子的吸附过程是一个复杂的多相反应过程,涉及物理、化学和生物等多个方面。
这一过程受到多种因素的影响,包括前述的土壤理化性质、重金属离子性质和环境因素等。
对这一过程的深入理解和研究,有助于我们更好地理解和预测土壤环境中的重金属行为,对于环境保护和污染治理等方面具有重要的意义。
对于土壤对重金属离子的吸附研究,未来的研究方向也很多。
土壤对铜的吸附剖析

土壤对铜的吸附XXX指导老师:XXXX摘要重金属在土壤中的迁移转化主要包括吸附作用、配合作用、沉淀溶解作用和氧化还原作用。
其中又以吸附作用最为重要。
铜是植物生长所必不可少的微量营养元素,但含量过多也会使植物中毒。
土壤的铜污染主要是来自于铜矿开采和冶炼过程。
进人到土壤中的铜会被土壤中的粘土矿物微粒和有机质所吸附,其吸附能力的大小将影响铜在土壤中的迁移转化。
因此,研究土壤对铜的吸附作用及其影响因素具有非常重要的意义。
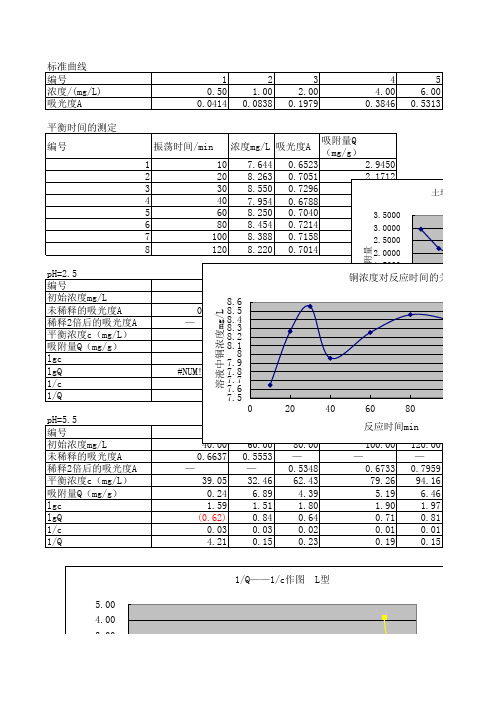
本次实验就土壤对铜的吸附做了标准曲线的绘制、吸附平衡时间的测定以及土壤对铜吸附量的测定。
实验原理土壤对铜的吸附可采用Freundlich 吸附等温式来描述。
即: Q =Kρ1/n 式中:Q ——土壤对铜的吸附量,mg/g ; ρ——吸附达平衡时溶液中铜的浓度,mg/L ;K ,n ——经验常数,其数值与离子种类、吸附剂性质及温度等有关。
将Freundlich 吸附等温式两边取对数,可得: 1g Q = lgK +n1lg ρ 以1gQ 对1g ρ作图可求得常数K 和n ,将K 、n 代人Freundlich 吸附等温式,便可确定该条件下的Freundlich 吸附等温式方程,由此可确定吸附量(Q )和平衡浓度(ρ)之间的函数关系。
仪器与试剂1仪器原子吸收分光光度计;恒温振荡器;离心机;酸度计;50mL 容量瓶;聚乙烯塑料瓶。
2试剂(1) 0.01mol/L 的NaNO 3溶液。
(2) 铜标准溶液(1000 mg/L ):将0.5000 g 金属铜(99.9%)溶解于30 mL l:1HNO 3中,用水定容至500 mL 。
(3) 50 mg/L铜标准溶液:吸取25 mL 1000 mg/L铜标准溶液于500 mL容量瓶中,加水定至刻度。
(4) 硫酸溶液:0.5 mol/L。
(5) 氢氧化钠溶液:1 mol/L。
(6) 铜标准系列溶液(pH=2.5):分别吸取10.00、15.00、20.00、25.00、30.00 mL 的铜标准溶液于250 mL烧杯中,加0.01 mol/L CaCl2溶液,稀释至240 mL,先用0.5 mol/L H2SO4调节pH=2,再以1 mol/L NaOH溶液调节pH=2.5,将此溶液移入250 mL容量瓶中,用0.01 mol/L CaCl2溶液定容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
土壤对铜的吸附11环科1 陈浩翔 1土壤中重金属污染主要来自于工业废水、农药、污泥和大气降尘等。
过量的载金属可引起植物的生理功能紊乱、营养失调。
由于重金属不能被土壤中的微主物所降解,因此可在土壤中不断地积累,也可为植物所富集并通过食物链危害气体健康。
重金属在土壤中的迁移转化主要包括吸附作用、配合作用、沉淀溶解作用和氧化还原作用。
其中又以吸附作用最为重要。
铜是植物生长所必不可少的微量营养元素,但含量过多也会使植物中毒。
土壤的铜污染主要是来自于铜矿开采和冶炼过程。
进人到土壤中的铜会被土壤中的粘土矿物微粒和有机质所吸附,其吸附能力的大小将影响铜在土壤中的迁移转化。
因此,研究土壤对铜的吸附作用及其影响因素具有非常重要的意义。
一、实验目的1. 了解影响土壤对铜吸附作用的有关因素。
2. 学会建立吸附等温式的方法。
二、实验原理不同土壤对铜的吸附能力不同,同一种土壤在不同条件下对铜的吸附能力也有很大差别。
而对吸附影响比较大的两种因素是土壤的组成和pH.。
为此,本实验通过向土壤中添加一定数量的腐殖质和调节待吸附铜溶液的pH ,分别测定上述两种因素对土壤吸附铜的影响。
土壤对铜的吸附可采用Freundlich 吸附等温式来描述。
即: Q =K ρ1/n式中:Q ——土壤对铜的吸附量,mg/g ; ρ——吸附达平衡时溶液中铜的浓度,mg/L ;K ,n ——经验常数,其数值与离子种类、吸附剂性质及温度等有关。
将Freundlich 吸附等温式两边取对数,可得: 1g Q = lgK +n1lg ρ 以1gQ 对1g ρ作图可求得常数K 和n ,将K 、n 代人Freundlich 吸附等温式,便可确定该条件下的Freundlich 吸附等温式方程,由此可确定吸附量(Q )和平衡浓度(ρ)之间的函数关系。
土壤对铜的吸附还可采用Langmuir 等温吸附方程来描述。
即1111Langmuir 1Q-mg/g mg/g-mg/l1111=+Q 11-Langmuir Q m m m m m q k Q k q k q k q q k ρρρρρ=+--∙吸附方程式中吸附量饱和吸附量吸附平衡时离子浓度常数等式两边取倒数,有作,可得常数、,即可得到该温度下吸附方程。
三、仪器和试剂1. 仪器(1) 原子吸收分光光度计。
(2) 恒温振荡器。
(3) 离心机。
(4) 酸度计。
(5) 复合电极。
(6) 容量瓶:50 mL ,250 mL ,500 mL 。
(7) 聚乙烯塑料瓶:50 mL 。
2. 试剂(1) 二氯化钙溶液(0.01 mol/L):称取1.5 g CaC12 · 2H 2O 溶于1L 水中。
(2) 铜标准溶液(1000 mg/L ):将0.5000 g 金属铜(99.9%)溶解于30 mL l:1HNO 3中,用水定容至500 mL 。
(3) 50 mg/L 铜标准溶液:吸取25 mL 1000 mg/L 铜标准溶液于500 mL 容量瓶中,加水定至刻度。
(4) 硫酸溶液:0.5 mol/L。
(5) 氢氧化钠溶液:1 mol/L。
(6) 铜标准系列溶液(pH=2.5):分别吸取10.00、15.00、20.00、25.00、30.00 mL 的铜标准溶液于250 mL烧杯中,加0.01 mol/L CaCl2溶液,稀释至240 mL,先用0.5 mol/L H2SO4调节pH=2,再以1 mol/L NaOH溶液调节pH=2.5,将此溶液移入250 mL容量瓶中,用0.01 mol/L CaCl2溶液定容。
该标准系列溶液浓度为40.00、60.00、80.00、100.00、120.00 mg/L。
按同样方法,配制pH= 5.5的铜标准系列溶液。
(7) 腐殖酸(生化试剂)。
(8) 1号土壤样品:将新采集的土壤样品经过风干、磨碎,过0.15 mm (100目)筛后装瓶备用。
(9) 2号土壤样品:取1号土壤样品300g,加人腐殖酸30g,磨碎,过0.15mm(100目)筛后装瓶备用。
四、实验步骤1. 标准曲线的绘制吸取50 mg/L的铜标准溶液0.00、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mL 分别置于50 mL容量瓶中,加2滴0.5 mol/L的H2SO4,用水定容,其浓度分别为0、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mg/L。
然后在原子吸收分光光度计上测定吸光度。
根据吸光度与浓度的关系绘制标准曲线。
原子吸收测定条件:波长:325. 0 nm;灯电流1 mA;光谱通带:20;增益粗调:0;燃气:乙炔;助燃气:空气;火焰类型:氧化型。
2. 土壤对铜的吸附平衡时间的测定(1) 分别称取1、2号土壤样品各6份,每份1g于50 mL聚乙烯塑料瓶中。
(2) 向每份样品中各加人50 mg/L铜标准溶液50 mL。
(3)将上述样品在室温下进行振荡,分别在振荡0min,15min,30min,45min,60min,90min后,过滤,迅速吸取上层清液10 mL于50 mL容量瓶中,加2滴0.5 mol/L的H2SO4溶液,用水定容后,用原子吸收分光光度计测定吸光度。
以上内容分别用pH为2.5和5.5的100 mg/L的铜标准溶液平行操作。
根据实验数据绘制溶液中铜浓度对反应时间的关系曲线,以确定吸附平衡所需时间。
3. 土壤对铜的吸附量的测定(1) 分别称取1、2号土壤样品各10份,每份1g ,分别置于50mL 聚乙烯塑料瓶中。
(2) 依次加入50 ml pH 为2.5和5.5、浓度为40.00、60.00、80.00、100.00、120.00 mg /L 铜标准系列溶液,盖上瓶塞后置于恒温振荡器上震荡45min 。
(3) 振荡达平衡后,过滤取10 mL 于50 mL 容量瓶中,加2滴0.5 mol/L 的H 2SO 4溶液,用水定容后,用原子吸收分光光度计测定吸光度。
(4) 剩余土壤浑浊液用酸度计测定pH 。
五、数据处理1. 土壤对铜的吸附量可通过下式计算: Q =WV1000)(0ρρ-式中:Q ——土壤对铜的吸附量,mg/g ; ρ0——溶液中铜的起始浓度,mg /L ; ρ——溶液中铜的平衡浓度,mg/L ; V ——溶液的体积,mL ; W ——烘干土样重量,g 。
由此方程可计算出不同平衡浓度下土壤对铜的吸附量。
2. 建立土壤对铜的吸附等温线以吸附量(Q)对浓度(ρ)作图即可制得室温下不同pH 条件下土壤对铜的吸附等温线。
3. 建立Freundlich 方程以1g Q 对1g ρ作图,根据所得直线的斜率和截距可求得两个常数K 和n ,由此可确定室温时不同pH 条件下不同土壤样品对铜吸附的Freundlich 方程。
4、建立Langmuir 等温吸附方程111-Langmuir Q m q k ρ作,可得常数、,即可得到该温度下吸附方程。
实验数据记录表1 1、2号土时间-吸附量记录时间/min 0 15 30 45 60 901测 mg/l 4.8695 4.1637 3.9649 3.8245 4.0025 3.6196 2测 mg/l 3.5991 1.9840 1.4110 1.1706 1.1339 1.11731 mg/l 24.3475 20.8185 19.8245 19.1225 20.0125 18.09802 mg/l 17.9955 9.9200 7.0550 5.8530 5.6695 5.5865Q1 mg/g 1.2826 1.4591 1.5088 1.5439 1.4994 1.5951 Q2 mg/l 1.6002 2.0040 2.1473 2.2074 2.2165 2.2207图1 1、2号土时间-吸附量曲线从图中可以得知,1、2 号土样在45min左右达到吸附平衡。
且2号图的吸附量比1号土高25.0%-38.3%。
表2 PH=3.5 不同铜离子浓度土壤吸附量Cu浓度mg/l406080100120 1测mg/l 3.5547 5.50369.127914.197017.9570 2测mg/l0.7580 2.52977.51549.691913.16901 mg/l17.773527.518045.639570.985089.78502 mg/l 3.790012.648537.577048.459565.8450Q1 mg/g 1.1113 1.6241 1.7180 1.4508 1.5108 Q2 mg/l 1.8105 2.3676 2.1212 2.5770 2.7078 lgC1 1.2498 1.4396 1.6593 1.8512 1.9532 lgc20.5786 1.1020 1.5749 1.6854 1.8185 1/C10.05630.03630.02190.01410.0111 1/c20.26390.07910.02660.02060.0152 logQ10.04580.21060.23500.16160.1792 logQ20.25780.37430.32660.41110.4326 1/Q10.89980.61570.58210.68930.6619 1/Q20.55230.42240.47140.38800.3693图1-图4 PH=3.5 不同铜离子浓度土壤吸附量曲线表3 PH=5.5 不同铜离子浓度土壤吸附量ph 5.5Cu浓度 mg/l 40 60 80 100 120 1测 mg/l 1.2173 1.3375 6.4185 7.1120 9.5469 2测 mg/l 0.3271 0.1618 3.4048 6.5941 9.78981 mg/l 6.0865 6.6875 32.0925 35.5600 47.73452 mg/l 1.6355 0.8090 17.0240 32.9705 48.9490Q1 mg/g 1.6957 2.6656 2.3954 3.2220 3.6133 Q2 mg/l 1.9182 2.9596 3.1488 3.3515 3.5526 lgC1 0.7844 0.8253 1.5064 1.5510 1.6788 lgc2 0.2137 null 1.2311 1.5181 1.6897 1/C1 0.1643 0.1495 0.0312 0.0281 0.0209 1/c2 0.6114 1.2361 0.0587 0.0303 0.0204 logQ1 0.2293 0.4258 0.3794 0.5081 0.5579 logQ2 0.2829 null 0.4981 0.5252 0.5505 1/Q1 0.5897 0.3751 0.4175 0.3104 0.2768 1/Q2 0.5213 0.3379 0.3176 0.2984 0.2815图5-图8 PH=5.5 不同铜离子浓度土壤吸附量曲线可以看出,土壤对铜离子的吸附用Langmuir等温吸附方程描述有更好的相关性。
