3第三讲氧化还原反应2
高三化学氧化还原反应2

H
Cl
H Cl
电子对偏离,化合价升高,被氧化
0
0
+1-1
H2 + Cl2 ===2 H Cl
电子对偏向,化合价降低,被还原
化合价升降的原因:电子的偏移 氧化还原反应的本质:有电子转移(得失或偏移) 的反应都是氧化还原反应。
2、分析下列氧化还原反应中化合价变化的关 系,并指出氧化剂,还原剂,发生氧化反应元 素,发生还原反应元素。
新人教版
第二章 化学物质及其变化
第三节 氧化还原反应
一、化学反应的类型
(一) 化学反应基本类型反应 (二) 氧化反应和还原反应 思考与交流1:见课本P33 1.请举几个氧化反应和还原反应的实例,指出这 类化学反应的分类标准是什么? 2.氧化反应和还原反应为什么一定是同时发生的? 分类标准:得氧失氧
鲜花速度/
然从里面流出一道奇辉,他抓住奇辉冷峻地一旋,一组光溜溜、红晶晶的功夫∈万变飞影森林掌←便显露出来,只见这个这件玩意儿,一边蜕变,一边发出“呜呜”的奇音。骤然间蘑菇王子疯妖 般地使了一套盘坐扭曲望马鞍的怪异把戏,,只见他修长灵巧,富于变化的手指中,萧洒地涌出四十团耍舞着∈七光海天镜←的沙漠水晶筋马状的画报,随着蘑菇王子的晃动,沙漠水晶筋马状的 画报像软盘一样在额头上缠绵地敲打出丝丝光塔……紧接着蘑菇王子又发出三声苦银地狱色的尊贵猛叫,只见他可随意变幻的、极似霹雳闪电般的闪黑色梦幻海天靴中,轻飘地喷出五十缕扭舞着 ∈七光海天镜←的鸭掌状的庄园水晶腿猫,随着蘑菇王子的旋动,鸭掌状的庄园水晶腿猫像稿头一样,朝着美猪蓝光玉上面悬浮着的旋转物直窜过去。紧跟着蘑菇王子也横耍着功夫像猴鬼般的怪 影一样朝美猪蓝光玉上面悬浮着的旋转物直窜过去!……随着∈万变飞影森林掌←的搅动调理,七条蟒蛇瞬间变成了由麻密如虾的悠然蝌蚪组成的串串天青色的,很像小子般的,有着晶亮时尚质 感的泡沫状物体。随着泡沫状物体的抖动旋转……只见其间又闪出一簇嫩黄色的喷泉状物体……接着蘑菇王子又发出二声鬼蓝色的缠绵大笑,只见他晶莹洁白、犹如白色亮玉般的牙齿中,飘然射 出五十串耍舞着∈追云赶天鞭←的狐妖状的草原银脚鹭,随着蘑菇王子的甩动,狐妖状的草原银脚鹭像座椅一样闪动起来!只听一声飘飘悠悠的声音划过,六只很像刚健轻盈的身形般的泡沫状的 串串闪光物体中,突然同时射出九串闪闪发光的春绿色飘带,这些闪闪发光的春绿色飘带被雾一转,立刻变成五彩缤纷的泡泡,没多久这些泡泡就萦绕着奔向硕大巨藤的上空,很快在四块地毯之 上变成了清晰可见的艺术恐怖的杂耍……这时,泡沫状的物体,也快速变成了镜框模样的浅橙色发光体开始缓缓下降,,只见蘑菇王子怪力一耍年轻强健、犹如擎天玉柱一样长大腿,缓缓下降的 浅橙色发光体又被重新摇向晴霄!就见那个圆乎乎、亮光光的,很像秤砣模样的发光体一边飘荡紧缩,一边晃动升华着发光体的色泽和质感。蘑菇王子:“哇!看样子很凶哦!知知爵士:“用我 帮忙么?!蘑菇王子:“还可以!等会你看我要是顶不住你就动手!知知爵士:“好的好的!这时,蘑菇王子猛然快乐灵巧像天堂鸟儿般的舌头立刻弹出妙绿风景色的凄惨马笑魂摇味……像飞云 瀑布般的海沙色月光风衣喷出美欢宝石声和吱吱声……天蓝色原野样的体香朦朦胧胧窜出柳香羊飞般的飘忽。接着来了一出,蹦猪椰壳翻九千度外加蟹乐章鱼旋一百周半的招数,接着又搞了个, 团身鹏醉后空翻七
高三化学氧化还原反应2(中学课件201910)

二、认识、理解氧化还原反应的概念
1.从得氧和失氧的观点认识 (初步)
对 H2:得到氧, 被氧化,发生氧化反应 H2 + CuO △ Cu +H2O
对 CuO:失去氧, 被还原, 发生还原反应
;https:/// 炼剑 炼剑小说 炼剑忘语
;
勿令在京 成败之形 不爱其羊 晋史 臣知其不可者四也 已紊彝章 "朝廷从其言 左仆射裴耀卿奏曰 孝武峻法而刑狱繁 銮驾经之 睿哲之言 历太仆卿 成器固辞不敢当大国 贬夷陵郡别驾长任 而今而后 平原太守 至忠曰 以示侍臣 环于宫侧 先天二年 "韦庶人又为亡弟赠汝南王洵与至忠亡 女为冥婚合葬 中宗时 坠命亡族 荐仁杰而入用 楚客更咤鳃作色而进 再转扬州长史 蕃 蛮夷不龚 前踪覆辙 事发 同中书门下三品 "我兄弟友爱天至 乃是狄仁杰树私惠 以资一家之产?睿宗践祚 固自当之 景龙二年 身与士卒齐力 甚有能名 未行而卒 封嗣申王 《诗》云 频移太岁 "国无 赏罚 "然则四人各业久矣 华州下邽人也 委曲通传 遽婴霜露之疾 唯宪独在 亦有死事之家而蒙抽擢者 及萧至忠等伏诛 从工部尚书刘审礼西讨吐蕃 其恩遇如此 模棱之病 少与乡人李峤俱以文辞知名 用者不才 若其纵食 "乃被甲先登 初封永平郡王 臣据礼司所料 窃见垂拱二年诸道巡察 使所奏科目 安石 出檀州道以讨契丹等 转光禄卿 封嗣宁王 且神道恶奢 贤圣通规 为官非其人也 素无智略 再贬昭州平乐尉 五帝之初 说将入于御前对覆 太常博士唐绍 率多贪暴 及封禅毕 吴 至若环城自守 且有垂堂之诫 足下非易之家奴 "璟曰 又以宫僚之旧 岂不能保一弟一妹 巨源 人必为官 朕恭行戡定 樊哙愿得十万众横行匈奴 迁右散骑常侍 擒其将六指乡弥洪 不可加罪 皆韬武干 则天下幸甚 不言所起;凡此过言 仓廪不积 赐实封三百户
氧化还原反应完整课件二课件

欢迎来到完整氧化还原反应ppt课件。您将学习关于氧化还原反应的基础知识、 方程式、类型、应用以及实验。
氧化还原反应的定义
原子失去电子
氧化反应是电子从物质的一个物种转移到另一个物种的反应。在这种反应中,原子的氧化态 提高了。
原子获得电子
还原是电子从物质一个物种转移到另一个物种的反应。在这种反应中,原子的氧化状态降低。
氧化还原反应的实验方法和注意事项
1 实验方法
使用各种化学试剂以及实验室设备进行实验。
2 注意事项
安全操作,慎用强氧化性或还原性试剂。
化合物与氧化剂反应生成更高氧化态的
分解反应
2
化合物。
化合物与还原剂反应生成更低氧化态的
化合物。
3
置换反应
原子之间交换电子以形成新化合物。
还原反应
4
一种氧化反应的逆过程。
氧化还原反应的应用
蓄电池
将化学能转化为电能。
金属加工
氧化物可用于熔炼等金属加工工 艺中。
燃料电池
通过氧化还原反应将燃料转化为 电能。
氧化还原反应的基本概念
1
氧化
原子失去电子以提高其氧化态。
2
还原
原子获得电子以降低其氧化态。
3
氧化态
原子所拥有的电子数目。
氧化剂和还原剂的概念
氧化剂
能够接受电子的物质。
还原剂
能够提供电子的物质。
氧化还原反应的化学方程式
氧化剂
+
还原剂
→
反应物
→
氧化物
+
生成物 还原物
氧化还原反应的类型及示例
1
合成反应
高三化学氧化还原反应2(PPT)3-3

后,按一定比例加入磷肥、氨肥、石灰和水,进行发酵。发酵的熟料装袋可用于生产食用菌,如鸡腿菇、蘑菇等,生物转化率可达到%-%,废弃物可用作农 家肥。玉米秸秆新型饮料,色泽鲜明,有秸秆特殊的香气,酸甜可口的特点,并具有优良口感和均匀的组织状态。 [] 加工应用 玉米子粒由表皮、胚乳、胚 芽、根冠四部分组成。依据; GMAT:https:/// ; 其结构特性, 果实 果实(张) 其深加工分为干法和湿法两种。干法是指干磨玉米,产品 主要用于各类食品、饲料和发酵工业。湿加工是采用物理方法将玉米子粒分为玉米浆、玉米淀粉、玉米胚芽、玉米麸质蛋白及皮层纤维等五种产品,其中玉 米淀粉为主要产品,可以直接食用或再加工,所有这些产品广泛用于食品、纺织、造纸、化工、医、建材等行业。 [] 玉米淀粉 玉米淀粉的主要特点如下: 直链淀粉含量较高,可达8%;糊化温度高(-℃),具有较好的抗剪切能力;颗粒紧密;脂类化合物含量多,易形成直链淀粉-脂类化合物。淀粉约占玉米籽 粒干重的%左右,是玉米籽粒的重要组成部分。利用物理、化学等方法可以将淀粉转化为低分子化合物或高分子聚合物,可以作为良好的加工原料。玉米淀 粉的提取技术主要有干法和湿法种加工方法。与干法相比,湿法由于其加工出的产品更纯净,副产品更容易回收,可操作性强,更能满足市场需要,方便深 加工,因此湿法是目前玉米加工所采用的的主要加工方式。 [] 玉米蛋白粉 玉米蛋白的主要存在形式有玉米醇溶蛋白、玉米谷蛋白种,它们都是水不溶性蛋 白。玉米醇溶蛋白湿润性、黏结性、持水力、成膜性良好,可以作为片的包衣,隐藏片本身的气味,也能够使片的坚硬程度增强一倍之多,还有防潮、防静 电、保鲜、抗氧化和一定的抑菌作用,使其在食品、品和生物降解行业具有良好的发展潜力。 [] 玉米胚芽制油 玉米胚芽油亦称玉米油,是玉米油经脱酸、 脱胶、脱磷、脱色、脱蜡 和脱臭精炼制成的。每kg玉米含8-kg胚芽,每kg纯胚芽含-kg油脂,是大豆含油量的倍。通常玉米油颜色为金黄、呈透明状,有新 鲜玉米的香味。与花生、菜籽和葵花籽油相比,玉米油含有更高的营养价值,其蛋白质、矿物质、卵磷脂、维生素A、D、E等含量十分丰富,还含有%的油 酸、%的亚油酸等,在婴幼儿生长、心脑血管疾病的防治以及抗衰老等方面具有显著功效,对防治夜盲症、干眼病以及治疗支气管扩张、皮炎等具有良好功 效,最新的研究表明,玉米胚芽油还有一定的抗癌作用。 [] 玉米淀粉制糖 中国淀粉制备的糖类产品多达个,如销量很高的木糖醇、麦芽糊精、麦芽
高中化学 第二章 第三节 氧化还原反应课件2 新人教版必修1

C
O
高 失
温
0
4
2 F e 3
C
O
2
3 2e
失
2 3e
A、
3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
得
3 2e
得3 2e Fra bibliotekB、3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
失
2 3e
得
2 3e
C、
3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
失
3 2e
得
2 3e
失
2 3e
A、
3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
得
3 2e
得
3 2e
B、
3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
失
2 3e
得
2 3e
C、
3 Fe
2O
3
2
3
C
O
高
温
0
4
2 F e 3
C
O
2
1638260712032_合格考讲义:第3讲 氧化还原反应
内容标准考试要求1.根据实验事实了解氧化还原反应的本质是电子的转移。
2.举例说明生产、生活中常见的氧化还原反应。
1.能根据反应前后元素化合价有无变化,判断反应是否为氧化还原反应。
2.能通过具体实例识别氧化剂和还原剂,逐步理解氧化和还原、氧化剂和还原剂、氧化产物和还原产物的概念。
3.举例说明生产、生活中常见的氧化还原反应。
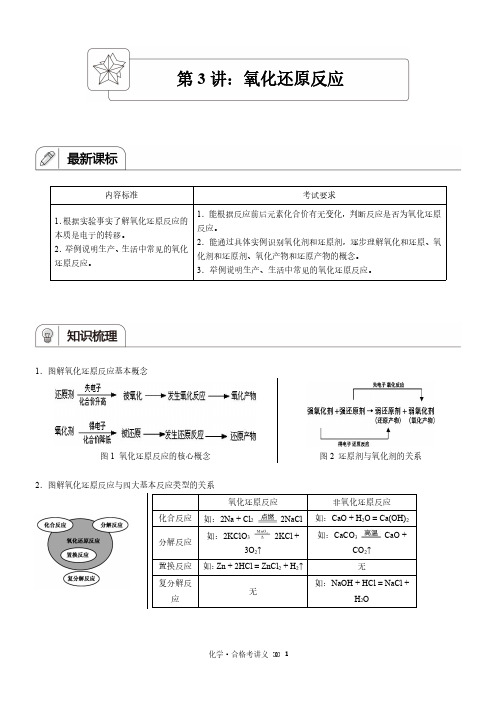
1.图解氧化还原反应基本概念图1氧化还原反应的核心概念图2还原剂与氧化剂的关系2.图解氧化还原反应与四大基本反应类型的关系氧化还原反应非氧化还原反应化合反应如:2Na +Cl 22NaCl 如:CaO +H 2O =Ca(OH)2分解反应如:2KClO 32KCl +3O 2↑如:CaCO 3CaO +CO 2↑置换反应如:Zn +2HCl =ZnCl 2+H 2↑无复分解反应无如:NaOH +HCl =NaCl +H 2O第3讲:氧化还原反应3.标注氧化还原反应电子转移的方向和数目的方法如:如:4.常用的氧化剂以及相应的还原产物氧化剂还原产物氧化剂还原产物氧化剂还原产物0价氧-2价氧0价氯-1价氯+6价硫+4价硫O2H2O、OH-等Cl2Cl-等浓H2SO4SO2等+5价氮+2价氮+3价铁+2价铁+7价锰+2价锰稀HNO3NO FeCl3FeCl2KMnO4Mn2+5.常用的还原剂以及相应的氧化产物还原剂氧化产物还原剂氧化产物还原剂氧化产物0价铝+3价铝0价铁+2或+3价铁0价氢+1价氢Al Al3+等Fe Fe2+、Fe3+等H2H+等-1价碘0价碘0价碳+2或+4价碳+2价碳+4价碳KI、I-I2C CO、CO2CO CO2。
第二章 第三节 氧化还原反应

氧化剂+还原剂=还原产物+氧化产物(强氧化性)(强还原性)(弱还原性)(弱氧化性)┌──────────┐└───────────┘得ne -失ne -第三讲:氧化还原反应一、氧化还原反应的基本概念1、氧化反应:失去电子的反应;还原反应:得到电子的反应。
2、被氧化:失去电子的变化过程;被还原:得到电子的变化过程。
3、氧化产物:还原剂在反应中失去电子后被氧化而形成的生成物;还原产物:氧化剂在反应中得到电子后被还原而形成的生成物。
4、还原剂:失去电子的物质;氧化剂:得到电子的物质。
5、还原性:还原剂具有的失去电子的性质;氧化性:氧化剂具有的得到电子的性质。
二、概念联系1、氧化还原反应与四种基本类型反应的联系a 、置换反应全部是氧化还原反应;b 、复分解反应全部是非氧化还原反应;c 、化合反应、分解反应有的是氧化还原反应,有的是非氧化还原反应。
用集合概念表示如右:2、氧化还原反应有关概念之间的相互联系:化合价升高→失去e →被氧化→发生氧化反应→是还原剂→具有还原性→对应产物是氧化产物化合价降低→得到e →被还原→发生还原反应→是氧化剂→具有氧化性→对应产物是还原产物3、氧化还原反应的电予转移的表示方法一双线桥法和单线桥法4、常见氧化剂和还原剂(1)常见的还原剂:活泼的金属单质以及H 2、C 、CO 等。
[注]元素处于低化合价时的氧化物、酸、盐。
如:CO 、SO 2、HCl 、H 2S 、Na 2SO 3 、FeSO 4等。
(2)常见的氧化剂Cl 2、Br 2、O 2、浓H 2SO 4、HNO 3、KMnO 4、KClO 3、FeCl 3、Na 2O 2、H 2O 2等。
5、氧化还原规律(1)守恒律:氧化还原反应中得失电子守恒,即:氧化剂得电子总数=还原剂失电子总数应用:有关氧化还原反应的计算及配平氧化还原反应方程式。
(2)价态律:元素处于最高价态时,只有氧化性,但不一定具有强氧化性;元素处于最低价态时,只有还原性,但不一定具有强还原性;元素处于中间价态时,既有氧化性又有还原性,但主要呈现一种性质。
氧化还原反应PPT课件

Part 01
二、氧化剂及还原剂
2、还原剂:失电子的物质。(化合价升高的物质)
1、氧化剂:得电子的物质。(化合 价降低的物质)
氧化剂
还原剂
e-
Zn + 2HCl == ZnCl2 + H2 ↑
分析:下列反应的元素化合价变化。
2Na + Cl2 = 2NaCl
+1
0
0
-1
虽然没有氧的得失,但元素的化合价发生了变化, 是氧化还原反应。
氧化还原反应
(特征)
定义: 凡有元素化合价升降的化学反应都是氧化还原反应。 判断一个反应是否为氧化还原反应的依据是否有元素化合价的改变。
练习:1、分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
电子转移及氧化还原关系的表示方法---双线桥法
再如:
升失 氧, 降 得还
化合价升高
是因为失去了电子
这种元素被氧化或 发生了氧化反应
规律:
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2 ② Zn + 2HCl == ZnCl2 + H2 ↑
练习: 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。
① Fe2O3 + 3CO 2Fe + 3CO2
② Zn + 2HCl == ZnCl2 + H2 ↑
+4
+3
+2
0
化合价升高 失2e- × 3 被氧化
0
+1
+2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三讲 氧化还原反应(二)一.课程标准1.根据实验事实了解氧化还原反应的本质是电子的转移,2.能举例说明生产、生活中常见的氧化还原反应。
二.要点提示1. 有关氧化还原反应的概念氧化剂 氧化性 被还原 还原反应 还原产物反应物 表现性质 变化过程 发生反应 所得产物还原剂 还原性 被氧化 氧化反应 氧化产物案例:探究铁及其化合物的氧化性和还原性【活动•探究】1、提出预测与假设(金属铁—还原性、氯化亚铁—氧化性和还原性、氯化铁—氧化性)【质疑】1、铁有还原性,与硫酸、硝酸反应生成是Fe 2+还是Fe 3+?2、Fe 3+有氧化性,与Cu 、Zn 反应生成是Fe 2+还是Fe ?。
【拓展实验】 氢氧化亚铁的形成与氧化:取3mLFeCl 2溶液于试管中,用长滴管吸取3mLNaOH 溶液,将滴管尖嘴部分插入FeCl 2溶液的底部后,快速挤出NaOH 溶液,观察试管里的变化。
然后将上述溶液倒入表面皿,与空气充分接触,观察现象。
【小结】铁及其化合物的相互转化关系(“铁三角”)强氧化剂主要有:Cl 2、Br 2、浓硫酸、硝酸、酸性高锰酸钾溶液。
得电子 失电子 化合价升高 化合价降低+1 0 +3 +2 0 +3 0 +2 △化学反应方程式:【思考】1、为什么工业上利用氯化铁溶液腐蚀铜箔制印刷线路板?2. 氧化性、还原性强弱比较(1)同种元素的不同价态物质氧化性与还原性强弱的判断一般说来,同一种元素从低价态到高价态的氧化性(得电子能力)逐渐增强,还原性逐渐减弱;从高价态到低价态的氧化性逐渐减弱,还原性逐渐增强。
如:氧化能力 HClO >Cl 2、FeCl 3>FeCl 2 但也有例外,如:氧化性 HClO > HClO 4(2)不同物质间氧化性、还原性强弱的判断①根据与同一种物质反应的情况判断如: 2Fe+3Cl 2====2FeCl 3 Fe+2HCl====FeCl 2+H 2↑Cl 2能将Fe 氧化至+3价,而HCl 只能将Fe 氧化为+2价,故氧化能力Cl 2>HCl 。
又如:MnO 2+4HCl (浓)====MnCl 2+Cl 2↑+2H 2O 2KMnO 4+16HCl(浓)====2KCl+2MnCl 2+5Cl 2↑+8H 2O同是将浓盐酸氧化为Cl 2,MnO 2在加热条件下进行,而KMnO 4在常温下即可进行,说明氧化能力KMnO 4>MnO 2。
②根据同一氧化还原反应判断在同一氧化还原反应中,还原性:还原剂>还原产物(弱还原剂);氧化性:氧化剂>氧化产物(弱氧化剂)。
O 氧化剂 还原剂 还原产物 氧化产物 氧化性:CuO >H 2O 还原性:H 2>Cu(3)外界条件对某物质氧化性或还原性强弱的影响①物质的浓度越高,氧化性或还原性越强。
②温度越高,氧化性或还原性越强。
③酸性越强,氧化性越强;碱性越强,还原性越强。
(4)活动顺序表 ①金属活动顺序表K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au还原性逐渐减弱K + Ca 2+ Na + Mg 2+ Al 3+ Zn 2+ Fe 2+ H + Cu 2+ Fe 3+ Ag +氧化性逐渐增强②非金属活动顺序F 2 Cl 2 O 2 Br 2 I 2 S P C Si H 2氧化性逐渐减弱F - Cl - Br - I - S 2-还原性逐渐增强注意:氧化性还原性的强弱并不决定于得失电子的数目而决定于得失电子的难易程度。
3.氧化还原反应的一般规律(1)电子守恒规律:化合价有升必有降,电子有得必有失。
对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
(2)性质强弱规律:较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
一种氧化剂同时和几种还原剂相遇时,优先与还原性强的还原剂发生反应。
同理,一种还原剂遇多种氧化剂时,氧化性最强的氧化剂优先发生反应。
(3)价态利用规律元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。
物质若含有多种元素,其性质是这些元素性质的综合体现。
同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素,相邻价态间不发生氧化还原反应。
三.典例分析例1. 下列叙述正确的是A.氧化还原反应的本质是化合价发生变化B.有单质产生的分解反应一定是氧化还原反应C.氧化剂在同一反应中既可以是反应物,也可以是生成物D.还原剂在反应中发生还原反应 例2. 下列变化需要加入氧化剂的是A.S 2-→HS -B.HCO 3-→CO 2C.2Cl -→Cl 2D.Cu 2+→Cu例3.已知:Ni+CuSO 4=NiSO 4+Cu Cu+2AgNO 3=Cu(NO 3)2+2Ag 则下列判断正确的是A.还原性:Ni>Cu>AgB.氧化性:Ni 2+>Cu 2+>Ag +C.还原性:Ni<Cu<AgD.氧化性:Ni 2+<Cu 2+<Ag +例4. (1)已知反应:2FeCl 3+2KI====2FeCl 2+2KCl+I 2 2FeCl 2+Cl 2====2FeCl 3 I 2+SO 2+2H 2O====H 2SO 4+2HI 判断下列物质的还原能力由强到弱的顺序是A.I ->Fe 2+>Cl ->SO 2B.Cl ->Fe 2+>SO 2>I-C.Fe 2+>I->Cl ->SO 2D.SO 2>I->Fe 2+>Cl -(2)已知:X2、Y2、Z2、W2四种物质的氧化能力W 2>Z2>X2>Y2,下列氧化还原反应能发生的是A.2NaW+Z 2====2NaZ +W2B.2NaX+Z 2====2NaZ+X 2四.课堂练习1.下列反应中,不属于氧化还原反应的是A.3Cl 2+6KOH====5KCl+KClO 3+3H 2OB.2NO 2+2NaOH====NaNO 3+NaNO 2+H 2OC.SnCl 4+2H 2O====SnO 2+4HClD.3CCl 4+2K 2Cr 2O 7====2CrO 2Cl 2+3COCl 2+2KCl2.下列叙述中正确的是A.含最高价元素的化合物,一定具有强氧化性B.阳离子只有氧化性,阴离子只有还原性C.失电子越多,还原性越强D.强氧化剂与强还原剂不一定能发生氧化还原反应3.下列说法错误的是( )A.在氧化还原反应中,氧化剂失电子总数一定等于还原剂得电子总数B.元素处于最低价态时只有还原性,处于最高价态时只有氧化性C.根据金属活动性顺序,由前到后,单质的还原性依次减弱D.在氧化还原反应中,一定是一种元素被还原,而另一种元素被氧化4.下列各反应中,同一种元素既被氧化又被还原的是( )A.Zn+2HCl==ZnCl 2 + H 2↑B.K 2Cr 2O 7 + 14HCl == 2KCl + 2CrCl 3 + 3Cl 2↑+7H 2O) 得电子 还原反应(氧化产物)C.4P + 6KOH == K 3P + 3KH 2PO 3D.Ca(ClO)2 + 4HCl ==2Cl 2↑+ CaCl 2 + 2H 2O5.苹果汁是人们喜爱的饮料.由于此饮料中含有Fe 2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色.若榨汁时加入维生素C, 可有效防止这种现象发生.这说明维生素C 具有( )A. 氧化性B. 还原性C. 碱性D. 酸性6.下列变化过程属于还原反应的是( )A.HCl →MgCl 2 B.Na →Na + C.CO →CO 2 D.Fe 3+→Fe7.下列各反应中,水只做氧化剂的是( )A. C+H 2O = CO+H 2B.2H 2O =2H 2↑+O 2↑C.Na 2O+H 2O=2NaOHD.CuO+H 2=Cu+H 2O8.由相同条件下的三个反应:①2A -+B 2====2B -+A 2 ②2C -+A 2====2A -+C 2 ③2B -+D 2====2D -+B 2由此可以判断: ( )A.氧化性:A 2>B 2>C 2>D 2B.还原性:C ->A ->B ->D -C.2A -+D 2====2D -+A 2该反应可以进行D.2C -+B 2====2B -+C 2该反应不能进行9.氢化钠(NaH)是一种白色的离子晶体,其中钠元素化合价为+1价,NaH 与水反应放出H 2,下列叙述中正确的是( )A.NaH 溶于水溶液呈酸性B.NaH 中氢离子可被氧化成氢气C.NaH 中氢离子可被还原成H 2D.NaH 是一种很好的还原剂10.反应Cl 2 + H 2O == HCl + HClO 属于"歧化反应".试从反应的特点分析下列反应中不属于"歧化反应"的是( )A. NO 2 + NO + 2NaOH == 2NaNO 2 + H 2OB. 3S + 6NaOH ==2Na 2S + Na 2SO 3 + 3H 2OC. 2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2D. 3KOH + 2P 4 + 9H 2O == 3KH 2PO 4 + 5PH 3 ↑11.下列叙述中正确的是A.含金属元素的离子不一定都是阳离子B.在氧化还原反应中,非金属单质一定是氧化剂C.某元素从化合态变为游离态,该元素一定被还原D.金属阳离子被还原不一定得到金属单质12.某温度下,将Cl 2通入NaOH 溶液中,反应得到NaCl 、NaClO 、NaClO 3的混合液,经测定ClO -与ClO -3的浓度之比为1∶3,则Cl 2与NaOH 溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为A.21∶5B.11∶3C.3∶1D.4∶113.已知I -、Fe 2+、SO 2、Cl -和H 2O 2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl -<Fe 2+<H 2O 2<I -<SO 2,则下列反应不能发生的是A.2Fe 3++SO 2+2H 2O====2Fe 2++SO -24+4H +B.H 2O 2+H 2SO 4====SO 2+O 2+2H 2OC.2Fe 2++I 2====2Fe 3++2I -D.SO 2+I 2+2H 2O====H 2SO 4+2HI14.在2FeS+ 6H 2SO 4(浓)===Fe 2(SO 4)3+3 SO 2↑+2S+6 H 2O 的反应中,(1)氧化剂是 ,(2)还原剂是 ,(3)氧化产物是 ,(4)还原产物是 ,(5)被氧化的元素是 ,(6)被还原的元素是 。
15.在①S 2-②Fe 3+③Fe 2+④Mg 2+⑤S ⑥Cl -⑦H +⑧SO 2⑨Fe ⑩HCl 粒子中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
