2016-2020五年高考化学专题汇编化学实验设计与探究
2020年高考化学试题分类汇编专题12 化学实验方案的设计(解析版)

专题12 化学实验基础1.[2019新课标Ⅰ]实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯【答案】D【解析】【分析】在溴化铁作催化剂作用下,苯和液溴反应生成无色的溴苯和溴化氢,装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,装置c中碳酸钠溶液呈碱性,能够吸收反应生成的溴化氢气体,倒置漏斗的作用是防止倒吸。
【详解】A项、若关闭K时向烧瓶中加注液体,会使烧瓶中气体压强增大,苯和溴混合液不能顺利流下。
打开K,可以平衡气压,便于苯和溴混合液流下,故A正确;B项、装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,溴溶于四氯化碳使液体逐渐变为浅红色,故B正确;C项、装置c中碳酸钠溶液呈碱性,能够吸收反应生成的溴化氢气体,故C正确;D项、反应后得到粗溴苯,向粗溴苯中加入稀氢氧化钠溶液洗涤,除去其中溶解的溴,振荡、静置,分层后分液,向有机层中加入适当的干燥剂,然后蒸馏分离出沸点较低的苯,可以得到溴苯,不能用结晶法提纯溴苯,故D错误。
故选D。
【点睛】本题考查化学实验方案的设计与评价,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验操作要点,结合物质的性质综合考虑分析是解答关键。
2.[2019新课标Ⅱ]下列实验现象与实验操作不相匹配的是实验操作实验现象A 向盛有高锰酸钾酸性溶液的试管中通入足量溶液的紫色逐渐褪去,静置后溶液分层的乙烯后静置B 将镁条点燃后迅速伸入集满CO2的集气瓶集气瓶中产生浓烟并有黑色颗粒产生C 向盛有饱和硫代硫酸钠溶液的试管中滴加稀有刺激性气味气体产生,溶液变浑浊盐酸D 向盛有FeCl3溶液的试管中加过量铁粉,充分黄色逐渐消失,加KSCN后溶液颜色不变振荡后加1滴KSCN溶液【答案】A【解析】A.乙烯被酸性高锰酸钾氧化生成二氧化碳无机小分子,则实验现象中不会出现分层,A 项错误;B.将镁条点燃后迅速伸入集满二氧化碳的洗气瓶,发生反应为:CO2+2Mg2MgO+C,则集气瓶因反应剧烈冒有浓烟,且生成黑色颗粒碳单质,实验现象与操作匹配,B项正确;C.向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸,发生氧化还原反应,其离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,则会有刺激性气味气体产生,溶液变浑浊,实验现象与操作匹配,C 项正确;D.向盛有氯化铁溶液的试管中加过量的铁粉,铁粉会将溶液中所有的铁离子还原为亚铁离子,使黄色逐渐消失,充分振荡后,加1滴KSCN溶液,因振荡后的溶液中无铁离子,则溶液不会变色,实验现象与操作匹配,D项正确;答案选A。
2016-2020五年高考化学试题有机化学合成与推断
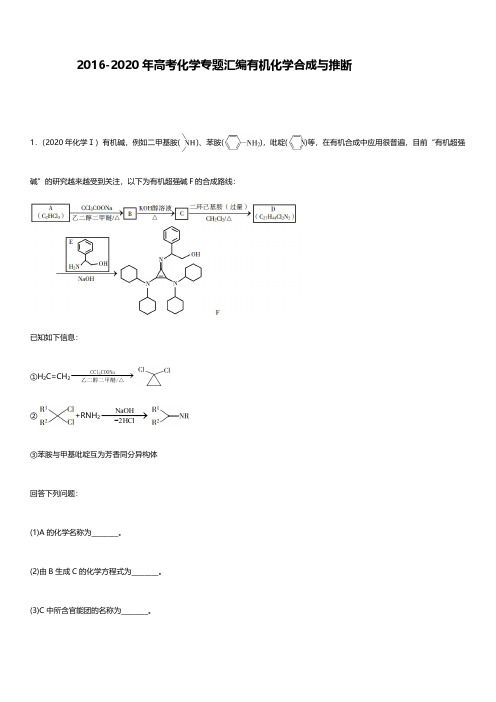
生酯化反应得到 D(
),D 再反应得到 E(
4.(2020 年天津卷)天然产物 H 具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
),据此解析解答问题。
已知:
( Z COOR-COOH 等)
回答下列问题:
(1)A 的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结构:__________。
生育酚组成,其中α-生育酚(化合物 E)含量最高,生理活性也最高。下面是化合物 E 的一种合成路线,其中部分反应略去。
已知以下信息:a) b) c) 回答下列问题: (1)A 的化学名称为_____________。 (2)B 的结构简式为______________。 (3)反应物 C 含有三个甲基,其结构简式为______________。 (4)反应⑤的反应类型为______________。 (5)反应⑥的化学方程式为______________。 (6)化合物 C 的同分异构体中能同时满足以下三个条件的有_________个(不考虑立体异构体,填标号)。
A.CHCl3 B.NaOH 溶液 C.酸性 KMnO4 溶液
D.金属 Na
(7)以
和
为原料,合成
,写出路线流程图(无机试剂和不超过 2 个碳的有机试剂任
选)_______________。 【答案】(1) (3) (6)1 a
、
、
、 H2C=CHCH2CHO (2)4
(4)加成反应 (5) C13H12O3 羰基、酯基
如下:
已知如下信息:
回答下列问题: (1)A 的化学名称是___________。 (2)B 的结构简式为___________。 (3)由 C 生成 D 所用的试别和反应条件为___________;该步反应中,若反应温度过高,C 易发生脱羧反应,生成分子式为 C8H8O2 的副 产物,该副产物的结构简式为________。 (4)写出化合物 E 中含氧官能团的名称__________;E 中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。 (5)M 为 C 的一种同分异构体。已知:1 mol M 与饱和碳酸氢钠溶液充分反应能放出 2 mol 二氧化碳;M 与酸性高锰酸钾溶液反应生 成对苯二甲酸。M 的结构简式为__________。
2016-2020五年高考化学试题电化学
2016-2020年高考化学专题汇编用电化学
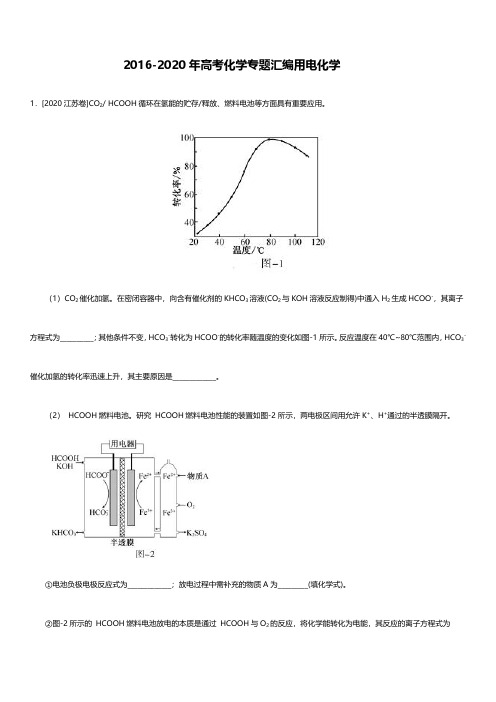
1.[2020江苏卷]CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。
在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为__________;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图-1所示。
反应温度在40℃~80℃范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是_____________。
(2)HCOOH燃料电池。
研究HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为_____________;放电过程中需补充的物质A为_________(填化学式)。
②图-2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为。
五年2016_2020高考化学真题专题点拨专题02化学计量与化学计算含解析

专题02 化学计量与化学计算【2020年】1。
(2020·新课标Ⅲ)N A 是阿伏加德罗常数的值.下列说法正确的是A .22.4 L (标准状况)氮气中含有7N A 个中子B .1 mol 重水比1 mol 水多N A 个质子C .12 g 石墨烯和12 g 金刚石均含有N A 个碳原子D .1 L 1 mol·L −1 NaCl 溶液含有28N A 个电子【答案】C【解析】标准状况下22.4L 氮气的物质的量为1mol ,若该氮气分子中的氮原子全部为14N ,则每个N 2分子含有(14-7)×2=14个中子,1mol 该氮气含有14N A 个中子,不是7N A ,且构成该氮气的氮原子种类并不确定,故A 错误;重水分子和水分子都是两个氢原子和一个氧原子构成的,所含质子数相同,故B 错误;石墨烯和金刚石均为碳单质,12g 石墨烯和12g 金刚石均相当于12g 碳原子,即12g12g/mol =1molC 原子,所含碳原子数目为N A 个,故C正确;1molNaCl 中含有28N A 个电子,但该溶液中除NaCl 外,水分子中也含有电子,故D 错误;故答案为C 。
2。
(2020·浙江卷)N A 为阿伏加德罗常数的值.下列说法正确的是( )A .24224MnO 5HCHO 12H 4Mn 5CO 11H O -++++=+↑+,41mol 4MnO 5HCHO -⎡⎤+⎣⎦完全反应转移的电子数为20N AB.用电解粗铜的方法精炼铜,当电路中通过的电子数为N A时,阳极应有32gCu转化为2Cu+C.常温下,pH9=的3CH COONa溶液中,水电离出的H+数为5A-10N D.1L浓度为1⋅的Na2CO3溶液中,阴离子数为0。
100N A0.100mol L-【答案】A【解析】Mn元素的化合价由+7价降至+2价,则4molMnO4-完全反应转移电子物质的量为4mol×[(+7)-(+2)]=20mol,即转移电子数为20N A,A正确;电解精炼铜时,阳极为粗铜,阳极发生的电极反应有:比铜活泼的杂质金属失电子发生氧化反应以及Cu 失电子的氧化反应:Cu—2e-=Cu2+,当电路中通过的电子数为N A 时,即电路中通过1mol电子,Cu失去的电子应小于1mol,阳极反应的Cu的物质的量小于0。
2020届高考化学复习之综合实验探究PPT(共18张)

实验设计与评价题:依据题中给出的信息给出实验方案及步骤,补充完善步 骤,对操作、现象的解释,对某些步骤、装置、结论作出评价。
例2 解题提示:紧扣信息,从信息中得出结论是解题的关键。本题中“用作 氧气吸收剂”是关键信息,此信息提示醋酸亚铬易被氧气氧化,必须在无氧环 境中进行。由平时熟悉的各种操作对应解决问题,如煮沸水是驱赶水中的氧, 装置中先制备气体是驱赶装置中的氧。第(3)问:分离过程紧扣信息“难溶 于冷水“第一空紧扣”冷”字,第二空是“固——液”分离操作。第(4)观 察装置,d装置是敞开与空气接触的,与“醋酸亚铬易被氧气氧化”不符。
探究一 定量实验型实验题
ⅣⅠ
定量实验题是指在实验过程中获取数据,对数据处理得出结果的实验题型, 保证数据的准确是实验目的,每一个实验步骤都是保证获得准确的数据。保 证必须实验环境(排出装置中的空气、在尾部加上防空气进入的装置)、排 除干扰(徐杂)、减少损失、正确操作、正确读数等都是围绕获得准确的数 据设计的实验步骤。在解题中按照这一思路进行分析。
本节到此结束,以下页面是第2课时的内 容,今天作业:限时训练十四
专题十四 (第2课时)
探究四 实验设计探究题
遵循实验设计原则:科学性、安全性、可行性、简约性
步骤:目的→原理→步骤→选择试剂和仪器→预设的现象和收集 数据→得出结论
例4 本题是实验探究题,先有假设后有实验验证,属于开放性题,答案有可 能不是唯一的,只要合理均可,解题时要顺应题设思路,从正反方面、排列组 合方面假设,如:本题中假设有Fe3+则反面是假设没有Fe3+,本题也可从另一角度 命题:探究反应后溶液中存在些阳离子,假设1,只存在Fe2+,假设2,只存在 Fe3+,假设3,只存在Ag+,假设4,只存在Fe2+、Fe3+,……等多种组合,并不 是每一个组合都存在,要依据题设条件找到哪一种组合是有可能的。此类题也 常设有对照实验研究某一变量对实验的影响。此类题大多数是物质检验题型, 常见物质的鉴别(检验)需掌握。(1)①小问,需对黑色固体成份作判断: 肯定有铁,可能有银,这样答题思路就清析了。(2)乙是依据现有的认识分 析问题,实验探究题往往是跳出我们的认识去探究问题。(2)③小问:在实验Ⅰ 设计中排除假设abc不成立,是利用对照实验原理,假设d的控量是:存在Ag+ 离子,故该空格填写的是原实验成份中去掉Ag+。将AgNO3改为NaNO3。第(3) 小问也可有另一种解释:因溶液中存在Ag+、Fe2+、Fe3+三种离子,Ag+具有强 氧化性,Fe2+具有还原性,两者并存,说明两者反应存在平衡: Ag++Fe2+ Ag+Fe3+,开始时Ag+浓度大,平衡右移,Fe3+增多,Fe3+与Fe反应 使Fe3+减少
2016-2020年高考化学试题化学与STSE

2016-2020五年高考化学分类汇编化学与STSE
1.【2020化学Ⅲ】宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为
Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO
3
【答案】C
【解析】A.字画主要由纸张和绢、绫、锦等织物构成,为防止受潮和氧化,保存古代字画时要特别注意控制适宜的温度和湿度,A
说法正确;
B.由孔雀石和蓝铜矿的化学成分可知,其中的铜元素、碳元素和氢元素均处于最高价,其均为自然界较稳定的化学物质,因此,用其
所制作的颜料不易被空气氧化,B说法正确;
C.孔雀石和蓝铜矿的主要成分均可与酸反应生成相应的铜盐,因此,用其制作的颜料不耐酸腐蚀,C说法错误;
D.因为氢氧化铜中铜元素的质量分数高于碳酸铜,所以Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3,D说法正确。
综上所述,相关说法错误的是C,故本题答案为C。
五年2016_2020高考化学真题专题点拨专题03离子反应与氧化还原反应含解析
专题03 离子反应与氧化还原反应【2020年】1。
(2020·新课标Ⅱ)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。
下列叙述错误的是A.海水酸化能引起3HCO-浓度增大、23CO-浓度减小B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少C.CO2能引起海水酸化,其原理为3HCO-H++23CO-D.使用太阳能、氢能等新能源可改善珊瑚的生存环境【答案】C【解析】海水酸化,H+浓度增大,平衡H++2-3CO⇌-3CO浓HCO正向移动,2-3度减小,-3CO浓度减小,导HCO浓度增大,A正确;海水酸化,2-3致CaCO3溶解平衡正向移动,促进了CaCO3溶解,导致珊瑚礁减少,B正确;CO2引起海水酸化的原理为:CO2+H2O⇌H2CO3⇌H++-3HCO⇌H++2-3CO,导致H+浓度增大,CHCO,-3错误;使用太阳能、氢能等新能源,可以减少化石能源的燃烧,从而减少CO2的排放,减弱海水酸化,从而改善珊瑚礁的生存环境,D正确;答案选C。
2。
(2020·新课标Ⅲ)对于下列实验,能正确描述其反应的离子方程式是A .用Na 2SO 3溶液吸收少量Cl 2:2-2322343SO +Cl +H O =2HSO +2Cl +SO ---B .向CaCl 2溶液中通入CO 2:2++223Ca+H O+CO =CaCO +2H ↓C .向H 2O 2溶液中滴加少量FeCl 3:3++2+2222Fe+H O =O +2H +2Fe ↑D .同浓度同体积NH 4HSO 4溶液与NaOH 溶液混合:+4NH 32+OH =NH H O⋅-【答案】A【解析】用Na 2SO 3溶液吸收少量的Cl 2,Cl 2具有强氧化性,可将部分SO 错误!氧化为SO 错误!,同时产生的氢离子与剩余部分SO 错误!结合生成HSO 错误!,Cl 2被还原为Cl -,反应的离子反应方程式为:3SO 2-,3+Cl 2+H 2O=2HSO -3+2Cl —+SO错误!,A 正确;向CaCl 2溶液中通入CO 2,H 2CO 3是弱酸,HCl 是强酸,弱酸不能制强酸,故不发生反应,B 错误;向H 2O 2中滴加少量的FeCl 3,Fe 3+的氧化性弱于H 2O 2,不能氧化H 2O 2,但Fe 3+能催化H 2O 2的分解,正确的离子方程式应为2H 2O 23+ Fe2H 2O+O 2↑,C 错误;NH 4HSO 4电离出的H +优先和NaOH 溶液反应,同浓度同体积的NH 4HSO 4溶液与NaOH 溶液混合,氢离子和氢氧根恰好完全反应,正确的离子反应方程式应为:H ++OHˉ=H 2O ,D 错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学实验设计与探究
1.(2020
年新课标Ⅰ)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10mol·L−1FeSO
4
溶液,需要的仪器有药匙、玻璃棒、
_________(从下列图中选择,写出名称)
。
(2)
电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化
学反应,并且电迁移率
(u
∞
)应尽可能地相近。根据下表数据,盐桥中应选择____________
作
为电解质。
阳离子u
∞×108/(m2·s−1·V−1)阴离子u∞×108/(m2·s−1·V−1
)
Li+4.073HCO4.61
Na+5.193NO7.40
Ca2+6.59Cl−7.91
K+7.6224SO8.27
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________
电极溶液
中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol·L
−1
。石墨电极上未见
Fe
析出。可知,石墨电极溶液中
c(Fe
2+
)=________
。
