附录pdf
附录一、附录二

附录一、附录二附录一珍的三个预言冒险。
赛斯的评论。
珍心智的内容。
这个附录包含珍.罗伯兹的三篇(未发表的)谈三种不同的「预言」和预知经验的随笔。
另外也包括了一段赛斯有关珍在一种相似经验上的才能的摘录。
珍在她的书:《如何开发你的ESP力量》《意识的探险》《心灵的政治》及《珍的神》里,都讨论过「预言」和「预知」。
珍在一九八〇与一九八一年写下这些随笔。
这里是摘自她的日志,我尽可能的不修改,以保存她的原始精神。
珍通常为她「自己的」书写好几次草稿,却以最终的稿本形式说出她替赛斯传述的书。
(二九八〇年五月)这小小的事件令我非常着迷。
周三晚,赛斯课后,在上床前,我突然开始好奇,不知罗在六〇年代卖给利布晚餐倶乐部的几幅画是否仍在那儿。
当我们躺在床上准备要休息时,罗和我开始谈起那些画。
我记得并且描述了其中三幅,虽然还要点是,对于我们通常忽略,而科学无法证明或反对的心智之心理内容保持警觉,在那儿我们重视经验更甚于理论。
这是另一个典型的例子,科学会简单地标示一件事为「巧合」,而未能给予任何客观性证据来支持其论点。
「自然的」主观经验--所涉及的感受--给了相反的解释。
它们坚持,涉及的不只是巧合,那事件是具重要意义的。
而在这种例子里,我们完全有权去顺从直接经验及我们的感受。
我们太常只想全速向前进--我们要崇高的憧憬。
但在此,在这些主观行动的微妙旁道里,我们很有可能看到一些具体事件所倚赖的这些隐蔽的心灵行动…以及今日的事件又如何与去年的事件彼此摩擦,就像同一株树上的叶子一样。
以及,赛斯去年八月的课如何像是很新鲜的适用于今天的事件。
在同时,这整个事情是旣鬼崇又明显的。
举例来说,今天,在我开始工作之前,在「一九八一年八月二十四日,预言。
」的标题下,快速地我潦草写下十个短句。
我花了约三分钟左右。
(完全以珍所写的样子呈现于下。
)预言--一九八一年八月二十四日星期一--中午1雪球机2重约了曾取消的约会3鸡蛋盒子4突出的三角--也许是礼物5雪鞋?6盒装蜡笔7送牛奶的人8侦探9炉子早送来了5两位数的系列一点左右,当罗和我在厨房吃完午餐,并且在等候邮差时,一位读友出现了。
新版2010GMP附录(原料药)

附录2:原料药第一章范围第一条本附录适用于非无菌原料药生产及无菌原料药生产中非无菌生产工序的操作。
第二条原料药生产的起点及工序应当与注册批准的要求一致。
第二章厂房与设施第三条非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应当按照D级洁净区的要求设置。
第四条质量标准中有热原或细菌内毒素等检验项目的,厂房的设计应当特别注意防止微生物污染,根据产品的预定用途、工艺要求采取相应的控制措施。
第五条质量控制实验室通常应当与生产区分开。
当生产操作不影响检验结果的准确性,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
第三章设备第六条设备所需的润滑剂、加热或冷却介质等,应当避免与中间产品或原料药直接接触,以免影响中间产品或原料药的质量。
当任何偏离上述要求的情况发生时,应当进行评估和恰当处理,保证对产品的质量和用途无不良影响。
第七条生产宜使用密闭设备;密闭设备、管道可以安置于室外。
使用敞口设备或打开设备操作时,应当有避免污染的措施。
第八条使用同一设备生产多种中间体或原料药品种的,应当说明设备可以共用的合理性,并有防止交叉污染的措施。
第九条难以清洁的设备或部件应当专用。
第十条设备的清洁应当符合以下要求:(一)同一设备连续生产同一原料药或阶段性生产连续数个批次时,宜间隔适当的时间对设备进行清洁,防止污染物(如降解产物、微生物)的累积。
如有影响原料药质量的残留物,更换批次时,必须对设备进行彻底的清洁。
(二)非专用设备更换品种生产前,必须对设备(特别是从粗品精制开始的非专用设备)进行彻底的清洁,防止交叉污染。
(三)对残留物的可接受标准、清洁操作规程和清洁剂的选择,应当有明确规定并说明理由。
第十一条非无菌原料药精制工艺用水至少应当符合纯化水的质量标准。
第四章物料第十二条进厂物料应当有正确标识,经取样(或检验合格)后,可与现有的库存(如储槽中的溶剂或物料)混合,经放行后混合物料方可使用。
应当有防止将物料错放到现有库存中的操作规程。
附录1.世卫组织针对成人、青少年及儿童的HIV感染临床分期

12206208210212213214218附录1. 世卫组织针对成人、青少年及儿童的HIV感染临床分期体系来源:改编自世卫组织成人及儿童HIV监测病例诊断标准及HIV相关疾病临床分期和免疫学 分类修订版。
日内瓦,世卫组织,2007(www.who.int/hiv/pub/guidelines/HIVstaging 150307.pdf)。
12. 附录206使用抗病毒药物治疗和预防艾滋病毒感染的综合指南a本表中,青少年定义为15岁或以上。
对于不足15岁者,应采纳儿童临床分期标准。
b 对于5岁以下儿童,中度营养不良定义为身高标准体重<-2倍z-值或上臂中部周径≥115mm,<125mm。
c一些特定症状可纳入地区性分类内容,如亚洲地区的青霉病,南非地区的HIV相关直肠阴道瘘以及拉丁美洲地区的再发性锥体虫病。
d对于5岁以下儿童,严重消耗综合征定义为身高标准体重<3倍z-值;发育障碍短小症定义为年龄别身长/年龄别身高<2倍z-值;严重畸形营养不良定义为身高标准体重<-2倍z-值或上臂中部周径<115mm,或出现浮肿。
20712. 附录附录1. 世卫组织针对成人、青少年及儿童的HIV感染临床分期体系附录2. 2013年成人及青少年抗病毒治疗流程建议a附录1中列出的世卫组织HIV疾病临床分期b患者出现严重或晚期症状(WHO临床3期或4期),不考虑CD4+T淋巴细胞计数优先启动ART ;或者CD4+T淋巴细胞计数≤350/mm 3,不考虑临床症状,优先启动ART。
c活动性结核指结核突破潜伏并导致疾病发生。
潜伏性结核感染指免疫系统成功抑制结核杆菌,并阻止疾病发生。
d严重慢性肝脏疾病包括归类为代偿期和失代偿期的肝硬化和晚期肝脏疾病。
失代偿期肝硬化定义为出现明显临床并发门静脉高压症状(腹水、静脉曲张出血和肝性脑病)或肝功能不全(黄疸)。
e 怀孕及哺乳HIV感染女性的抗病毒治疗(方案B和方案B+)详见附录3和低7.1.2、7.1.3、7.2.2节。
2020年新版GMP及附录完整版(共12个附录)

药品生产质量管理规范(2010年修订)《药品生产质量管理规范(2010年修订)》2011年02月12日发布历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)今天对外发布,将于2011年3月1日起施行。
《药品生产质量管理规范》(以下简称药品GMP)是药品生产和质量管理的基本准则。
我国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
药品GMP的修订是药监部门贯彻落实科学发展观和医疗卫生体制改革要求,进一步关注民生、全力保障公众用药安全的又一重大举措,它的实施将进一步有利于从源头上把好药品质量安全关。
1998年修订的药品GMP的实施,在提升我国药品质量、确保公众用药安全方面发挥了重要的作用,取得了良好的社会效益和经济效益。
随着经济的发展和社会的进步,世界卫生组织及欧美等国家和地区药品GMP的技术标准得到很大的提升,新的理念和要求不断更新和涌现,我国现行药品GMP需要与时俱进,以适应国际药品GMP发展趋势,也是药品安全自身的要求。
我国现有药品生产企业在整体上呈现多、小、散、低的格局,生产集中度较低,自主创新能力不足。
实施新版药品GMP,是顺应国家战略性新兴产业发展和转变经济发展方式的要求。
有利于促进医药行业资源向优势企业集中,淘汰落后生产力;有利于调整医药经济结构,以促进产业升级;有利于培育具有国际竞争力的企业,加快医药产品进入国际市场。
新版药品GMP修订的主要特点:一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。
EMA残留溶剂指南附录.pdf
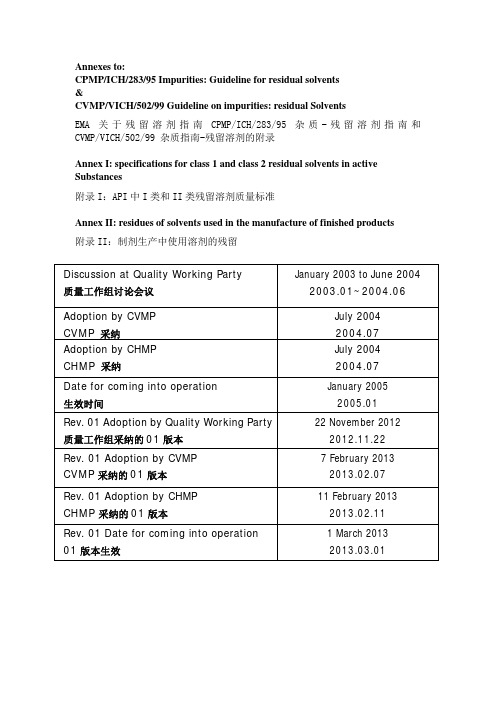
Annexes to:CPMP/ICH/283/95 Impurities: Guideline for residual solvents&CVMP/VICH/502/99 Guideline on impurities: residual SolventsEMA关于残留溶剂指南CPMP/ICH/283/95 杂质-残留溶剂指南和CVMP/VICH/502/99 杂质指南-残留溶剂的附录Annex I: specifications for class 1 and class 2 residual solvents in active Substances附录I:API中I类和II类残留溶剂质量标准Annex II: residues of solvents used in the manufacture of finished products附录II:制剂生产中使用溶剂的残留Discussion at Quality Working Party 质量工作组讨论会议January 2003 to June 2004 2003.01~2004.06Adoption by CVMP CVMP 采纳July 2004 2004.07Adoption by CHMP CHMP 采纳July 2004 2004.07Date for coming into operation 生效时间January 2005 2005.01Rev. 01 Adoption by Quality Working Party 质量工作组采纳的01版本22 November 20122012.11.22Rev. 01 Adoption by CVMP CVMP采纳的01版本7 February 2013 2013.02.07Rev. 01 Adoption by CHMP CHMP采纳的01版本11 February 2013 2013.02.11Rev. 01 Date for coming into operation 01版本生效1 March 2013 2013.03.01Introduction前言The two (V)ICH residual solvents guidelines, ICH Q3C Impurities: Guideline for residual solvents (CPMP/ICH/283/95) and VICH GL18 Guideline on impurities: residual solvents in new veterinary medicinal products, active substances and excipients (CVMP/VICH/502/99), have been in operation for several years, since March 1998 and June 2001 respectively.虽然ICH颁布的ICH Q3C 杂质: 残留溶剂指导原则 (CPMP/ICH/283/95) 和VICH GL18 杂质指导原则:兽用药、API和辅料(CVMP/VICH/502/99)中的残留溶剂这两个关于残留溶剂的指南分别从1998.03和2001.06就开始被采纳应用。
新版GMP附录医用氧.pdf

量符合要求。可以在加入前取样,也可以在混合后取样。 第二十四条 医用氧的充装生产过程应符合以下规定: (一)生产批号的划分应以同一连续生产周期中充装的医用氧
为一个批次。 (二)气瓶应符合相关规定,对回收的气瓶应予确认,不得充
装自有气瓶外的其他气瓶。 (三)应根据书面规程对充装设备、管路进行清洁及置换,并
—3—
学历(或中级专业技术职称),具有三年以上医用氧生产和质量管 理经验,其中至少一年的医用氧质量管理经验。
第八条 从事医用氧生产的人员应定期接受医用氧相关知识培 训,涉及特种设备操作人员应按国家规定持有有效的并与医用氧生 产相适应的资格证书。
第九条 应根据需要,为员工配备相应的工作服和安全防护用 品。
第三章 人 员 第六条 企业的生产管理负责人应具有相关专业(如化工、药 学、化学、机械和工业工程等)大专以上学历或中级专业技术职称, 具有三年以上的医用氧的生产和质量管理经验,其中至少一年的医 用氧生产管理经验。 第七条 企业的质量管理负责人和质量受权人应具有相关专业 (如化工、药学、化学、机械和工业工程等)大专以上(含大专)
—7—
8.确认气瓶的安全附件齐全并符合安全要求。 (六)重复使用的气瓶充装前应对瓶体进行清洗消毒,再用置 换法或者抽真空法处理至合格,抽真空应不小于 15kPa。或对每个 气瓶进行剩余气体全检。 (七)应采用适当的方法检查确认气瓶已充装。 (八)医用氧充装后,每只气瓶均需检漏,检漏不合格视为不 合格品,检漏过程不得影响医用氧产品质量。检漏合格对瓶嘴进行 密封,气瓶加戴瓶帽和防震圈,放入待检区域。 (九)每个气瓶都应贴有产品标签,标签上应注明:品名、企 业名称、生产地址、生产批号、生产日期、有效期、氧气数量、压 力、执行标准等。
第六章 生产管理 第二十二条 生产过程的所有关键步骤应经过验证。 第二十三条 液氧的生产应遵循以下原则: (一)分离和纯化工艺应经过验证,并按照工艺要求进行日常 监控。对于消耗性部件(如纯化过滤器的滤芯)的维护和更换,应 根据验证和监控的结果定期进行。 (二)生产过程应有连续质量和杂质监控措施,并有监测记录。 (三)用于监控工艺过程的计算机系统应经过验证。 (四)连续生产过程批次的划分应有文件规定,并按批次进行 取样检验。 (五)液氧的充装和转移操作等步骤应有防止污染措施,转移 管路应配备有止回阀或采取其他等同的措施。 (六)向装有液氧的液氧贮槽中加入液氧,必须证明液氧的质
《核电厂抗震设计规范》(正文、附录和条文说明).pdf
i 振型与 j 振型的相关系数; 分别为地基水平、竖向和摆动方向的辐射阻尼比; 阻尼比; 分别为对应 i 振型与 j 振型的阻尼比; 子结构总质量与主结构总质量的比值; 子结构基本频率与主结构主导频率的比值; 结构的基本自振圆频率。
ξ——
ξi、ξj —— λm —— λf —— ω1——
分别为基础沿水平、竖向和摆动方向的阻尼系数; 结构的阻尼矩阵; 分别为沿管道轴向和横向的基床系数; 分别为地基的水平、竖向和摆动方向的弹簧刚度; 分别为基础置于地表时的地基水平、竖向和摆动方向的弹簧 刚度; 分别为考虑基础置效应时的地基水平、竖向和摆动方向的附 加弹簧刚度; 结构的刚度矩阵; 地基弹簧刚度矩阵; 结构质量; 结构的质量矩阵; 反应谱; 设备所在楼层反应谱的最大谱值; 对应频率 i 的反应谱值; 动力阻抗矩阵; 位移影响矩阵; 输入反应谱中对应零周期的加速度谱值,即输入加速度峰值; i 支承点处反应谱的零周期加速度谱值; 分别为对应 i 振型与 j 振型的频率; 结构最低固有频率; 分别为沿管道轴向和横向的地基弹簧刚度; 输入结构体系的加速度矢量;
1 总则
1.0.1 本规范编制旨在贯彻国家防震减灾及核安全相关法律法规,严格执行民用核设施安 全第一的方针,确保核电厂运行安全、质量可靠、技术先进、经济合理。 1.0.2 本规范适用于极限安全地震动加速度峰值不大于 0.5g 地区的新建压水堆核电厂的抗 震设计,其基本原则和抗震计算方法也适用于重水堆、气冷堆和快中子堆核电厂。 1.0.3 核电厂工程厂址必须进行地震安全性评价以确定厂址的设计基准地震动。 1.0.4 按本规范设计的核电厂,当遭受极限安全地震动影响时,应能确保反应堆冷却剂压 力边界完整、反应堆安全停堆并维持安全停堆状态,且放射性物质释放对环境的影响不超 过国家规定的限值;当遭受运行安全地震动影响时,需停堆进行安全检查,在确认核电厂 相关物项保持安全功能的前提下可恢复正常运行。 1.0.5 核电厂物项的抗震设计应满足核电厂的整体安全要求;核电厂物项应依抗震分类实 施抗震设计,抗震分类应与核电厂各物项的安全重要性分级相对应。 1.0.6 核电厂物项的抗震分类可划分为抗震Ⅰ类、抗震Ⅱ类和非核抗震类。各具体物项的 抗震分类可采用相关技术标准的规定。 1.0.7 抗震Ⅰ、Ⅱ类物项的抗震设计应采用本规范规定的方法;非核抗震类物项的抗震设 计应满足适用的非核设施抗震设计规范的要求。 1.0.8 核电厂抗震设计除应符合本规范规定外,尚应符合相关技术标准的规定。
PDF-规范
P D F-规范(总125页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--PDF 规范第六版Adobe®便携式文件格式版本2006年11月Adobe系统公司目录目录................................................ 错误!未定义书签。
前言................................................ 错误!未定义书签。
第1章介绍......................................... 错误!未定义书签。
关于本书 ...................................... 错误!未定义书签。
PDF 功能简介 .................................. 错误!未定义书签。
相关文献 ...................................... 错误!未定义书签。
版权说明 ...................................... 错误!未定义书签。
第2章概述......................................... 错误!未定义书签。
图像模型 ...................................... 错误!未定义书签。
其他通用特性 .................................. 错误!未定义书签。
创建PDF ....................................... 错误!未定义书签。
PDF和PostScript语言.......................... 错误!未定义书签。
第3章语法......................................... 错误!未定义书签。
2020年新版GMP及附录完整版(共12个附录)
药品生产质量管理规范(2010年修订)《药品生产质量管理规范(2010年修订)》2011年02月12日发布历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)今天对外发布,将于2011年3月1日起施行。
《药品生产质量管理规范》(以下简称药品GMP)是药品生产和质量管理的基本准则。
我国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
药品GMP的修订是药监部门贯彻落实科学发展观和医疗卫生体制改革要求,进一步关注民生、全力保障公众用药安全的又一重大举措,它的实施将进一步有利于从源头上把好药品质量安全关。
1998年修订的药品GMP的实施,在提升我国药品质量、确保公众用药安全方面发挥了重要的作用,取得了良好的社会效益和经济效益。
随着经济的发展和社会的进步,世界卫生组织及欧美等国家和地区药品GMP的技术标准得到很大的提升,新的理念和要求不断更新和涌现,我国现行药品GMP需要与时俱进,以适应国际药品GMP发展趋势,也是药品安全自身的要求。
我国现有药品生产企业在整体上呈现多、小、散、低的格局,生产集中度较低,自主创新能力不足。
实施新版药品GMP,是顺应国家战略性新兴产业发展和转变经济发展方式的要求。
有利于促进医药行业资源向优势企业集中,淘汰落后生产力;有利于调整医药经济结构,以促进产业升级;有利于培育具有国际竞争力的企业,加快医药产品进入国际市场。
新版药品GMP修订的主要特点:一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。
WHO制药用水附录_WHO_TRS_970_chi_46_2012
1������ 2������ 4 药品的给药途径决定了所用水质的不同质量要求ꎮ 有关不同级别制药用水的指导原则可参见药典和相关文件ꎮ
1 本文件是 2005 年ꎬ 世界卫生组织药品标准专家委员会第 39 次技术报告附录 3: WHO 药品生产质量管理规范的修订版本ꎮ
������45������
7������ 3 对系统的持续监测 7������ 4 制药用水系统的维护 7������ 5 系统审查 8 制药用水系统的检查 参考文献
������46������
1 绪论
1������ 1 文件的适用范围
1������ 1������ 1 本文件中的指导原则提供了当前制药用水 ( WPU) 质量标准的相关信息ꎬ 提供了该指导原则的适用范围 ( 如药物活 性成分 ( APIs) 生产用水和制剂生产用水) ꎬ 提供了药品生产质 量管理规范 ( GMP) 中关于制药用水系统设计、 安装和操作的指 导原则ꎮ 虽然本文件的重点是制药用水的有关内容ꎬ 当其他工业 领域或某些特殊用途与该指导原则相关时ꎬ 也可应用相关的质量 标准和规范ꎮ
������48������
剂能被有效去除ꎮ
3 水质标准
3������ 1 概述
3������ 1������ 1 以下质量要求涉及散装水的生产、 贮存和分配ꎬ 不 包括患者服药时的配伍用水的质量标准ꎮ 散装水和制剂用水的质 量标准在药典中都有收录ꎮ
3������ 1������ 2 国家药典、 区域性药典和 « 国际药典» 中都收录制 药用水的质量标准ꎬ 同时还给出了制药用水中各种污染物的限度 规定ꎮ 如果制药用水生产企业希望向多个市场供应产品ꎬ 那么企 业设定的质量标准应符合相关药典中最严格的质量要求ꎮ
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物释放性能研究
附录三:
参会注意事项
一. 口头报告时间为 15 分钟/每人,请自备 PPT 演示;墙报版面制作 规格为 90 cm(宽)×120 cm(高),请于注册当日(10 月 9 日下 午)按照指定位置张贴。
二. 会务组为本市参会研究生提供免费餐饮,为外地受邀参会研究生 提供免费餐饮和住宿(10 月 9、10 日两晚)。 住 宿 地 址 :布丁酒店(上海松江大学城欢乐谷店),松江区龙源 路 1208 弄 148 号(广富林路和龙源路交叉口)。 联系电话:(021)37723355 会 议 地 址 :东华大学松江校区图文信息中心(上海市松江区人民
响
学)
14:45-15:00 硅酸钙涂层的表面纳米化制备及其促生物学 王秀惠(上海硅
性能研究
酸盐研究所)
15:00-15:15
茶歇
研究生报告 II. 药物缓释系统和纳米探针(15:15-16:45)
主持人:张传森,朱利民
图文信息中心第二报告厅
15:15-15:30 新型纺织基伤口清创材料的生物相容性评价 付译鋆(东华大
A19 刘艳丽 基于层层自组装修饰聚己内酯多孔薄膜应用于细胞培养 A20 王会 掺锌硼酸盐玻璃支架的制备及其性能研究 A21 黄鹏 基于β-甘油磷酸盐的新型磷酸化促骨再生聚合物 A22 王晓明 氨水改性对 PGA/PLGA 编织型输尿管支架管降解性能影响 A23 袁柳 氧化海藻酸钠与改性明胶的快速交联胶黏剂 A24 邢娟 材料表面化学影响成骨细胞对低强度流体剪切力的敏感性
PEI 脂质体-丝素蛋白纳米纤维骨支架的制备及其生物相容性评 B44 陈梦霞
价 B45 李大伟 利用圆盘无针静电纺丝技术制备 PCL/明胶复合纳米纤维 B46 孙彬彬 明胶/透明质酸纳米纤维膜的制备及组织工程应用 B47 王静 负载肝素和 VEGF 的 P(LLA-CL)覆膜支架的性能研究 B48 宋炜 导电型静电纺纳米纤的制备及其表征
9:10-9:40
戴尅戎(上海交通大学医学院附属第九人民
医院)
主持人:
组织工程研究的新进展
崔福斋
9:40-10:10
曹谊林(上海交通大学医学院附属第九人民 医院)
10:10-10:25
茶歇
10:25-10:55
从 矿 化 胶 原 研 究 ---谈 科 研 选 题 崔福斋(清华大学)
10:55-11:25
附录一:
上海市“生物材料与组织工程”研究生论坛会议程序
注册及张贴墙报(15:00-18:30)(2014 年 10 月 9 日)
图文信息中心大厅
晚餐(17:00-18:30)
东华大学第二食堂 3 楼
注册(8:00-8:40)(2014 年 10 月 10 日)
图文信息中心大厅
开幕式(8:40-9:10)
Poster B:组织工程支架
序号 B01 B02 B03 B04 B05 B06 B07 B08 B09 B10 B11 B12 B13 B14 B15 B16 B17 B18 B19 B20 B21 B22 B23 B24 B25
投稿人
论文题目
高珊 可释放 MCP-1 的 PCL/CS 复合膜促进体内微血管形成
和性能研究 B27 张珏 BG/PEEK 复合多孔硬组织植入材料的研究 B28 唐珺 共培养模型中成纤维细胞对内皮细胞微血管化的促进作用 B29 徐磊 间充质干细胞对软骨细胞形态和增殖的调控 B30 龚文澜 PCL 多孔微球制备及表面修饰对成纤维细胞粘附增殖的影响 B31 李晓童 组织工程化心传导束的形变 B32 袁鑫立 组织工程化房室结的体外构建 B33 刘镇 REDV 修饰对脱细胞带瓣静脉支架体外再内皮化的影响 B34 尹志兰 元素掺杂羟基磷灰石纤维的制备及组成调控 B35 孙园园 磁性纳米多孔聚 L-谷氨酸/壳聚糖微胶囊的制备 B36 张丹青 聚 L-谷氨酸基软骨基质模拟支架的构建及其软骨再生应用 B37 吴杰 天然多糖调制的聚(L-谷氨酸)静电复合多孔支架 B38 关颖 覆膜支架顺应性的测试方法探索 B39 管晓宁 覆膜组织结构对腔内隔绝术用人工血管疲劳性能的影响 B40 李超婧 针织物密度对 PLA/PCL 复合血管支架的力学性能能影响 B41 侯丹丹 编织工艺对医用抗菌真丝编织缝合线的性能影响研究 B42 李赵波 静电纺丝素蛋白/BAMG 搭载 VEGF 构建组织工程支架材料 B43 林思 绿色工艺制备负载葡萄籽提取物的丝素纳米纤维面膜
“雨水”与“土壤”的对话 骨组织工程多孔支架的血管化规律研究 卢建熙(上海贝奥路生物材料有限公司)
主持人: 任杰
11:25-11:50
静电纺纳米纤维及纳米纱用于组织再生 莫秀梅(东华大学)
午餐(11:50-13:00)
东华大学第二食堂 3 楼
研究生报告 I. 生物材料合成及组织工程支架(13:00-15:00)
秦嘉邦 聚吡咯-聚乳酸复合丝膜的构建及其蛋白结合研究
卢霄 可降解含银多孔β-磷酸三钙生物陶瓷
谭震 钛表面微纳结构制备及原位沉积磷酸钙的研究
许韬韬 热处理糖球制孔剂制备贯通多孔 HA 支架
崔静 Zein/PVA-SbQ 纳米材料的制备及其生物应用
吴惠英 丝素纤维复合韧带材料的构建
别诗宇 韧性丝素蛋白类凝胶膜材料研究
主持人:莫秀梅
图文信息中心第二报告厅
8:40-8:45
东华大学校长致欢迎词
8:45-8:50
上海市教委领导致辞
8:50-8:57
东华大学化学化工与生物工程学院院长致辞
8:57-9:00
研究生代表发言
9:00-9:10
集体合影
大会邀请报告(9:10-11:50)
图文信息中心第二报告厅
3D 打印及其材料学需求
“生物材料与组织工程”研究生论坛墙报分类
Poster A:生物材料合成与改性
序号 A01
A02
A03 A04 A05 A06 A07 A08 A09 A10 A11 A12 A13 A14 A15 A16 A17 A18
投稿人 王翠伟
漆超
赵灿灿 黄千里 胡彬 康灵芝 盛露瑶 周雪 王自豪 陈思原 王园园 赵鹏 李纯婷 姚燕杰 张彬 王大力 陈蕊 徐家柱
黄玉清 鲢鱼皮胶原海绵的制备及其性能研究
郭振超 蛋黄液促进较大细胞团在蛋清中的形成
曲亚运 生物材料表面血清吸附蛋白质介导细胞粘附的蛋白质组学研究
吴宏流 大尺寸 TiO2 纳米管生物相容性研究
张楷乐 纳米纱与纳米纤维膜构建兔尿道的初步对比研究
静电纺丝胶原/壳聚糖复合纳米纤维皮肤创面修复材料的制备 B26 周恬
Poster C:分子探针与影像
序号 C01 C02 C03
C04 C05
投稿人 段磊 吴昊 刘恬
周本青 罗宇
论文题目 表面装载不同浓度磁性纳米颗粒微气泡的特性及其超声/磁共 振双模式成像研究 纳米银诱导自噬在胶质瘤放射增敏中的应用 磁共振和超声双模态造影剂的制备及其在淋巴靶向成像中的应 用 叶酸靶向的聚乙二醇化聚乙烯亚胺包裹金纳米颗粒用于肿瘤靶 向 CT 成像的研究 PEI 介导的多功能 Mn3O4 纳米颗粒的制备及其 MR 成像应用
章艺 三层复合小口径人工血管的生物力学性能研究
张芳 BS-12 诱导丝素蛋白形成水凝胶的结构和性能研究
文建华 壳寡糖/胶原复合凝胶对 hMSCs 细胞的影响
李真真 基于胆固醇修饰的骨修复材料细胞生物学研究
李文强 PLLA 环带球晶对 MC3T3-E1 细胞的接触引导的影响
叶碧华 用于结膜修复的多糖基可注射水凝胶
宋会娟 EFK8 水凝胶的形成及其在三维细胞培养中的应用
夏婷 PLGA-壳聚糖双层复合膜制备与 BMP 蛋白纯化研究
姚生莲 定向纤维蛋白水凝胶束在神经修复中的研究
吴赛 羟基磷灰石表面蛋白吸附与细胞黏附、分化的关系
李秀媛 胶原不对称抗菌双层膜的制备及性能研究
李陆艳 基因活性胶原壳聚糖支架实现组织修复及附属器官再生
学)
15:30-15:45 植入式鱼胶原基缓释药膜的制备及性能研究 曹欢(福州大学)
15:45-16:00 载细胞/药物的海藻酸钠水凝胶体系的构建及 匙峰(西南交通
其活性研究
大学)
16:00-16:15 磁响应 PLGA 载药微囊的制备及在肿瘤磁热 房坤(东南大学)
疗联合化疗中的应用
16:15-16:30 SERS 金核壳探针的制备及其在细胞成像中 胡冲娅(上海交
主持人:卢建熙,何创龙
图文信息中心第二报告厅
时间
报告题目
报告人
13:00-13:15 基于类乙酰胆碱功能基的神经活性聚合物
王少飞(东华大 学)
13:15-13:30 含侧氨基聚氨酯弹性体的合成及磷酰胆碱功 方俊(东华大学)
能化修饰
13:30-13:45 可用于软骨缺损修复的纤维蛋白大孔支架的 代元坤(浙江大
论文题目 肌醇为核的星形聚己内酯的合成及表征 碳酸钙/二磷酸果糖复合纳米材料及其在微波水热条件下的转 变与应用研究 有序微米图案结构的 HA 生物陶瓷的制备及其性能研究 采用选择性激光熔化技术制备生物医用钛合金 基于聚富马酸丙二醇酯生物可降解不饱和聚氨酯的合成及表征 用于组织修复与再生的透明质酸寡糖的酶法制备 聚合物微球及纤维在多孔 HA 支架表面的组装 含铜多孔分级结构羟基磷灰石微球的制备及表征 中性环境下放射状多级结构纳米羟基磷灰石的合成与表征 一氧化氮催化生成型人工血管的构建及评价 构建 REDV 功能化及原位催化 NO 生成的人工血管 MIM 在细胞吞噬纳米颗粒过程中的作用 双硒键交联的纳米凝胶作为大分子药物用于癌症治疗 全氟化碳乳剂的制备及其对细胞复氧的影响 双亲性粘结剂的制备及纳米 SiO2 的改性研究 超分子核苷磷脂的可控合成,自组装及生物应用 酸敏感两亲性超支化聚缩醛的合成及应用 脱细胞基质修饰电纺纤维材料的制备及应用
