有机化学
有机化学全部课程

目录
• 有机化学绪论 • 烃类化合物 • 官能团化学 • 立体化学与反应机理 • 有机合成策略与技巧 • 天然产物与药物化学简介
01
有机化学绪论
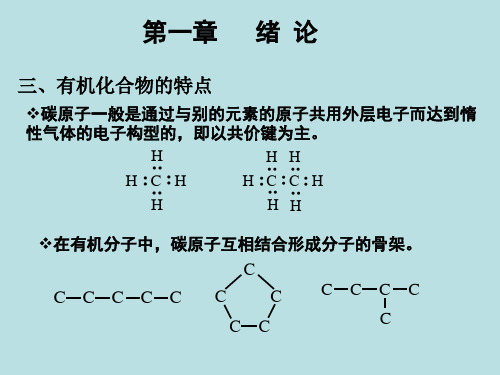
有机化学定义与特点
定义
有机化学是研究有机化合物的结构、性质、合成和反应机理的一门科学。
特点
有机化合物种类繁多,结构复杂,性质各异;反应类型多样,机理复杂;与生 命现象密切相关。
稠环芳香烃
了解稠环芳香烃的结构特点、物理性质和化 学性质,如萘、蒽等。
苯的结构与性质
理解苯的分子结构特点,掌握其物理性质和 化学性质,如取代反应、加成反应等。
非苯芳香烃
了解非苯芳香烃的结构特点、物理性质和化 学性质,如吡啶、呋喃等。
烃类化合物合成方法
烷烃的合成
了解通过烯烃、炔烃的加成反应,或者通过卤代烷的还原 等方法合成烷烃。
羟基的定义和性质
羟基(-OH)是有机化合物中的一类重要官能团,具有亲核性和弱酸 性。
醇的分类和命名
根据羟基所连碳原子的类型,醇可分为伯醇、仲醇和叔醇;根据醇分 子中羟基的数目,可分为一元醇、二元醇和多元醇。
醇的物理性质
醇类化合物通常具有特殊的香味和较低的沸点。
醇的化学性质
醇可以发生氧化、酯化、醚化、卤代等反应。
化学反应中,反应物的一个立体异构 体比另一个立体异构体优先发生反应 的现象。
立体选择性反应类型
反应机理
通过前线轨道理论、分子轨道对称守 恒原理等解释立体选择性反应的机理 。
包括加成反应、消除反应、取代反应 等。
周环反应和分子重排反应
周环反应概念
在化学反应中,形成环状过渡态的协同反应 。
周环反应类型
化工原料
化学基础有机

化学基础有机一、有机化学简介有机化学,又称为碳化合物化学,是化学科学的一个重要分支。
它主要研究含碳元素的化合物的合成、结构、性质、反应机理以及相互转化的规律。
有机化学不仅是合成具有重要实用价值的有机化合物的基础学科,同时也是化学工业的重要组成部分。
二、有机化学发展历程有机化学的发展可以追溯到古代,人类在生产和生活实践中就已经开始接触和利用有机化合物。
然而,真正意义上的有机化学的研究是从18世纪后半叶开始的。
这一时期的化学家们开始对有机化合物的结构、性质和反应机理进行系统的研究。
进入20世纪后,随着科技的不断进步,有机化学的发展取得了巨大的突破。
特别是在20世纪70年代以后,随着计算机技术和谱学分析方法的快速发展,有机化学的研究进入了分子设计和功能化的新阶段。
三、有机化学基本概念1.有机化合物:通常是指含有碳元素的化合物,但不包括碳的氧化物、碳酸盐、碳酸等无机化合物。
2.有机化学反应:是指碳与碳原子之间进行的各种化学反应,主要包括取代反应、加成反应、消除反应、重排反应等。
3.共价键:原子之间通过共享电子而形成的化学键,是有机化合物结构的基础。
4.官能团:是指一种或多种活性原子的组合,可以决定有机化合物的性质。
5.手性:是指一个物体不能与其镜像相重合的性质。
在有机化合物中,手性通常是指分子中存在手性碳原子。
四、有机化学反应类型1.取代反应:有机化合物分子中的某一原子或基团被其他原子或基团取代的反应。
2.加成反应:有机化合物分子中碳碳双键或三键发生断裂,与其它原子或基团结合生成新的化合物的反应。
3.消除反应:在一定的条件下,一分子有机物脱去一分子水或卤化氢等小分子的反应。
4.重排反应:由于基团之间的迁移或交换,使得分子的原有结构发生改变的反应。
5.聚合反应:由小分子重复生成高分子化合物的反应。
6.水解反应:水分子与有机化合物反应,使其分解成两部分或更多部分的反应。
7.氧化还原反应:涉及电子传递的氧化和还原的有机反应。
有机化学基础知识点总结

有机化学基础知识点总结有机化学是研究碳及其化合物的化学性质、结构、合成方法和应用的学科。
下面是有机化学的基础知识点总结:1.键合理论:有机化合物的化学性质与其分子内的键有着密切关系。
有机化学中常见的键有共价键、极性键和离子键。
2.碳骨架:大多数有机化合物的分子都是由碳原子构成的骨架。
根据碳原子之间的连接方式,碳骨架可分为直链、分支链、环状和杂环等几种不同的类型。
3.功能团:有机化合物中的功能团是指具有一定化学性质的结构单元。
常见的有机化合物功能团有羟基、醇基、酮基、酯基、羧基等。
4.反应类型:有机化学中常见的反应类型有取代反应、消除反应、加成反应、缩合反应、氧化还原反应等。
5.反应机理:有机化学反应的过程可以通过反应机理来描述。
常见的反应机理包括亲核取代反应机理、亲电取代反应机理、酸碱催化反应机理等。
6.按键性质分类:根据碳原子上的官能团的不同,有机化合物可分为饱和化合物和不饱和化合物。
饱和化合物中的碳碳键都是单键,而不饱和化合物中的碳碳键可以是双键或者三键。
7.合成方法:有机化学中的合成方法包括物理法、化学法和生物法。
常见的合成方法有酸催化、碱催化、取代反应、缩合反应等。
8.离子性和共价性:有机化合物既有离子性也有共价性。
大多数有机化合物分子中的键为共价键,但分子之间的作用力常常具有离子性质。
9.异构体:同一种分子式但结构不同的化合物称为异构体。
异构体可以分为构造异构体、空间异构体和立体异构体等几种类型。
10.应用领域:有机化学在药物、农药、材料科学等领域有着广泛的应用。
有机合成和有机反应研究的进展为新药的发现和农药的合成提供了重要的支持。
以上是有机化学的基础知识点总结,了解这些知识点对于学习和理解有机化学的基本概念和原理非常重要。
有机化学是一个广阔而深奥的学科,需要通过不断学习和实践来掌握和应用。
什么是有机化学

引言概述:有机化学是研究有机化合物的结构、性质和反应的化学分支学科。
有机化学在日常生活中无处不在,从药物、塑料、染料到香料、燃料等等,都是由有机化学合成或提取得到的。
本文将详细阐述有机化学的相关概念、重要性以及常见的反应和应用。
正文内容:一、有机化学的基本概念:1.1 有机化合物的定义:有机化合物是由碳和氢组成的化合物,往往还含有其他元素,如氧、氮等。
1.2 碳的特殊性质:碳具有四个价电子,可以形成四个共价键,也可以形成双键、三键甚至四键,这种多样性使得碳能够形成无数种不同结构的化合物。
1.3 有机化学与无机化学的区别:有机化学研究有机化合物,主要关注碳的存在和反应,而无机化学则关注其他元素的化合物。
二、有机化学的结构与性质:2.1 有机化合物的结构:有机化合物的结构可以分为直链、支链、环状等形式,其中分子式、结构式是描述有机化合物的重要工具。
2.2 有机化合物的性质:有机化合物具有多样的性质,如溶解性、熔点、沸点、电化学性质等,这些性质有助于我们对有机化合物的理解和应用。
三、有机化学的反应:3.1 反应类型:有机化学反应可以分为加成反应、消除反应、取代反应、重排反应等,不同类型的反应有不同的机理和特点。
3.2 加成反应:加成反应是通过在有机化合物的分子中引入一个或多个新原子团,常见示例包括酸碱催化的醇醚酯化反应、烯烃的氢化反应等。
3.3 消除反应:消除反应是通过去除有机化合物中的一个或多个原子团,常见示例有卤代烃的脱卤反应、醇的脱水反应等。
3.4 取代反应:取代反应是通过在有机化合物中将一个或多个原子团替换为其他原子团,常见示例有酯的水解反应、烃的卤代反应等。
3.5 重排反应:重排反应是有机分子内部的原子重排,常见示例有醇的重排反应、烃的骨架重排反应等。
四、有机化学的应用:4.1 药物合成:有机化学是药物化学的基础,通过有机合成可以研发出大量的药物,如抗生素、抗癌药等。
4.2 塑料和聚合物的制备:有机化学合成可以制备各种塑料和聚合物,如聚乙烯、聚丙烯等,这些材料在日常生活中非常常见。
什么是有机化学

什么是有机化学有机化学是一门研究有机化合物的学科,有机化合物是指含有碳元素的化合物,除此之外,还可能包含氢、氧、氮、硫等元素。
有机化学在科学技术的发展中起着举足轻重的作用,它不仅涉及到基础科学理论的研究,还与我们的生活、健康、环境、能源等方面密切相关。
有机化学的研究对象主要包括以下几个方面:1.有机化合物的合成与制备:研究如何通过化学反应合成新的有机化合物,以及优化合成方法、提高产率等。
2.有机化合物的结构与性质:研究有机化合物的分子结构、物理性质、化学性质,以及它们与生物活性的关系。
3.有机反应机制:研究有机化合物在化学反应中的转化过程,包括反应途径、反应速率、反应动力学等。
4.有机化合物的分析与表征:研究如何利用各种分析方法(如光谱、色谱、核磁共振等)对有机化合物进行定性和定量分析,以及结构鉴定。
5.生物有机化学:研究生物体内有机化合物的组成、结构、功能及其在生物体内的代谢、生物合成等过程。
6.环境有机化学:研究有机化合物在环境中的分布、迁移、转化及其对环境和生物体的影响。
7.有机材料化学:研究有机化合物的材料性质,如聚合物、液晶、有机光电材料等,以及它们的制备和应用。
有机化学在科学技术的发展中具有重要意义,例如:1.药物化学:研究药物的合成、结构与活性关系,为新药的研发提供理论基础。
2.农业化学:研究农药、肥料等农业化学品的设计、合成与应用,以提高农作物产量和保障粮食安全。
3.材料科学:研究有机材料的设计、制备与应用,如聚合物材料、有机光电材料等。
4.能源化学:研究有机化合物在能源领域的应用,如生物燃料、太阳能电池等。
5.生物化学:研究生物体内有机化合物的生物合成、代谢等过程,揭示生命现象的本质。
6.环境科学:研究有机化合物在环境中的行为及其对环境质量的影响,为环境保护提供科学依据。
总之,有机化学作为一门基础学科,研究范围广泛,与应用领域紧密相连,对于推动科学技术的发展具有重要意义。
有机化学知识点归纳全

有机化学知识点归纳(全)第 2 页 共 14 页催化剂 有机化学知识点归纳一、有机物的结构与性质1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C nH2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
烷烃分子中的每个C 原子的四个价键也都如此。
C) 物理性质:1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地,C1~C4气态,C5~C16液态,C17以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于1g/cm^3,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂 D) 化学性质:①取代反应(与卤素单质、在光照条件下),,……。
②燃烧③热裂解C 16H 34C 8H 18+ C 8H 16④烃类燃烧通式:O H 2CO O)4(H C 222yx y x tx+++−−−−→−点燃⑤烃的含氧衍生物燃烧通式: O H 2CO O )24(O H C 222y x z y x z y x +-++−−−−→−点燃E) 实验室制法:甲烷:3423CH COONa NaOHCH Na CO +→↑+注:1.醋酸钠:碱石灰=1:3 2.固固加热 3.无水(不能用NaAc 晶体) 4.CaO :吸水、稀释NaOH 、不是催化剂CH 4 + Cl 2CH 3Cl 光 CH 3Cl +光 CH 4 + 2O 2CO 2 + 点CH 4 C + 高隔绝原子:—X 原子团(基):—OH 、—CHO (醛化学—C ≡C=C 官能团 Ca第 3 页 共 14 页催(2)烯烃:A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。
双键碳原子与其所连接的四个原子共平面。
有机化学ppt课件完整版

重排反应通常发生在含有不稳 定结构或官能团的化合物中, 需要加热或加入催化剂。在重 排过程中,分子的骨架结构可 能发生变化。
重排反应在有机合成中具有重 要的应用价值,可以用于合成 具有特定结构或官能团的有机 化合物。同时,重排反应也是 研究有机化合物结构和性质的 重要手段之一。
08
有机化学在生活中的应 用
定义
特点
加成反应在有机合成中具有重要的应用价值,可以用 于合成各种烯烃、醇、醛、酮等有机化合物。
应用
加成反应通常发生在分子中的不饱和键上,需要一定 的反应条件和催化剂。
消除反应
定义
消除反应是指有机化合物分子中 失去一个小分子(如水、卤化氢
等),形成不饱和键的反应。
种类
包括脱水消除、脱卤化氢消除、 热消除等。
反应。此外,醇还可以与酸反应生成酯,是重要的有机合成原料。
酚类化合物结构与性质
结构特点 酚类化合物的分子中含有苯环和羟基(-OH)官能团,通 式为Ar-OH,其中Ar为苯基或其衍生物。
物理性质 酚类化合物一般为无色或淡黄色的固体或液体,具有特殊 的气味和较强的毒性。酚的熔点和沸点较高,易溶于有机 溶剂。
化学性质
03
可发生加成、氧化、还原等反应,如与氢气加成生成醇,被弱
氧化剂氧化成酸。
酮类化合物结构与性质
结构特点
羰基(C=O)两侧连接烃基或芳基,无双键性质。
物理性质
沸点较高、难溶于水、易溶于有机溶剂。
化学性质
主要发生加成和还原反应,如与氢气加成生成醇,被还原剂还原 成仲醇。
醌类化合物结构与性质
结构特点
04
醇、酚、醚类化合物
醇类化合物结构与性质
01
结构特点
有机化学(全)
Cl
-
+
H3O
+
共轭碱
较H2O弱的碱
共轭酸
较HCl弱的酸
酸碱质子理论体现了酸与碱两者相互转化和相互依存 的关系:酸给出质子后产生的酸根为原来酸的共轭碱。酸 越强,其共轭碱越弱;同样,碱接受质子之后形成的质子 化物为原来碱的共轭酸。碱越强,其共轭酸越弱。
在酸碱反应中平衡总是有利于生成较弱的酸和较弱的碱。 + H2SO4 + CH3OH HSO4 + CH3OH2
C C C
C
C
C
C C
C
有机化合物在物理性质方面表现为:
①挥发性大; ②熔点、沸点低,常温下多为气体,液体或低熔点固 体(mp.<400℃ ); CH3COOH: mp.16.6℃ bp.118℃
NaCl: mp.800℃ ③水溶性较差,大多数难溶于水。
bp.1440℃
有机化合物在化学性质方面表现为:
元素分析
元素定性分析和定量分析:化学法、仪器法
确定实验式和分子式
相对分子质量测定:沸点升高法、冰点降低法、质谱法
结构式的测定
化学方法、波谱方法
第二章 烷烃和环烷烃
自由基取代反应
仅由C和H两种元素组成的有机化合物称为 烃(hydrocarbon)
二、构造异构 1 烷烃的同系列
烷烃的通式CnH2n+2 同系列:具有一个通式,结构相似,性质相似的
异裂
CH3 CH3 C + Cl
CH3 CH3 异裂后生成带正电荷和带负电荷的基团或原子的反应, 称为离子型反应。带正电荷的碳原子称为正碳离子。
第五节
有机酸碱概念
一、勃朗斯德酸碱理论 —— 酸碱质子理论
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一. 合成1. CH 3CH 2OHCH 3CH 2CH 2CH 2OH2.H 2CCH 2CH 3CH 2OC(CH 3)3+CH 3CCH 2CH 33.3CH 2COOC 2H 5H 2CCH 4.H 2C CH 2CH 3CH 2CH 2COOC 2H 55.CH 3CH 2CH 2CH 2OHCH 2CH 2CH 2CH 36.CCH 3O, CH 3BrCCH 33OH7.CH 3OHCOOHNH 28.Br9.CO10. CH 3CHO CH 3CHCHCHOC 2H 5OC 2H 511.Br HOCOOHO12.CHO H 2CCH 2CH 2CH 2CH 2OH13.CH 2OHCOOCH 214.CH 3CH 2OHC CH 2CH 3OHCH 3二. 问答1. 按能量高低排列下列活性中间体顺序, 并说明理由。
a.CH 2CH 3CH 3ABC···b.ABC2. 按酸性由强到弱排列下列化合物顺序,并说明理由。
a.CH 3COO HABCCH 3CH 2CO OHCH 2ClCOO Hb.COOHO 2NCOOHO 2NABCOOH H 3CCOOH O 2Nc.AB3. 按碱性由强到弱排列下列化合物顺序,并说明理由。
a.C H 3C H 2N H 2N H 3N H 2A B Cb.NN H AB4. 比较下列化合物与H Br 加成反应活性,并说明理由。
CH 3C H C H 2CCCH 3C H 3C H 3H 3C ABCH 2CC H 25. 在氯苯的亲电取代反应中,Cl 为什么是第一类定位基,却使苯环钝化?6. 用化学方法鉴别(1). 苯乙酮 苯甲醛 苯甲醇 (2). 乙酰氯 乙酰胺 乙酸乙酯7. 分离下列各组化合物(1). 2-戊酮 3-戊酮 (2). 苯胺 硝基苯 8. 试画出下列化合物的最稳定的构象式(1). 顺-1-甲基-4-叔丁基环己烷 (3). 正丁烷 (2). 反-1-甲基-3-叔丁基环己烷9. 画出下列化合物所有对映体的Fisher 投影式,并标出R/S 构型 (1). 酒石酸(2,3-二羟基丁二酸) (2). 2-羟基-3-氯丁二酸 (3). 苹果酸(2-羟基丁二酸)10. 下列合成路线哪一条较实用,为什么?a.CH 3Br +NaO C CH 3CH 3CH 3CH 3OCCH 3CH 3CH 3b.CH 3ONa +(CH 3)3CBrCH 3O CCH 3CH 3CH 311. 指出下列反应的反应机理(如:亲核取代、亲电加成等)。
(1)季胺碱的热分解反应 反应机理为(2)醚与HI 的反应 反应机理为 (3)苯与混酸反应 反应机理为 (4)醇与浓HCl/无水ZnCl 2的反应 反应机理为 (5)甲醛与饱和NaHSO 3的反应 反应机理为 (6)叔丁基溴与NaOH/EtOH 的反应 反应机理为(7)烷烃的卤代反应 反应机理为 (8)烯烃与溴化氢的加成 反应机理为 三. 完成反应式+Cl 2hv1.2.H 2C CCH 2CH 3CH 3+ICl3.H 2CCCH 2CH 3CH 3+HBr 4.C +Br 2CH 5.CH 2+6.Na. NH 3n-C 4H 9Br H 3CC 7.+H 2O H 3CC CH HgSO 4H SO 8.( )CH 3CHCH 2H 3CC9.CH 3CH 3+HBr10.+CH 3CHCH 2AlCl 311.CH 3H 2SO 4(浓) 3. 24水蒸气12.+13.C CH 3Zn-Hg/HClO14.CH C(CH 3)3CH 2KMnO 4/H +15.KOH/乙醇CH 3CHCH 2CH 316.Cl Br+Mg纯乙醚17.BrCH 2+CN18.CH 3OHCH 3+HCl ZnCl 219.H3C CH CHC6H5O +CH3OHH20.H3C O CH CH2+HI21.CH2OCH3+HI22.O CH3+HI23.CHO+CN-OH H3+O24.CHO+(CH2OH)2干HCl H2/Ni H3+O 25.CH3CH2HBr Mg HCHO H3+O 26.CH3CHO5%NaOH27.CHO浓OH-28.CH3CHCH2CH3I2+NaOH29.CH3CH2COOH+ClP OH-30.COOH SOCl2C2H5OHPy31.CH3(CH2)15COOCH2CH(OH)CH2OH+CH3OHK2CO3 32.CH3CHCOOHOH33.CH3CCH2COOC2H5Br2O34.CH3COOC2H5①NaOC2H5②HOAc35.NH2+(CH3CO)2AlCl336.NHCH3NaNO2+HCl 37.N+(CH3)3OH38.NH2NaNO2+H2SO4__39.N2+HSO4-N(CH3)+40.N2+HSO4-C2H5OH41.OBr2二氧六环+42.N KNO3 + H2SO4300℃43.CH2+HBr ROOR MgEt2O B ①CH3CCH3②O3+44.+HBr①②NaCNH3OCl2, POH-D H2C CH2①+45.+Cl hv OO46.BrO+HOCH2CH2OH干HClA①CNB+47.AlCl3A 3. 24B C+D COOC2H5H2N22724 H2C CH+Fe, HClClOAlCl348.四. 反应机理预测反应产物, 写出反应机理1.Br2NaClH2C CH2+2.H3C+HBr(1mol)3.CCH3CHH3CCH3+ZnClH3C4.CH3OCH2CH3+5.CH3CHO+CN OH6.H3CHC CHCH3+Cl2hv7.+HNO3H2SO48.OH+HNO3H2SO49.HOHO五.选择题1.在甲基碳正离子中,碳原子的杂化状态是A. SP3B. SP2C. SPD. P2.下列化合物中,m.p最高的是A.苯B.甲苯C.对二甲苯D.间二甲苯A.正丁醇B.2-丁醇C.2-甲基-2-丙醇D. 2-甲基-1-丙醇 4. 下列化合物中,酸性最强的是A. 乙酸B.丙酸C.氯乙酸D.2-甲基丙酸 5. 气相中,下列化合物碱性最强的是A. 甲胺B.二甲胺C. 三甲胺D. 氯化四甲胺6. 在水溶液中,碱性最强的是A.氨B.甲胺C.二甲胺D.三甲胺 7. 季胺碱热分解符合 规则A.MarkovnikovB.HoffmannC.SaytzeffD.H Üc kel 8. 烯烃与溴化氢的加成符合 规则A.SaytzeffB.HoffmannC.ClemmensonD.Markovnikov 9.下列试剂作为亲核试剂,亲核性最强的是A. H 2OB. RO -C. ROHD.OH -10. 能与亚硝酸反应0~5℃下放出气体的化合物是 .N H 2N HN C H 3N H 2A.B.C.D.11. 某羟基酸加热反应后生成一个具有六元环的内酯,则该羟基酸是 羟基酸A.αB.βC.δD.γ12. 某羟基酸加热反应后生成一个具有五元环的内酯,则该羟基酸是 羟基酸 A.α B.β C.δ D.γ 13. 下列化合物中,烯醇式含量最高的是 .A.乙酰乙酸乙酯B.丙二酸二乙酯C.丙酮D.苯酚 14. 能够用于制备Grignard 试剂的是 .A. B. C. D.C lH 2NB rHOClCOC H 3C lHC15. 能够与氯化重氮盐发生偶合反应的是 .A.甲苯B.对甲苯酚C.硝基苯D.苯 16. D-乳酸与L-乳酸的区别是 .A. 熔点不同B. 溶解度不同C. 旋光方向不同D. 化学性质不同17. 下列哪一个极限结构对真实分子的结构贡献最大O HEHO HE HO HE HO HE HA. B. C. D.18. 下列各对化合物中,不属于立体异构的是A. 正戊烷和新戊烷B. 环己烷的椅式构象和船式构象C. (R )-乳酸和(S )-乳酸D. 顺-2-丁烯和反-2-丁烯 19. 共振论主要用于描述( )的结构A.有机分子B.离域体系C.含有两个以上п键的分子D.有机中间体 20. 对于S N 2反应,下列的几种说法不正确的是A. 增加反应物浓度反应速度增加B. 产物的构型发生翻转C.有活性中间体生成D. 反应速率与底物的浓度和亲核试剂的浓度有关 21. 下列化合物中,具有芳香性的化合物是A. B. C.D.A .正己烷B .正戊烷C .新戊烷D .异戊烷 23.正丁烷最稳定的构象是 .A .对位交叉式B .邻位交叉式C .完全重叠式D .部分重叠式 24.下列化合物中,能溶于冷的浓硫酸的化合物是 . A.1-溴丁烷 B.苯 C.正己烷 D.1-丁烯 25.-NH 2属于第 类定位基,使苯环A .一类、钝化B .一类、活化C .二类、钝化D .二类、活化 26.下列化合物中,能发生碘仿反应的是:C H 2OHA. B.C .D .CH 3CH 2C OCH 2CH 3CH 3CH 2CHCH 2C H 3OHC H 3CHCH 2CH 2CH 3OH27.下列分子中酸性最强的化合物是 .A .苯甲酸B .对甲基苯甲酸C .对硝基苯甲酸 D.2,4-二硝基苯甲酸28.在浓碱溶液中,甲醛发生的反应是 .A.羟醛缩合反应B.歧化反应C.缩醛化反应 D.不发生反应 29.如要把伯醇氧化为醛,可使用的氧化剂为 .A .Sarret 试剂B .Lcaus 试剂C .格氏试剂D .羰基试剂 30.下面所列基团不属于第一类定位基的是 .A .-ClB .-COCH 3C .-OCOCH 3D .-CH =CH 2 31.下列化合物中,酰化能力最强的是 .A.CH 3COClB.(CH 3CO)2OC.CH 3COOC 2H 5D.CH 3CONH 2 32.下列极限结构对1,3—丁二烯真实分子的结构贡献最大的是 .A.H 2C C H C H C H 2H 2C C H C H C H 2B.+-H 2CC HC HC H 2D.+-C.H 2CC HC C H 2+-H33. 下列试剂作为亲核试剂,亲核性最强的是 .A. NH 3B. CH 3O -C.OH -D.CH 3S - 34. 不能与饱和NaHSO 3溶液反应生成晶体的是 .A.甲醛B.环戊酮C.丁酮D.3-戊酮 35. 左旋体与右旋体的区别是 .A. 熔点不同B. 溶解度不同C. 旋光方向不同D. 化学性质不同 36. 下列性质哪一个不是共价键的属性 .A. 电负性B.键的极性C. 键长D. 键角 37. 若要由苯制备间硝基苯甲酸,正确的方法是 .A. 先硝化,再烷基化,最后氧化B. 先烷基化,再硝化,最后氧化C. 先烷基化,再氧化,最后硝化D. 都正确 38. 下列说法不符合S N 1反应的是 .A. 有活性中间体生成B.反应两步完成C.立体特征为产物为外消旋体D.亲核试剂浓度增加,反应速率加快 39. 下列说法不符合S N 2反应的是 .A. 反应经历过渡态一步完成B.反应速率决定于离去集团的性质C.叔卤烷反应比仲卤烷快D.立体特征为产物构型发生翻转40. 下列试剂作为亲核试剂,亲核性最弱的是 .A. NH3B. CH3O-C.-ONO2D.CH3S-41. 不能与饱和NaHSO3溶液反应生成晶体的是 .A.3-戊酮B.环戊酮C.2-戊酮D.戊醛42. Grignard试剂可以在下列哪种溶剂中制备 .A.乙醇B.四氢呋喃C.苯胺D.水43. 下列化合物中,烯醇式含量最高的是 .A.乙酰乙酸乙酯B.丙二酸二乙酯C.丙酮D.2,4-戊二酮44. 在丙烯分子中,碳原子的杂化状态是 .A.SP3SP2SP3B. SP3SP3SP2C. SP2SP2SP3D. SP2SP2SP245. 常温下能是溴水褪色的是 .A.乙酸B. 丙酮C. 乙苯D.环丙烷46. 下列化合物中,m.p最高的是 .A.正己烷B. 2--甲基戊烷C. 2,2--二甲基丁烷D.环己烷47. 下列化合物中,沸点最高的是 .A.正丁烷B. 3--甲基己烷C. 正己烷D.2--甲基戊烷48. 下列化合物酸性最强的是 .A.乙醇B.乙酸C. 水D.乙酸乙酯49. 下列化合物酸性最强的是 .A.乙醇B.水C. 乙醚D.乙炔50. 在水溶液中,碱性最强的是 .A.氨B.甲胺C. 苯胺D.乙酰苯胺51. 环己酮经Clemmensen还原产物是 .A.环己烷B.环己醇C. 环己烯D.环己炔52. 下列化合物中,哪一个与Lucas试剂反应最快 .A.异丙醇B.正丁醇C.烯丙醇D.丙烯醇53. 能够发生碘仿反应的是 .A.甲醛B.乙醇C. 3-戊酮D.苯甲醛54. Lucas试剂是指 .A.ZnCl2/HClB.Zn-Hg/HClC.RMgXD. AgNO3/己醇55. 能够与氯化重氮苯发生偶合反应的是 .A.甲苯B. N,N--二甲基苯胺C.硝基苯D.苯磺酸55. 二甲胺与HNO2反应的现象是 .A.放出气体B. 生成黄色沉淀C.黄色油状物D.不反应56. 按官能团分类,丙酮与乙二醇在浓硫酸中反应的产物应该属于 .A.醛B. 醚C.酮D.酯57. CH3CH=CH2分子中含有____个σ键,_____个π键.A.3,1B. 3,2C.8,1D.6,258. 丁烷绕C2- C3键旋转的最稳定的构象是 .A.完全重叠式B. 对位交叉式C.部分重叠式D. 邻位交叉式59. 环烷烃最稳定的构象是 .A.环丁烷蝶式B. 环戊烷信封式C.环己烷椅式D. 环己烷船式60. 能与亚硝酸反应生成黄色油状物的是 .A.苯胺B. N-甲基苯胺C.对甲基苯胺D. 乙酰苯胺61. 低级碳醇可以用下列哪种干燥剂干燥.A. CaCl 2B. NaC. H 2SO 4D. 无水Na 2SO 462. CH 3CH 2CHBrCH 3与KOH/醇溶液共热反应的主产物是 .A. CH 3CH=CHCH 3B. CH 3CH 2CH(OH)CH 3C. (CH 3)CHCH 2OHD. CH 3CH 2CH 2CH 3 63. 乙基碳正离子中,正电荷位于 轨道中。
