高中化学 专题3.2.3 铁的重要化合物(测)新人教版必修1
高中化学专题3_2_3铁的重要化合物练新人教版必修1

专题铁的重要化合物一、选择题1.随着人们生活节拍的加速,方便的小包装食物己被普遍接受。
为了延长食物的保质期,避免食物氧化变质,在包装袋中可以放入的化学物物质是( )A.无水硫酸铜B.硫酸亚铁C.食盐D.生石灰【答案】B【解析】避免食物氧化变质,可在包装袋中放入还原剂,以上四种物质,只有硫酸亚铁是常见的还原剂。
2.下列反映,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中A.②③①④B.③②①④C.③①②④D.①②③④【答案】B【解析】①钠在纯氧中燃烧生成淡黄色的Na2O2,②FeSO4与NaOH反映生成Fe(OH)2,在空气中放置生成红褐色Fe(OH)3,③FeCl3与KSCN反映生成红色Fe(SCN)3,④CuSO4遇医用酒精中的水变蓝色,故选B。
3.下列关于Fe2+和Fe3+的叙述中。
错误的是( )A.Fe2+的水溶液为浅绿色B.Fe3+的水溶液为黄色C.Fe3+具有氧化性,Fe2+具有还原性D.Fe3+溶液中滴入含SCN-的溶液,当即出现红色沉淀【答案】D【解析】Fe3+为高价,具有较强的氧化性,其溶液为黄色。
Fe2+为中间价态。
既有氧化性,又有还原性,其水溶液为浅绿色。
Fe3+溶液中滴入含SCN-的溶液,溶液呈现红色,并非沉淀,故D错。
4.下列物质反映后必然有+3价铁生成的是( )①过量的Fe与Cl2反映②Fe与过量稀H2SO4反映后,再向其中加入KNO3③Fe和Fe2O3的混合物溶于盐酸中A.①B.①③C .①②D .全部【答案】C5.下列能大量共存于溶液中的一组离子是( )A .Fe 3+、K +、SCN -、SO 2-4 B .Fe 3+、Fe 2+、H +、S 2-C .Mg 2+、Fe 2+、OH -、NO -3D .Na +、Fe 3+、NO -3、Cl -【解析】Fe 3+不能在碱性、还原性和有SCN -离子的环境中大量存在,Fe 2+不能在氧化性环境中大量存在。
高中化学3.2.3铁的重要化合物课件新人教版必修1

第十三页,共21页。
[实验] 在盛有氯化铁溶液的试管中,加入少量铁粉,振荡
(zhèndàng),充分反应后,滴加几滴KSCN溶液,有什么 现象?再加几滴氯水又发生什么变化?
第十四页,共21页。
实验现象: 溶液(róngyè)由黄色变为淡绿色,加KSCN溶
液(róngyè)没有明显变化,加氯水后溶液(róngyè) 实变验为(血sh红íy色àn。)结论:
Fe3+ + 3OH-
====Fe(OH)3↓
FeSO4
先有白色(báisè)的沉 淀, 迅速变成灰绿色, 最后变成红褐色
Fe2+ + 2OH- ====Fe(OH)2↓ 4Fe(OH)2+O2+2H2O====
4Fe(OH)3
第九页,共21页。
【想一想】
Fe(OH)2 由于易被空气中的氧气(yǎngqì)氧化, 在制备 Fe(OH)2时应采取哪些措施防止其被氧化? 【提示】(1)在溶液上加入保护层(如植物油),隔绝 (géjué)氧气。 (2)将胶头滴管(dī ɡuǎn)尖端插入试管 底部。 (3)用煮沸过的蒸馏水配制溶液。
第十六页,共21页。
一、铁的氧化物
二、铁的氢氧化物 (qīnɡ yǎnɡ huà wù)
4Fe(OH)2+O2+2H2O====4Fe(OH)3
三、铁盐和亚铁盐
1.检验
(jiǎnyàn)
Fe、Cu
2.转化
Fe2+
Fe3+
(zhuǎnhuà)
Cl2、H2O2、KMnO4
第十七页,共21页。
1.将下列(xiàliè)四种铁的化合物溶于稀盐酸,滴加
高中化学-3.2.3铁的重要化合物课件-新人教版必修1
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色 顺序排列的是( ) ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中 A.②③①④ B.③②①④ C.③①②④ D.①②③④
【解析】选B。①钠在纯氧中燃烧生成淡黄色的Na2O2, ② FeSO4与NaOH反应生成Fe(OH)2,在空气中放置生成红褐 色的Fe(OH)3, ③FeCl3与KSCN反应生成红色的Fe(SCN)3, ④CuSO4遇医用酒精中的水变蓝色,故选B。
A.FeO
B.Fe2O3
C.Fe3O4
D.Fe(OH)3
【解析】选B。因Fe(OH)2极易被空气中氧气氧化,当露置
于空气中时,Fe(OH)2首先转化为Fe(OH)3,然后Fe(OH)3分
解生成Fe2O3。
5.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应 后,溶液中的金属离子是( )
A.Fe2+
3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因 可能是( ) A.苹果汁中的Fe2+变成Fe3+ B.苹果汁中含有Cu2+ C.苹果汁中含有OHD.苹果汁中含有Fe3+ 【解析】选A。苹果汁由淡绿色变为棕黄色的实质是Fe2+变 成Fe3+,是Fe2+被氧化的过程。
4.将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
2Fe2++Cl2 ==2=Fe3++2Cl-,C正确;Fe3+与KSCN作用溶 液呈红色,但=不是沉淀,D错误。
二、非选择题(本题包括3小题,共30分)
6.(10分)已知给贫血者补充铁时,应给予含Fe2+的铁盐,如
【红对勾】2021学年高中化学 3-2-3铁的重要化合物课后作业 新人教版必修1 (1)

"【红对勾】2021-2021学年高中化学 3-2-3铁的重要化合物课后作业新人教版必修1 "限时:45分钟满分:100分一、选择题(每题3分,共36分。
)1.已知硝酸能将Fe2+氧化为Fe3+。
以下物质反映后必然有+3价铁生成的是( )①过量的Fe与Cl2反映②Fe与过量稀硫酸反映③FeCl2溶液中通入少量Cl2④Fe和Fe2O3的混合物溶于盐酸中A.只有①B.只有①③C.只有①②③ D.全数2. (双选)将Na2O2投入到FeCl2溶液中,能够观看到的现象是( )A. 生成白色沉淀B. 生成红褐色沉淀C. 有气泡产生D. 溶液变成棕黄色3. 某溶液中有Na+、Mg2+、Fe2+、Al3+四种离子,假设向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )A. Na+B. Mg2+C. Fe2+D. Al3+4.向某溶液中加入含Fe2+的溶液后,无明显转变。
当再滴入几滴新制氯水后,混合溶液变成红色,那么以下结论错误的选项是( )A.该溶液中必然含有SCN-B.氧化性:Fe3+>Cl2C. Fe2+与SCN-不能形成红色物质D. Fe2+被氧化为Fe3+5.为了探讨铁及其化合物的氧化性和还原性,某同窗设计如下实验方案,其中符合实验要求且完全正确的选项是( )实验操作实验现象离子反应实验结论32( )A.溶液中必然含Cu2+B.溶液中必然含Fe2+C.加入KSCN溶液必然不变血红色D.剩余固体中必然含Cu7. 将适量铁粉投入三氯化铁溶液中,完全反映后,溶液中的Fe3+和Fe2+浓度相等,那么已反映的Fe3+和未反映的Fe3+的物质的量之比是( )A. 2∶3B. 1∶2C. 1∶1D. 3∶28.向200 mL、0.1 mol·L-1的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,警惕加热沉淀,直到水分蒸干,再灼烧到质量再也不转变,现在固体的质量为( )A.1.44 g B.1.6 gC.2.82 g D.4.36 g9.将2.4 g Fe、Al混合粉末溶于75 mL 4 mol·L-1的盐酸中,反映一段时刻后,再加入250 mL 1.5 mol·L -1的NaOH溶液,反映完全后,溶液中大量存在的有( )A.Na+、Fe2+B.Al3+、Fe2+C.Fe3+、AlO-2D.Na+、AlO-210. 向必然量的Fe、FeO、Fe2O3的混合物中加入100 mL浓度为1.0 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL的气体(标准状况),所得溶液中加入KSCN溶液后无血红色显现。
人教版高中化学必修一 3.2.3 铁的重要化合物
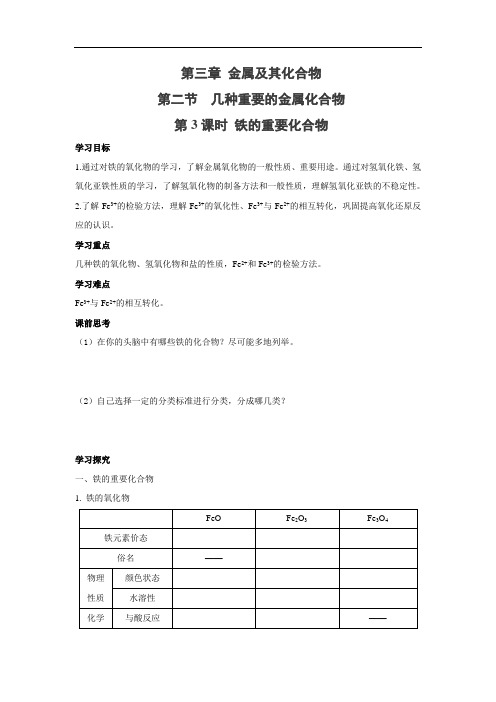
第三章金属及其化合物第二节几种重要的金属化合物第3课时铁的重要化合物学习目标1.通过对铁的氧化物的学习,了解金属氧化物的一般性质、重要用途。
通过对氢氧化铁、氢氧化亚铁性质的学习,了解氢氧化物的制备方法和一般性质,理解氢氧化亚铁的不稳定性。
2.了解Fe3+的检验方法,理解Fe3+的氧化性、Fe3+与Fe2+的相互转化,巩固提高氧化还原反应的认识。
学习重点几种铁的氧化物、氢氧化物和盐的性质,Fe2+和Fe3+的检验方法。
学习难点Fe3+与Fe2+的相互转化。
课前思考(1)在你的头脑中有哪些铁的化合物?尽可能多地列举。
(2)自己选择一定的分类标准进行分类,分成哪几类?学习探究一、铁的重要化合物1. 铁的氧化物FeO Fe2O3Fe3O4铁元素价态俗名——物理性质颜色状态水溶性化学与酸反应——性质(如盐酸)2. 铁的氢氧化物氢氧化物 Fe(OH)2Fe(OH)3铁元素价态制备 现象离子方程式 化学性质与酸反应 稳定性铁的氢氧化物的共性与个性: ①均为固体,不溶于水,但颜色不同。
②均与酸反应,受热分解。
但氢氧化亚铁表现出强还原性。
二、Fe 3+与Fe 2+的转化设计实验方案实现 Fe 3+与Fe 2+转变。
通入氧气。
(提示用双氧水、高锰酸钾等)加入铁粉或铜粉,通氢气等。
结论: Fe 3+具有氧化性,Fe 2+具有还原性,两者在一定条件下可互相转化。
三、Fe 2+与Fe 3+的检验 【思考】给你两瓶没有标签的试剂FeCl3溶液和FeCl2溶液,运用学过的知识,如何用化学的方法来检验那瓶溶液是FeCl3溶液呢?【实验探究】如何用实验的方法检验FeCl2溶液中是否含有FeCl3?[科学探究] Fe3+的检验[分组实验]在两只试管中分别加入5 mL FeCl3和5 mL FeCl2,然后各滴入几滴KSCN(硫氰化钾)溶液,记录现象。
滴入KSCN溶液结论FeCl3溶液FeCl2溶液【问题思考】(1)如何鉴别FeCl3溶液和FeCl2溶液?(2)如何用实验的方法检验FeCl2溶液中是否含有FeCl3?(3)证明某溶液只含有Fe2+而不含有Fe3+的实验方法?(4)如何用实验的方法检验FeCl3溶液中是否含有FeCl2?(5)如何除去FeCl2溶液中少量的FeCl3?(6)如何除去FeCl3溶液中少量的FeCl2?学习小结“铁三角”之间的转化关系当堂检测1. 在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是()A.Fe B.FeO C.Fe(OH)3D.Fe2O32. 某溶液中滴入KSCN溶液后变红,说明该溶液中存在()A.NO-3B.Fe3+C.SO2-4D.Mg2+3. 要除去FeCl2溶液中少量的FeCl3,可行的是()A.滴入KSCN溶液B.加入铁粉C.通入氯气D.加入铜粉4. 将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是()A.KSCN B.BaCl2C.NaOH D.HCl参考答案课前思考(1)FeO、Fe2O3、Fe3O4、Fe(OH)2、Fe(OH)3、FeSO4、FeCl2、FeCl3、FeS、FeI 、Fe(NO3)3等。
高一化学人教版必修1练习:3.2.3 铁的重要化合物 word版含解析

第3课时铁的重要化合物A组1.有关铁的氧化物的说法正确的是()A.Fe3O4是黑色固体,有磁性B.Fe2O3既不溶于水也不溶于酸C.FeO是碱性氧化物,可与H2O反应生成Fe(OH)2D.FeO、Fe2O3、Fe3O4中铁的化合价相同解析:Fe2O3能溶于酸,B错误;FeO是碱性氧化物,但不能与H2O反应生成Fe(OH)2,C错误;FeO中铁的化合价为+2价、Fe2O3中铁的化合价为+3价、Fe3O4中铁的化合价为+2价和+3价,D错误。
答案:A2.将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是()A.铁粉剩余,溶液呈浅绿色,Cl-基本不变B.向溶液中滴入无色KSCN溶液,仍无色C.Fe2+与Fe3+物质的量之比为6∶1D.氧化产物与还原产物的物质的量之比为2∶5解析:n(Fe)=0.02 mol,n(FeCl3)=0.05 mol,由Fe+2Fe3+3Fe2+知,Fe3+过量0.01 mol,铁粉全部溶解,反应生成Fe2+ 0.06 mol;Fe3+过量,滴入无色KSCN溶液,溶液显红色;氧化生成的Fe2+和还原生成的Fe2+的物质的量之比为1∶2。
答案:C3.为了检验某FeCl2溶液是否变质,可向溶液中加入()A.NaOH溶液B.铁片C.KSCN溶液D.石蕊溶液解析:Fe2+易被氧化为Fe3+,可用KSCN溶液检验是否存在Fe3+。
答案:C4.下列物质反应后一定有+3价铁生成的是 ()①过量的Fe与Cl2反应②Fe与过量稀硫酸反应③FeCl2溶液中通入少量Cl2④Fe和Fe2O3的混合物溶于盐酸中A.①B.①③C.①②③D.①②③④解析:①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。
②中Fe 与稀硫酸反应只能生成Fe2+。
③在溶液中Fe2+被Cl2氧化生成Fe3+。
④中首先发生Fe与盐酸生成FeCl2,Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
高中化学 第三章 金属及其化合物 3.2.3 铁的重要化合物b检测 新人教版必修1(2021年整理)

2017-2018学年高中化学第三章金属及其化合物3.2.3 铁的重要化合物b 检测新人教版必修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学第三章金属及其化合物3.2.3 铁的重要化合物b检测新人教版必修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学第三章金属及其化合物3.2.3 铁的重要化合物b检测新人教版必修1的全部内容。
第三章金属及其化合物 3。
2.3 铁的重要化合物b1)A.Fe3O4是一种红棕色粉末,俗称磁性氧化铁B.铁与水蒸气在高温下的反应产物为Fe2O3和H2C.去除FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤D.Fe3+与KSCN反应产生红色沉淀解析A项,Fe3O4是一种黑色粉末,俗称磁性氧化铁;B项,铁与水蒸气在高温下的反应产物为Fe3O4和H2;C项,去除FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤;D项,Fe3+与KSCN反应产生红色络合物,不是沉淀.答案C2.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )A.苹果汁中的Fe2+变成Fe3+B.苹果汁中含有Cu2+C.苹果汁中含有OH-D.苹果汁中含有Fe3+解析苹果汁由淡绿色变为棕黄色的实质是Fe2+变成Fe3+,是Fe2+被氧化的过程。
答案A3.[2015·应县一中高一月考]将Na2O2投入到FeCl2溶液中,可观察到的现象是( )①有气泡产生②生成白色沉淀③生成红褐色沉淀④无变化A.①③B.①②C.①②③D.④解析将过量的Na2O2投入FeCl2中,发生下列反应:2Na2O2+2H2O===4NaOH+O2↑FeCl2+2NaOH===Fe(OH)2↓+2NaCl4Fe(OH)2+O2+2H2O===4Fe(OH)3所以现象为有无色气体产生并有红褐色沉淀生成,观察不到白色沉淀,故选A.答案A4.[2014·银川一中高一期末考试]将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是( )A.Cu、Fe2+、Fe B.Cu、Fe3+C.Fe2+、Fe3+D.Cu、Cu2+、Fe解析通过题意知Fe剩余,则溶液中不再存在与Fe反应的Fe3+和Cu2+,其中Fe3+完全被还原为Fe2+,Cu2+被还原成Cu,A选项正确。
高中化学 3.2.3 铁的重要化合物课件 新人教版必修1
答案:(1)× (2)× (3)× (4)× (5)√
第二十三页,共44页。
第二十四页,共44页。
Fe、Fe2+、Fe3+的相互(xiānghù)转化—铁 三角
第二十五页,共44页。
1.Fe→Fe2+或Fe3+ (1)与弱氧化剂反应生成(shēnɡ chénɡ)Fe2+: 与S、Fe3+、Cu2+、H+等弱氧化剂反应生成(shēnɡ chénɡ)+2价铁,例如: Fe+2Fe3+===3Fe2+, Fe+Cu2+===Fe2++Cu, Fe+2H+===Fe2++H2↑。
第七页,共44页。
一、铁的主要(zhǔyào)化合物 1.铁元素的存在 地壳中金属元素的含量居前两位的是 、Al ,F铁e 元素
主要(zhǔyào)以 +2价 和 +3价的化合物形式存在。
第八页,共44页。
2.铁的氧化物 (1)物理性质(wùlǐ xìngzhì):
名称 化学式
俗名 铁的化合价 颜色、状态
[例1] 已知A是一种常见金属,F是一种红褐色沉淀 (chéndiàn)。试根据图中转化关系,回答下列问题。
第三十页,共44页。
(1)写出A、C、F、G的化学式 A、_______C、_______F、_______、G、_______。 (2)保存C溶液时要加固体A的原因________________ _________________________________________________。 (3)写出下列转化的离子(lízǐ)方程式或化学方程式。 ①E→F:___________________________________。 ②C→D:___________________________________。
第二十八页,共44页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3-2-3 铁的重要化合物
1.下列有关铁及其化合物的说法中正确的是( )
A.铁锈的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D.Fe3+与KSCN溶液反应产生红色沉淀
【答案】C
2.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁中含有OH-
D.苹果汁中含有Na+
【答案】A
【解析】苹果汁中含有丰富的铁元素,淡绿色为亚铁离子的颜色,棕黄色为三价铁离子的颜色,因此苹果汁在空气中颜色由淡绿色变为棕黄色,为Fe2+变成Fe3+,故选A。
3.在酸性溶液中,能大量共存的离子组是( )
A.Mg2+、Fe3+、NO3-、SCN-
B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-
D.Na+、Ba2+、NH4+、SO42-
【答案】B
【解析】A、Fe3+和SCN-反应,不能大量共存,故A错误;B、H+和四种离子之间均不能发生反应,可以共存,故B正确;C、HCO3-可与H+反应生成H2O和CO2,不能大量共存,故C 错误;D、Ba2+和SO42-反应生成BaSO4,不能大量共存,故D错误。
4.下列离子方程式正确的是( )
A.铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+
B.Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C.FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-
D.Fe(OH)3与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
【答案】D
5.某溶液中有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再加入过量的盐酸,所得溶液中大量增加的阳离子是( )
A.Mg2+ B.Fe2+ C.Fe3+ D.Al3+
【答案】C
【解析】Mg2+、Fe2+、Fe3+和Al3+四种阳离子中,
若向其中加入过量的NaOH溶液,发生反应有:
Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,
Al(OH)3+OH-=AlO2-+2H2O,Fe2++2OH-=Fe(OH)2↓,
4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe3++3OH-=Fe(OH)3↓,
过滤后滤渣中含有Mg(OH)2和Fe(OH)3,在滤渣中再加入过量的盐酸,所得溶液中含有的阳离子是Mg2+和Fe3+,因此大量增加的阳离子为Fe3+,故选C。
6.某水体中含有较多的泥沙及其他悬浮物,下列物质中不能用来净化此水的是( ) A.KCl B.Fe2(SO4)3
C.KAl(SO4)2 D.FeCl3
【答案】A
【解析】Fe2(SO4)3、FeCl3可产生Fe(OH)3胶体,能用于净水,KAl(SO4)2溶液可产生Al(OH)3胶体,也可用于净水。
7.将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.有黄绿色气体产生 D.无变化
【答案】B
【解析】Na2O2具有强氧化性,能将Fe2+氧化成Fe3+,可与Na2O2和水反应生成的OH-生成红褐色的Fe(OH)3沉淀,Na2O2与水反应产生O2,不放出黄绿色的Cl2。
8.为了检验某氯化亚铁溶液是否变质,可向溶液中加入( )
A.氢氧化钠溶液 B.铁片
C.硫氰酸钾溶液 D.酸性KMnO4溶液
【答案】C
9.将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe(OH)3
【答案】B
【解析】因Fe(OH)2极易被空气中的氧气氧化,当露置于空气中时,Fe(OH)2首先转化为Fe(OH)3,然后Fe(OH)3分解生成Fe2O3和H2O。
10.某溶液中有NH4+、Mg2+、Fe2+、和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
【答案】AC
【解析】根据题干信息可以得出以下变化过程:
NH4+
故AC符合题意。
11.将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
【答案】A
【解析】因为Fe3+和H+的氧化性强弱顺序为Fe3+>H+,所以当产生氢气时,Fe3+已经全部被还原为Fe2+,故向溶液中滴入KSCN溶液,溶液不变红色;根据题目给出的数据,
Fe+2H+=Fe2++H2
n2(HCl)=0.02mol n(H2)=0.01mol
2Fe3++Fe=3Fe2+,需要的盐酸n1(HCl)=0.06mol,可计算出n(Fe2O3)=0.01 mol,参加了个反应的n(Fe)=0.02 mol,答案选A。
12.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是()
试剂
甲组乙组
选项
A 新制氯水、KSCN溶液NaOH溶液
B 酸性KMnO4溶液KSCN溶液
C KOH溶液溴水
D 溴水酸性KMnO4溶液
【答案】B
13.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是______,证明Fe3+存在的现象是_______。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:_____________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列
步骤:
A.请写出上述实验中加入或生成的有关物质的化学式。
①_____,②_____,③_____,④_____,⑤_____,⑥_____。
B.请写出相关反应的化学方程式。
_____________, _____________, _____________, _____________。
【答案】 KSCN溶液溶液变成红色 2FeCl3+Cu=2FeCl2+CuCl2 Fe FeCl2 Fe和Cu HCl FeCl2Cl2CuCl2+Fe=FeCl2+Cu Fe+2HCl=FeCl2+H2↑2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
14.有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验:
I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。
(1)则原混合物中一定不存在,一定存在。
(2)实验中发生反应的化学方程式:。
(3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。
【答案】(1)CuSO4 CaCO3 KCl(2)CaCO3 + 2HCl CaCl2 + CO2 + H2O↑
(3)用试管取适量I过滤得到的无色溶液,加入少量BaCl2 溶液,若产生沉淀则白色固体组成中有Na2SO4,否则白色固体组成中有BaCl2
【解析】(1)固体粉末加到水中,得到白色沉淀,且上层清液为无色,说明粉末中一定没有硫酸铜,白色沉淀可能是碳酸钙或硫酸钠与氯化钡反应产生的硫酸钡;白色沉淀完全溶于稀盐酸,说明沉淀为碳酸钙,说明硫酸钠和氯化钡不能同时存在,因此一定含有碳酸钙、氯化钾,而硫酸钠和氯化钡含有其中之一。
(2)实验中的反应为碳酸钙和盐酸反应生成氯化钙和水和二氧化碳。
(3)要进一步确定混合物中是否含有硫酸钠或氯化钡,操作为:用试管取适量I过滤得到的无色溶液,加入少量BaCl2 溶液,若产生沉淀则白色固体组成中有Na2SO4,否则白色固体组成中有BaCl2。
15.下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。
实验时必须使用铁屑和6 mol/L的稀硫酸,其他试剂任选。
请回答下列问题:
(1)B装置中盛有一定量的NaOH溶液,A装置中应预先加入的试剂是________,A装置中发生反应的离子方程式是___________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述制取Fe(OH)2的操作过程__________________。
(4)实验完毕,拔去B装置中的橡胶塞,放入一部分空气,此时B装置中发生反应的化学方程式为_______________________。
(5)在下图中,装置________(填序号)能较长时间观察到Fe(OH)2白色沉淀。
【答案】(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开
(3)关闭活塞a,使FeSO4溶液压入B装置中进行反应(4)4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
(5)①②④。
