(完整word版)高中化学必修二练习题(DOC)
2023年第二学期人教版高中化学必修二全册测试题含答案及

2023-2023 年其次学期人教版高中化学必修二全册测试题本试卷共100 分,考试时间90 分钟。
一、单项选择题(共15 小题,每题3.0 分,共45 分)1.关于以下三种化合物的说法不正确的选项是( )A.香叶醇在铜作催化剂并加热条件下可与氧气反响生成柠檬醛B.月桂烯属于烃C.都可以发生加成反响、酯化反响、氧化反响D.都可以使溴的四氯化碳溶液褪色2.“民以食为天,食以安为先”。
近年来屡屡发生的劣质奶粉、苏丹红、多宝鱼等食品安全大事严峻威逼消费者的安康和生命安全。
以下有关油脂的说法不正确的选项是( )A.油脂在碱性条件下可制取肥皂B.为防止油脂在空气中变质,可在食用油中加一些抗氧化剂C.油脂易溶于有机溶剂,食品工业中,可用有机溶剂提取植物种子中的油D.可在酸性条件下,通过油脂的水解反响生产甘油和氨基酸3.以下说法中不正确的选项是( )A.检测乙醇中是否含有水可参与无水硫酸铜,假设固体变蓝则含水B.鉴别乙醇和水两种无色液体最简洁的方法是闻其气味C.获得无水乙醇的方法是直接加热蒸馏D.获得无水乙醇的方法通常承受先用生石灰吸水,然后再加热蒸馏4.有A,B 两种烃,含碳的质量分数相等。
关于A 和B 的以下表达正确的选项是( )A. A 和B 确定是同分异构体B. A 和B 不行能是同系物C. A 和B 的最简式一样D. A 和B 各1 mol 完全燃烧后生成二氧化碳的质量确定相等5.短周期主族元素X、Y、Z、W 原子序数依次增大,X 原子最外层有6 个电子,Y 是至今觉察的非金属性最强的元素,Z 在周期表中处于周期序数等于族序数的位置,W 的单质广泛用作半导体材料。
以下表达正确的选项是( )A.原子最外层电子数由多到少的挨次:Y、X、W、ZB.原子半径由大到小的挨次:W、Z、Y、XC.元素非金属性由强到弱的挨次:Z、W、XD.简洁气态氢化物的稳定性由强到弱的挨次:X、Y、W6.在冶金工业上,均能用化学复原剂制得的一组金属是( )A.Na、Mg、AlB.Na、Zn、FeC.Zn、Fe、CuD.Mg、Al、Zn、Fe7.2023 年4 月22 日是第51 个“世界地球日”,宣传主题是“善待地球——珍惜资源、持续进展”。
高中化学必修二综合测试题及解答

高中化学必修二综合测试题令狐采学时间90分钟,总分100分。
一、选择题(共25题,每题2分,共50分)1.海水是巨大的化学资源库,下列有关海水综合利用说法正确的是()。
A.海水的淡化,只需经过化学变化就可以得到B.海水蒸发制海盐的过程中只发生了化学变化C.从海水中可以得到NaCl,电解熔融NaCl可制备金属NaD.利用海水、铝、空气的航标灯的原理是将电能转化为化学能2.32He可以作为核聚变材料。
下列关于32He的叙述中,正确的是( )。
A.质子数为2B.电子数为3C.中子数为2D.质量数为23.目前世界上最重要的气态化石燃料是( )。
A.水煤气B.一氧化碳C.天然气D.氢气4.下列物质中,属于天然有机高分子化合物的是( )。
A.葡萄糖B.蔗糖C.淀粉D.油脂5.鉴别某种白色织物是否是蚕丝制品,可选用的方法是( )。
A.滴加盐酸B.滴加浓硫酸C.滴加氢氧化钠溶液D.滴加浓硝酸6.卤族元素随着原子序数的增大,下列递变规律正确的是( )。
A.单质熔、沸点逐渐降低B.单质的氧化性逐渐增强C.原子半径逐渐增大D.气态氢化物稳定性逐渐增强7.下列金属中,通常采用热还原法冶炼的是( )。
A.NaB.AlC.FeD.Ag8.下列关于甲烷分子结构的叙述中,正确的是( )。
A.甲烷分子中C、H原子间是离子键B.甲烷分子的空间结构是正方体C.甲烷的结构式为CH4D.甲烷分子中4个碳氢键完全相同9.运用元素周期律分析下列推断,其中错误的是()。
A.铍是一种轻金属,它的氧化物的水化物可能具有两性B.砹单质是一种有色固体,砹化氢很不稳定C.硫酸锶难溶于水D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体10.废电池必须进行集中处理的首要原因是( )。
A.充电后可再使用B.回收利用石墨电极和金属材料C.防止电池中汞、镉和铅等重金属离子污染土壤和水源D .防止电池中的电解质溶液腐蚀其他物品11.山梨酸(CH3—CH =CH —CH =CH —COOH)是一种常用的食品防腐剂。
人教版高中化学必修二单元测试题全套及答案.doc

最新人教版高中化学必修二单元测试题全套及答案模块综合测评(时间45分钟,满分100分)一、选择题(本题包括12小题,每小题4分,共48分)1 •化学与人类生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是()A.大量开发利用深海可燃冰,有助于海洋生态环境治理B.汽车尾气中含有大量大气污染物,其原因是汽油的不完全燃烧C・煤炭燃烧过程安装固硫装置,目的是提高煤的利用率D・PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害【解析】A项,大量开发深海可燃冰可能会影响海洋的生态环境;B项,汽车尾气中的NO是N2与。
2在放电条件下生成的,与汽油是否完全燃烧无关;C项,煤炭燃烧固硫是为了减少污染物SO2的排放。
【答案】D2.关于元素在周期表中的位置、原子结构和性质的关系,说法正确的是()A.非金展元素间形成的化学键都是共价键B.第三周期主族元素的最高正价等于它所处的族序数C•短周期元素形成离子后,最外层都达到8电子稳定结构D.最外层电子数相同的原子属于同一族且化学性质相似【解析】铁盐中全部是非金属元素,可以形成离子键,A错误;第三周期的元素都有最高正价,B正确;Li+是2个电子,H+没有电子,C错误;氮和皱最外层都是2个电子,但不属于同一个族,且化学性质不相似,D错误。
【答案】B3.(2015-福建蒲田一中检测)下列关于有机物的说法中正确的是()A.聚乙烯是由乙烯加聚生成的纯净物B.蛋白质和淀粉水解的最终产物都是氨基酸C.油脂、纤维素、淀粉在一定条件下均可发生水解反应D.蛋白质、纤维素、蔗糖都是高分子化合物【解析】高分子化合物的聚合度不同,属于混合物,A错;蛋白质水解的最终产物为氨基酸,而淀粉水解的最终产物为葡萄糖,B错;蛋白质和纤维素为高分子化合物,但蔗糖为双糖,分子式为C12H22O11,不是高分子化合物,D错。
【答案】C4.下列事实不能作为实验判断依据的是()A.钠和镁分别与冷水反应,判断金属活泼性强弱B.在MgCb与AlCb溶液中分别加入过量的氨水,判断镁与铝的金属活泼性强弱C.硫酸与碳酸钠溶液反应产牛co2,判断硫与碳的非金属活泼性强弱D.与【2分别与足量的H2反应,判断澳与碘的非金属活泼性强弱【解析】在MgCl2与AlCh溶液中分别加入过量的氨水发生的不是氧化还原反应,没有得失电子,所以不能判斷镁与铝的金属活动性强弱,B错;C体现了非金属活动性强弱与最高价含氧酸酸性强弱的关系。
2021新教材人教版高中化学选择性必修第二册对应练习--第1课时 共价键(可编辑Word)

第二章分子结构与性质第一节共价键第1课时共价键基础过关练题组一共价键的形成与特征1.下列不属于共价键成键因素的是(深度解析)A.电子在两原子核之间高概率出现B.未成对电子必须配对C.成键后体系能量降低,趋于稳定D.两原子核体积大小要适中2.共价键具有饱和性和方向性,下列有关叙述不正确的是()A.共价键的饱和性是由成键原子的未成对电子数决定的B.共价键的方向性与成键原子的轨道的伸展方向有关C.共价键的饱和性决定了各种原子形成分子时相互结合的数量关系D.共价键的饱和性与原子轨道的重叠程度有关3.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8电子的结构。
则一个三硫化四磷分子中含有的共价键个数是() A.7 B.9C.19D.不能确定4.下列说法正确的是()A.若把H2S分子写成H3S分子,违背了共价键的饱和性B.H3O+的存在说明共价键不具有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,电子仅存在于两核之间题组二σ键和π键5.(2020江苏徐州一中高二月考)下列分子中存在π键的是()A.H2B.Cl2C.N2D.HCl6.(2020云南昭通高二期末)下列分子中,既含有σ键,又含有π键的是()A.CH4B.HClC.CH2CH2D.F27.下列对σ键的认识不正确的是()A.σ键不属于共价键,是另一种化学键B.s-sσ键与s-pσ键的对称性相同C.分子中含有共价键,则至少含有一个σ键D.含有π键的化合物与只含σ键的化合物的化学性质不同8.具有下列电子排布式的原子中,不能形成π键的是()A.1s22s22p63s23p4B.1s22s22p3C.1s22s22p63s1D.1s22s22p29.下列对分子中σ键重叠方式的分析不正确的是()A B C DH2HCl Cl2ClF两个原子的s轨道重叠氢原子的s轨道和氯原子的p轨道重叠一个氯原子的s轨道和另一个氯原子的p轨道重叠氯原子的p轨道和氟原子的p轨道重叠10.下列分子中既有σ键,又有π键的是()①HCl②H2O③N2④H2O2⑤C2H4⑥C2H2A.①②③B.③④⑤⑥C.①③⑥D.③⑤⑥11.下列说法正确的是(深度解析)A.σ键强度小,容易断裂,而π键强度较大,不易断裂B.共价键都具有方向性C.π键是由两个原子的p轨道“头碰头”重叠形成的D.两个原子之间形成共价键时,最多有一个σ键12.(1)写出下图所表示的共价键名称,并列举含有该共价键的一种物质,写出其分子式。
(共47套120页)人教版高中化学必修2(全册)配套同步练习汇总 WORD版可编辑

超级资源(共47套120页)人教版高中化学必修2(全册)配套同步练习汇总 WORD版可编辑课时自测·基础达标1.(2018·淄博高一检测)下列说法正确的是 ( )A.元素周期表中元素排序的依据是原子的核电荷数B.元素周期表有十六个纵行,也就是十六个族C.原子的最外层电子数相同的元素,一定属于同一族D.氢与碳属于同一周期【解析】选A. 元素周期表有十八个纵行,十六个族,第Ⅷ族占三个纵行;Be和He的最外层电子数都是2,但不属于同一族;H和C分属第1、2周期.2.(2018·绵阳高一检测)在元素周期表中,第1、2、3周期中所含元素种数分别为( )A.2、8、8B.8、8、18C.2、8、18D.8、18、18【解析】选A. 元素周期表中第1~6周期的元素种类数分别为2、8、8、18、18、32,A正确.3.元素在周期表中的位置取决于( )A.元素的核电荷数B.元素的化合价C.元素原子的电子层数D.元素原子的最外层电子数【解析】选 A. 元素周期表中的元素是按原子序数递增顺序排列的,故元素在周期表中的位置由其核电荷数决定.4.不用查阅元素周期表,根据所学知识推断,原子序数为52的元素在元素周期表中位于( )A.第5周期第ⅡA族B.第5周期第ⅥA族C.第4周期第ⅡA族D.第4周期第ⅥA族【解析】选B. 元素周期表中稀有气体元素的原子序数分别为2、10、18、36、54和86,将某元素的原子序数减去与这个数值最相近的稀有气体的原子序数,52-54=-2,说明该元素处于氙(54)的同一周期(第5周期),从右往左数的第三列(第ⅥA族),所以选B.【补偿训练】原子序数为83的元素位于:①第5周期;②第6周期;③第ⅣA族;④第ⅤA族;⑤第ⅡB族,其中正确的组合是 ( )A.①④B.②③C.②④D.①⑤【解析】选C. 根据与该元素原子序数最接近的0族元素的位置来确定. 与83号元素最邻近的0族元素为86号元素氡,83号元素比氡的原子序数小3,那么它在元素周期表中的位置应该是氡左移3个格,即第6周期第ⅤA族.5.蓝宝石的主要成分为第ⅢA族元素的氧化物,该氧化物为( )A.Al2O3B.CuOC.Fe2O3D.MgO【解析】选A. 四个选项中,只有Al属于第ⅢA族元素.6.某周期的第ⅠA族元素的原子序数为x,那么同一周期第ⅢA族元素的原子序数为 ( )A.肯定是x+2B.肯定是x+2或x+8或x+32C.肯定是x+2或x+12或x+26D.肯定是x+2或x+10或x+26【解析】选C. 第ⅠA族元素在第2、第3周期时,同周期第ⅢA族元素的原子序数为x+2;第ⅠA族元素在第4、第5周期时,同周期第ⅢA 族元素的原子序数为x+12;第ⅠA族元素在第6、第7周期时,同周期第ⅢA族元素的原子序数为x+26.7.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素.表中所列元素中:(1)属于短周期元素的有________(填字母序号,下同).(2)属于主族元素的有_____________________________________.(3)e元素在元素周期表中的位置是第______周期______族.【解析】(1)短周期的元素位于第1、2、3周期,所以短周期元素有b、h、j、a、c、f、i、l、m.(2)主族就是第一、第二纵行,以及第13~17纵行;所以是a、b、c、d、f、h、g、i、j、k、l.(3)e元素位于第4横行,第4纵行,属于第4周期、ⅣB族.答案:(1)b、h、j、a、c、f、i、l、m(2)a、b、c、d、f、h、g、i、j、k、l(3)4 ⅣB课时自测·基础达标1.(2018·临沂高一检测)如图表示第ⅠA族金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是 ( )A.金属性B.与水反应的剧烈程度C.阳离子的氧化性D.最高价氧化物对应水化物的碱性【解析】选 C. 由图可知随着核电荷数的增大,碱金属的金属性逐渐增强,其单质与水反应剧烈程度增大,最高价氧化物对应水化物的碱性逐渐增强,A、B、D三项正确;随碱金属的核电荷数递增,其阳离子氧化性逐渐减弱,C项与图不符.2.下列关于卤素(用X表示)的叙述正确的是 ( )A.HF、HCl、HBr、HI的稳定性依次增强B.卤素单质与水都生成HX和HXOC.其单质都有颜色,都有毒D.卤素单质与其他物质化合时,均表现为还原性【解析】选 C. 同主族自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,A项错误. 要注意F2及氟的化合物的特殊性:F2与水反应置换H2O中的氧生成O2,不像其他卤素单质,B项错误. 卤素单质与其他物质化合时,多表现为氧化性,D项错误.3.下列叙述中能说明A金属比B金属活泼性强的是 ( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子电子层数比B原子的电子层数多C.1 mol A从酸中置换H+生成的H2比1 mol B从酸中置换H+生成的H2多D.常温时,A能从水中置换出氢气,而B不能【解析】选 D. 比较金属的活泼性不能根据最外层电子数的多少,如Li的最外层电子数比Ca少,但不如Ca活泼,故A错误;比较金属的活泼性不能根据原子电子层数的多少,如Na的电子层数比Cu少,但Na 比Cu活泼,故B错误;比较金属的活泼性不能根据生成氢气的多少来判断,例如1 mol Al从酸中置换H+生成的H2比1 mol Mg从酸中置换H+生成的H2多,但Mg的活泼性强,故C错误;常温时,A能从水中置换出氢,而B不能,说明A易失去电子,则A的活泼性肯定比金属B的活泼性强,故D正确.4.(2018·长春高一检测)下列关于碱金属的原子结构和性质的叙述不正确的是( )A.碱金属元素的原子在化学反应中容易失去电子B.碱金属单质都可以作还原剂C.碱金属单质都能在O2中燃烧生成过氧化物D.碱金属单质都能与水反应生成碱【解析】选 C. 碱金属元素原子的最外电子层上只有一个电子,同时原子半径又比较大,故在化学反应中易失去电子表现出强还原性,A、B 正确;锂与氧气反应生成的是Li2O,C错误;碱金属单质都能与水反应生成碱,D正确.5.下列事实不能说明元素的金属性或非金属性相对强弱的是( )选项事实推论A 与冷水反应,Na比Mg剧烈金属性:Na>MgB Ca(OH)2的碱性强于Mg(OH)2金属性:Ca>MgCSO2与NaHCO3溶液反应生成CO2非金属性:S>CDH2+Cl22HClH2+I22HI 非金属性:Cl>I【解析】选C. SO2与NaHCO3溶液反应生成CO2,说明H2SO3的酸性比H2CO3的酸性强,但不能说明S和C的非金属性强弱,应比较H2SO4和H2CO3的酸性,所以C项错误.6.(2018·郑州高一检测)X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示. 若Y原子的最外层电子数是6,下列说法不正确的是 ( )A.可以形成化合物ZY3B.非金属性:Z>YC.质子数:W>ZD.Y和W形成的单质都有较强的氧化性【解析】选B. X、Y、Z、W均为短周期元素,Y位于第2周期,则Y原子有2个电子层,Y原子的最外层电子数是6,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素. 氧和硫可以形成三氧化硫,故A正确;同主族元素从上到下非金属性减弱,则非金属性Y>Z,故B错误;W在Z的右边,质子数W比Z多1,故C正确;氧气和氯气都有较强的氧化性,故D正确.7.根据元素周期表回答下列问题:(1)自然界稳定存在的元素中,金属性最强的元素是________,非金属性最强的元素是________.(2)在稳定存在的碱金属元素中,最高价氧化物对应水化物的碱性最强的是________,写出钠与水反应的离子方程式为____________________________.(3)卤族元素中,氢化物热稳定性最强的是________;写出向KI溶液中通入Cl2的反应离子方程式__________________________________________.【解析】(1)自然界稳定存在的元素中,金属性最强的是第ⅠA族的Cs;非金属性最强的元素是F.(2)在稳定存在的碱金属元素中,碱性最强的是CsOH,Na与水反应的离子方程式为2Na+2H2O2OH-+2Na++H2↑.(3)卤族元素中,氢化物热稳定性最强的是HF,Cl2与KI溶液反应的离子方程式为Cl2+2I-I2+2Cl-.答案:(1)Cs F(2)CsOH 2Na+2H2O2Na++2OH-+H2↑(3)HF Cl2+2I-2Cl-+I2课时自测·基础达标1.(2018·成都高一检测)某研究团队在实验室成功合成了一种新型三维碳结构,这种碳被称为T-碳. T-碳与金刚石的关系是( )A.属于不同元素形成的单质B.同素异形体C.属于同种原子D.同位素【解析】选 B. 同一元素的不同单质互称同素异形体,T-碳与金刚石都是碳元素的不同单质,所以互称同素异形体.2.下列关于X与X+两种粒子的叙述正确的是 ( )A.质子数一定相等,电子数一定不同B.化学性质几乎相同C.一定由质子、中子和电子构成D.核电荷数、核外电子数一定相同【解析】选 A. 原子失去电子后形成离子,故原子和其对应的离子的电子数一定不等,A项正确,D项错误;原子和其对应的离子化学性质不同,B项错误,H+既无电子也无中子,C项错误.3.(RJ·P11改编题)下列有关Li Li Na Mg C N的叙述中正确的是( )A.Li和Li是同一种原子B Na和Mg的质子数、中子数都不相等C C和N的质量数相等,但不互为同位素D.上述微粒共有6种元素【解析】选C Li和Li是锂元素的两种核素,不是同一种原子,A、D错误Na和Mg的质子数不同、中子数都为12,B错误C和N 的质量数相等,但质子数不同,不是同一种元素,C正确.4.(2018·宜昌高一检测)中国科学家成功合成全氮阴离子,是制备全氮类物质的重要中间体,下列说法中,正确的是( )A.的中子数为7B.每个中含有35个质子C.每个中含有35个电子D.和属于同位素【解析】选B. 的中子数无法确定,但是不可能是7,A错误. N5+的质子数为7×5=35,B正确. C项,含有的电子数为5×7+1=36,C 错误. 和属于离子,不可能互为同位素,D错误.5.(2018·合肥高一检测)下列分子中所含中子数为18的是( )A.18O2B.1O2C.1O2D.14N18O【解析】选B. 18O2所含的中子数为2×(18-8)=20,故A错误;1O2所含的中子数为0+2×(17-8)=18,故B正确;1O2所含的中子数为0+2×(18-8)=20,故C错误;14N18O所含的中子数为(14-7)+(18-8)=17,故D错误.6.(2018·包头高一检测)下列说法正确的是 ( )A.有质子的微粒一定有中子B.通常所说的氢元素是指HC.16O中的“16”表示氧元素的近似相对原子质量D.根据反应K35ClO 3+6H37Cl KCl+3Cl2↑+3H2O得到的Cl2,其相对分子质量为73.3【解析】选D. 核素1H只有质子没有中子,A错误;通常所说的氢元素是指各种氢原子的总称,B错误;16O中的“16”表示该核素的质量数,C 错误;利用价态归中规律结合反应方程式知生成的3 mol Cl2中含有1mol 35Cl和 5 mol 37Cl,根据M=计算生成氯气的摩尔质量为73.3 g·mol-1,其相对分子质量为73.3,D正确.7.如表所示,符号中“2”的含义正确的一组是( )选项H 2He Cl2Ca2+A 质量数中子数质子数电荷数B 质量数质子数原子数电荷数C 质子数中子数原子数电子数D 质量数质子数分子数电荷数【解析】选B H中的“2”表示该核素的质量数为2;2He中的“2”表示He的质子数为2;Cl2中的“2”表示氯原子个数;Ca2+中的“2”表示钙离子带2个电荷,选B.8.已知a A m+与b B n-具有相同的核外电子排布,则下列关系正确的是( )A. a=b+m+nB.a=b-m+nC.a=b+m-nD.a=b-m-n【解析】选A. a A m+和b B n-的核外电子排布相同,说明二者核外电子数相同,即a-m=b+n,所以a=b+m+n.9.(1)________和________互为同位素.(2)________和________质量数相等,但不能互称同位素.(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素.(4)填写下列表格:原子组成Z N AK 19 ①______39O ②______③______④______Ar 18 22 ⑤_____ _【解析】(1Li Li质子数相同中子数不同,为锂元素的同位素.(2N C质量数同为14,质子数不同,属于不同元素.Mg中子数分别为23-11=12,24-12=12,中子数相等,但质子数不相等,不是同一种元素. (4K:N=A-Z=39-19=20O原子中A=18,Z=8,N=A-Z=18-8=10Ar原子中Z=18,A=40,N=A-Z=40-18=22.答案:(1Li Li (2N C (3Na Mg(4)①20 ②8 ③10 ④18 ⑤40课时自测·基础达标1.下列微粒的结构示意图,表示正确的是 ( )【解析】选A. B中微粒结构示意图表示的是Cl-而不是Cl,C中Ar的原子结构示意图应为,D中K的原子结构示意图应为. 【补偿训练】具有下列结构的原子,其元素一定属于ⅡA族的是( )A.最外层电子数与次外层电子数相等的原子B.K层电子数为M层电子数一半的原子C.最外层有2个电子的原子D.M层电子数等于其内层电子数之和的的原子【解析】选D. 若该元素位于ⅡA族,则其原子最外层电子数为2,A项中元素原子最外层电子数可能为2或8,B项中元素最外层电子数为4,C项中元素可能是He,位于0族. D项中,元素有三个电子层,其最外层电子数一定为2.2.(RJ·P19改编题)根据元素在周期表中的位置判断,下列正确的是( )A.金属性:Na>KB.非金属性:S>ClC.酸性:H3PO4>HNO3D.碱性:KOH>Mg(OH)2【解析】选D. 同主族自上而下金属性逐渐增强,A错误;同周期从左到右非金属性逐渐增强,同主族自下而上,最高价氧化物对应水化物的酸性逐渐增强,B、C错误;由同主族元素的最高价氧化物的水化物碱性递变规律可得:KOH>NaOH,由同周期元素的最高价氧化物的水化物碱性递变规律可得NaOH>Mg(OH)2,则碱性:KOH>Mg(OH)2,D正确. 【补偿训练】同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )A.原子序数:X>Y>ZB.非金属性:X>Y>ZC.原子半径:X>Y>ZD.气态氢化物的稳定性:HX>H2Y>ZH3【解析】选 C. 同周期元素由左向右元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强. 已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则X、Y、Z三种元素由左向右的顺序为Z、Y、X. 同周期由左向右元素的原子序数逐渐增大,故原子序数:X>Y>Z,A正确;同周期元素由左向右元素的非金属性逐渐增强,故非金属性:X>Y>Z,B正确;同周期元素由左向右原子半径逐渐减小,故原子半径:Z>Y>X,C错误;同周期元素由左向右元素的非金属性逐渐增强,气态氢化物的稳定性逐渐增强,故气态氢化物的稳定性:HX>H2Y> ZH3,D正确.3.(2018·天水高一检测)X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构. 下列说法正确的是( )A.原子最外层电子数:X>Y>ZB.原子序数:X>Y>ZC.离子半径:X2->Y+>Z-D.单质氧化性:X>Z>Y【解析】选B. X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,可推知Y为钠元素,Z为氟元素,X、Y同周期,则X为硫元素. A项,X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,故A错误;B项,X、Y、Z原子序数分别为16、11、9,原子序数:X>Y>Z,故B正确;C项,电子层结构相同,核电荷数越大离子半径越小,电子层越多,离子半径越大,故离子半径:S2->F->Na+,故C 错误;D项,Na为金属元素,单质只表现还原性,F、S为非金属,单质可以表现氧化性,非金属性S<F,故单质氧化性S<F2,故D错误.4.下列粒子半径之比小于1的是( )A. B.C. D.【解析】选A. 粒子半径之比小于1,说明分子比分母小,同种元素中阳离子半径比原子半径小,阴离子半径比原子半径大,A正确,B错误;同周期,自左至右,原子半径逐渐减小,C错误;同主族,自上至下,原子半径逐渐增大,D错误.5.(2018·龙门高一检测)短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为19. 则下列说法正确的是 ( )A.氢化物的沸点:Y<ZB.原子半径大小:Y>WC.非金属性:X>YD.形成化合物时元素的化合价:W>Y【解析】选D. W、X、Y、Z均为短周期主族元素,由位置关系可知,X、Y处于第2周期,W、Z处于第3周期,设W原子最外层电子数为a,则X、Y、Z最外层电子数依次为a+2、a+4、a+5,四种元素的原子最外层电子数之和为19,则a+a+ 2+a+4+a+5=19,解得a=2,则W为镁元素,故X 为碳元素、Y为氧元素、Z为氯元素;A项,H2O分子间有氢键,常温下是液态,而HCl常温下是气态,可知H2O的沸点大于HCl,故A错误;B 项,Mg与S同周期,核电荷数越大,原子半径越小,而S和O同主族,核电荷数大,原子半径大,则原子半径的大小关系是Mg大于O,故B错误;C项,同周期从左到右,非金属性逐渐增强,故C错误;D项,Mg是金属,形成化合物时化合价是+2,O形成化合物时化合价通常为-1或-2,故D正确.课时达标训练1.下列各组微粒中,半径由小到大的一组是( )A.H+、Al3+、Mg2+、K+B.Na+、Mg2+、K+、Ca2+C.O、N、P、SD.I、Br、Cl、F【解析】选 A. B项中半径Na+>Mg2+,K+>Ca2+,不符合题意;C项中半径:P>S,不符合题意;D项中半径依次减小,不符合题意.2.(2017·广州高一检测)下列不能说明氯元素的非金属性比硫元素强的事实是( )①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S ⑤氯原子最外层有7个电子,硫原子最外层有6个电子A.②⑤B.①②C.①②④D.①③⑤【解析】选A. 判断元素的非金属性强弱是根据元素的最高价氧化物对应的水化物的酸性强弱(即最高价含氧酸),故②错,③对;最外层电子数多的非金属性不一定强,如最外层电子数I>O,但非金属性I<O,⑤错.【方法规律】元素非金属性强弱的判断规律本质:原子越易得电子,则非金属性就越强.(1)根据元素周期表进行判断.同一周期:从左到右,随着原子序数的递增,元素的非金属性逐渐增强.同一主族:从上到下,随着原子序数的递增,元素的非金属性逐渐减弱.(2)非金属元素单质与H2化合的难易程度:化合越容易,非金属性越强. 如F2与H2在黑暗中就可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br.(3)形成气态氢化物的稳定性:气态氢化物越稳定,元素的非金属性越强. 如稳定性:HF>HCl,则非金属性:F>Cl.(4)最高价氧化物对应水化物的酸性强弱:酸性越强,对应非金属元素的非金属性就越强. 如酸性:HClO4>HBrO4,则非金属性:Cl>Br.(5)一般情况下,非金属单质的氧化性越强,则元素的非金属性就越强;对应阴离子的还原性越强,则元素的非金属性就越弱. 如氧化性Cl2>Br2,则非金属性:Cl>Br.(6)置换反应:如Cl2+2Br-2Cl-+Br2,则非金属性:Cl>Br.(7)根据与同一种金属反应,生成化合物中金属元素的化合价的高低进行判断. 例如,Cu+Cl2CuCl2,2Cu+S Cu2S,即得非金属性:Cl>S.3.镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是( )A.镭的金属性比钙弱B.单质能与水反应生成H2C.镭在化合物中呈+2价D.碳酸镭难溶于水【解析】选A. 镭是第ⅡA族元素,同主族自上至下,元素的金属性增强,故镭比钙还活泼,与水反应生成氢气,A错误,B正确;最外层有2个电子,在化合物中呈+2价,类比碳酸钙难溶于水,碳酸镭也难溶于水,C、D正确.【补偿训练】(双选)原子序数从11依次增加到17,下列递变关系错误的是( )A.电子层数逐渐增多B.原子半径逐渐增大C.最高正价数值逐渐增大D.从硅到氯,负价从-4到-1【解析】选A、B. 原子序数从11依次增加到17,电子层数不变,原子半径逐渐减小,最高正价数值逐渐增大,从硅到氯负价从-4到-1. 4.X、Y、Z均为短周期元素,在元素周期表中的位置如图所示,下列叙述正确的是( )A.X的单质一定是活泼金属B.Y的最高价氧化物是酸性氧化物C.Z的单质是双原子分子D.氢化物的稳定性:Y>X【解析】选D. 短周期只有第1、第2、第3三个周期,所以Z为氦元素,Y为氟元素,X为硫元素. X为硫元素,是非金属元素,A错误;Y为氟元素,没有最高价氧化物,B错误;Z的单质为稀有气体,是单原子分子,C错误;F的非金属性大于S的非金属性,所以氢化物的稳定性:Y>X,D正确.5.(2017·福州高一检测)锗(Ge)是第4周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是( )A.锗是一种金属性很强的元素B.锗的单质具有半导体的性能C.锗化氢(GeH4)稳定性很强D.锗酸(H4GeO4)是难溶于水的强酸【解析】选 B. 依据同主族元素性质递变规律可知:气态氢化物稳定性:CH4>SiH4>GeH4,而已知硅烷(SiH4)不稳定,故GeH4稳定性很弱;最高价氧化物的水化物的酸性:H2CO3>H4SiO4>H4GeO4,H4SiO4难溶于水,故H4GeO4为难溶于水的弱酸. 因为锗处于元素周期表中金属区与非金属区的交界线上,所以锗单质应具有半导体的性能.【补偿训练】如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示. 下列说法正确的是( )A.虚线左下方的元素均为非金属元素B.紧靠虚线两侧的元素都是两性金属元素C.可在虚线附近寻找半导体材料(如Ge、Si等)D.可在虚线的右上方,寻找耐高温材料【解析】选C. A、虚线左下方的元素均为金属元素,A错误;B、紧靠虚线两侧的元素不一定都是两性金属元素,如硅是非金属元素,B错误;C、元素周期表中的金属和非金属元素的分界线附近的元素往往都既具有金属性,也具有非金属性,可在虚线附近寻找半导体材料(如Ge、Si等),C正确;D、在过渡元素中可寻找耐高温材料,D错误. 6.(2017·淄博高一检测)某同学设计如图元素周期表,以下说法正确的是( )A.X、Y、Z元素分别为N、P、OB.白格中都是主族元素,灰格中都是副族元素C.原子半径:Z>X>YD.X、Y、Z的气态氢化物中最稳定的是Y的氢化物【解析】选A. 从元素周期表中找出规律,左侧第2周期原子序数应是3、5、6、7,右侧第2周期原子序数应为4、8、9、10,左侧第3周期原子序数应为11、13、14、15,右侧第3周期原子序数应为12、16、17、18,故X、Y、Z三种元素分别是N、P、O,A正确;白格中的He、Ne、Ar都是稀有气体,不属于主族元素,B错误;原子半径大小:P>N>O,C错误;非金属性越强,其氢化物越稳定,非金属性:O>N>P,最稳定的是O的氢化物,D错误.7.【能力挑战题】依据门捷列夫的元素周期表,人们总结出下面的元素化学性质的变化规律.(1)该表中元素化学性质的变化表明.A.同周期元素的性质是相似的B.元素周期表中最右上角的氦元素是非金属性最强的元素C.ⅠA族元素(H除外)的金属性肯定比同周期的ⅡA族元素的金属性强(2)据报道,美国科学家制得一种核素X,它属于一种新元素,是116号元素(元素符号暂用X代替),关于它的推测正确的是.A.这种核素的中子数为167B.它位于元素周期表的第6周期C.这种元素一定是金属元素D.这种元素的原子易与氢气化合【解析】(1)A ×根据同周期元素性质递变,而同主族元素性质相似判断B ×氦是稀有气体,性质比较稳定,氟元素是非金属性最强的元素C √符合同周期元素性质的递变规律(2)根据原子序数推断元素的位置可知,116号元素比118号元素少两个质子,其中子数=283-116=167,该元素应该属于第7周期ⅥA族,根据同主族元素性质的递变规律,该元素一定是金属元素,但不易与氢气化合.答案:(1)C (2)A、C课时达标训练1.(2017·江苏高考)下列有关化学用语表示正确的是( )A.质量数为31的磷原子:PB.氟原子的结构示意图:C. CaCl2的电子式:Ca2+D.明矾的化学式:Al2(SO4)3【解析】选A. A项,P的左上角标为质量数,左下角标为质子数,正确;B 项,氟原子的最外层为7个电子,错误;C项,两个Cl-应放在Ca2+的两边,错误;D项,明矾的化学式为KAl(SO4)2·12H2O,错误.2.(2017·长沙高一检测)关于氢键的说法中正确的是( )A.每个水分子内含有两个氢键B.在水蒸气、水和冰中都含有氢键C.分子间形成氢键能使物质的熔点和沸点升高D.HF的稳定性很强,是因为其分子间能形成氢键【解析】选C. 水在固态和液态时,分子间存在着氢键,而气态时氢键被破坏,所以A、B错误. 氢键不影响物质的稳定性,D错误.3.下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )A.KB.MgC.OD.Ne【解析】选C. 活泼金属元素Mg、K仅能形成离子键,Ne为稀有气体元素,原子已达到8电子稳定结构,一般不形成化学键,氧元素的原子在形成不同物质时,既能形成非极性键,如H2O2,也能形成极性键,如H2O,还能形成离子键,如K2O.【补偿训练】下列物质中既含离子键又含非极性键的是( )A.NaNO3B.KOHC.Na2O2D.CH4【解析】选C. A选项:NaNO3中Na+与N间以离子键结合,N中N、O原子间以极性共价键结合;B选项:KOH中K+与OH-间以离子键结合,OH-中H、O原子间以极性共价键结合;D选项:CH4中只存在C、H间的极性共价键. 所以,A、B、D均为错误选项. C选项:Na2O2中,Na+与间是以离子键结合的,而中两个氧原子间是以非极性共价键结合的,所以C选项为正确选项.4.下列物质中只含有共价键的是( )A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O3【解析】选C. NaCl只含有离子键,HCl、H2O只含有共价键,NaOH既含有离子键又含有共价键,A错误;Cl2、HCl、SO2分子中只有共价键,。
高中化学(人教版必修二)试题及答案

化 学 试 题第I 卷(选择题,共50分)一、 选择题(本题包括10个小题,每小题2分共20分,每个小题只有一个选项符合题意。
)1.下列有关基本营养物质的说法中,正确的是( )A. 淀粉遇碘化钾溶液变蓝B. 蔗糖和麦芽糖互为同分异构体C. 纤维素在人体内最终水解为葡萄糖D. 糖类、油脂、蛋白质都是由C 、H 、O 三种元素组成 2.下列说法中正确的一组是( )A.H 2和D 2互为同位素B.淀粉和纤维素互为同分异构体3.下列各项中表达正确的是( )A.CO 2的结构式:O —C —OB.乙烯分子球棍模型:C.NaCl 的电子式:D. F —的结构示意图4.苯的结构式可用来表示,下列关于苯的叙述中正确的是 ( )A .苯主要是以石油分馏而获得的一种重要化工原料B .苯中含有碳碳双键,所以苯属于烯烃C .苯分子中6个碳碳化学键完全相同D .苯可以与溴的四氯化碳、高锰酸钾溶液反应而使它们褪色 5.下列说法正确的是 ( )①离子化合物一定含离子键,也可能含极性键或非极性键 ②同位素的化学性质几乎完全相同③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键A .①③⑤B .②④⑤C .②③④D .①②③6.下列叙述中能说明金属A 肯定比金属B 的活泼性强的是 ( )A .A 原子的最外层电子数比B 原子的最外层电子数少 B .A 原子电子层数比B 原子电子层数多C .1mol A 从酸中置换出的H 2比1molB 从酸中置换的H 2多D .常温时,A 能从稀盐酸中置换出氢,而B 不能7.取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气Br Br C H H Br BrH HC 和 互为同分异构体 C. CH 3—CH —CH 2—CH 3 CH 3CH 3—CH —CH 3 CH 3—CH 2和 是同一种物质D. Cl ·× ·· ·· ·· Na +9 2 8(如下图),下列说法正确的是( )A .此反应属于加成反应B .此反应无光照也可发生C .试管内壁出现油状液滴D .此反应得到的产物是纯净物8.根据反应:2Ag ++Cu===Cu 2++2Ag ,设计如图所示原电池, 下列说法错误的是( )A.X 可以是银或石墨B. Y 是硫酸铜溶液C.电子从铜电极经外电路流向X 电极D.X 极上的电极反应式为:Ag ++e-==Ag 9.下列实验结论不正确的是 ( ) 实验操作现象结论A将石蜡油加强热产生的气体通入溴的四氯化碳溶液中溶液褪色产物不都是烷烃B将乙醇与酸性重铬酸钾(K 2Cr 2O 4)溶液(溶液显橙色)混合 橙色溶液变为绿色乙醇具有还原性C 将碘酒滴到土豆片上土豆片变蓝 淀粉遇碘元素变蓝D将新制Cu(OH)2与葡萄糖溶液混合加热 产生砖红色沉淀()葡萄糖具有还原性 10.已知MgO、MgCl 2的熔点分别为2800℃、604℃,将MgO 、MgCl 2加热熔融后通电电解,都可得到金属镁。
新人教版高一化学必修第二册有机化学基础-同分异构体(基础版)(WORD版含解析)
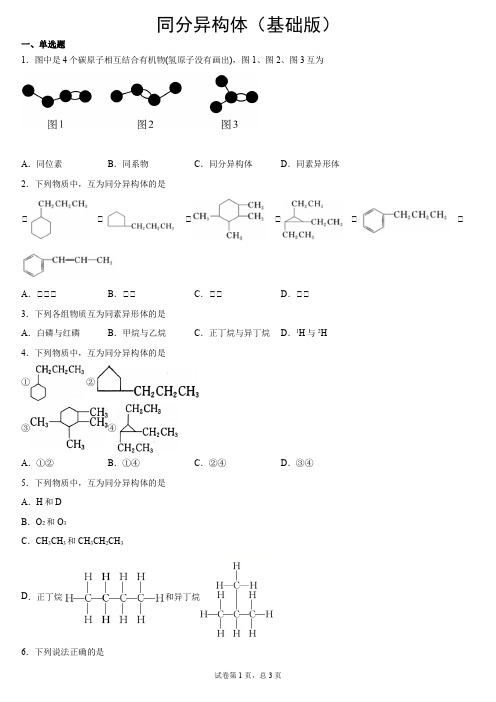
15.B
【分析】
分子式相同,结构不同的有机物互为同分异构体。
【详解】
①和④虽都有5个碳原子,但结构相同,属于同种物质,而②③⑤都含6个碳原子,且都属于烷烃,分子式相同,故互为同分异构体,B项正确;
答案选B。
16.B
【分析】
【详解】
A.同分异构体是指具有相同的分子式且空间结构不同的一类物质,所以其具有相同的相对分子质量,而具有相同的相对分子质量的物质不一定为同分异构体,如NO和C2H6,故A错误;
D.乙醚的分子式为C4H10O,乙醇的分子式为C2H6O,两者分子式不同,因此,两者不能互称同分异构体,D不正确。
综上所述,本题选B。
7.C
【详解】
A.35Cl和37Cl互为同位素 ,故A不选;
B.CH3CH2OH和CH3OCH3分子式相同,结构不同,属于同分异构体 ,故B不选;
C.O2和O3同种元素形成的结构不同的单质 ,互为同素异形体,故C选;
综上所述答案为A。
13.C
【详解】
同位数是指具有相同质子数而不同中子数的同一元素的不同原子之间的互称,据此分析解题:
A.H2与D2均是H2分子,不是原子,属同一物质,A不合题意;
B.氧气与臭氧是分子,不是原子,属于同素异形体关系,B不合题意;
C.12C与14C是两种碳原子,是C元素的两种同位素,C符合题意;
D.干冰和CO2是同一种物质,故D不选;
故选:C。
8.B
【详解】
A.O2与O3都是氧元素组成的不同单质,互为同素异形体,故A不符合题意;
B. 与 是碳元素的两种核素,质子数相同、中子数不同,互为同位素,故B符合题意;
C.H2O与H2O2是氢和氧组成的两种物质,故C不符合题意;
高一化学同步人教版必修二课时跟踪检测:(一) 元素周期表 Word版含答案

课时跟踪检测(一)元素周期表1.下列对现行的元素周期表的说法中正确的是()A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的B.最外层电子数相同的元素都是同一族C.同族元素的最外层电子数一定相同D.同周期元素的电子层数相同解析:选D现行的元素周期表是按照原子的核电荷数(即质子数)递增的顺序排列而成的,18个纵行分成了7个主族、7个副族和1个0族、1个第Ⅷ族。
最外层电子数相同的元素不一定是同一族(如Mg、Mn最外层都是2个电子)。
对副族元素和第Ⅷ族及0族元素来说,同族的最外层电子数可能不相同(如He和Ne不同等)。
2.在元素周期表中,第一、二、三周期中所含元素种数分别为()A.2、8、8B.8、8、18C.2、8、18 D.8、18、18解析:选A在元素周期表中,第一周期只有H、He两种元素;第二周期有Li、Be、B、C、N、O、F、Ne共8种元素;第三周期有Na、Mg、Al、Si、P、S、Cl、Ar共8种元素。
3.下列元素属于第三周期的是()A.H B.NC.Na D.K解析:选C Na位于元素周期表的第三周期。
4.银在周期表中的表示如右图所示,下列叙述不正确的是()A.银的原子序数为47B.银的摩尔质量为107.9C.银为过渡金属元素D.银原子核外有47个电子解析:选B107.9是银元素的相对原子质量,而非摩尔质量,摩尔质量的单位是g·mol -1,B项不正确。
5.在下列元素中,不属于主族元素的是()A.铁B.铍C.砷D.碘解析:选A A项,铁位于元素周期表第四周期、第Ⅷ族,不属于主族元素;B项,铍为ⅡA族元素,为主族元素;C项,砷为第ⅤA族元素,为主族元素;D项,碘为ⅦA族元素,为主族元素。
6.由长周期元素和短周期元素共同构成的族是()①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④解析:选A因为副族和第Ⅷ族均在第四周期及以下,所以只有0族和主族由长周期和短周期共同构成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学必修二复习练习[基础达标1]1.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相等,因此称为“铱星计划”。
已知铱的一种同位素是19177Ir,则其核内的中子数是A.77B.286C.191D.1142.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是A.12 B.14 C.16 D.183. Se是人体必需微量元素,下列关于说法正确的是A.互为同素异形体B.互为同位素C.分别含有44和46个质子D.都含有34个中子4. 下列分子中,电子总数最少的是A. H2SB. O2C. COD. NO5. 某些建筑材料中含有氡(Rn),氡是放射性元素。
222Rn、219Rn、220R n分别来自镭、锕、钍,因而分别称为镭射气、锕射气和钍射气。
下列有关氡的说法,正确的是A. 氡是双原子分子B. 氡气因其化学性质活泼而对人体有害C. 氡气因其具有放射性而对人体有害D. 222Rn、219Rn、220Rn是三种同素异形体6. 几种单核微粒具有相同的核电荷数,则A. 一定是同位素B. 一定是同种原子C. 一定是同种元素D. 一定质量数相等7. 同温同压下,等容积的两个密闭集气瓶中分别充满12C18O和14N2两种气体。
关于这两个容器中气体的说法正确的是A. 质子数相等,质量不等B. 分子数和质量都不相等C. 分子数、质量均相等D. 原子数、中子数和质量数均相等8. 已知元素A的氢化物分子式为H2A,其最高价氧化物含氧60%,则A元素的相对原子质量为A. 16gB. 32gC. 16D. 329. A元素原子的L层比B元素原子的L层少3个电子,B元素的原子核外电子总数比A元素原子的核外电子总数多5个,则A与B可形成的化合物类型为A. ABB. BA2C. AB4D. B3A210. 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是A. x+2B. x+4C. x+8D. x+1811. X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为A.XYB.XY2C.XY3D.X2Y313.下列微粒的结构示意图中,表示氟离子的是14. X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是A. X的原子序数比Y的小B. X原子的最外层电子数比Y的大C. X的原子半径比Y的大D. X元素的最高正价比Y的小15. X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这3种元素组成的化合物的化学式不可能是A. XYZB. X 2YZC. X 2YZ 2D. X 2YZ 316. 美国劳仑斯国家实验室曾在1999年宣布用86Kr 离子轰击208Pb 靶得到118号元素的一种原子,其质量数为293。
其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文。
但是科学家们相信,完成的第七周期包含的元素数目与第六周期相同。
若118号元素将来被确认,则下列预测合理的是A. 它的中子数是118B. 它是第八周期元素C. 它是活泼的金属元素D. 它的最外层电子数是817. 已知碳有三种常见的同位素:12C 、13C 、14C ,氧也有三种同位素:16O 、17O 、18O ,由这六种微粒构成的二氧化碳分子中,其相对分子质量最多有A.18种B.6种C.7种D.12种18. 氯元素的天然同位素有Cl3517和Cl3717。
氯元素的相对原子质量为35.45,则天然氯元素中Cl3517和Cl3717的原子数目之比约为A.3:1B.1:3C.3:2D.4:119.下列各组中的三种微粒,所含质子数与电子数都相等的是A. Na +、 Mg 2+、 Al 3+B. HCl 、H 2S 、 ArC. H 2O 、OH -、 Na +D. NH 4+、 Na +、F -20.某元素R 的核内含有N 个中子,R 的质量数为A ,在其与氢化合时,R 呈-n 价,则WgR 的气态氢化物中所含电子的物质的量为A.mol m N n W A )(-+ B. mol n N n A W)(++C. mol n N A n A W )(+-+D. mol n A N nA W )(--+21.对第n 电子层,若它作为原子的最外层,则容纳的电子数最多与n-1层的相同;当它作为次外层,则容纳的电子数比n+1层上电子数最多能多10个,则第n 层为 A .L 层 B .M 层 C .N 层 D .任意层22.A 、B 、C 均为周期表中的短周期的元素,它们在周期表的位置如下图。
已知B 、C 两元素在周期表中族数之和是A 元素族数的2倍;B 、C 元素的原子序数之和是A 元素的原子序数的4倍,则A 、B 、C 所在的一组是A .Be 、Na 、AlB .B 、Mg 、SiC .O 、P 、ClD .C 、Al 、P 23. 关于主族元素的叙述,不正确的是A. 主族序数等于元素原子的最外层电子数B. 元素的最高正价等于原子最外层电子数C. 最低负价数的绝对值等于原子最外层达稳定结构时所需电子数D. 都既有正化合价,又有负化合价 24.11g 2H 218O 所含的中子的物质的量为A .4.5molB .5molC .5.5molD .6mol 1 2 3 4 5 6 7 8 9 10111213D C B C C C A D D B A B A 14 151617181920 2122 23 24 25 26 D D C A B C BCD D[基础达标2]1. 下列元素的原子半径最大的是A. 氮B. 磷C. 氧D. 硫2.下列单质中,最容易跟氢气发生反应的是A.O2 B.N2 C.F2 D. Cl23. 下列物质中酸性最强的是A. H3PO4B. HNO3C. H2CO3D. H3BO34.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。
下列有关叙述正确的是A.X肯定为碱金属元素B.稳定性:Y的氢化物>Z的氢化物C.X、Y两元素形成的固体化合物一定为离子晶体D.Y、Z两元素形成的化合物熔点较低5. 已知短周期元素的离子,a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是A. 原子半径A >B>C> DB.原子序数A >B>C> DC. 离子半径C>D>B>AD. 单质的还原性A>B>D>C6. 下列元素中化学性质最活泼的是A. 硅B. 磷C. 硫D. 氯7. 下列说法错误的是A. 原子及其离子核外电子层数等于该元素所在的周期数B. 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C. 除氦外的稀有气体原子的最外层电子数都是8D. 同一元素的各种同位素的物理性质、化学性质均相同8. 已知(Be)的原子序数为4。
下列对铍及其化合物的叙述中,正确的是A. 铍的原子半径大于硼的原子半径B. 氯化铍分子中铍原子的最外层电子数是8C. 氢氧化铍的碱性比氢氧化钙的弱D. 单质铍跟冷水反应产物为氢气10. 下列关于原子的几种描述中,不正确的是A. 18O与19F具有相同的中子数B. 16O与17O具有相同的电子数C. 12C与13C具有相同的质量数D. 15N与14N具有相同的质子数11. 关于元素周期律和周期表的下列说法,正确的是A. 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现B. 元素的性质随着原子序数的增加而呈周期性变化C. 俄国化学家道尔顿为元素周期表的建立作出巨大贡献D. 同一主族的元素从上到下,金属性呈周期性变化12.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是A.S B.C C.Si D.Cl13.主族元素R最高正价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是A.HRB.RH3C.H2RD.RH314.同周期X,Y,Z三元素,其最高价氧化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是A. 原子半径:X>Y>ZB. 非金属性:X>Y>ZC. 阴离子的还原性按X,Y,Z的顺序由强到弱D. 气态氢化物的稳定性按X,Y,Z的顺序由弱到强15.下列微粒半径由大到小的排列是A.P3-,S2-,Cl-B.Cl-,S2-,O2-C.Ca,Mg,NaD.K+、Cl-,S2-17. 下列递变规律正确的是A.HClO4、H2SO4、H3PO4的酸性依次增强,B.HCl、HBr 、HI的稳定性依次增强C.钠、镁、铝的还原性依次减弱D.P、S、Cl最高正价依次降低。
18.X元素的阳离子、Y元素的阳离子和Z元素的阴离子都具有相同的电子层结构。
X的阳离子半径大于Y的阳离子半径,则X、Y、Z三元素的原子序数大小顺序正确的是A.X<Y<ZB.Y<Z<XC.Y<X<ZD.Z<X<Y19.A、B两元素位于短周期,A原子半径小于B原子半径,两元素可形成A显正价的AB2型化合物,下列有关A、B两元素的叙述正确的是A. A、B可能为同一周期B. A位于B的下一周期C. A只能是金属元素D. A可能是第二周期中的第ⅡA族或第ⅣA族元素20.A、B为前三周期元素,两者组成A2B3型离子化合物,A离子比B离子少一个电子层,已知B的原子序数是x,则A的原子序数是A.x-3 B.x+3 C.x+11 D.x-1121. 已知元素X,Y的核电荷数分别为a和b,它们的离子X n+的Y n-的核外电子排布完全相同,则下列关系中正确的是A. a + m = b - nB. a + b = m + nC. a – m = b + nD. a + m = b – n22. 下列各组中的三种酸,按酸性由强到弱的顺序排列的是A. H2SiO3、H2CO3、HNO3B. H2SO4、HClO4、HBrO4C. HNO3、H3PO4、H4SiO4D. H2SO4、H3PO4、HClO4[1. 下列物质中,含有非极性键的离子化合物是A. CaCl2B. Ba(OH)2C. H2O2D. Na2O22.下列化合物中,只存在离子键的是A. NaOHB. CO2C. NaClD. HCl3. 下列分子中所有原子都能满足最外层为8电子结构的是A. BF3B. H2OC. SiCl4D. PCl54.X是由两种短周期元素构成的离子化合物,1 mol X含有20 mol电子。
