No2.第3-5章习题及答案
高中化学必修2第5章第2节 氨和铵盐 练习新解析版)

第五章 化工生产中的重要非金属元素第2节 氮及其化合物 第2课时 氨和铵盐1.下列关于氨气的叙述,错误的是( ) A .氨气极易溶解于水B .氨气可以使湿润的蓝色石蕊试纸变红色C .氨气具有还原性D .可以用玻璃棒蘸取浓盐酸检验氨气的存在 【答案】B2.下列方法适合实验室制取氨气的是( ) A .N 2和H 2催化加热制取氨气 B .加热NH 4Cl 制取氨气 C .将浓氨水向碱石灰固体上滴加 D .将NH 4Cl 溶液和NaOH 溶液混合 【答案】C【解析】A 项适合用于工业生产;B 项因为NH 4Cl 分解生成的NH 3、HCl 遇冷又化合为NH 4Cl ,不能制取氨气;D 项由于NH 3极易溶于水,不适合制取NH 3。
3.下列离子方程式书写正确的是( )A .实验室用氯化铵和熟石灰制氨:NH +4+OH -=====△NH 3↑+H 2O B .NaOH 溶液与NH 4Cl 溶液混合加热:NH +4 +OH -=====△NH 3·H 2O C .氨水中加盐酸:NH 3·H 2O +H +===NH +4+H 2OD .氨水中加入氯化铁溶液:Fe 2++2NH 3·H 2O===2NH +4+Fe(OH)2↓ 【答案】C【解析】A 项,该反应属于固体间的加热反应,不能书写相应的离子方程式;B 项,加热条件下NH 3·H 2O 应分解为NH 3和H 2O ,离子方程式应为NH +4+OH -=====△NH 3↑+H 2O ;C 项,符合反应原理及离子方程式书写要求;D 项,向氨水中滴加FeCl 3溶液应生成Fe(OH)3沉淀,离子方程式为Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH +4。
4.下列说法中正确的是( )A .所有铵盐受热均可以分解,产物均有NH 3B .所有铵盐都易溶于水,所有铵盐中的N 均呈-3价C .NH 4Cl 溶液中加入NaOH 浓溶液共热时反应的离子方程式为NH +4+OH -=====△NH 3↑+H 2O D .NH 4Cl 和NaCl 的固体混合物可用升华法分离 【答案】C【解析】A 项,有的铵盐受热分解产生氨气(如NH 4Cl),有的铵盐受热分解不产生氨气(如硝酸铵);D 项,可用加热法分离NH 4Cl 和某些固体(不分解、不升华的固体)的混合物,但其过程为先受热分解,再降温化合,而不是升华。
《好题》初中高中化学必修二第五章《化工生产中的重要非金属元素》复习题(含答案)

一、选择题1.某溶液中可能含有Na +、K +、Mg 2+、Fe 2+、4NH +、Cl -、Br -、23CO -、24SO -、23SO -中的若干种离子。
取该溶液做焰色反应,火焰呈黄色。
某同学设计并完成如图实验:下列有关判断中正确的是A .该溶液焰色反应火焰呈黄色,说明溶液中一定存在Na +,不存在K +B .实验①后溶液呈黄色,说明原溶液中含Fe 2+C .原溶液中一定存在的离子是Na +、Cl -、Br -、23CO -、24SO -D .检测原溶液中是否含有4NH +,可取少量的原溶液,滴加足量的NaOH 浓溶液,加热,用湿润的红色石蕊试纸检验气体2.下列表述Ⅰ、Ⅱ均正确并且有因果关系的是 选项 表述Ⅰ 表述ⅡA SO 2具有漂白性 SO 2能使酸性KMnO 4溶液褪色B SiO 2具有弱氧化性 工业上利用SiO 2与焦炭制备粗硅C NH 3是电解质 NH 3的水溶液可以导电D 浓硫酸具有吸水性 可用来干燥H 2S 气体D .D3.氮的固定是指A .植物从土壤中吸收氨肥B .大豆的根瘤菌将含氮的化合物转变为植物蛋白质C .将空气中的氮气转变为氮的化合物D .硝酸和氨气反应生成氨肥4.反应后下列溶液颜色变化对应的离子方程式不正确的是A .向稀硫酸中加入CuO 固体后,溶液变蓝:22CuO 2H Cu H O +++=+B .向溴水中通入过量的SO 2后,溶液由橙黄色变为无色:222242H O SO Br 2Br SO 4H --+++=++C .向FeCl 3溶液中滴加KSCN 溶液后,溶液由黄色变为红色:33Fe 3SCN Fe(SCN)+-+D .向硫酸锰溶液中滴加K 2S 2O 8溶液后,溶液变为紫红色:22228244Mn S O 4H O MnO 2SO 8H +---+++=++5.工业上制备下列物质的生产流程合理的是( )A .由铝土矿冶炼铝:铝土矿−−−→提纯Al 2O 3HCl −−→AlCl 3−−−→电解AlB .从海水中提取镁:海水−−−→石灰乳Mg(OH)2−−−→加热MgO −−−→电解MgC .由NaCl 制漂白粉:饱和食盐水−−−→电解Cl 2NaOH −−−−→溶液漂白粉D .由石英砂制纯硅:石英砂−−−→焦炭高温粗硅HCl −−−→加热SiHCl 32H −−−→高温纯硅6.氮化铝(AlN) 是一种新型无机材料。
人教版初中高中化学必修二第五章《化工生产中的重要非金属元素》复习题(含答案解析)(3)

一、选择题1.如图是氮氧化物(NO x )储存还原的工作原理:NO x 的储存过程与还原过程在不同时刻是交替进行的。
下列有关说法不正确的是A .“还原”过程中,Ba(NO 3)2转化为BaOB .在储存还原过程中,Pt 作催化剂C .在储存还原过程中,参加反应的NO 和O 2的物质的量之比为2∶1D .若还原性气体为H 2,则参加反应的H 2与生成的N 2的物质的量之比是5∶12.反应后下列溶液颜色变化对应的离子方程式不正确的是A .向稀硫酸中加入CuO 固体后,溶液变蓝:22CuO 2H Cu H O +++=+B .向溴水中通入过量的SO 2后,溶液由橙黄色变为无色:222242H O SO Br 2Br SO 4H --+++=++C .向FeCl 3溶液中滴加KSCN 溶液后,溶液由黄色变为红色:33Fe 3SCN Fe(SCN)+-+D .向硫酸锰溶液中滴加K 2S 2O 8溶液后,溶液变为紫红色:22228244Mn S O 4H O MnO 2SO 8H +---+++=++3.将3.84g 铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO 、NO 2混合气体2.24L(标准状况下),则所消耗酸的物质的量是A .0.1molB .0.11molC .0.16molD .0.22mol 4.下列离子方程式书写正确的是 A .NaHCO 3溶液中加入稀盐酸:CO 23-+2H +=CO 2↑+H 2OB .SO 2通入少量NaClO 溶液中:SO 2+ClO -+H 2O=SO 24-+Cl -+2H +C .FeO 与稀硝酸反应:2H ++FeO=Fe 2++H 2OD .碳酸氢钠溶液中滴入氢氧化钙溶液:HCO 3-+OH -=CO 23-+H 2O5.用下列装置进行相应实验,能达到实验目的的是 A B C D验证浓H 2SO 4的脱水性、强氧化性 制备少量O 2,其优点是能随时控制反应的发生和停止 证明非金属性强弱:N >C >Si 配制100 mL 一定物质的量浓度的硫酸溶液A .AB .BC .CD .D6.A 、B 、C 、D 四种物质之间的转化关系如图所示(部分产物已略去)下列说法正确的是A .若A 为AlCl 3溶液,B 可能为氨水,反应①的离子方程式为:Al 3++4NH 3·H 2O=-2AlO +4+4NH +2H 2OB .若A 为NaAlO 2溶液,B 稀盐酸,则D 为AlCl 3溶液C .若A 为Fe ,B 可能为稀硝酸,反应②的离子方程式为:3Fe+8H ++2-3NO =3Fe 2++2NO↑+4H 2OD .若A 为Cl 2,B 可能为NH 3,实验室可用加热固体C 的方法制取NH 37.下列各组物质,不满足组内任意两种物质在一定条件下均能发生反应的是( )甲 乙 丙 A ()()32Fe NO aq ()32NH H O aq ⋅()3HNO aq B NaOH(aq) ()3NaHCO aq()24H SO aq C ()2SiO sC(s) ()2H O g D ()2Cl g ()3FeBr aqNaI(aq)A.A B.B C.C D.D8.1.76 g铜镁合金完全溶解于 40 mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1344 mL (标准状况),向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到3.12 g沉淀。
有机化学(第二版)课后答案

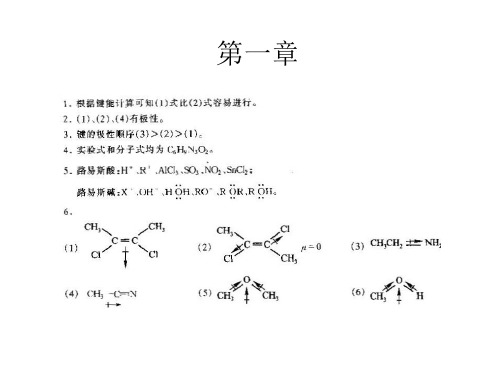
有机化学(第二版)课后习题参考答案第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
)键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol 气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
、(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学(第二版)答案__赵建庄
另一组答案为: A.
B. H3C CH2 CH2 CH2Br
C. H3C CH 2 CH CH2
10.
氧化后得到的
对称二酮为:
11.
反应式如下:
12. 透视式
纽曼式
第五章 卤代烃习题参考答案
1. (1) 2-甲基-4-氯戊烷 (3) 4-溴-1-环己烯 (5) 2-氯-4-溴甲苯
(2) 2-氯-2-己烯-4-炔 (4) 苄溴(溴化苄,苯溴甲烷) (6) 3,6-二氯-2-甲萘
H+ -H2O
H3C C CH CH 2 CH3 CH3
+ (1) O3
(2) Zn, H2O H3C CH 2 CHO
O H3C C CH3
丙醛可发生银镜反应,丙酮可发生碘仿反应。
第十章 羧酸、羧酸衍生物和取代酸 参考答案
1. (1) 3-甲基丁酸
(2) 3-乙基-3-丁烯酸
(3) 2,3-环氧丁酸
(4) 1,3-(间)苯二甲酸
(5) 2,4-二氯苯氧乙酸
(6) 反-1,2-环丙二甲酸
(7) 4-甲基-2,4-戊二烯酸
(8) 2-甲基丁酸
(9) 3-(间)甲基苯甲酰溴 (10) 乙酸对甲基苯酯
(11) N-甲基-N-乙基甲酰胺 (12) 乙丙酐
(13) 二乙酸乙二酯
(14) γ –丁内酯
(15) 2-甲基-3-丁酮酸
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
《谱学导论》各章习题+参考答案

第一章 习 题1.127I 35Cl 的转动常数是0.1142 cm -1,计算ICl 的键长。
2. 12C 16O 2的转动常数是0.39021 cm -1。
计算分子的键长。
3. 已知14N 16O 的键长是115 pm 。
计算该分子23←=J 跃迁的纯转动光谱的频率。
4. 计算12C 16O 分子12←=J 纯转动跃迁的频率。
已知分子的键长是112.81 pm 。
5. 已知35Cl 19F 转动常数是1.033 cm -1,计算分子的转动惯量和键长。
6. 下列那些分子有纯转动光谱?H 2、HCl 、CH 4、CH 3Cl 。
7. 下列那些分子有红外吸收光谱?O 2、CCl 3-CCl 3、HF 、CO 2。
8.35Cl 2的振动基频是564.9 cm -1,计算分子化学键的力常数。
9. 79Br 81Br 振动基频是323.2 cm -1。
计算分子化学键的力常数。
10. 拉曼光谱的入射频率是20487 cm -1,计算O 2分子02←=J 的Stokes 线的波数。
11. 拉曼光谱的入射频率是20623 cm -1,计算N 2分子24←=J 的Stokes 线的波数。
12. 实验测定得到H 2和D 2在入射波长为488.0 nm 的激光照射下的大拉曼位移分别是612.1 nm 和571.4 nm 。
计算他们的力常数并说明力常数变化不大的原因。
13. 对下列点群,写出给定直积表示的特征标,并约化成不可约表示的直和:(1) C 2h 点群:g u B A ⊗(2) C 4v 点群:E B A ⊗⊗2214. 求积分⎰ΓΓτψψd F j i ˆ不等于零时,F ˆ应该属于那些不可约表示? (1)D 3点群:2A i =Γ,E j =Γ (2) C 2v 点群:2A i =Γ,2B j =Γ15. 画出乙炔分子所有可能的简正振动方式,并指出哪些是有红外活性的,哪些没有?16. 写出下列分子的基态和第一激发态的电子谱项,并根据选律判断,哪些跃迁是允许的,哪些是禁阻的?(1)H 2;(2)LiH ;(3)N 217. HCl 分子的光谱学解离能e D =5.33eV ,7.2989~=νcm -1,νχ~e=52.05 cm -1。
成都西北中学高中化学必修二第五章《化工生产中的重要非金属元素》经典习题(答案解析)

一、选择题1.可用于检验SO 24的试剂是A .稀硝酸B .NaOHC .BaCl 2D .KNO 32.下列实验方案设计正确是A .用乙醇萃取碘水中的碘单质B .用焰色反应(焰色试验)鉴别NaCl 和 Na 2SO 4C .用溶解、过滤的方法分离 KCl 和 MnO 2固体D .用NaOH 溶液和红色石蕊试纸检验溶液中是否存在NH +43.某企业利用下列流程综合处理工厂排放的含有二氧化硫的烟气,以减少其对环境造成的污染。
下列有关说法正确的是A .二氧化硫吸收塔中发生的反应为SO 2+2-3SO +H 2O=2-3HSOB .氨气吸收塔中发生的反应为-3HSO +OH -=H 2O+2-3SOC .上述流程利用的是氧化还原反应原理D .上述流程中二氧化硫可循环利用4.下列关于N 、S 的化合物的性质解释错误的是A .HNO 3需避光保存,是因为HNO 3见光易分解B .SO 2能使品红溶液褪色,是因为SO 2有漂白性C .NH 4HCO 3化肥需密封储存,是因为NH 4HCO 3分解D .浓硫酸可用作气体干燥剂,是因为浓硫酸具有脱水性5.下列有关实验描述正确的是A .在某溶液中加入稀盐酸,产生无色无味的气体,该气体能使澄清石灰水变混浊,证明其中含有CO 2-3B .要证明某烧碱溶液中可能含有Cl -,应先加稀盐酸酸化,再滴加AgNO 3溶液,若有白色沉淀生成,证明其中含有Cl -C .焰色反应时,观察到火焰呈黄色,可以推测肯定含钠元素,可能含钾元素D .在某溶液中加入BaCl 2溶液,产生白色沉淀,加盐酸,沉淀不溶解,证明其中含有SO 2-46.下列物质不需要密封保存的是A .氢氧化钠B .氯化钠C .浓盐酸D .浓硫酸7.用下列装置进行相应实验,能达到实验目的的是( )“随开随用、随关随停”制CO 2快速制备氨气 干燥HCl 气体 验证SO 2漂白性 A B C D A .A B .B C .C D .D8.将2 g 由Mg 、Cu 组成的混合物投入到一定量的稀HNO 3溶液中,当混合物完全溶解时收集到的0.448 L(标准状况)NO 气体,向反应后的溶液中加入2 mol/L NaOH 溶液60 mL 时金属离子恰好沉淀完全,则形成沉淀的质量为A .4.28gB .4.04 gC .3.02 gD .5.34 g 9.有一无色溶液,可能含有K +、Al 3+、Mg 2+、NH 4+、Cl -、SO 24-、HCO 3-、MnO 4-中的几种。
有机化合物波谱解析-有机波谱分析-课后习题答案-xu

第二章 质谱习题及答案1、化合物A 、B 质谱图中高质荷比区的质谱数据,推导其可能的分子式解:分子离子峰为偶数62=•+M表明不含氮或含有偶数个氮。
对于A ,1:3)(:)2(≈+M RI M RI ,所以分子中含有一个Cl 原子,不可能含氮。
则根据8.41.1100)()1(==⨯+x M RI M RI ,得3,2==y x ,所以A 分子式C 2H 3Cl ,UN=1合理;对于B ,4.4)2(=+M RI ,所以分子中可能含有一个S 原子,不可能含氮。
则根据8.38.01.1100)()1(=+=⨯+z x M RI M RI ,6,2==y x ,所以B 分子式C 2H 6S ,UN=0合理。
2、化合物的部分质谱数据及质谱图如下,推导其结构解:1:6:9)4(:)2(:)(≈++M RI M RI M RI ,所以分子中含有两个Cl ,m/z=96为分子离子峰,不含氮。
根据4.21.1100)()1(==⨯+x M RI M RI ,2,2==y x ,分子式为C 2H 2Cl 2,UN=1,合理。
图中可见:m/z 61(M-35),RI(100)为基峰,是分子离子丢失一个Cl 得到的; m/z=36, 为HCl +;m/z=26(M-Cl 2), RI(34),是分子离子丢失Cl 2得到的,相对强度大,稳定,说明结构为CHCl=CHCl 。
解:分子离子峰m/z 185为奇数表明含有奇数个氮。
基峰m/z 142=M 43,丢失的碎片可能为(C 3H 7,CH 3CO ),若丢失碎片为(CH 3CO),则来源于丁酰基或甲基酮,结合分子中含氮元素,很有可能为酰胺类物质,那么就应该有很强的分子离子峰,而m/z 185峰较弱,所以,丢失的中性碎片应该是(C 3H 7),来源于长链烷基,谱图中有而则m/z 29,43,57的烷基m/z 142=A 的组成, C x H y N z O w S S3.1037.01.1100)()1(=+=⨯+z x A RI A RI ,设z=1,则x=,若z=3,则x=,不合理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《数据库系统概论》第三~五章习题答案
一、选择题
1、下列的SQL语句中,()不是数据定义语句。
A)CR EA TE TA BL E B)DROP V IE W C)CR EA TE VI EW D)GRA NT
答案:D
2、下列聚集函数中不忽略空值(null)的是()。
A)S UM(列名)B)MA X(列名)C)CO UN T(*)D)A VG(列名
答案:C
3、下述SQL命令中,允许用户定义新关系时,引用其他关系的主码作为外码的是()。
A)IN SERT B)DE LE TE C)RE FE REN CE S D)SE LE CT
答案:C
4、下述SQL命令的短语中,不是定义属性上约束条件的是()。
A)N OT N UL L短语B)UNI QU E短语C)CH EC K短语D)HA VI NG短语
答案:D
5、若用如下的SQL 语句创建了一个表SC:CREATE TABLE SC (S# CHAR(6)NOT NULL,
C# CHAR(3)NOT NULL,SCORE INTEGER,NOTE CHAR(20));向SC 表插入如下行时,()行可以被插入。
A) (’201009’,’111’,60,必修)B) (’200823’,’101’,NULL,NULL)
C) (NULL,’103’,80,’选修’)D) (’201132’,NULL,86,’ ’)
答案:B
6、假设学生关系S(S#,SNAME,SEX),课程关系C(C#,CNAME),学生选课关系SC(S#,C#,GRADE)。
要查询选修“Computer”课的男生姓名,将涉及到关系()。
A)S B)S,SC C)C,SC D)S,C,SC
答案:D
7、当关系R 和S 自然联接时,能够把R 和S 原该舍弃的元组放到结果关系中的操作是( )
A)左外联接B)右外联接C)外部并D)外联接
答案:D
8、保护数据库,防止未经授权的或不合法的使用造成的数据泄漏、更改破坏。
这是指数据的()。
A)安全性B)完整性C)并发控制D)恢复
答案:A
9、数据库的()是指数据的正确性和相容性。
A)安全性B)完整性C)并发控制D)恢复
答案:B
10、在数据库的安全性控制中,为了保证用户只能存取他有权存取的数据。
在授权的定义中,数据对象的(),授权子系统就越灵活。
A)范围越小B)范围越大C)约束越细致D)范围越适中
答案:A
二、填空题
1、SQL语言具有两种使用方式,分别是交互式和()。
B # 答案:嵌入式
2-3 在SQL 语言的结构中,( )有对应的物理存储,而( )没有对应的物理存储。
答案:基本表 视图
4-5-6-7-8、下列 SQL 语句中,实现数据检索的语句是( ),修改表结构的是( ),修改属性 值的是( ),删除表结构的是( ),删除表记录的是( )。
答案:SELECT ,ALTER ,UP DATE ,DROP ,DELETE
9-10、当前大型的DBMS 一般都支持( )存取控制 ,有些DBMS 同时还支持( )存取控制。
答案:自主存取控制(DAC ) 强制存取控制(MAC )
三、用 SQL 语句描述查询
1、设有如下三个关系:
A(A#,ANAME,WQTY ,CITY) : A#:商店代号;ANAME :商店名;WQTY:店员人数 B(B#,BNAME,PRICE) :B#:商品号;BNAME :商品名称;
AB(A#,B#,QTY) :QTY :商品数量 试分别用关系代
数表达式和 SQL 语言写出下列查询。
1) 找出店员人数不超过 100 人或者在长沙市的所有商店的代号和商店名;
2) 找出供应书包的商店名;
3) 找出至少供应代号为 256 的商店所供应的全部商品的商店名和所在城市。
解:
1)
A #, ANAME (⎛ WQTY <=100 ( CITY ='长沙' ( A )) SELECT A#,ANAME FROM A WHERE WQTY<=100 OR CITY=’长沙’; 2)
ANAME ((⎛ BNAME = '书包' (B )) AB A )
SELECT ANAME FROM A,B,AB
WHERE BNAME=’书包’ AND B.B#=AB.B# AND AB.A#=A.A#;
3)
( ANAME ,CITY A #,B # AB ⎪ (⎛ A #= '256 '
( AB )) A ) SELECT ANAME,CITY FROM A WHERE NOT EXISTS
(SELECT * FROM AB AB1 WHERE AB1.A#=’256’ AND NOT EXISTS
(SELECT * FROM AB AB2 WHERE AB2.A#=A.A# AND AB2.B#=AB1.B#));
2. 设有如下关系模式:∨
student(NO, NAME , SEX ,BIRTHDAY , CLASS) 其中属性依次为学号,姓名,性别,出 生日期,班级;
teacher(NO,NAME,SEX,BIRTHDAY ,PROF,DEPART) 其中属性依次为教师号,姓名,性 别,出生日期,职称,系别;
course(CNO, CNAME, TNO) 其中属性依次为课程号,课程名,教师号;
score(NO, CNO, DEGREE) 其中属性依次为学号,课程号,成绩; 写出实
现以下各题查询功能的 SQL 语句:
(1) 查询至少有 2 名男生的班号;
(2) 查询不姓“王”的同学记录;
(3) 查询每个学生的姓名和年龄;
(4)查询学生中最大和最小的birthday 日期值;
(5)查询学生表的全部记录并按班号和年龄从大到小的顺序;
(6)查询男教师及其所上的课程;
(7)查询和“李军”同性别并同班的所有同学的姓名;
(8)查询“计算机系”教师所教课程的成绩表;
(9)查询成绩在60 到80 之间的所有记录;
(10)查询成绩比该课程平均成绩低的同学的成绩表;
解:(1)SELECT CLASS FROM student WHERE SEX=‘男’
GROUP BY CLASS HA VING COUNT(*)>=2;
(2)SELECT * FROM student WHERE NAME NOT LIKE ‘王*’;
(3)SELECT NAME,year(date())-year(BIRTHDAY ) FROM student;
(4)SELECT MAX(BIRTHDAY), MIN(BIRTHDAY) FROM student ;
(5)SELECT * FROM student ORDER BY CLASS,BIRTHDAY ;
(6)SELECT , ame FROM teacher x, course y WHERE x.no=y.tno and x.sex=’男’;
(7)SELECT name FROM student WHERE sex=(SELECT sex FROM student WHERE nam e=’李军’ ) and class=(SELECT class FROM student WHERE name=’李军’);
(8)SELECT * FROM score s, teacher t, course c WHERE t.depart=’计算机系’ and t.no=c.tno and o=o;
(9)SELECT * FROM score WHERE degree BETWEEN 60 AND 80;
(10)SELECT * FROM score a WHERE degree < (SELECT avg(degree) FROM score b WHERE o=o );
3、设有学生表S(SNO, SN)(SNO 为学生号,S N 为姓名)和学生选修课程表SC(SNO,CNO,CN,G) (CNO 为课程号,CN 为课程名,G 为成绩),试用SQL 语言完成以下各题:
a) 建立一个视图V-SSC(SNO, SN, CNO, CN, G);
b) 从视图V-SSC 上查询平均成绩在90 分以上的SN, CN 和G。
解:
1)CREATE VIEW V-SSC(SNO , SN, CNO, CN, G) AS
SELECT S.SNO, SN, CNO, CN, G FROM S, SC WHERE S.SNO=SC.SNO;
2)SELECT SN, CN, G FROM V-SSC GROUP BY SNO HA VING AVG(G)>90;。
