《第一单元 原子核外电子排布与元素周期律》
苏教化学必修2专题1第一单元 原子核外电子排布和元素周期律(共17张PPT)

• 结论1:随着元素核电荷数的递增,原子最 外层电子的排布呈周期性变化(1-2号元素 :最外层电子数由1到2递变;3-10号、11 到18号元素,则重复着从1到8的周期性变 化。)
• 结论2:随着核电荷数的递增,元素原子半 径呈现由大到小的周期性变化(稀有气体 元素除外)。
元素的金属性、非金属性是否也呈现周期性变化?
判断依据是什么呢?
金属性: 元素原子失电子的能力(还原能力) 非金属性: 元素原子得电子的能力(氧化能力)
注意:
金属性(非金属性)的强弱只与原子失(得)电子的能 力有关,与失(得)电子的多少无关。
探究活动一:金属置换出氢气的难易
核电荷数 元素符号 与冷水反应
稳定性
14Si 15P
SiH4 PH3
高温下少量反应 磷蒸气,反应
很不稳定 不稳定
16S
17Cl
H2S 加热能反应 HCl 光照或点燃化合
较不稳定 稳定
非金属性:Si < P < S < Cl
探究活动三:
核电荷数 11
12
13 14 15 16 17
元素符号 Na Mg
Al
Si
P
Hale Waihona Puke S Cl最高价氧 化物
引起了
最外层电子数 1→8
核外电子排布呈周期性变化
(K层电子数 1→2)
原子的半径呈周期性变化 原子半径 大→小
决定了
(稀有气体元素除外)
金属性、非金属性
元素性质呈周期性变化
最高价、最低价
归纳出
元素周期律
元素的性质随元素核电荷数的 递增而呈现周期性变化的规律
作业:完成校本作业(1)
第一单元 核外电子排布与周期律

深入探讨
原子半径受哪些因素制约? 原子半径受哪些因素制约?为什么随原子序数 的递增,原子半径出现从大到小的周期性变化? 的递增,原子半径出现从大到小的周期性变化?
①电子层数:电子层数越多,原子半径越大 电子层数:电子层数越多, 影响原 子半径 大小的 因素 ②核电荷数: 核电荷数: 核电荷数增多, 核电荷数增多,使原子半径有减小的趋向
分析元素主要化合价的变化情况?
18号元素 1~18号元素主要化合价
原子序数 1 2 3 4 元素名称 氢 氦 锂 铍 主 要 +1 0 +1 +2 化合价 原子序数 10 11 12 13
5 硼 +3 6 碳 +4 7 氮 +5 8 9 氧 氟
-4 -3 -2 -1 14 15 16 17 18
元素名称 氖 钠 镁 铝 硅 磷 硫 氯 氩 主 要 0 +1 +2 +3 +4 +5 +6 +7 0 化合价 -4 -3 -2 -1
③核外电子数: 核外电子数: 电子数增多,增加了相互排斥, 电子数增多,增加了相互排斥,使原子 半径有增大的倾向。 半径有增大的倾向。
二、随原子序数的递增,原子半径呈现周期性的 随原子序数的递增,原子半径呈现周期性的 周期性 变化(除稀有气体外) 变化(除稀有气体外) 1、从左到右,原子半径由大到小 、从左到右, 2、自上而下,原子半径由小到大 、自上而下, 3、同种元素的微粒半径比较 、 原子半径>阳离子半径 原子半径 阳离子半径 低价阳离子半径>高价阳离子半径 低价阳离子半径 高价阳离子半径 原子半径<阴离子半径 原子半径 阴离子半径 4、具有相同电子层结构的离子,原子序数 、具有相同电子层结构的离子, 相同电子层结构的离子 越大,离子半径越小 越大,离子半径越小
知识点 原子核外电子排布与元素周期律

原子核外电子排布与元素周期律一、原子结构(Z 个)原子核注意:(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X 原子序数= = =核外电子(Z 个)2.原子核外电子的排布规律:①电子总是尽先排布在能量 的电子层里;②各电子层最多容纳的电子数是 ;③最外层电子数不超过 个(K 层为最外层不超过 个),次外层不超过 个,倒数第三层电子数不超过 个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: 3.元素、核素、同位素元素: 。
核素: 。
同位素: 。
(对于原子来说) 二、元素周期表 1.编排原则:①按 递增的顺序从左到右排列 ②将 相同..的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把 相同..的元素按电子层数递增的顺序从上到下排成一纵行..。
=原子最外层电子数 2.结构特点:核外电子层数 元素种类第一周期 种元素短周期 第二周期 种元素周期 第三周期 种元素元 (7个横行) 第四周期 种元素 素 (7个周期) 第五周期 种元素 周 长周期 第六周期 种元素 期 第七周期 未填满(已有 种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族: 纵行,位于 之间 (16个族) 零族: ① 主族(A ):由 和 元素共同组成的族(除第18纵列)列序与主族序数的关系② 副族(B ):完全由 元素组成的族(第8、9、10纵列除外)③ Ⅷ族:包括 三个纵列。
④ 0族:第 纵列,该族元素又称为 元素。
三、元素周期律1.元素周期律: 。
元素性质的周期性变化实质是... 。
族碱金属元素: ( 是金属性最强的元素,位于周期表 ) 第ⅦA 族卤族元素: ( 是非金属性最强的元素,位于周期表 ) ★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——① ;② ;③ 。
(2)非金属性强(弱)——① ;② ;③ 。
第一单元原子核外电子排布与元素周期律
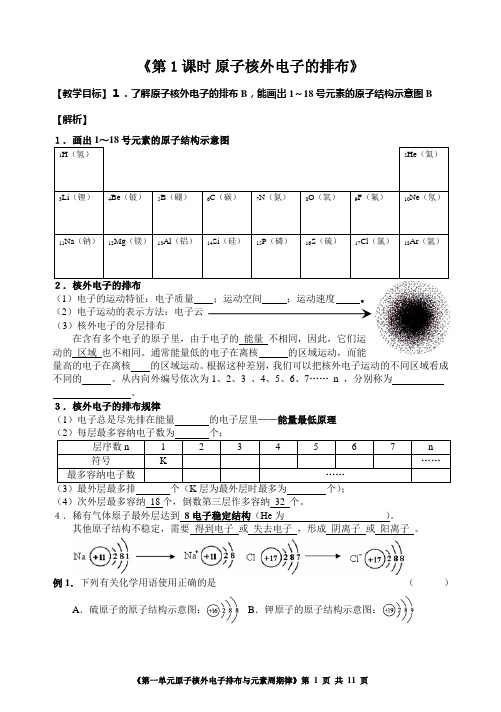
《第1课时原子核外电子的排布》【教学目标】1.了解原子核外电子的排布B,能画出1~18号元素的原子结构示意图B 【解析】(1)电子的运动特征:电子质量;运动空间;运动速度。
(2)电子运动的表示方法:电子云(3)核外电子的分层排布在含有多个电子的原子里,由于电子的能量不相同,因此,它们运动的区域也不相同。
通常能量低的电子在离核的区域运动,而能量高的电子在离核的区域运动。
根据这种差别,我们可以把核外电子运动的不同区域看成不同的。
从内向外编号依次为1、2、3 、4、5、6、7……n ,分别称为。
3.核外电子的排布规律(1)电子总是尽先排在能量的电子层里——能量最低原理)最外层最多排个(层为最外层时最多为个)(4)次外层最多容纳18个,倒数第三层作多容纳32 个。
4.稀有气体原子最外层达到8电子稳定结构(He为)。
其他原子结构不稳定,需要得到电子或失去电子,形成阴离子或阳离子。
例1.下列有关化学用语使用正确的是()A.硫原子的原子结构示意图:B.钾原子的原子结构示意图:C.氯离子的离子结构示意图:D.原子核内有10个中子的氧原子:《第1课时 原子核外电子的排布》练习1.下列有关Si 4214的说法不正确的是()A .Si 4214原子核内含有14个质子B .Si 4214的原子序数为14C .Si 4214的核外电子数为14D .Si 4214原子核内含有42个中子2.某微粒的核外电子的数目分别为:K 层2个,L 层8个,M 层8个,该微粒是( )A .氩原子B .钾离子C .氯离子D .无法确定3.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )A .SB .C C .SiD .Cl 4.下列表示式书写正确的是 ( )A .Cl -的结构示意图B .铝原子的结构示意图C .S 2-的结构示意图D .镁原子的结构示意图5.与Ne 的核外电子排布相同的离子是 ( )A .ClB .Na +C .K +D .S 2-6.某元素的原子最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为( )A .3B .7C .8 .D .107.元素A 的原子获得2个电子或元素B 的原子失去3个电子后,它们的电子排布均与氖原 子的电子排布相同。
苏教版必修2化学《第一单元原子核外电子排布与元素周期律》说课稿

苏教版必修2化学《第一单元原子核外电子排布与元素周期律》说课稿一、前言本说课稿以苏教版必修2化学教材中的第一单元《原子核外电子排布与元素周期律》为主题,针对该单元的教学内容进行详细描述和阐述。
本单元是高中化学课程的基础内容,对于学生理解化学原理、掌握元素周期表的结构和规律具有重要意义。
二、教学目标本单元的教学目标主要包括以下几个方面: 1. 理解原子核外电子的排布规律,包括主、次能级的构成和电子的填充顺序; 2. 掌握元素周期表的结构和元素周期律的基本概念; 3. 学会利用元素周期表中的信息预测元素的性质和电子排布; 4. 进一步加深对原子核结构和电子排布的理解,为后续的化学学习打下坚实基础。
三、教学重点本单元的教学重点主要包括以下几个方面: 1. 原子核外电子的排布规律,包括壳层、亚层和轨道的概念; 2. 元素周期表的结构,包括周期、周期表和主、副族的划分; 3. 元素周期律的基本规律,包括周期性和规律性的定义等。
四、教学内容1. 原子核外电子的排布规律1.1 壳层、亚层和轨道 - 壳层是指原子中电子分布的能级,用 n 表示,第一层为 K 壳,第二层为 L 壳,以此类推; - 亚层是在壳层内划分的,用 l 表示,分别为 s、p、d、f 等;- 轨道是在亚层内进一步划分的,用 m 表示,分别为轨道 s、p、d、f 内的不同取向。
1.2 电子的填充顺序 - 电子按照一定的规律填充在不同的壳层、亚层和轨道中; - 先填充低能级的壳层,再填充高能级的壳层; - 每个轨道能容纳的电子数目不同,s 轨道最多容纳 2 个电子,p 轨道最多容纳 6 个电子,d 轨道最多容纳10 个电子,f 轨道最多容纳 14 个电子。
2. 元素周期表的结构2.1 周期 - 周期是指元素周期表中横向排列的行,共有 7 个周期; - 每个周期表示了一个新的壳层开始填充电子。
2.2 周期表 - 周期表是按照元素的原子序数和壳层构造的表格; - 元素按照原子序数递增的顺序排列在周期表中。
苏教化学必修2专题1第一单元 原子核外电子排布和元素周期律(共28张PPT)
稀有气体元素原子电子层排布:
核元元
各电子层的电子数
电素素
荷名符 K 数称号
L
M
N
O
P
最外层 电子数
2 氦 He 2
2
10 氖 Ne 2 8
8
18 氩 Ar 2 8 8
8
36 氪 Kr 2 8 18 8
8
54 氙 Xe 2 8 18 18 8
8
86 氡 Rn 2 8 18 32 18 8
18 氩 Ar 2 8 8
8
36 氪 Kr 2 8 18 8
8
54 氙 Xe 2 8 18 18 8
8
86 氡 Rn 2 8 18 32 18 8
8
思考2: 每个电子层中容纳的电子数量有何规律?填充各层有先后顺序吗?
3.原子核外电子分层排布的一般规律:
a、能量最低原理(K、L、M、N、O、P、Q) b、每层最多容纳电子数2n2(n表示电子层数) c、最外层电子数目不超过8个(第一层不超过2个) d、次外层电子数目不超过18个 e、倒数第三层电子数目不超过32个
C.16
D.17
课堂练习:
3.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2: ___硅_____
(2)B元素原子的最外层电子数是次外层电子数的 1.5倍:__硼_ __
(3)C元素的次外层电子数是最外层电子数的1/4: ___氖_________.
课堂练习:
5.在1~18号元素中,最外层电子数等于电子
层数的元素有( C )
A.1种
B.2种
C.3种
原子核外电子排布和元素周期律完整版课件

2.电子层
(1)概念:在含有多个电子的原子里, 电子运动 的___能__量__不__同____的区域简化为__不__连__续____的壳 层,称作电子层。(也称作洋葱式结构,如图所 示)
(2)不同电子层的表示及能量关系
各电 子层 (由 内到 外)
序号(n) 1 2 3 4 5 6 7
符号 __K__ __L_ _M__ _N__ O P Q
(2)当最外层为8个电子(氦为2个电子)时,原子处 于稳定结构,化学性质稳定。
例2 (2011年高考天津卷改编题)以下有关原子 结构及元素周期律的叙述正确的是( ) A.第ⅠA族元素铯的两种同位素137Cs比133Cs多 4个质子 B.同周期元素(除0族元素外)从左到右,原子半 径逐渐减小
C.第ⅦA族元素从上到下,其氢化物的稳定性 逐渐增强
与原子核 的距离
__由__近__到__远___
能量
____由__低__到__高____
3.电子分层排布 电子总是尽可能先从__内__层____排起,当一层充 满后再填充下一层。
思考感悟
1.思考并讨论在前20号元素中有哪些离子的核 外电子排布分别与稀有气体He、Ne、Ar的核外 电子排布相同?
【提示】 (1)与He原子电子层结构相同的离子 有:Li+、Be2+、H-。 (2)与Ne原子电子层结构相同的离子有: F-、O2-、N3-、Na+、Mg2+、Al3+。
D.同主族元素从上到下,金属性逐渐减弱
【解析】 A项,137Cs比133Cs多4个中子,两者 质子数相等。C项,氢化物的稳定性随元素非金 属性的增强而增强。D项,同主族元素从上到下, 金属性逐渐增强。
【答案】 B
变式训练2 (2010年高考广东卷)短周期金属元 素甲~戊在元素周期表中的相对位置如表所示,
(完整word版)第一单元原子核外电子排布与元素周期律基础知识

第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核中子(N个)1、原子z A X核外电子(Z个)注意:质量数(A)=质子数(Z)+中子数(N)核电荷数=质子数=原子的核外电子★熟背前20号元素,熟悉1~20号元素原子中具有特俗的电子层结构:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca例如:最外层电子数是次外层电子数2倍的是,3倍的是;2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号:K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)记住几种重要的核素的用途:235U(核燃料);14C(考古断代);2H、3H(制造氢弹)4、10e—-微粒:二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数 2.结构特点:核外电子层数 元素种类第一周期 1 2种元素短周期 第二周期 2 8种元素周期 第三周期 3 8种元素元 (7个横行) 第四周期 4 18种元素 素 (7个周期) 长周期 第五周期 5 18种元素 周 第六周期 6 32种元素期 不完全周期: 第七周期 7 未填满(已有26种元素) 表 主族:ⅠA~ⅦA 共7个主族族 副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族 (18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间 (16个族) 零族:稀有气体3、记住112号以后的元素在周期表中的位置:4、记住同周期的IIA 和IIIA 元素的原子序数之差可能是:1 、11、255、记住周期表中族的分布情况和所有主族元素的元素符号和名称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题1 第一单元原子核外电子排布与元素周期律
姓名:班级:
§1-1-1原子核外电子的排布
1、原子核外电子排布规律
(1)原子核外电子数= = = 。
(2)核外电子分层排布,电子层是根据电子在核外运动的不同来划分的。
电子离核越能量越。
电子共分层,分别为。
(3)原子核外电子排布规律:电子尽先排布在能量离核的电子层里,再依次排布在能量离核的电子层里;K层最多容纳个电子,L层最多容纳个电子,M层最多容纳个电子,n层最多容纳个电子;最外层不超过个电子(K层不超过个),次外层不超过个电子(K层不超过个,L层不超过个)。
§1-1-2元素周期律
1、元素周期律
(1)定义:元素的性质随着而呈性变化的规律叫做元素周期律。
(2)内容:随着原子核电荷数的递增,原子呈周期性变化,原子的呈周期性变化,元素的呈周期性变化,元素的性和
性呈周期性变化。
(3)实质:元素周期律是随着
发生周期性变化的结果。
2、微粒半径比较
(1)主族元素原子,每个主族由上至下,原子半径,每个周期从左到右,原子半径。
如:r Na r Mg;r P r Cl;r N r P。
(2)简单离子半径比较:电子层数越多,微粒半径越;电子层数相同时,核电荷数越大,半径越;电子层数和核电荷数均相同,某元素的阴离子半径该元素的原子。
如:Mg2+Ca2+;F-Cl-;Na+F-;Ca2+S2-;Al3+Mg2+;S2-Cl-;
K+Ca2+;Na Na+;S S2-。
3、化合价
最高正价= ;
∣负价∣= 。
4、金属性和非金属性
金属性越强:金属单质的越,相应阳离子的越;
金属单质与酸或水反应置换出H2的能力越;
金属最高价氧化物的水化物(即)的性越。
非金属性越强:非金属单质的越,相应阴离子的越;
非金属单质与H2化合时越,生成氢化物稳定性越;
非金属最高价氧化物的水化物(即)的性越。
§1-1-3元素周期表及其应用
1、现代元素周期表是在俄国化学家的周期表的基础上派出来的。
2、元素周期表的结构
(1)周期序数= ;
元素周期表共个周期,分别有种元素;
元素周期表的周期分为、和三种;
每个周期的最后一种元素为稀有气体元素,它们的原子序数依次是
,如果第7周期也完全排满,最后一种元素的原子序数为。
镧系位于元素周期表第周期第族,包含种元素;锕系位于元素周期表第周期第族,包含种元素。
(2)主族序数= ;
元素周期表共有列,种族,分别为族,族,族和族。
主族由周期和周期共同构成,含(写主族序
数);副族完全由周期构成,含(写副族序数);第Ⅷ族包含第、、列;0族为第列,全部是稀有气体元素。
3、元素的原子结构决定了元素在周期表中的位置,元素在周期表中的位置反映了元素的原
4、元素周期表的意义
元素周期表中位置相近的元素性质相似,人们可以借助元素周期表研究合成有特定性质的新物质,例如在附近寻找半导体材料,在中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。
