高考化学水溶液中的离子平衡盐类的水解盐溶液呈现不同酸碱性的原因2练习20180109166.doc
2018年高考化学真题分类汇编水溶液中的离子平衡
2018年高考化学真题分类汇编专题8水溶液中的离子平衡(选修4)I—弱电解质的电离1. [2018天津卷-3]下列叙述正确的是A. 某温度下,一元弱酸HA的K a越小,则NaA的K h(水解常数)越小B. 铁管镀锌层局部破损后,铁管仍不易生锈C. 反应活化能越高,该反应越易进行D. 不能用红外光谱区分C2H5OH和CHOCH J【答案】B【解析】A.根据越弱越水解”的原理,HA的K a越小,代表HA越弱,所以A-的水解越强,应该是NaA 的心(水解常数)越大。
选项A错误。
B.铁管镀锌层局部破损后,易形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀。
选B正确。
C.反应的活化能越高,反应越难进行。
选项C错误。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH和CH S OCH S的官能团明显有较大差异,所以可以用红外光谱区分,选项D错误。
【考点】水解平衡常数与电离平衡常数的关系、金属的防护、活化能、红外光谱与化学键。
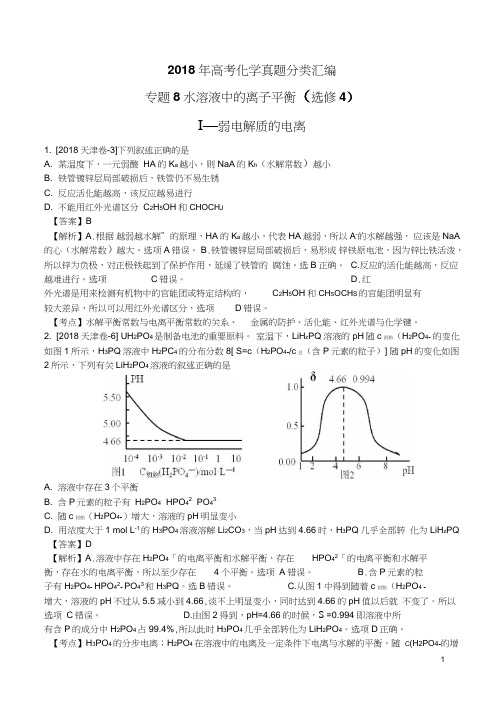
2. [2018天津卷-6] UH2PO4是制备电池的重要原料。
室温下,LiH z PQ溶液的pH随c初始(H2PO4- 的变化如图1所示,H3PQ溶液中H2PC4-的分布分数8[ S=c(H2PO4-/c总(含P元素的粒子)] 随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是A. 溶液中存在3个平衡B. 含P元素的粒子有H2PO4-HPO42-PO43-C. 随c初始(H2PO4-)增大,溶液的pH明显变小D. 用浓度大于1 mol L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PQ几乎全部转化为LiH z PQ 【答案】D【解析】A.溶液中存在H2PO4「的电离平衡和水解平衡,存在HPO42「的电离平衡和水解平衡,存在水的电离平衡,所以至少存在4个平衡。
选项A错误。
B.含P元素的粒子有H2PO4- HPO42- PO43和H3PQ。
第三节 盐类的水解

4、特点: ⑴可逆:中和反应的逆反应,存在水解平衡;
盐 + 水
水解 中和
酸 + 碱
⑵吸热,溶质微粒数增多; (3)微弱:水解程度很小,水解产物较少,盐 溶液的酸碱性一般较弱。
1.下列离子在水溶液中不会发生水解的是
A、 NH4+ B、
_ 2 SO4
C、
Al3+
D、F
_
2. 下列溶液PH小于7的是
A、 溴化钾 B、硫酸铜 C、硫化钠 D、硝酸钡
Fe3++3H2O
条件 升温
移动方向
Fe(OH)3+3H+
H+数 pH值 Fe3+的水 解率 现象 颜色变深
正反应
逆反应 正反应 正反应
增加
增加 增加
降低 降低 升高
增大 减小 增大
通HCl 加水
加NaHCO3
颜色变浅 颜色变浅
红褐色沉淀无色 气泡
减少
升高
增大
四、盐的水解常数(Kh)
1. 强碱弱酸盐的水解常数Kh与弱酸电离常数 Ka的关系: Kh=Kw/ Ka
(4)除杂: 问题6:除去KNO3溶液中少量的Fe3+可用加热的方法吗, 说明理由?
练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅 拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是 ( A、 D )
A.氧化镁 C. 碳酸钠 B.氢氧化钠 D. 碳酸镁
2.农业生产中的盐类水解问题
问题7:化肥的使用——草木灰不能和铵态氮肥 混合使用,为什么?
③同一弱酸对应的盐 碱 性 对应的酸 Na2CO3 HCO3-
> <
NaHCO3 H2CO3
江苏省启东市高考化学 水溶液中的离子平衡 盐类的水解 盐溶液呈现不同酸碱性的原因(1)练习

盐溶液呈现不同酸碱性的原因1.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( ) A.pH=3的HNO3跟pH=11的KOH溶液B.pH=3的HCl跟pH=11的氨水C.pH=3的H2SO4跟pH=11的NaOH溶液D.pH=3的CH3COOH跟pH=11的Ba(OH)2溶液2.常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是()A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>bC.若c(OH-)=c(H+),a>b D.若c(K+)<c(CH3COO-),a<b3.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式:;此时溶液呈性(填“酸性”,“中性”或“碱性”),原因:。
4.常温下,已知0.1 mol·L-1的NaX、NaY、NaZ溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性强弱排列正确的是()A.HX>HY>HZB.HY>HX>HZC.HZ>HY>HXD.HZ>HX>HY5.在下列溶液中,一定能大量共存的一组离子是()A.溶液的pH=13:ClO-、HCO3—、Na+、Mg2+B.溶液中含有大量NO3—:NH4+、I-、SO42—、H+C.溶液中c(HCO3—)=0.1 mol/L:Na+、K+、CO32—、Br-D.溶液中由水电离出的c(H+)=1×10-13mol/L:Na+、H+、Cl-、Br-6.浓度均为0.1mol/L的8种溶液:①HNO3②H2SO4③CH3COOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl,其溶液的pH由小到大的顺序是________。
7.下列有关电解质溶液中微粒的物质的量浓度关系正确的是()①在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)②在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)③向0.2mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH -)>c(H+)④常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO -)>c(H+)=c(OH-)A.①④B.②④C.①③D.②③8. 25 ℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。
专题3-3-1 盐溶液呈现不同酸碱性的原因-试题君之K三关2017-2018学年高二化学 含解析 精品

第三节盐类的水解第1课时盐溶液呈现不同酸碱性的原因1.盐溶液酸碱性的理论分析(常温下)(1)强碱弱酸盐水解,溶液呈_______性,pH_______7。
原因:_______离子和水电离出来的_______结合生成_______,从而使溶液中c(H+)降低,水的电离平衡右移,c(OH−)增大,结果c(OH−)_______c(H+)。
(2)强酸弱碱盐水解,溶液呈_______性,pH_______7。
原因:阳离子与水电离出来的________结合生成_______,使溶液中c(OH−)降低,水的电离平衡右移,c(H+)_______,结果c(H+)_______c(OH−)。
(3)强酸强碱盐(如NaCl)_______水解,c(H+)_______c(OH−),溶液呈______________。
2.盐类水解的定义和实质(1)盐类水解的定义在溶液中盐电离出来的离子与__________所电离出来的__________或__________结合生成__________的反应,叫作盐类的水解。
(2)盐类水解的实质盐类的水解是盐与水之间的化学反应,水解(反应)的实质是,生成____________________,使__________被破坏而建立起新的平衡。
3.盐类水解反应离子方程式的书写盐类水解一般程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般__________“↑”或“↓”。
盐类水解是_________反应,除发生强烈相互促进水解反应的盐外,一般离子方程式中不写“_________”号,而写“_________”号。
【答案】1.(1)碱>弱酸根 H+弱酸>(2)酸 < OH−弱碱增大 > (3)不 = 中性2.(1)水 H+OH−弱电解质(2)弱酸或弱碱水的电离平衡3.不写可逆盐类水解方程式的书写盐类水解的通式为“盐中能水解的离子+水弱酸(或弱碱)+OH−(或H+)”。
高中化学 第三章 水溶液中的离子平衡 3-1 盐溶液呈现不同酸碱性的原因课后作业(含解析)新人教版选

盐溶液呈现不同酸碱性的原因作业时限:45分钟作业满分:100分一、选择题(每小题4分,每小题有1个正确选项,共44分)1.下列反应不属于水解反应或水解方程式不正确的是( D )①HCl+H2O H3O++Cl-②ZnCl2+2H2O===Zn(OH)2+2HCl③Na2CO3+H2O H2CO3+2NaOH④Al2(CO3)3+6H2O2Al(OH)3↓+3H2CO3A. ①②B. ③④C. ①②④ D.全部解析:①不是水解反应,是HCl的电离反应:HCl===H++Cl-、H++H2O===H3O+;该电离是完全的,不是可逆的,正确的写法是HCl+H2O===H3O++Cl-。
②ZnCl2水解是可逆的,应用“”连接,不应写“===”,正确的写法是ZnCl2+2H2O Zn(OH)2+2HCl,或Zn2++2H2O Zn(OH)2+2H+。
③多元弱酸根的水解是分步进行的,以第一步为主,以后各步逐渐减弱,可分步写,也可只写第一步,不可多步合为一步写,正确的写法是Na2CO3+H2O NaHCO3+NaOH,NaHCO3+H2OH2CO3+NaOH。
④因为Al2(CO3)3的水解相互促进,能进行到底,故正确的写法应为Al2(CO3)3+3H2O===2Al(OH)3↓+3CO2↑。
2.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( D )A.酸的强弱:HCN>HClOB. pH:HClO>HCNC.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCND.酸根离子浓度:c(CN-)<c(ClO-)解析:强碱弱酸盐的水溶液呈碱性,相应酸的酸性越弱,其强碱盐溶液的碱性越强。
NaCN 溶液的pH比NaClO大,说明HCN的酸性比HClO弱。
3.相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是( C )A.NaHSO4CH3COONa NH4Cl NaNO3B .NaNO 3 CH 3COONa NaHSO 4 NH 4ClC .CH 3COONa NaNO 3 NH 4Cl NaHSO 4D .NaNO 3 CH 3COONa NH 4Cl NaHSO 4解析:本题通过对溶液pH 大小的比较,考查盐在水溶液中的电离和盐类水解的规律。
高考化学一轮第8章水溶液中的离子反应与平衡第33讲盐类的水解新人教版

应用
举例
实验室盛放Na2CO3、CH3COONa、Na2S等溶液的试剂瓶
试剂的保存
不能用磨口玻璃塞,应用橡胶塞或软木塞。因为这些盐水
解生成的NaOH会腐蚀玻璃生成Na2SiO3,若使用磨口玻璃
塞,会使试剂瓶瓶口和玻璃塞黏结在一起
某些较活泼的
金属与强酸弱
碱盐溶液反应
把Mg粉放入NH4Cl溶液中可产生H2:
2.盐类水解的应用
(1)盐类水解在化学实验中的应用
应用
判断
溶液
的酸
碱性
举例
以同浓度的 Na2CO3、NH4Cl、NaClO 溶液为例,NH4+水解使溶液呈
酸性,CO2、ClO
水解使溶液呈碱性,因 H2CO3 的二级电离常数比
3
HClO 的电离常数小,所以 ClO-水解程度比 CO23 水解程度小,NaClO
烧得到Al2O3
胶体的制取
制取Fe(OH)3胶体反应的离子方程式为Fe3++3H2O Fe(OH)3
(胶体)+3H+
物质的提纯
除去MgCl2溶液中的Fe3+,可加入MgO、Mg(OH)2或MgCO3
23+
CO
、HCO
3
3 、S2-、HS-等因相互
离子共存的判 Al 与[Al(OH)4] 、
断
促进水解而不能大量共存
如:Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑。在一定条件下,BrCl、CuCl2、
Mg2C3和K3P均可以发生水解。根据上述观点,下列说法不正确的是( B )
A.BrCl的水解产物是HBrO和HCl
B.K3P的水解产物是KOH和H3PO4
高中化学知识点详解盐类的水解

盐类水解知识点及习题考点1盐类水解反应的本质一盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟结合生成 ,从而了水的电离;二盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等;三盐类水解的结果1 了水的电离;2盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 ;3生成了弱电解质;四特征1水解:盐+水酸 + 碱,ΔH 02盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大;特别提醒:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素;强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中cH+减小,cOH-增大,即cOH->cH+;如Na2CO3,NaHCO3强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中cH+增大,cOH-减小,即cOH->cH+;NH4Cl,AlCl3弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子;CH3COONH4例1 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是①KNO3②NaOH③CH3COO NH4④NH4Cl A、①>②>③>④ B、④>③>①>②C、③>④>②>① D、③>④>①>②解析①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO—对水的电离平衡无影响;②NaOH为强碱在水溶液中电离出的OH—对水的电离起抑制作用,使水的电离程度减小;③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO—均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大;④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH4+可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度;答案D规律总结酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用;考点2溶液中粒子浓度大小的比较规律1.多元弱酸溶液,根据电离分析,如在H3PO4的溶液中,2.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2 S溶液中cNa+>cS2->cOH->cHS-3.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素;如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,cNH4+由大到小的顺序是 ;4.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素,水解因素等;1弱酸与含有相应酸根的盐混合,若溶液呈酸性,说明弱酸的电离程度相应酸根离子的水解程度;如CH3COOH与CH3COONa溶液呈 ,说明CH3COOH的电度程度比CH3COO—的水解程度要大,此时,c CH3COOH<c CH3COO—;2弱酸与含有相应酸根的盐混合,若溶液呈碱性,说明弱酸的电离程度相应酸根离子的水解程度;如HCN与NaCN的混合溶液中,c CN—<c Na+,则说明溶液呈碱性,HCN的电度程度比CN—的水解程度要 ,则c HCN>c CN—;3弱碱与含有相应弱碱阳离子的盐的混合的情况,与1、2的情况类似;特别提醒理解透水解规律:有弱才水解,越弱越水解,谁强显谁性;例2 在mol·L-1的 NH4Cl和mol·L-1的氨水混合溶液中,各离子浓度的大小顺序;答案cNH4+>cCl->cOH->cH+;在该溶液中,NH3·H2O的电离与NH4+的水解互相抑制,NH3·H2O电离程度大于NH4+的水解程度时,溶液呈碱性:c OH->c H+,同时c NH4+>c Cl-;规律总结要掌握盐类水解的内容这部分知识,一般来说要注意几个方面:1、盐类水解是一个可逆过程;2、盐类水解程度一般都不大;3、要利用好守恒原则即电量守恒和物料守恒这两个方法在比较离子浓度和相关计算方面有较多的运用;考点3 盐类水解的应用1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 ;如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、NH42SO4、NaHSO4等溶液,pH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>NH42SO4>NaHSO42.比较盐溶液中各离子浓度的相对大小时,当盐中含有的离子,需考虑盐的水解;3.判断溶液中离子能否大量共存;当有和之间能发出双水解反应时, 在溶液中大量共存;如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存;4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来盐的水解;5.选择制备盐的途径时,需考虑盐的水解;如制备Al2S3时,因无法在溶液中制取会完全水解,只能由干法直接反应制取;加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体;6.化肥的合理使用,有时需考虑盐的水解;如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用;因草木灰有效成分K2CO3水解呈 ;7.某些试剂的实验室存放,需要考虑盐的水解;如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 ;8.溶液中,某些离子的除杂,需考虑盐的水解;9.用盐溶液来代替酸碱10.明矾能够用来净水的原理特别提醒:盐类水解的应用都是从水解的本质出发的;会解三类习题:1比较大小型,例:比较PH值大小;比较离子数目大小等;2实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等;3反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等;例3蒸干FeCl3水溶液后再强热,得到的固体物质主要是A. FeCl3B. FeCl3·6H2OC. FeOH3D. Fe2O3解析 FeCl3水中发生水解:FeCl3+3H2O FeOH3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成FeOH3,FeOH3为不溶性碱,受热易分解,最终生成Fe2O3;答案D规律总结易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体;例如:AlCl3、FeCl3;而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2;参考答案考点1 一水电离出来的H+或OH- 弱电解质促进;二溶于水弱酸的酸根离子或弱碱阳离子三1促进; 2酸性碱性中性谁强显谁性四 1吸热 >;2小考点2 1.多步c H+>c H2PO4->c HPO42->c PO43-;3. ③>①>②;4.1大于酸性 2小于小考点3 1. 盐的水解 2. 易水解 3. 弱碱阳离子弱酸阴离子不能4. 对应的强酸抑制5. HCl6. 碱性7. 磨口玻璃塞盐类水解盐类水解,水被弱解;有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强呈谁性,同强呈中性;电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等;如NaHCO3溶液中:nNa++nH+=nHCO3-+2nCO32-+nOH-推出:Na++H+=HCO3-+2CO32-+OH-物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的;如NaHCO3溶液中:nNa+:nc=1:1,推出:C Na+=c HCO3-+c CO32-+c H2CO3质子守恒:不一定掌握电解质溶液中分子或离子得到或失去质子H+的物质的量应相等;例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c H3O++c H2CO3=c NH3+c OH-+c CO32-;。
江苏省启东市高考化学水溶液中的离子平衡盐类的水解盐溶液呈现不同酸碱性的原因(2)练习(new)

9. 答案:A
解析:A、根据△G=△H—T·△S可知,△G〈0时反应自发。如果TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加,即△S>0,A正确;B、氯化钠是强酸强碱盐,不水解,溶液显中性.醋酸铵是弱酸弱碱盐,酸根离子与铵根离子水解程度相同,溶液显中性,但促进水的电离,B不正确;C、pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为弱碱,碱过量,溶液显碱性,C不正确;D、Na2CO3溶液中加入少量Ca(OH)2固体生成碳酸钙沉淀和氢氧化钠,CO32—水解程度减小,但溶液的碱性增强,pH增大,D不正确,选A。
2.在25℃时,NH4+浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol·L-1),下列判断正确的是()
A.a=b=cB.a=c〉bC.b〉a>cD.c〉a>b
3.将pH=3的盐酸aL分别与下列三种溶液混合后,溶液均呈中性:①1×10-3mol/L的氨水bL;②c(OH-)=1×10-3mol/L的氨水cL;③c(OH-)=1×10-3mol/L的Ba(OH)2溶液dL.其中a、b、c、d的关系正确的是( )
10. 答案:A
解析:A、Na2CO3为强碱弱酸盐,水解呈碱性,正确;B、Na2SO4为强酸强碱盐,溶液呈中性,错误;C、NH4Cl为强酸弱碱盐,水解呈酸性,错误;D、KAl (SO4)2为强酸弱碱盐,水解呈酸性,错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐溶液呈现不同酸碱性的原因
1.在10 mL 0.1 mol·L-1 NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各粒子的浓度关系错误的是
A.c Na+>c Ac->c H+>c OH-
B.c Na+>c Ac->c OH->c H+
C.c Na+=c Ac->c HAc
D.c Na++c H+=c Ac-+c OH-
2.在25℃时,NH4+浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol·L-1),下列判断正确的是()
A.a=b=c B.a=c>b C.b>a>c D.c>a>b
3.将pH=3的盐酸a L分别与下列三种溶液混合后,溶液均呈中性:①1×10-3mol/L的氨水b L;②c(OH-)=1×10-3mol/L的氨水c L;③c(OH-)=1×10-3mol/L的Ba(OH)2溶液d L。
其中a、b、c、d的关系正确的是()
A.b>a>d>c B.b>a=d>c C.a=b>c>d D.c>a=d>b
4. NA代表阿伏加德罗常数,下列说法正确的是()
A.9 g D2O中含有的电子数为5 NA
B.1 mol MgCl2中含有的离子数为2 NA
C.1 mol CH4分子中共价键总数为4 NA
D.7.1 g C12与足量NaOH溶液反应转移的电子数为0.2 NA
5.常温下,有甲、乙两份体积均为1 L,浓度均为 0.1 mol/L 的氨水,其pH为11。
①甲用蒸馏水稀释至1/100后,溶液的pH变为a;②乙与等体积、浓度为 0.2 mol/L 的盐酸混合,在混合液中n(NH4+)+n(H+)-n(OH-)= b mol。
则关于a、b值的正确组合是()A.9~11;0.1 B.9~11;0.2 C.12~13;0.2 D.13;0.1
6.下列有关说法正确的是()
A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
C.pH=6的纯水中,c(OH-)=10-8 mol·L-1
D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小
7. 25 ℃时,关于浓度均为0.2 mol/L的Na2CO3和NaHCO3溶液的说法不正确的是()A.两溶液中均存在电离平衡和水解平衡
B.两溶液分别加水稀释后,pH和K W均减小
C.两溶液中均存在c(OH-)+2c(CO32-)+c(HCO3-)=c(Na+)+c(H+)
D.c(OH-)前者大于后者
8. 25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是()
A.该溶液的pH可能是7 B.该溶液的pH可能是5
C.该溶液的pH一定是9 D.此溶液不存在
9.下列有关说法正确的是()
A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
10.下列物质的水溶液中,呈碱性的是( )
A.Na2CO3 B. Na2SO4 C.NH4Cl D. KAl (SO4) 2
参考答案:
1.答案: A
解析:
2.答案: C
解析: CH3COONH4溶液中,CH3COO—和NH4+互相促进水解,也就是发生了双水解;NH4HSO4溶液中,H+抑制了NH4+的水解。
3.答案: B
解析:盐酸为强酸,Ba(OH)2为强碱,pH=3的盐酸与c(OH-)=1×10-3mol/L的Ba(OH)2溶液恰好中和时,二者的体积相等,即a=d。
等浓度的盐酸与氨水等体积混合,溶液显酸性,因此,b>a。
因为氨水是弱碱,c(OH-)=1×10-3mol/L的氨水的浓度远远大于pH=3的盐酸的浓度,因此,a>c。
4.答案: C
解析:根据题中所给出的信息分析,本题重点考察的是阿弗加德罗定律的应用。
5.答案: B
6.答案: A
解析: NH4Cl溶液显酸性,稀释时溶液酸性减弱,pH增大,A项正确;25 ℃时,任何水溶液中c(H+)与c(OH-)的乘积等于10-14,但c(H+)与c(OH-)不一定是由水电离出来的,B 项错误;纯水呈中性,中性溶液中c(H+)=c(OH-),C项错误;稀释酸性溶液时,溶液中的c(H+)减小,而温度不变,水的离子积常数K W不变,故c(OH-)增大,D项错误。
7.答案: B
解析:两溶液中均存在水的电离平衡和盐类的水解平衡,A项正确;K W只与温度有关,温度不变K W不变,B项错误;根据溶液的电中性可知C项正确;CO32-的水解程度要远大于HCO3-的水解程度,故等物质的量浓度的Na2CO3溶液和NaHCO3溶液,c(OH-)前者要大于后者,D项正确。
8.答案: B
解析:加酸加碱都能抑制水的电离,所以溶液可以为酸性溶液,也可以为碱性溶液,水电离产生的c(H+)和c(OH-)均为1×10-9 mol/L,若为酸性溶液,则溶液中c(H+)=1×10-5 mol/L,pH=5,若为碱性溶液,则溶液中的c(OH-)=1×10-5mol/L,pH=9,正确选项为B。
9.答案: A
解析: A、根据△G=△H—T·△S可知,△G<0时反应自发。
如果TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加,即△S>0,A正确;B、氯化钠是强酸强碱盐,不水解,溶液显中性。
醋酸铵是弱酸弱碱盐,酸根离子与铵根离子水解程度相同,溶液显中性,但促进水的电离,B不正确;C、pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为弱碱,碱过量,溶液显碱性,C不正确;D、Na2CO3溶液中加入
少量Ca(OH)2固体生成碳酸钙沉淀和氢氧化钠,CO32-水解程度减小,但溶液的碱性增强,pH 增大,D不正确,选A。
10.答案: A
解析: A、Na2CO3为强碱弱酸盐,水解呈碱性,正确;B、Na2SO4 为强酸强碱盐,溶液呈中性,错误;C、NH4Cl为强酸弱碱盐,水解呈酸性,错误;D、KAl (SO4) 2为强酸弱碱盐,水解呈酸性,错误。
精美句子
1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂;幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。
幸福是“壮志饥餐胡虏肉,笑谈渴饮匈奴血”的豪壮。
幸福是“先天下之忧而忧,后天下之乐而乐”的胸怀。
幸福是“人生自古谁无死,留取丹心照汗青”的气节。
3、大自然的语言丰富多彩:从秋叶的飘零中,我们读出了季节的变换;从归雁的行列中,我读出了集体的力量;从冰雪的消融中,我们读出了春天的脚步;从穿石的滴水中,我们读出了坚持的可贵;从蜂蜜的浓香中,我们读出了勤劳的甜美。
4、成功与失败种子,如果害怕埋没,那它永远不能发芽。
鲜花,如果害怕凋谢,那它永远不能开放。
矿石,如果害怕焚烧(熔炉),那它永远不能成钢(炼成金子)。
蜡烛,如果害怕熄灭(燃烧),那它永远不能发光。
航船,如果害怕风浪,那它永远不能到达彼岸。
5、墙角的花,当你孤芳自赏时,天地便小了。
井底的蛙,当你自我欢唱时,视野便窄了。
笼中的鸟,当你安于供养时,自由便没了。
山中的石!当你背靠群峰时,意志就坚了。
水中的萍!当你随波逐流后,根基就没了。
空中的鸟!当你展翅蓝天中,宇宙就大了。
空中的雁!当你离开队伍时,危险就大了。
地下的煤!你燃烧自己后,贡献就大了
6、朋友是什么?
朋友是快乐日子里的一把吉它,尽情地为你弹奏生活的愉悦;朋友是忧伤日子里的一股春风,轻轻地为你拂去心中的愁云。
朋友是成功道路上的一位良师,热情的将你引向阳光的地带;朋友是失败苦闷中的一盏明灯,默默地为你驱赶心灵的阴霾。
7、一粒种子,可以无声无息地在泥土里腐烂掉,也可以长成参天的大树。
一块铀块,可以平庸无奇地在石头里沉睡下去,也可以产生惊天动地的力量。
一个人,可以碌碌无为地在世上厮混日子,也可以让生命发出耀眼的光芒。
8、青春是一首歌,她拨动着我们年轻的心弦;青春是一团火,她点燃了我们沸腾的热血;青春是一面旗帜,她召唤着我们勇敢前行;青春是一本教科书,她启迪着我们的智慧和心灵。
