化学反应与能量2013高考真题汇编
2013高考化学真题专业解析(北京卷)(出版原稿)汇总

2013年普通高等学校招生全国统一考试理综试卷(化学部分) (北京卷)一、单项选择题(每小题 6分)1.下列设备工作时,将化学能转化为热能的是( )A.硅太阳能电池答案:D 思路分析:考点解剖:本题考查能量之间的转化及应用。
解题思路:根据装置的名称和能量转化关系进行分析。
解答过程: 解:选项A 中,硅太阳能电池是将太阳能直接转化为电能,故 A 错误;选项B 中,锂离子电池将化学能直接转化为电能,故 B 错误;选项C 中,太阳能集热器是将太阳能转变为热能,故 C 错误; 选项D 中,燃料燃烧将化学能直接转化为热能,故 D 正确。
所以本题的答案为 D 。
规律总结:D. B.锂离子电池C.太阳能集热器 燃气灶答案:C 此类型题目涉及的化学内容比较简单, 密切联系生活、生产实际、 等问题,通过测试学生应用化学知识和技能解决简单实际问题的过程, 和对社会的关注态度。
2. 下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A. 水中的钢闸门连接电源的负极B. 金属护拦表面涂漆C. 汽车底盘喷涂高分子膜D. 地下钢管连接镁块答案:A 思路分析:考点解剖:本题考查金属的腐蚀与防护。
解题思路:根据电化学、氧化还原反应原理等分析。
解答过程: 解:选项A 中,钢闸门连接电源的负极, 为电解池的阴极,被保护,属于外加电流的阴极保护法,故A 正确;选项B 和选项C 中,是金属表面覆盖保护层,通过隔绝空气防止金属被腐蚀,故 B 、C错误;选项D 中,镁比铁活泼,构成原电池,铁为正极,被保护,是牺牲阳极的阴极保护法, 故D 错误。
所以本题的答案为 A 。
规律总结:金属腐蚀的防护方法有:(1)改变金属内部结构(如在钢中加 Cr 、Ni 等制成不锈钢);(2)在金属表面覆盖保护层 (如上题中表面覆盖一层防渗的高分子膜) ;(3)电化学保护法,主要有牺牲阳极的阴极保护法和外加电流阴极保护法。
此外,保存在干燥的环境中也可有效防止形成原电池而发生电化学腐蚀。
2013年高考真题——化学(江苏卷)解析版

2013年普通高等学校招生统一考试(江苏卷)【卸识点】橋題可1⅛化学与生活的存关知识・化学与能源的内容 【答案】I) 【斛析】甲醉・天然气.浪化石油气都伶仃ffi>ι2⅛t 燃⅛⅛⅛J y Γ√⅛⅛Jfe 1⅝;氢气燃烧生IS 曲无污組是赧环保的0 2•下列有关化学用语表示正确的是A .丙烯的结构简式: C 3H 6B .氢氧根离子的电子式:D .中子数为146、质子数为92的铀(U)原子14692U CfcIiH?-J 的化学川粘 ⅛l ⅛f ⅛A> ⅛ f 式.Ki Γ⅛^^√⅛I ¾W ⅛⅛Γ的・【解折】l ⅛i ⅛!Tj 结构简Λ¾<-H2=C>∣<∣B. IM -轧丫[槪的咆鬥弋为LO'H 】.I lin 盹 中f ⅛ h HS. M Γ S 为9Z 的铀Kl f 的质 ⅛tt ⅛23B. DittiM3.常温下,下列各组离子在指定溶液中一定能大量共存的是A .使甲基橙变红色的溶液: Mg"、KS Sθ42~、NO 3B .使酚酞变红色的溶液: Na : Cu 2+> HCO 3「、NO 3「 C . 0. 1 mol L -1AgNO 3 溶液:H 、K +、SO 42 、丨D . 0. 1 mol L -1NaAlO 2 溶液:H +、Na +、Cl _、SO 42~【知识点】本题考查离了并存问题。
【答案】A【解析】便甲基橙变纣的諮液是酸杵瘠液.卩q 种离F 能大最共苗 A 正确;⅛^⅛变红色的 化学试题可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32Ni 59 CU 64Cl 35. 5 Ca 40 Mn 55 选择题单项选择题:本题包括 10小题,每小题2分,共计1•燃料电池能有效提高能源利用率,具有广泛的应用前景。
下列物质均可用作燃料电池的燃料,其中最环保的是 A •甲醇B •天然气C .液化石油气Fe 56 20分。
专题27 化学反应与能量变化(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)
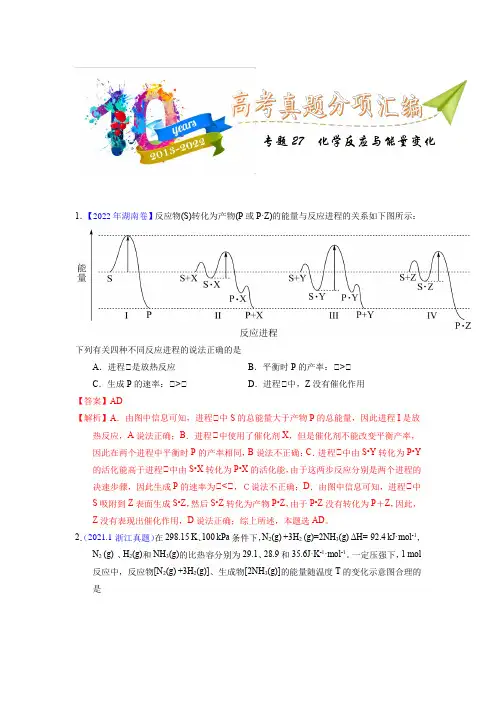
专题27 化学反应与能量变化1.【2022年湖南卷】反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:下列有关四种不同反应进程的说法正确的是A.进程Ⅰ是放热反应B.平衡时P的产率:Ⅰ>ⅠC.生成P的速率:Ⅰ>ⅠD.进程Ⅰ中,Z没有催化作用【答案】AD【解析】A.由图中信息可知,进程Ⅰ中S的总能量大于产物P的总能量,因此进程I是放热反应,A说法正确;B.进程Ⅰ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P的产率相同,B说法不正确;C.进程Ⅰ中由S•Y转化为P•Y 的活化能高于进程Ⅰ中由S•X转化为P•X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅰ<Ⅰ,C说法不正确;D.由图中信息可知,进程Ⅰ中S吸附到Z表面生成S•Z,然后S•Z转化为产物P•Z,由于P•Z没有转化为P+Z,因此,Z没有表现出催化作用,D说法正确;综上所述,本题选AD。
2.(2021.1·浙江真题)在298.15 K、100 kPa条件下,N2(g) +3H2 (g)=2NH3(g) ΔH=-92.4 kJ·mol-1,N2 (g) 、H2(g)和NH3(g)的比热容分别为29.1、28.9和35.6J·K-1·mol-1。
一定压强下,1 mol 反应中,反应物[N2(g) +3H2(g)]、生成物[2NH3(g)]的能量随温度T的变化示意图合理的是A.B.C.D.【答案】B【解析】该反应为放热反应,反应物的总能量大于生成物的总能量,根据题目中给出的反应物与生成物的比热容可知,升高温度反应物能量升高较快,反应结束后反应放出的热量也会增大,比较4个图像B符合题意,故答案选B。
3.(2018·上海高考真题)H2(g)和I2(g)、H2(g)和I2(s)以及HI(g)的能量高低如图所示,下列判断错误的是()A.1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量B.I2(g)→I2(s)+QkJ(Q>0)C.H2(g)+I2(g)→2HI(g)+9.3kJD.H2(g)+I2(s)→2HI(g)+53.0kJ【答案】D【解析】A.由能量高低图分析可知,2molHI(g)→1molH2(g)和1molI2(g)需要吸收9.3kJ的能量,故1molH2(g)和1molI2(g)的能量总和高于2molHI(g)的能量,正确;B.由能量高低图可知,I2(g)→I2(s)放出能量,即I2(g)→I2(s)+QkJ(Q>0),正确;C.根据能量高低图分析可知,H2(g)+I2(g)→2HI(g)放出9.3kJ的能量,故H2(g)+I2(g)→2HI(g)+9.3kJ,正确;D.根据能量高低图分析可知,H2(g)+I2(s)→2HI(g)吸收53.0kJ的能量,故H2(g)+I2(s)→2HI(g)-57.3kJ,错误;答案选D。
2013高考化学真题专业解析(江苏卷)(出版原稿)(精)

2013年普通高等学校招生全国统一考试化学试卷(江苏卷)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32 Cl 35. 5 Ca 40 Mn 55 Fe 56 Ni 59 Cu 64选择题单项选择题:本题包括10 小题,每小题2 分,共计20 分。
每小题只有一个选项符合题意。
1.燃料电池能有效提高能源利用率,具有广泛的应用前景。
下列物质均可用作燃料电池的燃料,其中最环保的是()A.甲醇 B.天然气 C.液化石油气 D.氢气答案:D思路分析:考点解剖:本题属于考核化学与社会问题中的节能减排、保护环境、资源利用等相关问题。
解题思路:根据燃料电池的特点分析,A、B、C和D都能构成燃料电池,做燃料电池的负极,写出电极反应式从环保角度分析即可。
解答过程:解:选项A中,甲醇中含有碳元素,燃烧容易生成污染物;选项B中,天然气中含有碳元素,燃烧容易生成污染物;选项C中,液化石油气中含有碳元素,燃烧容易生成污染物;选项D中,氢气燃烧生成水,无污染,是最环保的。
所以本题的答案为D。
规律总结:燃料电池的能量转换率为 80%,普通燃烧过程能量转换率为 30%左右(《选修四》教材P77),氢气作为燃料电池的燃料,其产物又是水,对环境无危害性,从能效比及环境保护的角度看,氢气的确是最理想的能源。
2.下列有关化学用语表示正确的是()A.丙烯的结构简式:C3H6B.氢氧根离子的电子式:C.氯原子的结构示意图:D.中子数为146、质子数为92 的铀(U)原子14692U答案:B思路分析:考点解剖:本题考查有关的化学用语,结构简式、电子式、原子结构示意图以及原子的表示方法。
解题思路:根据有机物的结构简式来分析A;根据电子式分析B;根据质量数与质子数分析C、D。
解答过程:解:选项A中,丙烯的结构简式为CH2=CH-CH3;故A错误;选项B中,氢氧根的电子式为;故B正确;选项C中,氯原子的结构示意图为;故C错误;选项D中,中子数为146、质子数为92的铀原子的质量数为238。
2013高考 化学真题专业解析(福建卷)(出版原稿)汇总

2013年普通高等学校招生全国统一考试理综试卷(化学部分)(福建卷)一、单项选择题(每小题6分)1. 化学与社会、生产、生活密切相关。
下列说法正确的是()A.石英只能用于生产光导纤维B.从海水提取物质都必须通过化学反应才能实现C.为了增加食物的营养成分,可以大量使用食品添加剂D.“地沟油”禁止食用,但可以用来制肥皂答案:D思路分析:考点解剖:本题考查化学与生活以及自然资源的综合利用。
解题思路:依据石英用途可解答A项,联系油脂性质等可分析C、D项,结合海水的综合利用可解答B项。
解答过程:解:选项A,纯净的石英不仅可用于制造光导纤维,还可用于现代光学制品的原料和制作饰物或工艺品,A项错误;选项B,从海水中提取食盐不需要发生化学变化,B项错误;选项C,使用食品添加剂需严格按照国家食品安全标准添加,大量使用食品添加剂对人体有害,C项错误;选项D,地沟油是动植物的油脂混合物,因此可利用地沟油,通过皂化反应制取肥皂,D项正确。
所以本题答案为D。
规律总结:化学与STSE的试题经常在选择题中出现,一般难度不大,解答时只需联系生活常识即可。
2. 下列关于有机化合物的说法正确的是()A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别B.戊烷(C5H12)有两种同分异构体C.乙烯、聚氯乙烯和苯分子均含有碳碳双键D.糖类、油脂和蛋白质均可发生水解反应答案:A思路分析:考点解剖:本题考查烷烃、烯烃及乙醇、乙酸等有机物的基本性质等知识。
解题思路:解答时联系乙酸乙酯、营养物质的性质等分析A、D项;利用有机物分子结构来分析B、C项。
解答过程:解:选项A,乙酸可与Na2CO3溶液反应产生CO2气体、乙酸乙酯与Na2CO3溶液互不相溶,液体分层;选项B,戊烷有3种同分异构体(正戊烷、新戊烷、异戊烷);选项C,聚乙烯、苯分子中均不存在碳碳双键;选项D,糖类中单糖不能发生水解。
所以本题答案为A。
规律总结:苯、乙烯以及糖类、油脂、蛋白质等属必修中有机化学,历年来必考一个选择题,解答时需联系有关物质的性质、结构以及有关概念来分析。
2013年全国各地高考真题及解析

B.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)∙c(X—),故K(AgI)<K(AgCl)
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
6.已知:P4(g)+6Cl2(g)=4PCl3(g)△H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g)△H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为
1.2c kJ∙mol—1。
6.C【解析】原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,A项错误;利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,B项错误;利用Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1可得E(Cl-Cl)+3×1.2c-5c=(b-a)/4,因此可得E(Cl-Cl)=(b-a+5.6c)/4kJ·mol-1,C项正确;由P4是正四面体可知P4中含有6个P-P键,由题意得6E(P-P)+10×(b-a+5.6c)/4-4×5c=b,解得E(P-P)=(2.5a-1.5b+6c)/6 kJ·mol-1,D项错误。
【备考2014】2013高考化学_(真题+模拟新题分类汇编)_化学反应与能量
化学反应与能量F1化学反应与能量变化20.F1 B3 H1 K1[2013·江苏卷] 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。
它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。
相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-12Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=______________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO460 mol CuSO4能氧化白磷的物质的量是__________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
图0①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为____________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________________________________________________________________________ ________________________________________________________________________(用离子方程式表示)。
2011--2013高考真题汇编之化学反应与能量
考纲要求(新课标全国2013)5、化学反应与能量①了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
②了解化学反应中能量转化的原因,能说出常见的能量转化形式。
③了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
④了解热化学方程式的含义。
⑤了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
⑥了解焓变与反应热的含义。
了解∆H =H (反应产物)-H (反应物) 表达式的含义。
⑦理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
2013(2013新课标Ⅱ卷)在1200℃时,天然气脱硫工艺中会发生下列反应H 2S (g )+ 32O 2(g)=SO 2(g)+H 2O(g) △H 12H 2S(g)+SO 2(g)=S 2(g)+2H 2O(g) △H 2H 2S(g)+O 2(g)=S(g)+H 2O(g)△H 3 2S(g) =S 2(g) △H 4则△H 4的正确表达式为( )A.△H 4=32(△H 1+△H 2-3△H 3)B.△H 4=32(3△H 3-△H 1-△H 2) C.△H 4=32(△H 1+△H 2+3△H 3) D.△H 4= 32(△H 1-△H 2-3△H 3) 【答案】A【解析】考察盖斯定律。
根据S 守恒原理,要得到方程式4,可以用(方程式1+方程式2—3×方程式2)×32. (2013 ∙重庆卷∙6)已知:P 4(g)+6Cl 2(g)=4PCl 3(g) △H =a kJ ∙mol —1P 4(g)+10Cl 2(g)=4PCl 5(g) △H =b kJ ∙mol —1P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是A.P-P键的键能大于P-Cl键的键能B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△HC.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1【答案】C【解析】考察盖斯定律以及键能与反应热的关系原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,A 项错误;利用“盖斯定律”,结合题中给出两个热化学方程式可求出Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,B项错误;利用Cl2(g)+PCl3(g)=PCl5(g)△H=(b-a)/4KJ·mol-1可得E(Cl-Cl)+3×1.2c-5c=(b-a)/4,因此可得E(Cl-Cl)=(b-a+5.6c)/4kJ·mol-1,C项正确;由P4是正四面体可知P4中含有6个P-P键,由题意得6E(P-P)+10×(b-a+5.6c)/4-4×5c=b,解得E(P-P)=(2.5a-1.5b+6c)/6 kJ·mol-1,D项错误。
2013年各地高考化学《能量及化学平衡》汇编
2013年 各地高考《能量及化学平衡》 题目汇编友情提示:江苏、上海、四川题目难度偏大,可根据自己的情况进行选择1. (2013年四川卷)在一定温度下,将气体X 和气体Y 各0.16mol 充入10L 恒容密闭容器中,发生反应△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是A .反应前2min 的平均速率ν(Z)=2.0×10—3mol·L —1·min —1B .其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)C .该温度下此反应的平衡常数K =1.44D . 其他条件不变,再充入0.2molZ ,平衡时X 的体积分数增大2. (2013年安徽卷)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO :MgSO 4(s) + CO(g)MgO(s) + CO 2(g) + SO 2(g); △H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x 的值,重新达到平衡后,纵坐标y 随x 变化趋势合理的是 3. (2013年 重庆卷)已知:P 4(g)+6Cl 2(g)=4PCl 3(g) △H =a kJ∙mol —1P 4(g)+10Cl 2(g)=4PCl 5(g) △H =b kJ∙mol —1P 4具有正四面体结构,PCl 5中P -Cl 键的键能为c kJ∙mol —1,PCl 3中P -Cl 键的键能为 1.2c kJ∙mol —1。
下列叙述正确的是A .P -P 键的键能大于P -Cl 键的键能B .可求Cl 2(g)+ PCl 3(g)=4PCl 5(s)的反应热△HC .Cl -Cl 键的键能为(b -a+5.6c)/4 kJ∙mol —1D .P -P 键的键能为(5a -3b+12c)/8 kJ∙mol —14. (2013年 重庆卷)将E 和F 加入密闭容器中,在一定条件下发生反应:2G(g)。
2013年全国高考化学试题分类汇编----化学反应中的能量变化 - 答案
2013年全国高考化学试题分类汇编----化学反应中的能量变化 1/11.(2013·高考新课标全国卷Ⅱ·12) 选A 。
根据盖斯定律找出各反应的反应热之间的关系。
将前三个热化学方程式分别标为①、②、③,根据盖斯定律,由23×①+23×②-2×③可得:2S(g)===S 2(g) ΔH 4=23(ΔH 1+ΔH 2-3ΔH 3)。
2.(2013·高考重庆卷·12) 选C 。
根据盖斯定律和焓变与键能的关系解答。
A.根据Cl 原子半径小于P 原子半径,可判断P —P 键键长大于P —Cl 键键长,所以P —P 键的键能小于P —Cl 键的键能,故A 错误。
B.根据盖斯定律可得Cl 2(g)+PCl 3(g)===PCl 5(g) ΔH =(b -a )/4 kJ·mol -1,但不知PCl 5(g)转化为PCl 5(s)时的热效应,故B 错误。
C.由B选项分析得出的热化学方程式可知:(b -a )/4=x (Cl —Cl 键的键能)+3×1.2c -5c ,x =(b -a )/4+1.4c ,故C正确。
D.由P 4(g)+6Cl 2(g)===4PCl 3(g) ΔH =a kJ·mol -1可知:a =6y (P —P 键的键能)+6×b -a +5.6c 4-12×1.2c ,得:y =2.5a +6c -1.5b 6,D 错误。
3.(2013·高考福建卷·11) 解析:选C 。
A.根据题干中已知的两个反应可以看出,CeO 2在反应前后没有变化,CeO 2应是水和二氧化碳转化为氢气和一氧化碳的催化剂。
B.在太阳能的作用下,水和二氧化碳转化为氢气和一氧化碳,太阳能转化为化学能。
C.根据盖斯定律可知-ΔH 3=ΔH 1+ΔH 2。
D.以一氧化碳和氧气构成的碱性燃料电池,负极应为一氧化碳失电子,在碱性条件下一氧化碳应变为碳酸根离子,结合选项中所给的电极反应式,再根据电荷守恒、得失电子守恒则可判断其正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应与能量
1.2013·安徽卷] 我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO +O 2――→催化剂
CO 2+H 2O 。
下列有关说法正确的是( )
A .该反应为吸热反应
B .CO 2分子中的化学键为非极性键
C .HCHO 分子中既含σ键又含π键
D .每生成1.8 g H 2O 消耗2.24 L O 2
2.[2013·福建卷]某科学家利用二氧化铈(CeO 2)在太阳能作用下将H 2O 、CO 2转变为H 2、CO 。
其过程如下:mCeO 2――→太阳能①
(m -x) CeO 2·xCe +xO 2
(m -x)CeO 2·xCe +xH 2O +xCO 2――→900 ℃
②
mCeO 2+xH 2+xCO 下列说法不正确的是( ) A .该过程中CeO 2没有消耗
B .该过程实现了太阳能向化学能的转化
C .图中ΔH 1=ΔH 2+ΔH 3
D .以CO 和O 2构成的碱性燃料电池的负极反应式为CO +4OH --2e -===CO 2-
3+2H 2O
3. [2013·山东卷] 对于反应CO(g)+H 2O(g)
CO 2(g)+H 2(g) ΔH <0,在其他
条件不变的情况下( )
A .加入催化剂,改变了反应的途径,反应的ΔH 也随之改变
B .改变压强,平衡不发生移动,反应放出的热量不变
C .升高温度,反应速率加快,反应放出的热量不变
D .若在原电池中进行,反应放出的热量不变
4. [2013·新课标全国卷Ⅱ] 在1200 ℃时,天然气脱硫工艺中会发生下列反应:
H 2S(g)+3
2O 2(g)===SO 2(g)+H 2O(g) ΔH 1;
2H 2S(g)+SO 2(g)===3
2S 2(g)+2H 2O(g) ΔH 2;
H 2S(g)+1
2O 2(g)===S(g)+H 2O(g) ΔH 3;
2S(g)===S 2(g) ΔH 4。
则ΔH 4的正确表达式为( )
A .ΔH 4=23(ΔH 1+ΔH 2-3ΔH 3)
B .ΔH 4=2
3
(3ΔH 3-ΔH 1-ΔH 2)
C.ΔH4=3
2
(ΔH1+ΔH2-3ΔH3) D.ΔH4=
3
2
(ΔH1-ΔH2-3ΔH3)
5.[2013·北京卷] 下列设备工作时,将化学能转化为热能的是( )
6.[2013·江苏卷] 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。
它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。
相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1 CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=______________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是__________。
7. [2013·浙江卷] 捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
8.[2013·安徽卷] X 、Y 、Z 、W 是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(4)在25 ℃、101 kPa 下,已知13.5 g 的Z 固体单质在Y 2气体中完全燃烧后恢复至原状态,放热419 kJ ,该反应的热化学方程式是__________________________________。
9. [2013·广东卷] 大气中的部分碘源于O 3对海水中I -
的氧化。
将O 3持续通入NaI 溶液中进行模拟研究。
(1)O 3将I -
氧化成I 2的过程由3步反应组成: ①I -
(aq)+O 3(g)===IO -
(aq)+O 2(g) ΔH 1; ②IO -
(aq)+H +
(aq) == HOI(aq) ΔH 2;
③HOI(aq)+I -
(aq)+H +
(aq) == I 2(aq)+H 2O(l) ΔH 3。
总反应的化学方程式为____________________________________________ 其反应热ΔH =________。
10. [2013·天津卷] 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM 2.5(直径小于等于2.5 μm 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。
因此,对PM 2.5、SO 2、NO x 等进行研究具有重要意义。
请回答下列问题:
(2)为减少SO 2的排放,常采取的措施有: ①将煤转化为清洁气体燃料。
已知:H 2(g)+1
2O 2(g)===H 2O(g)
ΔH =-241.8 kJ·mol -1
C(s)+12
O 2(g)===CO(g) ΔH =-110.5 kJ·mol -1
写出焦炭与水蒸气反应的热化学方程式:______________________________________ (3)汽车燃油不完全燃烧时产生CO ,有人设想按下列反应除去CO :
2CO(g)===2C(s)+O2(g)
己知该反应的ΔH>0,简述该设想能否实现的依据:_____________________________ ________________________________________________________________________。
11. [2013·北京卷] NO x是汽车尾气中的主要污染物之一。
(1)NO x能形成酸雨,写出NO2转化为HNO3的化学方程式:_______________________________________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
,其量变化示意图如下
①写出该反应的热化学方程式:_______________________________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NO x的排放。
①当尾气中空气不足时,NO x在催化转化器中被还原成N2排出。
写出NO被CO还原的化学方程式:_______________________________________________________。
12. [2013·新课标全国卷Ⅰ] 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。
由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)===CH3OH (g) ΔH1=-90.1 kJ·mol-1
(Ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。
工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是________________________________________ ________________________________________________________________________ (以化学方程式表示)。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。
