物质结构与性质高考试题
高考化学复习专题检测—物质结构与性质(含解析)

高考化学复习专题检测—物质结构与性质(含解析)一、选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意)1.(2023·黑龙江省绥化市第九中学高三质检)已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2=3S+2H2O,下列化学用语使用正确的是()A.SO2的VSEPR模型:B.HS-电离的离子方程式:HS-+H2O H2S+OH-C.基态硫原子p x轨道的电子云轮廓图:D.基态氧原子最外层电子的轨道表示式:【答案】C【解析】A项,二氧化硫中心原子S的价层电子对数为3,有1对孤电子对,S杂化类型为sp2,VSEPR模型为平面三角形,A错误;B项,HS-电离的离子方程式HS-H++S2-,B错误;C项,基态硫原子P x轨道的电子云轮廓为哑铃型,C正确;D项,基态氧原子最外层电子的轨道表示式:,D错误;故选C。
2.(2023·江苏省南京市江宁区高三期中)尿素CO(NH2)2是一种高效化肥,也是一种化工原料。
反应CO2+2NH3CO(NH2)2+H2O可用于尿素的制备。
下列有关说法不正确...的是()A.NH3与CO(NH2)2均为极性分子B.N2H4分子的电子式为C.NH3的键角大于H2O的键角D.尿素分子σ键和π键的数目之比为6∶1【答案】D【解析】A项,NH3分子为三角锥形,为极性分子,CO(NH2)2中的N原子与NH3中的N成键方式相同,所以二者均为极性分子,A正确;B项,N原子的最外层电子数为5个,要达到稳定结构,N2H4的电子式为:,B正确;C项,NH3分子中有3个σ键,1对孤电子对,H2O分子中有2个σ键和2对孤电子对,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以H2O的键角小于NH3中的键角,C正确;D项,1个单键1个σ键,1个双键1个σ键和1个π键,尿素中含有6个单键和1个双键,7个σ键和1个π键,尿素分子σ键和π键的数目之比为7∶1,D错误;故选D。
高考复习(化学)专项练习:物质结构与性质【含答案及解析】(B)

专题突破练七 物质结构与性质(B)一、选择题1.(2021广东广州一模)2020年我国北斗三号全球卫星导航系统正式开通,其中“铷(Rb)原子钟”被誉为卫星的“心脏”,下列有关说法错误的是( )A.铷元素位于第ⅠA 族B.铷的金属性比钠弱C .3785Rb 的中子数为48D .3785Rb 和 3787Rb 具有相同的电子数2.(2021 湖南岳阳质量检测二)用化学用语表示C 2H 2+HClC 2H 3Cl(氯乙烯)中的相关粒子,其中正确的是( )A.中子数为7的碳原子:67CB.氯乙烯的结构简式:CH 2CHClC.氯离子的结构示意图:D.HCl 的电子式:H +[··Cl ······]- 3.(双选)(2021山东聊城一模)研究发现,在CO 2低压合成甲醇反应(CO 2+3H 2CH 3OH+H 2O)中,Co 氧化物负载的Mn 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
下列关于该反应的说法中错误的是( )A.CO 2和Mn 都属于金属晶体B.CO 2和CH 3OH 分子中C 原子的杂化形式相同C.该反应利用了H 2的还原性D.干冰晶体中每个CO 2分子周围有12个紧邻分子 4.(2021山东菏泽一模)LiAlH 4是重要的还原剂与储氢材料,在120 ℃下的干燥空气中相对稳定,其合成方法为NaAlH 4+LiCl LiAlH 4+NaCl 。
下列说法正确的是( )A.该反应可以在水溶液中进行B.基态锂原子的电子排布式为1s 22s 1,核外电子的空间运动状态有2种C.LiAlH 4中Al 原子采用sp 3杂化,Al H 4-的空间结构为正方形D.上述所有物质中电负性最大的元素与电负性最小的元素形成的化合物,其电子式为Na +[··H]-5.(2021山东济南十一校联考)下列各组物质性质的比较,结论正确的是( )A.物质的硬度:NaCl<NaBr<NaIB.物质的沸点:AsH 3>PH 3>NH 3C.氢化物水溶液的酸性:HCl>HBr>HID.稳定性:BaCO 3>SrCO 3>CaCO 36.(2021北京丰台区一模)已知1~18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同电子层结构,下列关系正确的是()A.质子数:c>bB.离子的还原性:Y2->Z-C.氢化物的稳定性:H2Y>HZD.原子半径:X<W7.(2021辽宁丹东一模)下列有关晶体及配合物结构和性质的判断错误的是()贵金属磷化物Rh 2P 可用作电解水的高效催化剂,其立方晶胞如图所示该晶体中磷原子的配位数为配离子[Co(NO)]3-可用于检验K+的存在该离子中8.(2021辽宁葫芦岛第一次模拟)向CuSO4溶液中通入H2S,会生成CuS沉淀,反应为CuSO4+H2SCuS↓+H2SO4。
高考化学二轮复习专题五物质结构与性质

专题五物质结构与性质A组基础巩固练1.(2022北京海淀区一模)铋可改善钢的加工性能。
元素周期表中铋与砷(As)同主族,铋最稳定的同位素是Bi。
下列说法不正确的是( )A.Bi是第六周期元素B Bi的中子数是126C.Bi的原子半径比As的小D Bi和Bi具有相同的电子数2.(2022辽宁本溪一模)下列有关化学用语表示正确的是( )A.水分子的球棍模型:B.钾原子的结构示意图:C.Na2O2的电子式:Na+[]2-Na+D.中子数为20的氯原子Cl3.(2022广东梅州一模)为纪念元素周期表诞生150周年,IUPAC向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。
中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。
下列说法正确的是( )A.S6与S8互为同位素B Hg的中子数为118C.NH3的电子式为H HD.金属汞的熔点高于硫黄4.(2022北京朝阳区一模)下列性质的比较,不正确的是( )A.酸性:H2SO4>H3PO4B.电负性:S<ClC.热稳定性:H2S>H2OD.第一电离能:S<O5.短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外电子只有一种自旋取向,Y、Z两种原子核外s能级上的电子总数与p能级上电子总数相等,W原子的价电子中,在不同形状的原子轨道中运动的电子数之比为2∶1。
下列说法不正确的是( )A.W的第一电离能比同周期相邻元素的小B.原子半径:r(X)<r(Y)<r(W)<r(Z)C.工业上电解熔融化合物ZY制备单质ZD.W的最高价氧化物是非极性分子6.(2022山东日照一模,改编)硼砂阴离子[B4O5(OH)4]2-的球棍模型如图所示,下列说法不正确的是( )A.B原子的杂化方式为sp2和sp3B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键C.硼砂阴离子呈链状结构,则阴离子间以氢键结合D.1、2原子之间的化学键为配位键7.(2022辽宁省名校联盟联考)Cu、Au能形成多种组成固定的合金,其中一种晶体的晶胞结构(立方体)如图所示,下列说法正确的是( )A.该晶体的化学组成可表示为CuAuB.与1个Cu原子距离最近的Au原子是4个C.Au填充了与之距离最近的Cu原子构成的正四面体空隙D.根据图中信息,铜原子a的分数坐标为(0.5,0.5,0.5)8.(2022湖南卷,5)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。
物质结构与性质高考题练习

《物质结构与性质》山东省07-11年高考题(07年) (1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有___________种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为。
在GaN晶体中,每个Ga原子与_____个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为_______。
在四大晶体类型中,GaN属于_________晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
(08年) 氮是地球上极为丰富的元素。
( l )Li3N 晶体中氮以N3-存在,基态N3-的电子排布式为。
( 2 ) N≡N 的键能为942kJ · mol-1,N一N单键的键能为247kJ·mol-1,计算说明N2中的键比键稳定(填"σ"或"π")。
( 3 ) (CH3)3 NH+和AlCl4-可形成离子液体。
离子液体由阴、阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂(填"大"或"小") ,可用作(填代号)。
a.助燃剂b."绿色"溶剂c.复合材料d.绝热材料( 4 ) X+中所有电子正好充满K、L、M 三个电子层,它与N3-形成的晶体结构如图所示。
X的元素符号是,与同一个N3-相连的X+有个。
(09年) C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为,微粒间存在的作用力是。
(3)氧化物MO的电子总数与SiC的相等,则M为(填元素符号)。
MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。
物质结构与性质化学试题

物质结构与性质化学试题2020.4相对原子质量:H:1 C:12 O:16 N :14 Na :23 Si :28 P :31 S :32 Zn :65第I 卷(选择题)一、选择题(本题包括20个小题,每小题3分,共60分,每题只有一个正确选项) 1. 化学科学需要借助化学专用语言来描述,下列关于基态原子或离子的表达式错误的是( ) A .Na +的结构示意图:B .Ge 的价电子排布图:C .Cr 的电子排布式: 1s 22s 22p 63d 44s 2D .Fe 2+的简化电子排布式: [Ar]3d 62.下列有关元素周期表及元素周期律的说法错误的是( )A .N 能层的能级数最多为3个B .Cu 元素在元素周期表的ds 区C .F 元素在同周期中电负性最大D .根据对角线规则,铍和铝的化学性质具有相似性3.价电子排布式为4d 55s 2的元素在周期表中的位置是( )A .第5周期ⅦB 族 B .第4周期Ⅶ族C .第5周期ⅦB 族D .第4周期ⅦB 族4. 下列各组顺序的排列不正确的是( )A . 第一电离能:He > O > P > Cu > NaB . 离子半径:F - > O 2- > Al 3+ > Na +C . 酸性强弱:H 2SiO 3 < H 2CO 3 < H 2SO 3 < HNO 3D . 碱性强弱:KOH > NaOH > Mg(OH)2 > Al(OH)35. 在以离子键为主的化学键中常含有共价键的成分。
下列各对原子形成化学键中共价键成分最少的是( )A . Li ,FB . Na ,FC . Na ,C1D . Mg ,O4s4p6. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:Ⅶ原子半径A<B;Ⅶ离子半径A>B;Ⅶ原子序数A>B;Ⅶ原子最外层电子数A<B;ⅦA 的正价与B的负价绝对值一定相等;ⅦA的电负性小于B的电负性;ⅦA的第一电离能小于B 的第一电离能。
2024年高考化学总复习卷:物质结构与性质

2024年高考化学总复习卷:物质结构与性质考生注意:1.本试卷共4页。
2.答卷前,考生务必用蓝、黑色字迹的钢笔或圆珠笔将自己的姓名、班级、学号填写在相应位置上。
3.请在密封线内作答,保持试卷清洁完整。
一、选择题(本题包括15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.下列各项叙述中正确的是()A.N、P、As的电负性随原子序数的增大而增大B.价电子排布为4s24p3的元素位于第四周期ⅤA族,是p区元素C.2p和3p轨道形状均为哑铃形,能量也相等D.氮原子的最外层电子排布图:答案B解析同主族元素从上到下,电负性逐渐减小,则N、P、As的电负性随原子序数的增大而减小,故A错误;价电子排布为4s24p3的元素有4个电子层,最外层电子数为5,位于第四周期ⅤA族,最后填充p轨道,是p区元素,故B正确;p轨道均为哑铃形,离原子核越远,能量越高,2p轨道的能量低于3p轨道,故C错误;利用“洪特规则”可知最外层电子排布图应为,故D错误。
2.(2020·山东菏泽高三期中)X、Y、Z、W是原子序数依次增大的四种短周期元素,Z元素的2p轨道上有两个成单电子。
A、B、C、D、E是由其中的两种或三种元素组成的化合物,A是淡黄色固体,F是Z元素的气体单质。
已知:A+B→D+F,A+C→E+F;25℃时0.1mol·L-1D溶液的pH为13。
下列判断错误的是()A.X与W属于同主族元素B.原子半径:W>Y>Z>XC.1.0L0.1mol·L-1E溶液中阴离子的总物质的量大于0.1molD.物质A中既含有离子键,又含有共价键,且阴阳离子个数比为1∶1答案D解析X、W分别是H、Na,属于同主族元素,故A正确;电子层数越多半径越大,电子层数相同,原子序数越大半径越小,原子半径:Na>C>O>H,故B正确;1L0.1mol·L-1碳酸第1页共15页。
高考复习(化学)专项练习:物质结构与性质【含答案及解析】(A)

专题突破练七物质结构与性质(A)一、选择题1.(2021北京石景山一模)下列关于元素及元素周期律的说法,正确的是()A.同主族元素的原子,最外层电子数相等且等于主族序数B.铝元素在周期表中位于第四周期ⅢA族C.410Be的原子核内中子数是10D.第117号元素Ts的非金属性强于Br2.(2021湖北八市联考)长征六号运载火箭将卫星送入预定轨道的过程中,提供动力的化学反应为C2H8N2+2N2O43N2+2CO2+4H2O。
下列说法错误的是()A.N2的电子式:··N︙︙N··B.CO2的空间填充模型:C.CO2是氧化产物D.电负性大小:O>N3.(2021湖北七市州教科研协作体联考)NF3与汞共热得到N2F2和一种汞盐,下列有关说法错误的是()A.NF3的空间结构为三角锥形B.N2F2的结构式为F—N N—FC.NF3的沸点一定高于NH3的沸点D.N2F2:分子存在顺反异构4.(2021湖北教科研协作体联考)一种用于治疗流行性感冒的药物的主要成分的结构简式如图。
下列关于该有机物的说法错误的是()A.分子中只有1个手性碳原子B.分子中共平面碳原子最多有7个C.键角α>βD.1 mol该有机物消耗Na与NaOH的物质的量之比为3∶25.(2021山东烟台诊断性测试)已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定错误的是()A.电负性:W>Z>Y>XB.气态氢化物熔、沸点:W > ZC.简单离子的半径:W>X>ZD.若X与W原子序数之差为5,则形成化合物的化学式为X3W26.(2021湖南永州第三次模拟)如表所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T 的单质常温下为液体。
下列说法错误的是()A.X、Y的单质均存在同素异形体B.Y、Z的简单氢化物的稳定性依次递增C.R的单质可用于制造半导体材料D.Y、Z、W元素简单阴离子的半径大小:Y>Z>W7.(2021辽宁葫芦岛第一次模拟)一种新型电池的电解质是由短周期主族元素组成的化合物,结构如右图所示。
选修3物质结构与性质 历年高考题
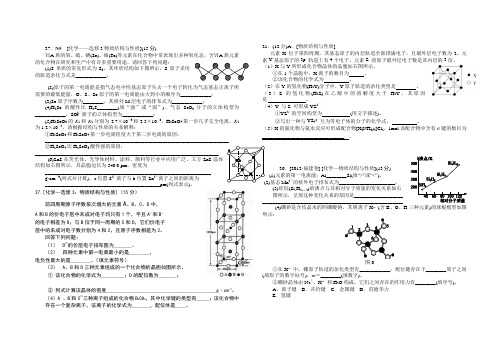
37.N5 [化学——选修3物质结构与性质](15分)ⅥA 族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA 族元素的化合物在研究和生产中有许多重要用途。
请回答下列问题:(1)S 单质的常见形式为S 8,其环状结构如下图所示,S 原子采用的轨道杂化方式是____________;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O 、S 、Se 原子的第一电离能由大到小的顺序为____________;(3)Se 原子序数为________,其核外M 层电子的排布式为____________;(4)H 2Se 的酸性比H 2S________(填“强”或“弱”)。
气态SeO 3分子的立体构型为____________,SO 2-3离子的立体构型为____________;(5)H 2SeO 3的K 1和K 2分别为2.7×10-3和2.5×10-8,H 2SeO 4第一步几乎完全电离,K 2为1.2×10-2,请根据结构与性质的关系解释:①H 2SeO 3和H 2SeO 4第一步电离程度大于第二步电离的原因:________________________________________________________________________ ②H 2SeO 4比H 2SeO 3酸性强的原因:________________________________________________________________________(6)ZnS 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。
立方ZnS 晶体结构如右图所示,其晶胞边长为540.0 pm ,密度为_________________________________________________________________g·cm -3(列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的距离为 _____________________________________________pm(列式表示)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质结构与性质高考试题1、(2014年四川)X、Y、Z、R为前四周期元素,且原子序数依次增大。
XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是_______ _____。
2、(2013四川)X、Y、Z、R为前四周期元素且原子序数依次增大。
X的单质与氢气可化合生成气体G,其水溶液pH>7;Y的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。
Y、Z分别与钠元素可形成化合物Q和J, J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀I;Z与氢元素形成的化合物与G反应生成M。
(1)M固体的晶体类型是。
(2)Y基态原子的核外电子排布式是;G分子中X原子的杂化轨道类型是。
(3)R的一种含氧酸根RO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是。
3、(2013安徽)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:(1)W位于元素周期表第周期第族;W的原子半径比X的(填“大”或“小”)。
(2)Z的第一电离能比W的(填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X 、Y 的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z 单质与盐酸反应后的无色溶液中滴加NaOH 溶液直至过量,能观察到的现象是________;W 的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 ________________________ 。
(4)在25°、101kpa 下,已知13.5g 的Z 固体单质在2Y 气体中完全燃烧后恢复至原状态,放热419kJ ,该反应的热化学方程式是 。
4、(2013山东)卤族元素包括F 、Cl 、Br 等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。
(2)利用“卤化硼法”可合成含B 和N 两种元素的功能陶瓷,下图为其晶体胞结构示意图,则每个晶胞中含有B 原子的个数为 ,该功能陶瓷的化学式为 。
(3)BCl 3和NCl 3中心原子的杂化方式分别为 和 。
第一电离能介于B 、N 之间的第二周期元素有 种。
(4)若BCl 3与XY n 通过B 原子与X 原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是 。
5、(2013·海南化学·)(14分)图A 所示的转化关系中(具体反应条件略),a 、b 、c 和d 分别为四种短周期元素的常见单质,其余均为它们的化合物,i 的溶液为常见的酸,a 的一种同素异形体的晶胞如图B 所示。
a b c d(1)图B对应的物质名称是,其晶胞中的原子数为,晶体类型为。
(2)d中元素的原子核外电子排布式为。
(3)图A中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为。
(4)图A中的双原子分子中,极性最大的分子是。
(5)k的分子式为,中心原子的杂化轨道类型为,属于分子(填“极性”或“非极性”)。
6、(大纲卷)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。
A和B、D、E均能形成共价型化合物。
A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
回答下列问题:(1)五种元素中,原子半径最大的是,非金属性最强的是(填元素符号);(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是(用化学式表示);(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为,其中存在的化学键类型为;(4)D最高价氧化物的水化物的化学式为;()单质E与水反应的离子方程式为。
7、(福建)(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:2NH3+3F2NF3+3NH4F①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体b.分子晶体c.原子晶体d.金属晶体②基态铜原子的核外电子排布式为____ ___。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:Cu①晶体Q中各种微粒间的作用力不涉及...___________(填序号)。
a.离子键b.共价键c.配位键d.金属键e.氢键f.范德华力②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚()具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子COOOH能形成分子内氢键。
据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
8、(2013江苏)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。
元素Y基态原子的3p轨道上有4个电子。
元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是。
(4)Y与Z可形成YZ42-①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为。
9、(2013全国2)前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
(1)D2+的价层电子排布图为______ 。
(2)四种元素中第一电离最小的是__ __,电负性最大的是___ _。
(填元素符号)(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_____ __;②列式计算该晶体的密度_____ __g·cm-3。
(1)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有__ __;该化合物中存在一个复杂离子,该离子的化学式为___ ____,配位体是___ _。
10、(2013全国1)硅是重要的半导体材料,构成了现代电子工业的基础。
(1)基态Si原子中,电子占据的最高能层符号,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。
工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。
Si与O 的原子数之比为化学式为1、(1)①1s22s22p4②Cl (2)①V形②O(3)2∶1 (4)2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++4OH-+6H2O2、(1)离子晶体;(2)1s2 2s2 2p6 3s2 3p4,sp3杂化;(3)Ksp(AgCl)<KSP(Ag2S),Ag2S的溶解度小于AgCl的溶解度; (4)4 Fe O42-+20H+==4Fe3++3O2↑+10H2O.3、(1)三NA 小(2)小分子间作用力(范德华力)甲醛(甲酸)(3)先产生白色沉淀,后沉淀溶解Si + 4HF = SiF4↑+ 2H2↑(4)2Al + 3 O2 =Al2O3△H= -1675KJmol4、(1)a (2)2;BN (3)sp2;sp3;3 (4)X5、[答案](1)金刚石8 原子晶体(2)1s22s22p63s23p5(3)H2O 分子间形成氢键V形(或角形)sp3(4)HCl (5)COCl2sp2极性6、(1)Na(1分)Cl (1分)(2)PH3(2分)(3)NH4Cl(2分)离子键和共价键(2分)(4)H3PO4(2分)(5)Cl2+H2O=H++Cl-+HClO(2分)7、参考答案:(1)(2)①a、b、d②1s22s22p63s23p63d104s1或[Ar]3d104s1(3)①a、d ②三角锥型sp3(4)< COOOH中形成分子9.[2014·重庆卷] 月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为_________ __;SiO2的晶体类型为_____ ___。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。
若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(2)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
10.[2014·浙江卷] 某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。
