吸收液
吸收液

H2S吸收液:4.3g硫酸铬,0.3gNAOH,10.0g聚乙烯醇磷酸铵分别溶解,导入1000mI容量瓶,强烈振摇,定容。
长时间放置形成白色悬浮液,每次使用前摇匀。
H2S显色液:1,对氨基二甲基苯胺溶液储备液:量取50mI浓硫酸,缓慢加入30mI水中,放冷后,称量12g对氨基二甲基苯胺盐溶于硫酸溶液中,置于冰箱中,可保存一年。
使用液:量取2.5mI储备液,用1+1硫溶液稀释至100mI。
三氯化铁:称取100g三氯化铁(FecI3·6H2O)溶于水,稀释至100mI,若有沉淀,需过滤。
2,混合显色液:临用时,按1mI对氨基二甲基苯胺使用液和1滴(0.04mI)三氯化铁溶液的比例相混合,若出现沉淀,应弃之不用。
(以上均放入棕色试剂瓶中)NO2吸收液:5.0g对氨基苯磺酸于1000mI容量瓶,用热水400mI溶解,冷却后加50.0mI冰乙酸+0.05gN-1奈乙胺盐酸盐,定容,然后4:1稀释。
(棕色试剂瓶)SO2吸收液:吸取36%~38%的甲醛溶液5.5mI,浓度为0.05moI/L环己二胺四乙酸二钠溶液20.0mL,称取2.04g邻苯钾酸氢钾,溶于少量水中,将三种溶液混合,再用水稀释至100mI,贮存于冰箱保存。
SO2使用液:0.6g氨基磺酸于100mL容量瓶,再加4mL 1.5mo I/LNaoH溶解,定容。
(氨磺酸钠溶液)CS2吸收液:1,乙酸铜-乙醇溶液称量0.05g乙酸铜,溶解于少量无水乙醇中,移入100mL容量瓶中,并用无水乙醇稀释至标线混合。
2,吸取乙酸铜-乙醇溶液10mL于500mL容量瓶中,依次加入无水乙醇300mL,二乙胺2.5mL和乙醇胺2.5mL,并用无水乙醇稀释至标线。
(棕色试剂)NH3吸收液:取500mL容量瓶加入适量一级水(多半),取0.14mL浓硫酸=0.01mo l/L硫酸移入到容量瓶中,再用一级水稀释至标线转入白色试剂瓶中。
甲醇吸收液:取1000mL一级水加入1000mL的试剂瓶中(白色)。
吸收液配置详细表(理化室)
缓冲液(pH=6.8):称取6.80g磷酸二氢钾,7.10g无水磷酸
氢二钠,溶于水,稀释到1L。
吸收液 体积(ml)
9.00ml
吸收瓶 多孔波板吸收管
吸收液 取适量储备液用磷酸盐缓冲液稀释成每毫升相
当于2.5μg(或5.0μg)此溶液20℃以下暗处可保存一个
月
储备
液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到
氯化氢
职业卫生
氟化氢
职业卫生
配制气体一览表
吸收液/膜
吸收液 靛蓝二磺酸钠溶液:量取25.00ml靛蓝二磺酸
钠储备液,用磷酸盐缓冲液稀释到1L棕色容量瓶中,冰
箱内储放可使用1个月。
储
备液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到
500ml棕色容量瓶中,在室温暗处存放24h后标定。标定
后的溶液在冰箱内可稳定1月。磷酸盐
有组织:125ml多 有组织:50.0ml 孔波板吸收瓶 无组织:10.0ml 无组织:10mlU型
多孔波板吸收管
A:碳酸钠+碳酸氢钠吸收液 B:微孔滤膜(0.8μm)
A:5.0 B:/
A:多孔波板吸收管 B:/
微孔滤膜(0.8μm) 碳酸钠+碳酸氢钠吸收液
/
/5Biblioteka 0多孔波板吸收管碳酸钠+碳酸氢钠吸收液
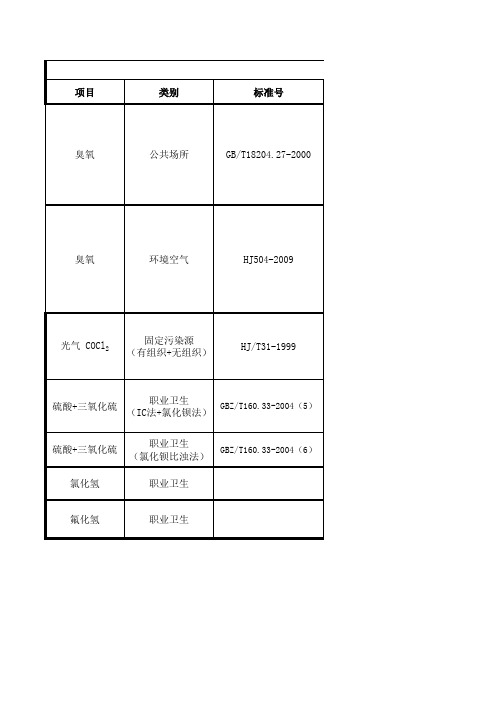
项目
类别
标准号
臭氧
公共场所
GB/T18204.27-2000
配制气体一览表
臭氧
环境空气
HJ504-2009
光气 COCl2
固定污染源 (有组织+无组织)
HJ/T31-1999
硫酸+三氧化硫
职业卫生 (IC法+氯化钡法)
吸收液配置详细表

硫酸+三氧化硫 氯化氢
GBZ/T160.33-2004(6)
氟化氢
职业卫生
列3
吸收液/膜
吸收液 靛蓝二磺酸钠溶液:量取25.00ml靛蓝二磺酸 钠储备液,用磷酸盐缓冲液稀释到1L棕色容量瓶中,冰 箱内储放可使用1个月。 储 备液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到 500ml棕色容量瓶中,在室温暗处存放24h后标定。标定 后的溶液在冰箱内可稳定1月。磷酸盐 缓冲液(pH=6.8):称取6.80g磷酸二氢钾,7.10g无水磷酸 氢二钠,溶于水,稀释到1L。 吸收液 取适量储备液用磷酸盐缓冲液稀释成每毫升相 当于2.5μ g(或5.0μ g)此溶液20℃以下暗处可保存一个 月 储备 液:称取0.25gIDS(靛蓝二磺酸钠)溶于水,稀释到 500ml棕色容量瓶中,在室温暗处存放24h后标定。标定 后的溶液在20℃下暗处存放可稳定2周。 磷酸盐缓冲液(c=0.050mol/L):称取6.80g磷酸二氢 钾,7.10g无水磷酸氢二钠,溶于水,稀释到1L。
配制气体一览表
项目
列1
类别
列2
标准号
臭氧
公共场所
GB/T18204.27-2000
臭氧
环境空气
HJ504-2009
光气 COCl2
固定污染源 (有组织+无组织)
HJ/T31-1999
硫酸+三氧化硫
职业卫生 GBZ/T160.33-2004(5) (IC法+氯化钡法) 职业卫生 (氯化钡比浊法) 职业卫生
列4
吸收液 体积(ml)
列5
吸收瓶
9.00ml
多孔波板吸收管
10.00±0.02ml
多孔波板吸收管
化工原理实验报告_吸收

化工原理实验报告_吸收
实验名称:吸收实验
实验目的:
1. 掌握吸收塔的操作方法;
2. 熟悉吸收塔的工作原理;
3. 了解吸收塔在化工过程中的应用。
实验原理:
吸收是指将气体中的某种成分溶解在液体中的过程。
在工业生产中,吸收常用于气体分离和净化。
吸收塔是常用的吸收装置,常见的吸收塔有塔板吸收塔和填料吸收塔两种类型。
实验仪器及材料:
1. 塔式吸收塔;
2. 气源;
3. 转子流量计;
4. 吸收液;
5. 相应的连接管道。
实验步骤:
1. 将吸收液倒入吸收塔中,注意液位不要过高;
2. 连接气源至吸收塔的底部,控制气源流量;
3. 打开气源,调节气源流量;
4. 连接转子流量计并调节流量;
5. 观察吸收液的变化并记录实验数据。
实验数据记录和分析:
根据实验步骤所得到的数据,可以计算出气体吸收的效率和吸收塔的传质系数。
根据数据分析,可以得到吸收塔的工作效果和适用范围。
实验结果和结论:
通过实验可以得到气体吸收的效率和吸收塔的传质系数,进而评估吸收塔的性能。
根据实验结果,可以判断吸收塔是否适用于化工过程中的气体分离和净化。
根据实验结果和结论,可以调整吸收塔的操作方法和参数,进一步优化吸收塔的性能。
实验注意事项:
1. 操作吸收塔时需注意安全,避免发生意外事故;
2. 控制气源流量时需谨慎,避免发生压力过大或流量过大的情况;
3. 实验结束后,及时清洗吸收塔和相关设备。
化工单元操作-传质过程(吸收)

• 2.解吸方法 • 解吸方法有汽提解吸、减压解吸、加热解吸、
加热减压解吸。工程上很少采用单一的解吸方 法,往往是先升温再减压至常压,最后采用汽 提法解吸。 • (1)汽提解吸 也称为载气解吸法。 • 向解吸塔中通入不含溶质的惰性气体或溶剂蒸 气等气体,降压液面上溶质气体的分压,使吸 收剂中溶质气体更完全的解吸出来,常以空气 、氮气、二氧化碳、水蒸气、吸收剂蒸气作为 载气。
经济上:X 2L (1.1 ~ 2.0)Lmin
4、塔内返混
吸收塔内气液两相可因种种原因造成少量流体发生
与主流提方向相反的流动,这一现象称为返混。
传质设备发生返混会使传质推动力下降、效率降低
或填料层高度增加。
5、吸收剂是否再循环
吸收剂再循环会降低吸收推动力,使填料层 高度加大,但当喷淋密度不足以保证填料的 充分润湿时,必须采用溶剂再循环。
• 第五节 解吸和吸收流程
一、基本概念——解吸
• 从吸收液中分离岀已被吸收的气体吸收 质的操作称为解吸。显然,解吸与吸收 是相反的过程。生产中解吸的作用有两 个:一个是把吸收剂中吸收的气体重新 释放出来,获得高纯度的吸收质气体; 另一个是使吸收剂释放了被吸收的气体 ,使吸收剂从新具有吸收作用,再返回 吸收塔循环使用,节约操作费用。
1、液气比
操作线斜率L/V称为液气比,是吸收剂与惰性气体摩 尔流量之比,反映了单位气体处理量的吸收剂消 耗量的大小。
当气体处理量一定时,确定吸收剂用量就是确定液 气比,是一个重要参数。
吸收液配制方法
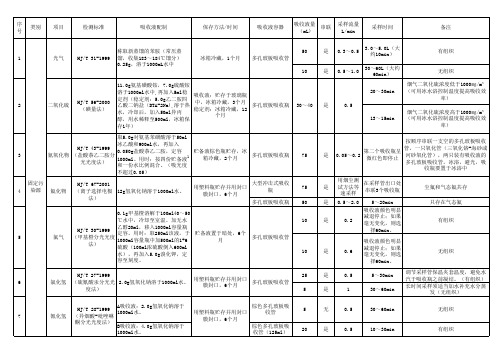
75
是
按顺序串联一支空的多孔玻板吸收 管,一只氧化管(三氧化铬-海砂或 第二个吸收瓶呈 0.05~0.2 河砂氧化管),两只装有吸收液的 微红色即停止 多孔玻板吸收管,冰浴,避光,吸 收瓶要置于冰浴中 用烟尘测 在采样管出口处 试方法等 串联3个吸收瓶 速采样 0.5~2.0 5~20min 吸收液颜色明显 减退停止;如果 0.2 毫无变化,则选 择60min。 吸收液颜色明显 减退停止;如果 毫无变化,则选 择60min。 5~30min 30~60min 尘氟和气态氟共存 只存在气态氟 有组织
有组织
是
0.5~1.0
无组织 烟气二氧化硫浓度低于1000㎎/m³ (可用冰水浴控制温度提高吸收效 率) 烟气二氧化硫浓度高于1000㎎/m³ (可用冰水浴控制温度提高吸收效 率)
2
二氧化硫
HJ/T 56-2000 (碘量法)
11.0g氨基磺酸铵,7.0g硫酸铵 溶于1000ml水中,再加入5ml稳 吸收液:贮存于玻璃瓶 定剂(稳定剂:5.0g乙二胺四 中,冰箱冷藏,3个月 乙酸二钠盐(DTA-2Na),溶于热 多孔玻板吸收瓶 稳定剂:冰箱冷藏,12 水,冷却后,加入50ml异丙 个月 醇,用水稀释至500ml,冰箱保 存1年)
/
大型气泡吸收管
5
是
0.5
15min
采样后,采集氯化汞的样品,立即 向每个吸收管加入0.5ml高锰酸钾溶 液摇匀。
19
称取4.0g对氨基苯磺酰胺、10g 酒石酸和100mg乙二胺四乙酸二 钠盐,溶于400mL热的水中。冷 多孔玻板吸收管 GB 12372-1990 却移入1L容量瓶中。加入 25℃暗处可稳定3个 (改进的Saltzman 100mLN-(1-萘基)乙二胺盐酸 月,若出现淡红色,表 二氧化氮 法) )——居住 盐储备液(0.45gN-(1-萘基) 示已被污染,应弃之重 区 乙二胺盐酸盐溶于500ml水 配。 中),混匀后,稀释定容至刻 大型多孔玻板吸 度。实验用水为无亚硝酸根离 收管 子二次蒸馏水。 GB/T 18204.22014(靛酚蓝分光 光度法) GB/T 18204.22014(纳氏试剂分 光光度法) 量取2.8ml浓硫酸加入水中,稀 释至1L。用时再稀释10倍。水 为无氨蒸馏水。 量取2.8ml浓硫酸加入水中,稀 释至1L。用时再稀释10倍。水 为无氨蒸馏水。 称取1.0g三乙醇胺,0.25g偏重 GB/T 16129-1995 亚硫酸钠和0.25g乙二胺四乙酸 (分光光度法)— 二钠溶于水中,定容1000ml。 —居住区 水为蒸馏水。 现配现用 大型气泡吸收管
化工原理少学时知识点

1、吸收分离的依据是什么?如何分类?答:依据是组分在溶剂中的溶解度差异。
(1)按过程有无化学反应:分为物理吸收、化学吸收(2)按被吸收组分数:分为单组分吸收、多组分吸收(3)按过程有无温度变化:分为等温吸收、非等温吸收(4)按溶质组成高低:分为低组成吸收、高组成吸收2、吸收操作在化工生产中有何应用?答:吸收是分离气体混合物的重要方法,它在化工生产中有以下应用。
①分离混合气体以回收所需组分,如用洗油处理焦炉气以回收其中的芳烃等。
②净化或精制气体,如用水或碱液脱除合成氨原料气中的二氧化碳等。
③制备液相产品,如用水吸收氯化氢以制备盐酸等。
④工业废气的治理,如工业生产中排放废气中含有NO SO等有毒气体,则需用吸收方法除去,以保护大气环境。
3、吸收与蒸馏操作有何区别?答:吸收和蒸馏都是分离均相物系的气—液传质操作,但是,两者有以下主要差别。
①蒸馏是通过加热或冷却的办法,使混合物系产生第二个物相;吸收则是从外界引入另一相物质(吸收剂)形成两相系统。
因此,通过蒸馏操作可以获得较纯的组分,而在吸收操作中因溶质进入溶剂,故不能得到纯净组分。
②传质机理不同,蒸馏液相部分气化和其相部分冷凝同时发生,即易挥发组分和难挥发组分同时向着彼此相反方向传递。
吸收进行的是单向扩散过程,也就是说只有溶质组分由气相进入液相的单向传递。
③依据不同。
4、实现吸收分离气相混合物必须解决的问题?答:(1)选择合适的溶剂(2)选择适当的传质设备(3)溶剂的再生5、简述吸收操作线方程的推导、物理意义、应用条件和操作线的图示方法。
答:对塔顶或塔底与塔中任意截面间列溶质的物料衡算,可整理得上式皆为逆流吸收塔的操作线方程。
该式表示塔内任一截面上的气液相组成之间的关系。
式中L/V为液气比,其值反映单位气体处理量的吸收剂用量,是吸收塔重要的操作参数。
上述讨论的操作线方程和操作线,仅适用于气液逆流操作,在并流操作时,可用相似方法求得操作线方程和操作线。
应予指出,无论是逆流还是并流操作,其操作线方程和操作线都是通过物料衡算得到的,它们与物系的平衡关系、操作温度与压强及塔的结构等因素无关。
吸收液配制方法.docx

序类别项目检测标准吸收液配制保存方法 / 时间号称取新蒸馏的苯胺(常压蒸1光气HJ/T 31-1999馏,收集 183~184℃馏分)冰箱冷藏, 1个月0.25g ,溶于 1000mL水中11.0g 氨基磺酸铵, 7.0g 硫酸铵溶于1000ml水中, 再加入 5ml稳吸收液:贮存于玻璃瓶定剂(稳定剂: 5.0g 乙二胺四HJ/T 56-2000中,冰箱冷藏, 3个月2二氧化硫乙酸二钠盐( DTA-2Na),溶于热(碘量法)稳定剂:冰箱冷藏, 12水,冷却后,加入 50ml异丙个月醇,用水稀释至 500ml,冰箱保存1年)取5.0g 对氨基苯磺酸溶于 50mlHJ/T 43-1999冰乙酸和 900ml水,再加入0.050g盐酸萘乙二胺,定容贮备液棕色瓶贮存,冰3氮氧化物(盐酸萘乙二胺分11000ml。
用时:按四份贮备液箱冷藏, 2个月光光度法)和一份水比例混合。
(吸光度不超过 0.05 )固定污HJ/T 67-2001用塑料瓶贮存并用封口4染源氟化物(离子选择电极12g氢氧化钠溶于 1000ml水。
膜封口, 6个月法)0.1g 甲基橙溶解于 100ml40~50℃水中,冷却至室温。
加无水HJ/T 30-1999乙醇20ml,移入 1000ml容量瓶定容。
用时:取 250ml该液,于贮备液置于暗处, 6个5氯气(甲基橙分光光度1000ml容量瓶中加 500ml的1+6月法)硫酸( 100ml浓硫酸倒入 600ml水),再加入 5.0g 溴化钾,定容至刻度。
HJ/T 27-1999用塑料瓶贮存并用封口6氯化氢(硫氰酸汞分光光 2.0g 氢氧化钠溶于 1000ml水。
膜封口, 6个月度法)HJ/T 28-1999A吸收液: 2.0g 氢氧化钠溶于1000ml水。
用塑料瓶贮存并用封口7氰化氢(异烟酸 - 吡唑啉膜封口, 6个月酮分光光度法)B吸收液: 4.0g 氢氧化钠溶于1000ml水。
吸收液容器吸收液量串联采样流量采样时间备注(mL)L/min50是0.3 ~0.53.0 ~5.0L (大有组织约10min)多孔玻板吸收管10是0.5 ~1.030~60L(大约无组织60min)烟气二氧化硫浓度低于 1000㎎/m320~30min(可用冰水浴控制温度提高吸收效率)多孔玻板吸收瓶30~40是0.5烟气二氧化硫浓度高于 1000㎎/m313~15min(可用冰水浴控制温度提高吸收效率)按顺序串联一支空的多孔玻板吸收第二个吸收瓶呈管,一只氧化管(三氧化铬 - 海砂或多孔玻板吸收瓶75是0.05 ~0.2河砂氧化管),两只装有吸收液的微红色即停止多孔玻板吸收管,冰浴,避光,吸收瓶要置于冰浴中大型冲击式吸收用烟尘测在采样管出口处75是试方法等尘氟和气态氟共存瓶串联3个吸收瓶速采样多孔玻板吸收瓶50是0.5 ~2.05~20min只存在气态氟吸收液颜色明显10是0.2减退停止;如果有组织毫无变化,则选择60min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
创新助手平台提供
北京万方软件股份有限公司
Hale Waihona Puke 2014-06-18报告目录
报告核心要素......................................................................................................... I 一、主题简介........................................................................................................ 1 二、主题相关科研产出总体分析........................................................................ 1 2.1 文献总体产出统计 ................................................................................ 1 2.2 学术关注趋势分析 ................................................................................ 2 三、主题相关科技论文产出分析........................................................................ 2 3.1 中文期刊论文 ........................................................................................ 2 3.1.1 近十年中文期刊论文分布列表 ................................................. 2 3.1.2 中文期刊论文增长趋势 ............................................................. 3 3.1.3 发文较多期刊 ............................................................................. 4 3.1.4 发文较多的机构 ......................................................................... 4 3.1.5 发文较多的人物 ......................................................................... 7 3.1.6 核心期刊分布数量对比 ............................................................. 7 3.1.7 最近相关中文期刊论文 ............................................................ 11 3.1.8 被引较多的相关期刊论文 ........................................................ 16 3.2 学位论文 .............................................................................................. 24 3.2.1 近十年学位论文年代分布列表 ............................................... 24 3.2.2 学位论文增长趋势 ................................................................... 25 3.2.3 硕博学位论文数量对比 ........................................................... 25 3.2.4 发文较多的机构 ....................................................................... 26 3.2.5 发文较多的人物 ....................................................................... 29 3.2.6 最近相关学位论文 ................................................................... 31 3.3 中文会议论文 ...................................................................................... 35 3.3.1 近十年中文会议论文年代分布列表 ....................................... 35 3.3.2 中文会议论文增长趋势 ........................................................... 36 3.3.3 中文会议论文主办单位分布 ................................................... 36 3.3.4 发文较多的机构 ....................................................................... 37 3.3.5 发文较多的人物 ........................................................................ 41 3.3.6 最近相关中文会议论文 ............................................................ 44 3.4 外文期刊论文 ...................................................................................... 49 3.4.1 近十年外文期刊论文年代分布列表 ....................................... 49 3.4.2 外文期刊论文增长趋势 ........................................................... 50 3.4.3 最近相关外文期刊论文 ........................................................... 50 3.5 外文会议论文....................................................................................... 50
