透明质酸测定试剂盒(上转发光法)产品技术要求热景
D-二聚体测定试剂盒(上转发光法)产品技术要求rejing

D-二聚体测定试剂盒(上转发光法)
适用范围:与本公司生产的上转发光免疫分析仪配套使用,用于体外定量测定人血浆样本中D-二聚体(D-dimer)的含量。
1.1规格:20人份/盒和40人份/盒。
1.2组成:
2.1 外观
2.1.1 液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.1.2 液体试剂的净含量应不少于标示值。
2.1.3 试纸条宽度应为4.0±0.1nm。
2.1.4 液体移行速度应不低于10mm/min。
2.2准确性
检测D—二聚体(D-dimer)纯品,其回收率应在(85%~115%)范围内。
2.3线性范围
[50,5000]ng/mL范围内,相关系数(r)应不低于0.9900。
2.4 精密度
2.4.1 批内变异系数(CV):分别检测(1000±100)ng/mL、(200±20)ng/mL 的样本,批内变异系数应均不高于15.0%。
2.4.2 批间变异系数(CV):检测(200±20)ng/mL的样本,批间变异系数应不高于15.0%。
2.5空白检测限
试剂盒空白检测限应不大于25ng/mL。
2.6 特异性
2.7 稳定性
本产品有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6项要求。
透明质酸(HA)测定试剂盒(化学发光免疫分析法)产品技术要求bf

透明质酸(HA)测定试剂盒(化学发光免疫分析法)
适用范围:用于体外定量测定人血清中透明质酸的含量。
1.1 本试剂盒由8种组分、封板膜、自封袋和说明书组合而成,由硬纸板包装盒进行包装。
8种组分中除HA包被板组分为真空包装的微孔板外,其他7种组分均为塑料瓶包装的液体组分。
试剂盒包装规格为96人份/盒,具体组成见表1:
表1试剂盒主要组成成分
2.1物理性能
液体组分应澄清,无沉淀或絮状物;所有组分应无包装破损。
各组分装量不少于表1中要求。
2.2准确性
回收率应在90.0~110.0%范围内。
2.3线性
用Log-Logit(四参数logistic、样条曲线)数学模型拟合,在20~1000ng/ml 范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4精密度
2.4.1批内精密度(CV%)应不高于15%。
2.4.2批间精密度(CV%)应不高于20%。
2.5最低检测限
应不大于10ng/ml。
2.6质控血清测定值
每次检测结果均应在允许范围内。
2.7特异性
检测浓度为2000ng/ml的LN结果不大于20ng/ml;
检测浓度为2000ng/ml的CIV结果不大于20ng/ml;
检测浓度为2000ng/ml的PIIINP结果不大于20ng/ml。
2.8稳定性
试剂盒在2~8℃保存12个月,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5要求。
透明质酸化学发光法103

透明质酸化学发光法103
透明质酸(Hyaluronic Acid)是一种高分子聚糖,常用于皮肤
保湿和填充等美容领域。
化学发光法是一种利用化学反应产生的荧光现象来进行分析的方法。
透明质酸化学发光法103(Hyaluronic Acid Chemiluminescence Assay 103)是一种用于检测透明质酸的化学发光法。
该方法
基于透明质酸与特定试剂之间的化学反应,产生的荧光信号与透明质酸的浓度呈正相关关系,可以通过测定荧光信号的强度来定量测定透明质酸的含量。
具体操作步骤如下:
1. 准备样品:将含有透明质酸的样品制备成适当的浓度。
2. 加入试剂:将透明质酸样品与特定的试剂混合,使其发生反应。
3. 反应产生荧光:试剂与透明质酸反应后,会产生荧光信号。
4. 测定荧光信号:使用荧光测定仪器,测量反应产生的荧光信号的强度。
5. 数据处理:根据测得的荧光信号强度,利用标准曲线等方法,计算出透明质酸的浓度。
透明质酸化学发光法103在透明质酸的检测中具有准确性和灵敏度高的优点。
然而,具体的试剂配方和操作步骤可能因不同的研究或应用领域而有所差异,需要根据具体的实验要求进行调整和优化。
透明质酸化学发光法103

透明质酸化学发光法103摘要:一、透明质酸概述二、透明质酸化学发光法原理三、透明质酸化学发光法的应用四、透明质酸化学发光法的优势与局限五、未来发展展望正文:透明质酸(Hyaluronic acid,简称HA)是一种广泛存在于生物体内的多糖,具有高度的生物相容性。
近年来,随着生物科技的不断发展,透明质酸在医学、化妆品、生物材料等领域得到了广泛应用。
透明质酸化学发光法作为一种检测透明质酸含量的方法,具有高灵敏度、高准确度、快速等特点,被越来越多地应用于科研和临床检测。
透明质酸化学发光法的原理是将透明质酸与特定试剂发生化学反应,产生发光信号。
通过测量发光信号的强度,可以推算出透明质酸的含量。
这种方法的优点在于,试剂与透明质酸的特异性结合,使得发光信号具有较强的抗干扰能力,提高了检测的准确性。
同时,化学发光法具有较高的灵敏度,可以检测到微量的透明质酸。
透明质酸化学发光法在医学领域有广泛的应用,如关节炎、皮肤老化、骨折等疾病的诊断和治疗。
在化妆品行业,透明质酸化学发光法可用于检测化妆品中透明质酸的含量,以确保产品的质量和功效。
此外,在生物材料研究中,透明质酸化学发光法也为研究透明质酸的结构与功能提供了有力支持。
尽管透明质酸化学发光法具有诸多优点,但仍存在一定的局限性。
例如,在实验过程中,发光信号的强度可能受到其他因素的干扰,如实验环境、仪器稳定性等。
此外,透明质酸化学发光法对于样品的前处理要求较高,有时会影响检测的效率。
在未来,随着技术的不断创新和发展,透明质酸化学发光法有望得到进一步优化。
例如,通过改进试剂的设计和优化实验条件,提高发光信号的稳定性和抗干扰能力;采用自动化仪器设备,提高检测的准确性和效率;将透明质酸化学发光法与其他检测方法相结合,实现对透明质酸的全方位研究。
总之,透明质酸化学发光法作为一种检测透明质酸含量的方法,具有较高的准确性和灵敏度,广泛应用于医学、化妆品和生物材料等领域。
透明质酸检验操作规程

透明质酸检验操作规程透明质酸(hyaluronic acid,简称HA)检验操作规程一、实验目的:通过透明质酸检验,了解样品中透明质酸的含量,判断其质量和纯度。
二、实验原理:透明质酸是一种由N-乙酰-D-葡萄糖胺和D-葡萄糖醛酸通过β-1,3-和β-1,4-糖苷键连接而成的聚糖。
其含量的测定一般采用比色法或溶胀法。
三、实验材料:1. 透明质酸标准溶液2. 待测样品3. 0.1mol/L盐酸溶液4. 稀释剂5. 甲醇6. 氢氧化钠溶液7. 硫酸8. 硫酸铵四、实验步骤:1. 准备工作:(1)将透明质酸标准溶液稀释至一定浓度,制备浓度梯度。
(2)准备待测样品,确保其干燥和无杂质。
2. 比色法测定透明质酸含量:(1)取透明质酸标准溶液的一定体积,加入试管中。
(2)加入足够的稀释剂将溶液稀释至合适浓度。
(3)加入甲醇溶液溶解样品,使其溶解均匀。
(4)加入适量的氢氧化钠溶液,使溶液呈现碱性。
(5)加入硫酸铵溶液,使溶液呈现酸性。
(6)酸性溶液与盐酸溶液反应生成甲胺。
(7)甲胺与硫酸反应生成氮气。
(8)利用氮气生成的浑浊度与透明质酸含量成正比关系,通过比色计测定溶液的浑浊度。
(9)将待测样品按照相同的步骤进行测定。
(10)根据透明质酸标准曲线,计算出待测样品中透明质酸的含量。
3. 溶胀法测定透明质酸含量:(1)取一定量的待测样品,加入容量瓶中。
(2)加入足够的溶胀剂溶解样品,使其溶解均匀。
(3)将容量瓶体积定至一定体积,充分摇匀。
(4)取一定体积的溶液进行取样。
(5)通过比重计或其他方法测定样品的溶液密度。
(6)将样品的溶液密度与标准溶液的溶液密度进行比较,根据比例关系计算出透明质酸的含量。
五、实验注意事项:1. 实验过程应严格按照操作规程进行,避免误差的产生。
2. 透明质酸标准溶液的稀释要根据实验需求进而进行,避免过高或过低的浓度对实验结果的影响。
3. 样品的制备要求干燥和纯净,避免水分和杂质的干扰。
4. 比色法和溶胀法的选择要根据实验要求进行,确保结果的准确性。
透明质酸ELISA试剂盒说明书

透明质酸ELISA试剂盒产品编号:SEKH-0509该试剂盒用于定量检测血清、血浆或细胞上清等样本中Hyaluronan的浓度仅供研究,不用于临床诊断订购热线:400-968-6088﹡技术支持邮箱:公司官网:目录背景介绍 (1)检测原理 (1)检测原理图 (2)注意事项 (2)技术要点 (3)试剂盒组成及储存 (4)自备实验器材(不提供,可代购) (4)样本收集及储存 (5)试剂准备 (6)检测步骤 (8)操作流程图 (10)结果计算 (11)典型数据 (11)常见问题及解决方法 (14)相关产品 (15)发表优秀文献 (15)透明质酸,又称透明质酸(HA)或透明质酸钠,是一种天然存在的线性聚合物。
透明质酸是一种糖胺聚糖(GAG),广泛存在于所有脊椎动物的细胞外基质中,也存在于链球菌的某些菌株的囊中。
哺乳动物透明质酸是由三种不同的透明质酸合成酶(HAS1、2和3)之一合成的,它们产生不同链长和不同合成速率的HA聚合物。
高分子量HA(>;500kDa)具有抗血管生成、抗炎和免疫抑制作用,低分子量HA(10-500kDa)具有高血管生成和促炎作用。
HA寡聚体具有抗凋亡和上调热休克蛋白表达的作用。
在功能上,透明质酸分子对于维持组织中高度水化的细胞外基质很重要,它参与细胞粘附,支持细胞迁移。
检测原理Solarbio(Solarbio®)ELISA试剂盒采用基于双抗体夹心法的酶联免疫吸附检测技术。
将抗Hyaluronan单克隆抗体包被在酶标板上;分别加入梯度稀释的标准品和预稀释的样本,标准品和样本中的Hyaluronan 会与酶标板上的包被抗体充分结合;洗板后加入生物素化抗Hyaluronan 抗体,该抗体会与板子上包被抗体捕获的标准品和样本中的Hyaluronan 发生特异性结合;洗板后加入辣根过氧化物酶(HRP)标记的链霉亲和素,生物素与链霉亲和素会发生高强度的非共价结合;洗板后加入显色剂底物TMB,若反应孔中样品存在不同浓度的Hyaluronan,则HRP会使无色TMB变成不同深浅(正相关)的蓝色物质,加入终止液后反应孔会变成黄色;最后,在λmax=450nm(OD=450nm)处测定反应孔样品吸光度(OD),样本中的Hyaluronan浓度与OD成正比,通过绘制标准曲线和四参数拟合软件便可计算出样本中Hyaluronan的浓度。
透明质酸(HA)测定试剂盒(磁微粒化学发光法)产品技术要求lideman

透明质酸(HA)测定试剂盒(磁微粒化学发光法)适用范围:该产品用于体外定量测定人血清样本中的透明质酸(HA)含量。
1.1 规格100测试/盒50测试/盒。
1.2 主要组成成分试剂盒由试剂1、试剂2、磁分离试剂、校准品和质控品组成。
校准品和质控品浓度具有批特异性,具体浓度见瓶标签。
2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应澄清,无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2准确度回收率应在85.0%~115.0%范围内。
2.3最低检测限应不大于20.0ng/mL。
2.4线性在(20.0,1500.0)ng/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.5重复性用(200.0±40.0)ng/mL和(1000.0±200.0)ng/mL的样本各重复检测10次,变异系数(CV)应不大于10.0%。
2.6批间差用三个不同批号的试剂盒分别检测(200.0±40.0)ng/mL和(1000.0±200.0)ng/mL的样本,重复检测10次,其批间变异系数应≤15%。
2.7质控品的赋值有效性质控品的测量值应在质控范围内。
2.8 稳定性试剂盒在2℃~8℃条件下储存,有效期为12个月,在有效期满后一个月内的任一天检测试剂盒的准确度、最低检测限、线性、重复性和质控品的赋值有效性,应符合2.2、2.3、2.4、2.5和2.7的要求。
2.9溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,校准品溯源至企业标准品,企业标准品与已上市产品比对赋值。
透明质酸(HA)测定试剂盒(化学发光法)产品技术要求科美
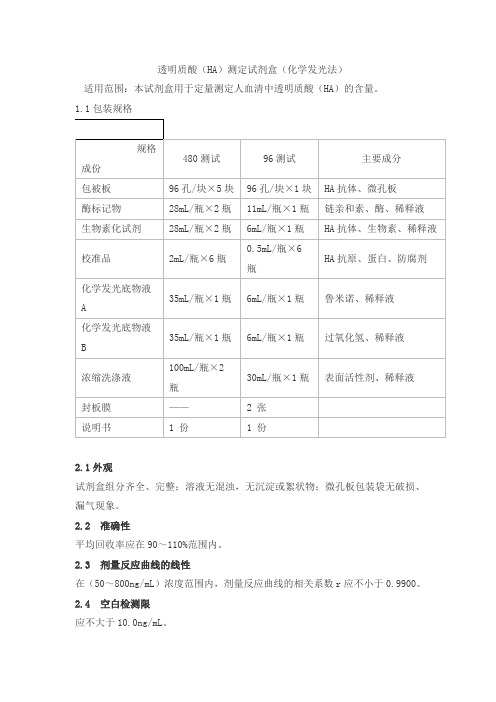
透明质酸(HA)测定试剂盒(化学发光法)
适用范围:本试剂盒用于定量测定人血清中透明质酸(HA)的含量。
1.1包装规格
2.1外观
试剂盒组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2 准确性
平均回收率应在90~110%范围内。
2.3 剂量反应曲线的线性
在(50~800ng/mL)浓度范围内,剂量反应曲线的相关系数r应不小于0.9900。
2.4 空白检测限
应不大于10.0ng/mL。
2.5精密度
2.5.1分析内精密度
测定QC血清,变异系数(CV)应小于15.0%。
2.5.2分析间精密度
测定QC血清,变异系数(CV)应小于20.0%。
2.6批间差
用三个批号的试剂盒,分别测量同一质控血清,变异系数(CV)应小于20.0%。
2.7 质控血清测定值
应在允许的范围内。
2.8 特异性
2.8.1与人Ⅳ型胶原(IVC)的交叉反应
检测浓度为640 ng/mL的IVC,测定值应小于6 ng/mL。
2.8.2与Ⅲ型前胶原N端肽(PⅢNP)的交叉反应
检测浓度为120 ng/mL的PⅢNP,测定值应小于6 ng/mL。
2.8.3与人层粘连蛋白(LN)的交叉反应
检测浓度为800 ng/mL的LN,测定值应小于6 ng/mL 。
2.9 稳定性
HA试剂盒在2~8℃避光保存,有效期12个月。
在HA试剂盒有效期满后2个月内,分别检测2.1、2.2、2.3、2.4、2.5.1、2.7项,结果应符合各项目的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
透明质酸测定试剂盒(上转发光法)
适用范围:用于体外定量测定人血清或血浆中透明质酸(HA)的含量。
1.1 包装规格:40人份/盒。
1.2 主要组成成分:
2.1 外观
液体组分应澄清透明、无沉淀或絮状物,铝箔袋应无破损漏气现象。
2.2 准确度
检测透明质酸(HA)纯品,其回收率应在(85%~115%)范围内。
2.3 线性
[5,1000]ng/mL范围内,相关系数(r)应不低于0.9900。
2.4 精密度
2.4.1 批内变异系数(CV)应不高于15.0%。
2.4.2 批间变异系数(CV)应不高于15.0%。
2.5 空白限
空白限应不大于5ng/mL。
2.6 特异性
与人血清白蛋白(HSA)、胆红素无显著交叉反应。
表1 与其它物质的交叉反应数据
2.7 溯源性
根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准信息的来源、赋值过程以及测量不确定度等内容,校准信息溯源至企业内部工作校准品,并与已上市产品比对赋值。
2.8 稳定性
本产品有效期18个月,取到效期产品在2个月内进行检测,测定结果应符合上述2.1、2.2、2.3、2.4、2.5、2.6项要求。
