第 2节电解2
第6单元 第2节 电能转化为化学能——电解

解析 答案
第六单元
考点一
考点二
第2节 电能转化为化学能——电解
核心考点分·分层层突突破破 体系构建·随堂演练
-13-
必备知识·自主预诊 关键能力·考向突破
关闭
用石墨作电极电解 KNO3 和 Cu(NO3)2 的混合溶液,阳极反应式为 4OH--4e- 2H2O+O2↑,阴极先后发生两个反应:Cu2++2e- Cu, 2H++2e- H2↑。从收集到 O2 为 2.24 L(标准状况下)这个事实可推 知电解过程中共转移 0.4 mol 电子,而在生成 2.24 L H2 的过程中转移 0.2 mol 电子,所以 Cu2+共得到 0.4 mol-0.2 mol=0.2 mol 电子,电解前 Cu2+的物质的量和电解得到的 Cu 的物质的量都为 0.1 mol。电解前
-17-
必备知识·自主预诊 关键能力·考向突破
电解原理在工业生产中的应用
1.电解饱和食盐水
(1)电极反应。
阳极:
2Cl--2e-==Cl2↑
阴极:
2H++2e-==H2↑
(2)总反应式。
(反应类型:氧化反应), (反应类型:还原反应)。
总反应方程式: 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 。
电子:从电源 负极 流出后,流向电解池的 阴极 ;从电解池
的 阳极 流出,流向电源的 正极 。
离子:阳离子移向电解池的 阴极 ,阴离子移向电解池的 阳极 。
第六单元
第2节 电能转化为化学能——电解
核心考点分·分层层突突破破 体系构建·随堂演练
-5-
考点一
高中化学第二节 第2课时 电解池学案

第二节电解池(第二课时)班级姓名小组[学习目标]1.通过对氯化铜溶液电解过程的分析,了解电解、电解池的概念,认识电解是电能转化为化学能的一种重要形式。
2.形成系统分析电解池的一种思路和方法,能初步设计简单的电解池。
[重点、难点]1.重点:电解池原理2.难点:电解池思维模型的建构[学业要求]利用电解池原理分析电解池[候课2分钟]阅读课本101-105页一、电解饱和食盐水烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做。
1.电解饱和食盐水的原理通电前:溶液中的离子是。
通电后:①移向阳极的离子是,比容易失去电子,被氧化成。
阳极:( 反应)。
②移向阴极的离子是,比容易得到电子,被还原成。
其中H+是由水电离产生的。
阴极:( 反应)。
③总反应:化学方程式为;离子方程式为。
2.氯碱工业生产流程工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行。
(1)阳离子交换膜电解槽(2)阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的与阳极产生的混合发生爆炸,也能避免与阴极产生的反应而影响氢氧化钠的产量。
3.氯碱工业的产品及其应用(1)氯碱工业的产品主要有 、 、 、 、 等。
(2)以电解饱和食盐水为原理的氯碱工业的产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中应用广泛。
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl --2e -===Cl 2↑( ) (2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区( ) (3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)( ) (4)电解饱和NaCl 溶液可以制取金属钠( ) (5)利用电解饱和食盐水可制得“84”消毒液( )在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。
新教材高中化学第4章第2节第2课时电解原理的应用课件新人教版选择性必修1ppt

4.电冶金 (1)金属冶炼的本质。 使矿石中的金属离子____获__得__电__子____变成金属单质的过程:Mn++ ne-═══M。 (2)电冶金。 电解是强有力的氧化还原手段,适用于制取一些__活__泼__金__属__单质, 如冶炼钠、钙、镁、铝等活泼金属。
(3)电解熔融的氯化钠。 阳极反应:___2_C_l_-_-__2_e_-_═__═_═__C_l_2↑_______; 阴极反应:___2_N__a_+_+__2_e_-_═__═_═_2_N__a____; 总反应:____2_N_a_C__l(_熔__融__)_═_电═_═解__═_2_N__a_+__C_l_2↑_____。
【解析】(1)铜极增重,说明银在铜极上析出,则铜极为阴极,X 为 负极。(2)C 中铜极增重 2.16 g,即析出 0.02 mol Ag,电路中通过 0.02 mol 电子。由 4e-~O2,可知 B 中产生的 O2 只有 0.005 mol,即 112 mL。但 B 中共收集到 224 mL 气体,说明还有 112 mL 气体是 H2,即 Cu2+全部 在阴极放电后,H+接着放电产生了 112 mL H2,则通过 0.01 mol 电子时, Cu2+恰好完全被还原。由 2e-~Cu,可知 n(Cu2+)=0.005 mol,则 c(CuSO4) =0.000.25 Lmol=0.025 mol·L-1。
(1)哪个装置是原电池?哪个装置是电解池? 【答案】甲 、乙构成原电池,丙是电解池。 (2)a、b、c、d电极名称分别是什么? 【答案】a是负极,b是正极,c是阳极,d是阴极。 (3)若模拟氯碱工业生产烧碱、氯气和氢气,如何选用电极材料和电 解质溶液? 【答案】c 电极用Pt或石墨,d电极用铁丝(导体均可),X溶液为饱 和食盐水。
高三一轮复习化学课件: 第2章 第2节 电解质 (共164张PPT)

式盐
在熔融状态下的电离方程式为 _N_a_H__S_O_4_=_=_=_N__a_+_+__H_S_O__- 4 ___
多元弱酸 第一步完全电离,其余部分电离,如 酸式盐 _N_a_H__C_O__3=_=_=__N_a_+_+__H_C__O_3-_、__H__C_O__- 3____H_+_+__C__O_23_-
质,C 正确;Fe(OH)3 和 H2O 都是弱电解质,D 错误。
2.有下列物质:①硫酸 ②食盐水 ③氯气 ④碳酸钡
⑤蔗糖 ⑥Al(OH)3 ⑦醋酸 ⑧铜 ⑨Na2O ⑩氨气
⑪CO2 ⑫NaHCO3 ⑬CH3COONH4 ⑭H2O2 其中属于电解质的是__①__④__⑥__⑦__⑨__⑫__⑬__⑭____,属于非电解 质的是___⑤__⑩__⑪_____,属于强电解质的是_① __④__⑨__⑫__⑬___, 属于弱电解质的是___⑥__⑦__⑭_____。
(4)强电解质溶液的导电性比弱电解质溶液的导电性强 ( × ) 解析:电解质溶液导电性的强弱与溶液中离子浓度的大小及所
带电荷数的多少有关,与电解质强弱没有必然联系。
(5)BaSO4 投入水中, 导电性较弱,故它是弱电解质 ( × )
解析:尽管 BaSO4 难溶于水,但溶解的部分全部电离,故其为
强电解质。
举例
强电解质
弱电解质
在水溶液中能_完__全__电离 在水溶液中_只__能__部__分__
第2节 电解原理

电 解 减小 质
考纲要求
1.了解电解池的工作原理 2.能写出电解池的电极反应式和电解总反应式 3.能进行有关电子转移的计算
复习回顾 1.电解质、电离、氧化反应、还原反应的定义?
电解质:在水溶液里或熔融状态下能够导电的化合物 电离:电解质在水溶液或熔化状态下离解成自由移动 的离子的过程 氧化反应:失去电子,化合价升高的反应; 还原反应:得到电子,化合价降低的反应。
电解 质溶 液复 原的 方法
2H++2e- 无氧酸 HCl ===H2↑
电解 电解 质型
2Cl-- 2HCl 2e- 通电 ===Cl2 ===== ↑ 2Cl--
H2↑+Cl2↑
不活泼 金属无 氧酸盐
Cu Cl2
Cu2++2e 2e- -===Cu ===Cl2 ↑
CuCl2 通电 ===== Cu+ Cl2↑
课堂小结:电解原理
1.能量——电能转化为化学能 反应实质——氧化还原反应 2.电极产物——氧化性、还原性强弱 电极反应式——守恒 3.溶液酸碱性的判断 4.电解复原问题
【当堂检测】
1.D 2.C 3.A 4.D
谢谢大家! 再见!
电极反应式 类 型 电解质 实例 特点 阴极 阳极
电解 电解 电 电解 质溶 质溶 解 方程 液浓 液复 对 式 度的 原的 象 变化 方法
3.最常用,最重要的放电顺序是:
阳极:Cl- > OH- 阴极:Ag+ > Cu2+ > H+
课堂探究
三、溶液酸碱性的判断方法
增大 减小
例3.D 变式训练2.B
课堂探究
四、电解质溶液的复原 使溶液的复原加入试剂原则:加入电解质溶液损 失的元素组成的物质
第二节电解学案2

第一章第二节电能转化为化学能——电解学案 2009.9.07学习目标:1.了解电解池的工作原理,能正确写出电极反应和电池反应方程式。
能够正确的判断阴极和阳极。
2.了解氯碱工业、铜的电解精炼、电镀工业的化学原理,以及在人类社会的价值和贡献。
学习的重、难点:能正确写出电极反应和电池反应方程式;能够正确的判断阴极和阳极。
知识梳理:一、电解原理1、电解池组成:交流 .研讨画出电解熔融氯化钠的装置示意图:思考:①接通电源后,熔融氯化钠中的Na+和Cl-各向那个方向移动?②移到两极表面的Na+和Cl-将发生什么变化?(1)的过程叫电解。
电解质的导电过程即是被的过程。
(2)的装置叫电解池。
电解池由、、组成,其中与外电源的正极相连的极板叫___极,发生反应;与外电源的负极相连的极板叫____极,发生反应。
思考:电解池有哪些构造?例题1.下列说法描述不正确的是()。
A.在电解池当中,阳离子移向移向阴极。
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁C.阳极是失去电子发生氧化反应D.与电源负极相连的是电解池的阴极2、电解池工作原理错误!未找到引用源。
电解通电时,电子从电源的_____极沿导线流入电解池的____极,在阴极区氧化性强的微粒先得电子,被_________。
同时,电子又从电解池的________流出,沿导线流回电源的正极,即在阳极区还原性强的微粒(包括电极本身)先_______电子被_______。
错误!未找到引用源。
当极板材料(阳极)为 Pt 或C时,还原性非常弱,此条件不被氧化称为______电极。
当极板材料(阳极)为Cu、Ag等金属(除了Pt和C),还原性强,易______电子,易被氧化称为_______电极。
二、电解原理应用1、电解饱和食盐水:用一根碳棒作阳极,一根铁棒作阴极,电解滴加有酚酞试液的饱和食盐水,阳极电极反应式为该极实验现象有如何验证阴、阳极的产物。
阴极电极反应式为该极实验现象有总反应式为:。
第2节 电能转变成化学能——电解
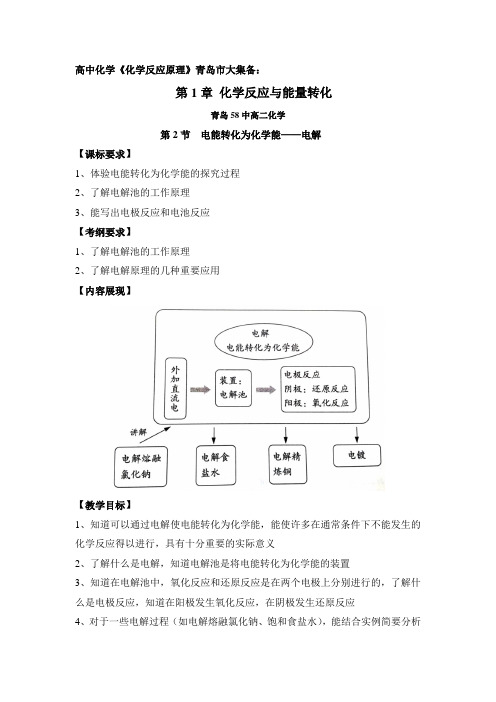
高中化学《化学反应原理》青岛市大集备:第1章化学反应与能量转化青岛58中高二化学第2节电能转化为化学能——电解【课标要求】1、体验电能转化为化学能的探究过程2、了解电解池的工作原理3、能写出电极反应和电池反应【考纲要求】1、了解电解池的工作原理2、了解电解原理的几种重要应用【内容展现】【教学目标】1、知道可以通过电解使电能转化为化学能,能使许多在通常条件下不能发生的化学反应得以进行,具有十分重要的实际意义2、了解什么是电解,知道电解池是将电能转化为化学能的装置3、知道在电解池中,氧化反应和还原反应是在两个电极上分别进行的,了解什么是电极反应,知道在阳极发生氧化反应,在阴极发生还原反应4、对于一些电解过程(如电解熔融氯化钠、饱和食盐水),能结合实例简要分析电解的工作原理,能根据所给出的离子放电序分析电极上发生的反应,写出相应的电极反应式5、能举例说明电解原理在氯碱生产、金属冶炼和电镀中的应用【重点难点】本节教材的重点是电解原理,难点是阴极和阳极以及电极反应的概念、正确书写电极反应式【教学方法】实验探究,演绎、归纳法【教学建议】1、电解原理中关于阴、阳两极上的放电原因的解释:与直流电源正极相连的电极带有正电荷,电势高,具有夺取电子的能力,发生氧化反应;与直流电源负极相连的电极带有负电荷,电势低,能给出电子,发生还原反应。
2、阴、阳两极的定义:发生氧化反应的电极叫做阳极,发生还原反应的电极叫做阴极,这在电极池和原电池中是统一的。
金属的防护中的牺牲阳极的阴极保护法这一名称就源于此。
3、电解食盐水过程的探究:要让学生体会到,①并不是所有离子都能在电极上放电,阳极上还原性强的离子先失去电子被氧化,阴极上氧化性强的离子先得到电子被还原。
②电极反应的发生使电极附近溶液组成发生变化。
③电极反应的产物和在电极附近溶液中富集的物质都是电解的产品。
另外水的电离平衡的移动尽量淡化,换做其他通俗的语言来描述。
4、惰性电极电解规律的总结:大胆放给学生,多练习几个例子(硫酸、氢氧化钠、硫酸钠,氯化铜、盐酸,硫酸铜、硝酸银等),让学生通过充分的练习和讨论得出规律:电解水型、电解电解质型、放氢生碱型、放氧生酸型四种类型电解规律。
高二化学电能转化为化学能—电解2

氯 气 实例
铜
CuCl2溶液
电极反应
浓度
PH 值 减 小
复原
CuCl2
阳极:2Cl- → Cl2↑ + 2e阴极:Cu2++ 2e- → 2Cu 电解 CuCl2 Cu+Cl2 ↑
减小
CuCl2
阳极
阴极 氢 气
浓度 PH 值 复原
氧 气
实例
Na2SO4溶液
电极反应
阳极: 4OH- → 4e- + 2H2O+O2 ↑ 阴极: 4H ++ 4e- → 2H2 ↑
+
-
e-
失 电 子
阳极
阳离子
阴极 得
电 子
氧
化 反 应
还 阴离子
原 反 应
这是电解熔融盐的情况。
电解电解质溶液又会发生什么反应呢?
下面以石墨为电极电解氯化铜溶液 为例来分析。
实验:用惰性(石墨)电极电解氯化铜溶液 现象: 阳极:有气泡,有 刺激性气味,并能使 湿润的KI-淀 粉试纸 变蓝(Cl2)
①、首先分析、比较出阴阳极的放电离子:
H+ < Cu2+ CuSO4 = Cu2++ SO4 2- 阴极: H2 O H++OH- 阳极: OH- > SO4 2-
++2e -→ H ↑ 2 H 阴极: 2 ②、然后写电极反应式 : 阳极: 2Cl- → Cl2↑ +2e-
③、两极半反应相加得总方程式;
第2节 电能转化为化学能----电解
一、电解原理
电解:在直流电的作用下,在两电极上分别发
生氧化反应和还原反应的过程叫做电解。
电解池:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解原理的应用——2.电镀
1.概念:利用电解原理在某些金属表面镀上一薄
层其他金属或合金的过程
2.目的:电镀可以使金属更加
- +
美观耐用,增强防锈抗腐能力
和增加表面硬度。
铜 片
3.电镀池构成条件
阳极:镀层金属 阴极:镀件
待 镀 铁 CuSO4 制 溶液 品
电镀液:含有镀层金属离子的电解质溶液
电解原理的应用——3.氯碱工业
小组 1 、 2、 3 、 4、 5后
用活性电极分别电解:1.粗铜当阳极、精铜当阴极电 解硫酸铜溶液。2.铜作阳极、铁做阴极电解硫酸铜溶 液。3.锌做阳极、铁做阴极电解硫酸锌溶液。画出装 9、8、 7前 置图、标记电极材料;写出电极反应式,并指出电 解质溶液浓度的变化。
【要求】1.脱稿展示
2.展示同学书写工整、迅速,按时完成
3.非展示同学全心投入学习, 找准疑问,做好探究准备。
电解原理的应用——1.电解精炼铜
1.粗铜精炼中,电极、电解质溶液怎样选择更科学? 阳极:粗铜 阴极:纯铜 电解质溶液:硫酸铜溶液
2.电解质溶液浓度变了吗?两电极质量改变相同吗? 电解质溶液中CuSO4的浓度略有下降。 阳极上:比铜活泼的金属:Zn、Fe、Ni只溶解,不析出; 比铜不活泼的金属:Au、Pt不溶解,而以单质沉积形成阳极泥; 阴极上:铜离子得电子析出。
+ 淡盐水
阳 极
Cl2
H;
阴 极
金属钛网
Na+ OH—
碳钢网
精制饱和 NaCl溶液
离子交换膜
H2O(含少量NaOH)
电解原理的应用——4.电冶金
• 由于电解是最强有力的氧化还原手段,所以电解 法是冶炼金属的一种重要的方法。对于冶炼像 Na、Ca、Mg、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
电解工作原理的应用
第二课时
1.能利用电解池工作原理准确书写氯碱工业等电极反 应式和电池反应式。 2.实验探究、合作交流电解原理在电解精炼、电镀中 的应用,体会电解对人类社会的重要贡献。
精炼铜 电镀金
氯碱工业
冶炼铝
电解原理应用展示内容
用惰性电极分别电解:氯化钠溶液、硫酸铜溶液、 硫酸钠溶液、氯化铜溶液、熔融氯化钠;画出装置 图、标记电极;写出电极反应式、总反应式;并指 出电极产物及电极附近溶液酸碱性的变化;若溶液 要恢复需加什么物质。
总结反刍,巩固落实
【要求】 迅速总结反刍,梳理基础知识,构 建知识体系。
某上门直销的离 子排毒泡脚仪, 介绍说用该仪器 泡脚可以排走人 体内毒素,起到 保健作用!
小小魔术师:你 能在白纸上用黑 笔写出红字来吗?
实验用品:导线 电源 NaCl溶 液 酚酞试剂 碳棒 铝片 滤纸
