实验11食盐中碘含量的测定
实验11 食盐中碘含量的测定

实验11 食盐中碘含量的测定教学目的与要求:1.学习测定食盐中碘含量的原理和方法;2.了解碘量法测定食盐中碘含量的具体步骤;3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;4.进一步熟练掌握滴定操作;5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:重点:1.碘量法的原理和方法;2.培养学生的动手操作能力及创新意识。
难点:1.降低碘量法测定误差的条件控制;2.碘量法滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:食盐,又称餐桌盐,是对人类生存最重要的物质之一,也是烹饪中最常用的调味料。
盐的主要化学成份氯化钠(化学式NaCl)在食盐中含量为99%,部份地区所出品的食盐加入氯化钾以降低氯化钠的含量以降低高血压发生率。
同时世界大部分地区的食盐都通过添加碘来预防碘缺乏病,添加了碘的食盐叫做碘盐。
2011年3月11日,日本本州岛海域发生地震引发核电站爆炸,我国多地居民出现为防止核辐射而抢购食盐的现象,专家表示,吃食盐能防辐射一说不靠谱,市民请勿信谣言。
问题1:食盐中为什么加碘?碘是人体必需的微量元素之一,有智力元素之称。
世界卫生组织将碘缺乏危害简称IDD,为目前导致人类智力发育落后的最主要原因。
现已证实,人脑发育大部分是在胚胎期和婴幼儿期完成的。
在智力发育全过程中,如果碘摄入不足,就会在生长发育过程中产生一系列障碍,即使轻微缺碘,也会引起智力的轻度落后并持续终生。
而严重的缺碘会对儿童的体格发育造成障碍,即身材矮小,性发育迟缓、智商低下。
并可造成早产、死胎、先天畸形、聋、哑、痴呆等,更为常见的为地方性甲状腺肿(即粗脖子病)和地方性克汀病。
这些损害统称为碘缺乏病。
问题2:食盐中添加的碘以什么形式存在?如何检验?食盐中添加的碘以碘酸钾形式存在。
检验方法:①碘单质的检验:淀粉溶液+食盐。
结果:不变蓝,说明食盐中的碘不是碘单质。
②碘化物的检验:5mLH2O2+少量食盐+几滴硫酸+滴入淀粉溶液;对比实验:5mLH2O2+少量碘化钾+几滴硫酸+滴入淀粉溶液。
食盐中碘含量的光度分析法测定

食盐中碘含量的光度分析法测定李继胜,朱自强,彭 滨 摘要: 目的 用较简单的方法测定食盐中碘的含量。
方法 试用分光光度法(波长为590nm)测定食盐中碘的含量。
结果 在30m in内测定其吸光度,碘浓度在0.3~1.6L g/ml范围内呈线性,碘标准曲线的相关系数r=0.992; 5次精密度测定标准偏差RSD s=0.425%;加标试验平均回收率=100.4%。
结论 试验表明:分光光度法测定食盐中微量碘酸钾含量的方法简单、快速,有较高的灵敏度和较好的准确性。
关键词: 碘酸钾;分光光度法;食盐 中图分类号:O657.3 文献标识码:ASpectrophotometer Determination Of Micro Amounts of Potassium Iodate in Edible Salt Li Jisheng,Zhu Ziqiang,Peng Bin (Dept.o f Chemistry,Wuyi University,Jiangmen529020,China) Abstract: Obj ective A m ethod for the determinati on of m icro amounts of potassium iodate in iodized salt by spec-trophotom eter was reported in this paper. Result The l inear range of the method was0.3~1.6L g/ml and r=0.992 ,the average recovery was100.4%,the RSDs were0.425%(n=5). Conclusion The method is pr oved to be sim-pl e,rapid and reliable with hi gher sensiti vity and better accuracy,and has been used for determination of potassium io-date in edible salt wi th satisfactory results. Key words: Potassium iodate;Spectrophotometer;Edible sal t 食盐加碘是防治碘缺乏病的根本措施,食盐的含碘量一般采用直接滴定方法检测。
食盐中碘含量测定

食盐中碘含量的测定组员:梁惠芳,何佩芬,龙业添,任华丰,黄华明一.实验目的1.学习使用色度计传感器。
2.使用色度计测定食盐中的碘含量。
二.实验原理在酸性条件下,溶液中的碘酸根离子定量地被碘化钾溶液还原为碘单质,碘与淀粉反应使溶液变蓝,在一定条件下,颜色随碘浓度的增大而加深。
通过色度计传感器测量标准溶液的吸光度后,在标准曲线上查出食盐中碘的含量5I- + IO3- + 6H+ ===3I2 + 3H2O三.实验仪器1.仪器色度计传感器,数据采集器,移液管,烧杯,100ml容量瓶,吸液球,玻璃棒2.试剂0.001mol/L KIO3标准溶液,2mol/LH2SO4溶液,10%KI溶液,淀粉指示剂(5g/L)四.实验步骤及数据处理1.用移液管准确移取0.001mol/L KIO3标准溶液10.00ml,8.00ml,6.00ml,4.00ml,2.00ml分别于50ml烧杯中,然后依次向烧杯中加入0.00ml,2.00ml,4.00ml,6.00ml,8.00ml蒸馏水。
2.向烧杯中依次加入2滴2mol/LH2SO4,摇匀后加入3ml 10%KI溶液,再加入适量的淀粉指示剂直至溶液变为蓝色不再加深。
3.连接色度计传感器与数据采集器,用蒸馏水进行校正使透光率为100%,再依次取上述的待测标准溶液于比色皿中测量吸光度,按照浓度由低到高测量,重复3次平行测量,绘制标准曲线。
4.称取15.0g食用加碘盐于50ml烧杯中,加适量蒸馏水溶解,然后定容至100ml,再用移液管准确移取10.00ml待测溶液于烧杯中,然后按照测量标准溶液吸光度的方法测量待测溶液,重复3次平行测量,然后利用标准曲线查找待测溶液的浓度,再计算食盐中碘的含量。
实验数据记录与处理文献值:碘酸钾(以I计)18-33mg/kg。
盐中碘含量的检测方法

盐中碘含量的检测方法概述碘是人体必需的微量元素之一,对人体的正常生长发育、代谢和智力发育都有重要影响。
为了确保人们获得足够的碘,各国纷纷开展了碘盐程序,即向盐中添加碘化钾或碘化钠来增加盐的碘含量。
为了确保盐中碘含量的合格和均匀性,需要进行碘盐的检测。
本文将介绍常用的盐中碘含量检测方法。
碘盐检测方法1.碘滴定法碘滴定法是一种常用的检测盐中碘含量的方法。
它的原理是用含有淀粉的碘滴定溶液滴入待检样品中,当滴定溶液中的碘剩余时,会出现蓝色继续滴加,直到不再出现蓝色为止,这时滴定液中的碘与样品中的碘达到平衡。
通过滴定液的用量,可以计算出样品中的碘含量。
2.电化学法电化学法是一种准确度较高的盐中碘含量检测方法。
它利用电化学池中的两个电极测量样品中的电位变化来确定碘的含量。
通常使用的电化学方法有极谱法、电位滴定法等。
3.分光光度法分光光度法是一种通过测量物质对特定波长的光的吸收或透过能力来测定物质浓度的方法。
对于盐中的碘含量检测,可以利用碘化物-淀粉反应中产生的蓝色复合物对样品中的碘进行测定。
通过测量复合物的吸光度,可以计算出样品中的碘含量。
4.电导法电导法是通过测量样品中的电导率来确定其中溶解物质的含量的方法。
盐中碘的浓度较高时,样品中的电导率也相应增加。
可以通过测量盐溶液的电导率来间接测定其中碘的含量。
5.火焰原子吸收光谱法火焰原子吸收光谱法是一种常用的元素分析方法,可以用来测定盐中碘的含量。
该方法通过将碘化钠、碘化钾等碘化物溶解在盐水中,然后将溶液喷射到氢火焰或氧-甲烷火焰中,利用相应的碘元素的吸收光谱特征进行定量分析。
碘盐检测注意事项1.样品准备:样品应当充分混匀,避免团块和颗粒的存在,以保证测试结果的准确性。
2.操作规范:在进行碘盐检测时,需要严格按照操作规程进行,避免误差的发生。
3.校准仪器:使用前需要校准仪器,确保测试结果的准确性和可靠性。
4.重复测试:为了验证测试结果的准确性,可以进行多次重复测试,然后取平均值。
实验食盐中碘的含量测定

食盐中碘含量测定问题的探讨杨荣淇碘是合成甲状腺激素的主要成分,适量的碘可供应人体合成生长发育所必需的甲状腺激素,如果缺乏碘,会产生地方性甲状腺肿和地方性克汀病,但碘过量则又可引起甲状腺功能低下和甲状腺肿大。
为了保障人民群众的健康,国家规定食用盐中必须加碘,且严格控制碘加入量,因而对于食用盐中碘含量的测定十分重要。
目前我国国家标准GB/T 13025.7—91《制盐工业通用试验方法碘离子的测定》(简称国标法)•采用的是溴水氧化法,即在酸性溶液中碘离子经溴氧化为碘酸根,再加碘化钾析出碘,而后用硫代硫酸钠标准溶液滴定,测定碘离子含量。
这种方法需消除过量氧化剂,否则将对结果数据产生影响,使试验数据不准确;另外,由于此法使用饱和溴水,对人体的危害和化验室环境的污染较为严重。
为此,本人查阅有关资料,设计了“双氧水氧化—吸光光度法”测定食盐中碘含量的试验方法,通过反复对比试验,认为采用该法能够达到精确度高、操作简便、不需消除过量氧化剂的影响且无污染的效果。
一、试验部分1、原理在酸性条件下,溶液中的碘离子经过过氧化氢(双氧水)氧化为碘,碘与淀粉反应使溶液变蓝,在一定条件下,颜色随碘浓度的增大而加深。
通过分光光度计测量溶液的吸光度后,在标准曲线上查出碘离子的含量。
2I-+H2O2+2H+ → I2+2H2O本试验采用在氯化钠溶液中加入已知浓度的碘化钾溶液来模拟加碘食盐溶液,通过测定出的碘含量与已知值比较,来判断试验的准确性与精确度。
2、试验(1)主要仪器与试剂721分光光度计(上海分析仪器厂)。
本法所有试剂和水未特别注明要求的,均使用分析纯试剂和蒸馏水。
碘化钾标准溶液:100ug/ml,准确称取碘化钾0.1000g溶于水,定容至1l (用时新配)。
碘化钾标准使用液:10ug/ml,准确移取10.00mL碘化钾标准溶液于100ml容量瓶中,用水定容至刻度。
氯化钠溶液:200g/l,称取氯化钠100.0g溶于水,定容至500ml。
紫外分光光度法测定食盐中的碘含量

Cl,3.0 mL10 % NaCl溶液,再分别加入0,
0.5,1.0,2.0,3.0,4.0,5.0 mL 10.0 μ g / mL的KIO3标准使用液,用水冲至刻 度,摇匀。以空白溶液作为参比,分别在 最大吸收峰285nm和351nm 处测定吸光度值。 浓度为横坐标,对应的吸光度值为纵坐标, 绘制工作曲线或进行线性回归,求得线性
四.实验步骤
1.仪器与试剂
仪器:岛津UV-1700型分光光度计 KIO3标准溶液(储备液):1.0
mg / mL(以KIO3
计),使用时 稀释为10.0μ g / mL 的使用液。
KI溶液:0.05 HCl溶液:0.1 NaCl溶液:10
mol / L mol / L %
四.实验步骤
度,摇匀。分别在285nm和351nm 处测定吸光度值,记录实验数据。
五.数据处理
由线性回归方程求得含量或在工作曲线上查 得含量,计算食盐样品中的碘含量。
A 0.8 0.6 0.4 0.来自 0 0 0.5 u g/ml 1 1.5
y = 0.598x + 0.0836 R 2 = 0.9995
六.思考题
A=lg(I0/It)=kbc
吸光度 介质厚度(cm)
二.紫外分光光度法简介
2 、光学光谱区
远紫外
(真空紫外)
近紫外 可见
近红外
中红外
远红外
10nm~200nm 200nm ~380nm
380nm ~ 780nm
780 nm ~ 2.5 m
2.5 m ~ 50 m
50 m ~300 m
紫外分光光 度法工作区
2.实验流程
吸收曲线绘制
工作曲线绘制 样品测定 吸收曲线的绘制 取步骤[2]中任一标准溶液 在分光光度计上从250 nm 至
高效液相色谱法测定食盐中碘含量

高效液相色谱法测定食盐中碘含量长春市卫生防疫站任凯刘剑平左社清长春市中心医院孙轶峰碘被认为是体内不能合成的必需的微量元素U当机体摄入量不足时则可引起碘缺乏病V人体摄入的碘主要来自碘盐U而碘盐中的碘酸钾易被氧化为单质碘而逸失U使碘盐中的碘化物与碘的比例达不到%aC KK K K b%aS KK K K U降低了补碘的作用U因此对碘盐定期监测是对碘盐市场进行监督的手段U是消除碘缺乏病的重要措施之一V近年来碘的检测方法发展迅速U过去使用的氧化法W比色法等化学法及\N]*_<法均有操作繁锁W使用试剂较多等缺点U本文作者现将高效液相色谱法测定食盐中的碘含量介绍如下V%实验部分c仪器[高效液相色谱仪%%K K型7美国惠普公司;Vd试剂[K$%B@e碘酸钾标准液W%K=B@e碘酸钾标准应用液Vf仪器测定条件[色谱柱C K K==OJ==U</)+1(’+#g&<C$S h=V流动相S$C B@eL流速%=6@=1-U柱C i]g J@N j k E S a%S V温C J lU进样量%K h6V检测器m N&U电极[玻璃碳工作电极W计数电极W参考电极V工作电压为%n U操作方法是电流滴定分析V o标准曲线[准确移取%K=B@e碘化钾标准应用液K$K K W K$C K W K$J K W K$H K W K$E K和%$K=6于小烧杯中U加去离子水至%K=6U在上述色谱条件下进样C K h6U以蜂面积定量U工作曲线相关系数为+pK$T T S VC结果与讨论加标回收实验U在市售碘盐样品中加入碘标准液U用本法进行回收率实验V回收率在T H$J qb%K%$E q之间U 取含碘量为D E$H S h B@B的样品U在同一周内进行五次实验U变异系数在%$E%qbC$J E q之间V食盐中碘含量测定方法的改进是本着准确W简易W快速W经济的原则V高效液相色谱法测定食盐中碘含量U具有选择性强W方法简单W快速W准确W使用化学试剂少等优点U此方法也适用于其它样品中碘含量的测定U对防治碘缺乏病具有重要意义V万方数据r%S%r高效液相色谱法测定食盐中碘含量作者:任凯, 刘剑平, 左社清, 孙轶峰作者单位:任凯,刘剑平,左社清(长春市卫生防疫站), 孙轶峰(长春市中心医院)刊名:白求恩医科大学学报英文刊名:JOURNAL OF NORMAN BETHUNE UNIVERSITY OF MEDICAL SCIENCES年,卷(期):2001,27(2)本文链接:/Periodical_bqeykdxxb200102055.aspx。
分光光度法测定食盐中的碘含量
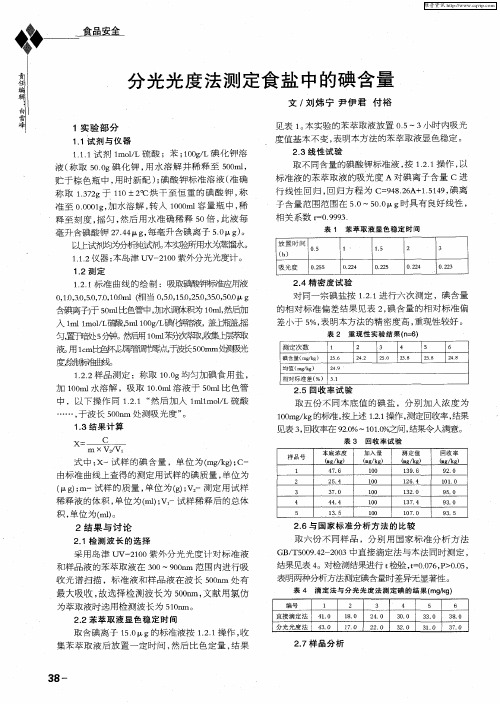
111 剂 l o/ .. 试 ml L硫酸 ;苯 ;OgL碘 化钾 溶 lO/
液( 称取 5 . 碘 化钾 , 水溶 解并 稀释 至 50 l 0O g 用 0m , 贮于 棕色瓶 中 , 用时新 配 ) 碘酸 钾标准 溶液 ( 确 ; 准
称 取 132 于 10 R 烘 干至 恒重 的碘 酸钾 , . g 7 1 ±22 称 准 至 000 g加 水溶解 , 入 l0 m 容 量瓶 中 , . 1, 0 转 O0 l 稀 释至刻度 , 摇匀 , 然后 用水准 确稀释 5 倍 , 液每 0 此 毫升 含碘酸 钾 2 . g 每毫升 含碘离 子 50 ) 74 4 , . g 。 l 试剂均为分忻纯{剂。 式 本实验所用水为蒸锤 < } 。 1 .仪器 : .2 1 本岛津 u 一 10 v 20 紫外分光光度计 。
表 1 苯 萃取 液显 色稳定 时 间
放 置 时 间
( h)
O5 1 、 15 . 2 3
吸 光 度
02 5 .5
02 4 .2
02 5 .2
024 .2
023 2
1 . 标准 曲线的绘 制 :吸取碘酸钾标准应用液 .1 2
01 ,.,07 ,0 ml( 当 05 ,5 ,5 ,5 ,0 g ,. 3 5 ,01. 0 0. . 0 相 ,. 1. 2 . 3 . 5. 0 0 0 0 0
的相对标准偏 差结果见 表 2 碘 含量的相对 标准偏 , 差小于 5 表明本方法的精密度高 , %, 重现性较好 。
表 2 重现性 实 验结 果(= ) n 6
测 次 定数
均值 ( g ) a r /
1
2 49
} 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验11 食盐中碘含量的测定
教学目的与要求:
1.学习测定食盐中碘含量的原理和方法;
2.了解碘量法测定食盐中碘含量的具体步骤;
3.让学生熟练掌握移取,称量,配制一定浓度标准溶液等操作;
4.进一步熟练掌握滴定操作;
5.学会如何合理的设计实验并培养学生的动手操作能力及创新意识。
教学重点与难点:
重点:1.碘量法的原理和方法;
2.培养学生的动手操作能力及创新意识。
难点:1.降低碘量法测定误差的条件控制;
2.碘量法滴定中反应条件的控制。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:
食盐,又称餐桌盐,是对人类生存最重要的物质之一,也是烹饪中最常用的调味料。
盐的主要化学成份氯化钠(化学式NaCl)在食盐中含量为99%,部份地区所出品的食盐加入氯化钾以降低氯化钠的含量以降低高血压发生率。
同时世界大部分地区的食盐都通过添加碘来预防碘缺乏病,添加了碘的食盐叫做碘盐。
2011年3月11日,日本本州岛海域发生地震引发核电站爆炸,我国多地居民出现为防止核辐射而抢购食盐的现象,专家表示,吃食盐能防辐射一说不靠谱,市民请勿信谣言。
问题1:食盐中为什么加碘?
碘是人体必需的微量元素之一,有智力元素之称。
世界卫生组织将碘缺乏危害简称IDD,为目前导致人类智力发育落后的最主要原因。
现已证实,人脑发育大部分是在胚胎期和婴幼儿期完成的。
在智力发育全过程中,如果碘摄入不足,就会在生长发育过程中产生一系列障碍,即使轻微缺碘,也会引起智力的轻度落后并持续终生。
而严重的缺碘会对儿童的体格发育造成障碍,即身材矮小,性发育迟缓、智商低下。
并可造成早产、死胎、先天畸形、聋、哑、痴呆等,更为常见的为地方性甲状腺肿(即粗脖子病)和地方性克汀病。
这些损害统称为碘缺乏病。
问题2:食盐中添加的碘以什么形式存在?如何检验?
食盐中添加的碘以碘酸钾形式存在。
检验方法:
①碘单质的检验:淀粉溶液+食盐。
结果:不变蓝,说明食盐中的碘不是碘单质。
②碘化物的检验:5mLH2O2+少量食盐+几滴硫酸+滴入淀粉溶液;
对比实验:5mLH2O2+少量碘化钾+几滴硫酸+滴入淀粉溶液。
结果:前者不变蓝,后者变蓝。
说明食盐中的碘不是碘化物。
③碘酸物的检验:少量食盐+少量碘化钾+几滴硫酸+滴入淀粉溶液。
对比实验:5mL碘酸钾溶液+少量碘化钾+几滴硫酸+滴入淀粉溶液。
结果:都变蓝。
说明食盐中的碘是碘酸钾。
知识拓展:食盐中为什么要添加亚铁氰化钾?如何检验?
食盐中添加亚铁氰化钾是作为抗结剂。
检验方法:
亚铁氰化钾的定性检测:少量食盐+滴入FeCl3 (含量太低,可能检测不出)
对比:少量K4[Fe(CN)6]溶液+滴入FeCl3,生成KFe [Fe(CN)6] ↓(深蓝色)。
问题3:测定食盐中添加的碘的原理是什么?
首先将食盐中所含的KIO3在酸性条件下用I-还原,定量析出I2。
IO3- + 5I- + 6H+═ 3I2+ 3H2O
然后以CCl4 (或淀粉)做指示剂,用Na2S2O3标准溶液来滴定析出的I2。
I2单质在CCl4中呈紫色(在淀粉中显蓝色),滴定至CCl4层无色(或蓝色)时即为终点。
I2 + 2 Na2S2O3═Na2S4O6 +2 NaI
问题4:实验中需要哪些仪器和试剂?
1、仪器:碱式滴定管、容量瓶、10mL、25mL移液管、碘量瓶。
2、试剂:食盐、Na2S2O
3、淀粉)、重铬酸钾、1 mol·L-1硫酸2% 、
10%KI、H2O2、碘酸钾溶液、K4[Fe(CN)6]、5% FeCl3。
问题5:测定食盐中添加的碘的具体步骤是什么?
1、K2Cr2O7(0.01667mol·L-1)标准溶液的配制:(二排一瓶)
将K2Cr2O7在150—180℃烘干2h,于干燥器中冷却到室温。
(老师准备好)
准确称取2.4516g K2Cr2O7于200mL烧杯中,加水溶解后,转入500mL 容量瓶中,稀释至刻度,摇匀,备用。
(8人用)
2、Na2S2O3 (0.05mol·L-1):称取5g Na2S2O3·5H2O,溶于刚煮沸并冷却后的400mL 水中,将溶液保存在棕色瓶子中,备用。
(4人用)
3、Na2S2O3标准溶液的标定:
准确移取上述K2Cr2O7溶液10mL,置于250mL的碘量瓶中,加入10%的KI 溶液5mL,加入1 mol·L-1的H2SO4溶液5mL,塞上塞子在暗处放置5min后,加入30mL蒸
馏水稀释,用Na2S2O3溶液标定,当溶液由棕色转变为淡黄色时,加入2mL淀粉,继续滴定至溶液由蓝色变为亮绿色即为终点。
记下消耗Na2S2O3溶液的体积,平行做2次,计算Na2S2O3溶液的浓度。
(2次/人)
4、Na2S2O3标准溶液的稀释:移取已标定的Na2S2O3标准溶液10mL于500mL的容量瓶中,加水至标线,摇匀。
(4人用)
5、洗涤滴定管。
6、测定食盐中碘的含量:准确称取14—15g的食盐于碘量瓶中,加2mL、10%KI 和2mL淀粉,再加入5~8滴1 mol·L-1硫酸后,加盖置于暗处5min,然后用稀释后的Na2S2O3标准溶液滴定至蓝色消失。
(2次/人)
操作工作中注意事项
1、KI溶液需配制浓度为3mg·mL -1:称取3g KI固体,溶于1000 mL蒸馏水中,保存于棕色瓶中。
2、Na2S2O3标准溶液的稀释一定要准确,而且在移取前必须将稀释的溶液充分摇匀。
3、需控制好KIO3与KI反应的酸度。
酸度太低,反应速度慢;酸度太高则I-易被空气中的O2氧化。
4、为防止生成的I2分解,反应需在碘量瓶中进行,且需避光放置。
5、碘淀粉指示反应的灵敏度很高,含碘量为1.5 mg/kg 的食盐即可辨认出,因此可以用淀粉作为本次实验的指示剂。
交流与讨论
1、为什么不加碘单质、碘化物或碘化钠?
碘单质受热易升华,碘化物(即碘离子形成的)易被氧化,且碘酸钾制取较方便成本低。
钠盐的吸湿性比钾盐强,加碘酸钾不易使食盐受潮。
目前我国在食盐中加碘主要使用碘酸钾,而过去则是碘化钾。
碘化钾的优点是含碘量高(76.4%),缺点是容易氧化,稳定性差,使用时需在食盐中同时加稳定剂。
碘酸钾稳定性高不需要要稳定剂,但含碘量较低(59.3%)。
相比之下,使用碘酸钾优点还是较大的。
因此,90年始我国规定民用食盐的碘的添加剂为碘酸钾。
2、加碘盐为什么要忌高温蒸炒?
食盐中的典是以碘酸钾的形式存在的碘酸钾加热易分解为碘单质,最后升华,因此加热后会导致典的流失。
3、本实验为何要控制酸度?用哪种试剂控制酸度?
(1)在碱性溶液中,I2与S2O32- 将发生下列反应:4I2+S2O32- =2SO42- +8I-+5
而且,I2在碱性溶液中会发生歧化反应生成HIO和IO3-。
(2)在强酸性溶液中,S2O32-会发生分解:S2O32-+2H+=SO2+S+ H2O
4、食盐中的碘成分以哪种形式存在?如何检验?
买一包市售碘盐,取少量样品,进行下面几项检验:
①碘单质的检验:用淀粉溶液可检验食盐中是否有碘单质存在。
②碘化物的检验:选择如高锰酸钾、重铬酸钾、碘酸钾、H2O2等氧化剂,滴加在食
盐上,用淀粉溶液检验是否有碘单质生成。
并可用碘化钾溶液与氧化剂反应后,滴加淀粉溶液,做对比实验。
③碘酸物的检验:选择如亚硫酸钠、硫代硫酸钠等还原剂,滴加在食盐上,用淀粉溶液检验是否有碘单质生成。
并可用碘酸钾溶液与还原剂反应后,滴加淀粉溶液,做对比实验。
知识拓展
1、吃什么才能增加人体的碘含量?
含碘最多的食物是海带、紫菜、发菜、海蜇、海参、苔菜、柿子。
2、我国食用盐国家标准:
能力拓展:食盐中锌含量的测定
问题1:食盐中为什么加锌?
问题2:食盐中添加的锌以什么形式存在?
问题3:测定锌离子的原理是什么?
问题4:如何测定食盐中锌的含量?。
