分离过程典型例题
分离过程典型例题
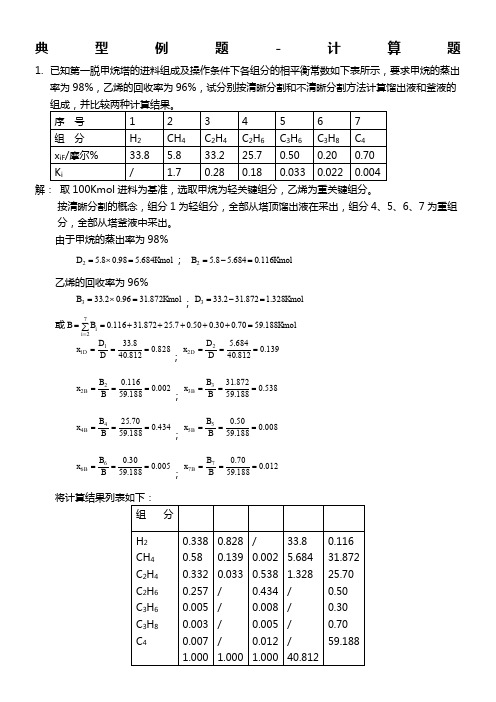
典型例题-计算题1. 已知第一脱甲烷塔的进料组成及操作条件下各组分的相平衡常数如下表所示,要求甲烷的蒸出率为98%,乙烯的回收率为96%,试分别按清晰分割和不清晰分割方法计算馏出液和釜液的解: 取100Kmol 进料为基准,选取甲烷为轻关键组分,乙烯为重关键组分。
按清晰分割的概念,组分1为轻组分,全部从塔顶馏出液在采出,组分4、5、6、7为重组分,全部从塔釜液中采出。
由于甲烷的蒸出率为98%Kmol D 684.598.08.52=⨯=; Kmol B 116.0684.58.52=-=乙烯的回收率为96%Kmol B 872.3196.02.333=⨯=;Kmol D 328.1872.312.333=-=或Kmol B B i i 188.5970.030.050.07.25872.31116.072=+++++==∑=828.0812.408.3311===D D x D ;139.0812.40684.522===D D x D 002.0188.59116.022===B B x B ;538.0188.59872.3133===B B x B 434.0188.5970.2544===B B x B ;008.0188.5950.055===B B x B005.0188.5930.066===B B x B ;012.0188.5970.077===B B x B不清晰分割物料衡算 由iiH K =α由于氢气的相对挥发度很大,该组分全部从塔顶馏出液中采出。
由333B DB D m N i i i α=和i i i B D F +=分别计算组分4、5、6、7的分布。
对组分4:0074.0872.31328.1643.092.333444===B D B D m N α;而447.25B D += 由此计算得189.04=D ;511.254=B 对组分5:00001.0872.31328.1118.092.333555===B D B D mN i α;而555.0B D += 由此计算得0.05≈D ;50.05=B 2. 要求在常压下分离环己烷a.(沸点80.8℃)和苯b.(沸点80.2℃),它们的恒沸组成为苯0.502(摩尔分数),共沸点77.4℃,现以丙酮为恒沸剂进行恒沸精馏,丙酮与环己烷形成恒沸物,共沸组成为0.60(环己烷摩尔分数),若希望得到几乎纯净的苯,试计算: ①所需恒沸剂量。
苏教版高一化学必修1_《物质的分离和提纯》典型例题

第二单元物质的分离和提纯典型例题例1. 下列仪器:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是A. ①③④B. ①②⑥C. ①③⑤D. ③④⑦【解析】掌握常见仪器的分类依据和每种仪器的用途,并弄清其使用时的注意事项。
①漏斗:用来过滤分离固液混合物;③蒸馏烧瓶:用于液体蒸馏,分离沸点相差较大的液态混合物;⑤分液漏斗:萃取分离互不相溶的液态混合物。
【答案】C例2. 下列物质的分离方法不正确的是()A. 用过滤的方法除去食盐中泥沙B. 用蒸馏的方法将自来水制成蒸馏水C. 用酒精萃取碘水中的碘D. 用水冲洗的方法从沙里淘金【解析】萃取剂的选择必须满足三个条件:①萃取剂与原溶剂不混溶、不反应②溶质在萃取剂中有较大的溶解度③溶质不与萃取剂发生任何反应;酒精与水互溶,所以酒精不能作萃取剂。
【答案】C例3. 现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是()A. 过滤B. 蒸发C. 分液D. 萃取【解析】过滤需要的仪器:漏斗、滤纸、铁架台(带铁圈)、烧杯、玻璃棒;蒸发:蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈);萃取(分液):分液漏斗,烧杯。
【答案】A例4. 下列实验方案能达到目的的是()A. 除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤B. 实验室获取少量纯净的水:蒸馏自来水C. 提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤D. 提取碘水中的碘:加入适量乙醇,振荡、静置、分液【解析】除杂过程中,其中一个原则是不能带入新的杂质,所以A选项中应加入适量的NaOH;C选项提纯混有少量硝酸钾的氯化钾,正确的方法是加热蒸发至有大量固体析出,然后趁热过滤;D选项中酒精与水互溶,所以不做萃取剂。
【答案】B例5. 提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为A. 加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸B. 加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸C. 加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸D. 加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸【解析】提纯的基本思路是除杂试剂在除去杂质的同时,不能引入新的杂质。
分离工程题库

《分离工程》复习题库一、 填空题1. 分离作用是由于加入 而引起的,因为分离过程是 的逆过程。
2. 分离过程是 的逆过程,因此需加入 来达到分离目的。
3. 分离过程中按有无物质传递现象发生来划分,分离过程可分为 和4. 精馏塔计算中每块板由于 改变而引起的温度变化,可用 确定。
5.若分离过程使组分i及j之间并没有被分离,则有 。
6.多组分精馏根据指定设计变量不同可分为 型计算和 型计算。
7.平衡分离的基础是利用两相平衡 的原理,常采用 作为处理手段,并把其它影响归纳于 中。
8.速率分离的机理是利用溶液中不同组分在某种 作用下经过某种介质时 差异而实现分离的。
9. 汽液相平衡是处理 过程的基础。
相平衡的条件是气液两相中温度压力相等,每一组分的 。
10.对单相物流的独立变量数为 ,对相平衡物流的独立变量数为 11.完全理想系的相平衡关系为12. 根据泡点露点的概念,精馏塔塔顶温度即为对应塔顶汽相组的 ,塔釜温度即为对应塔釜液相组成的 。
13.计算泡点温度时,若1i i K x ∑>,温度应调 。
14.平衡常数与组成有关的露点计算,需迭代露点温度和压力外,还需要对 进行试差。
15.在分离流程中常遇到的部分汽化和冷凝过程属 。
16.绝热闪蒸与等温闪蒸计算不同点是需要考虑 。
17.相对挥发度的定义为两组的 之比,它又称为 18.非清晰分割法假设各组分在塔内的分布与在 时分布一致。
19.精馏塔中,温度分布主要反映物流的 ,而总的级间流量分布则主要反映 的限制。
20.萃取精馏塔中,萃取剂是从塔 出来。
21.恒沸剂与组分形成最高沸点的恒沸物时,横沸剂从塔 出来。
22.超临界流体具有类似液体的 和类似气体的 。
23. 分离最小功是分离过程必须消耗能量的下限它是在分离过程 时所消耗的功。
24.恒摩尔流假设指的是 25.恒沸精馏与萃取精馏主要用于 和 。
二、 选择题1.分离过程是一个A.熵减少的过程B.熵增加的过程C.熵不变的过程D.自发过程2. 下列操作中,不属于平衡传质分离过程的是A.结晶B.吸热C.加热 D 浸取 3.下列分离过程中属于机械分离过程的是A.蒸馏B.吸收C.膜分离D.离心分离 4、约束变量关系数就是A 过程所涉及的变量数目B 固定设计变量的数目C 独立变量数与设计变量数的和D 变量之间可以建立的方程数和给定的条件5.每一单股进料均有 个设计变量。
导数分离变量法知识点

导数分离变量法知识点一、知识概述“导数分离变量法知识点”①基本定义:导数分离变量法就是在解决含有导数的方程或不等式时,把含有变量的式子放在等号或不等号的一边,把不含变量的式子放在另一边,这样可以方便我们进一步分析和求解。
就像是把一群羊和一群牛分开,好分别照顾它们一样。
②重要程度:在数学学科里,尤其是涉及导数的问题中,它是一种非常有用的方法。
很多看似复杂的导数等式或不等式,一用这个方法就条理清晰了,是解决很多导数相关问题的一把“钥匙”。
③前置知识:得先掌握导数的基本概念和求导公式,像幂函数的求导公式(x^n)' = nx^(n - 1)等。
还得了解一些基本的等式和不等式运算规则,不然即便分离了变量,后面也做不了。
④应用价值:在研究函数的单调性、极值、最值等方面有着广泛的应用。
比如在物理学里研究速度随时间的变化规律时可能就会用到,或者经济学里分析成本随产量的变化时也可能涉及。
二、知识体系①知识图谱:在导数这一块知识中,它是属于利用导数解决问题的一个很重要的方法,就像大树上的一个重要树枝。
②关联知识:和求导公式、函数的单调性、函数的极值等知识都有联系。
如果求不出函数的导数,就没办法有效使用分离变量法;而求出的导数也是为了进一步了解函数特性,和函数单调性、极值等相关。
③重难点分析:掌握难度不算特别大,关键是要能准确地把变量分离出来,有时候那些式子看起来乱糟糟的就很棘手。
重难点主要就在准确识别哪些部分是含有变量可以分到一边的,哪些是常数能分到另一边的。
④考点分析:在考试里是比较常考的内容。
可能会单独出一道用分离变量法解导数方程或者不等式的题目,也可能在综合题里涉及。
考查方式就是让你求解变量的取值范围、证明某个不等式什么的。
三、详细讲解【方法技能类】①基本步骤:先把含有导数的等式或者不等式列出来,比如f'(x)+g(x)h(x)=k(x)这种式子(这只是个例子啊)。
然后把含有x这个变量的式子尽可能全地放到一边,假设就是含g(x)h(x)这部分的放到一边,另一边就是k(x)- f'(x)。
精馏典型例题

第9章 精馏 典型例题例1:逐板法求理论板的基本思想有一常压连续操作的精馏塔用来分离苯-甲苯混合液,塔顶设有一平衡分凝器,自塔顶逸出的蒸汽经分凝器后,液相摩尔数为汽相摩尔数的二倍,所得液相全部在泡点下回流于塔,所得汽相经全凝器冷凝后作为产品。
已知产品中含苯0.95(摩尔分率),苯对甲苯的相对挥发度可取为2.5 。
试计算从塔顶向下数第二块理论板的上升蒸汽组成。
解: 884.095.05.15.295.05.115.20000=⨯-=→=+=x x x x y DR=L/D=2905.03/95.0884.0323/95.032:11=+⨯=+=+y x y n n 精馏段方程845.03/95.0793.032793.0905.05.15.2905.05.15.22111=+⨯==⨯-=-=y y y x例2:板数较少塔的操作型计算拟用一 3 块理论板的(含塔釜)的精馏塔分离含苯50%(摩尔分率,下同)的苯-氯苯混合物。
处理量F=100 Kmol/h ,要求 D=45 Kmol/h 且 x D >84%。
若精馏条件为:回流比R=1 ,泡点进料,加料位置在第二块理论板,α=4.10 ,问能否完成上述分离任务? 解:W=55kmol/h精馏段操作线方程:y n+1=0.5x n +0.42提馏段的操作线方程:Fq D R Wx x F q D R qFRD y w )1()1()1()1(--+---++=将相关数据代入得提馏段操作线方程:134.061.1-=x y 逐板计算:y 1=x D =0.84y 2=0.5×0.56+0.42=0.7057.0134.036.061.13=-⨯=y.22.05584.04550=⨯-=-=WDx Fx x Df w ()56.084.01.31.484.01111=⨯-=--=y y x αα36.07.01.31.470.02=⨯-=x22.024.057.01.31.457.03≥=⨯-=x所以不能完成任务。
高考数学经典常考题型第22专题 恒成立问题——参变分离法

高考数学经典常考题型第22专题恒成立问题——参变分离法第22专题训练:恒成立问题——参变分离法一、基础知识1、参变分离:当不等式中含有两个字母时,一个被视为变量,另一个被视为参数。
通过等价变形,让两个字母分居不等号的两侧,即不等号的每一侧都是只含有一个字母的表达式。
然后,可利用其中一个变量的范围求出另一变量的范围。
2、确定变量与参数:一般情况下,那个字母的范围已知,就将其视为变量,构造关于它的函数,另一个字母(一般为所求)视为参数。
3、参变分离法的适用范围:判断恒成立问题是否可以采用参变分离法,可遵循以下两点原则:1)已知不等式中两个字母是否便于进行分离。
如果仅通过几步简单变换即可达到分离目的,则参变分离法可行。
但有些不等式中由于两个字母的关系过于“紧密”,会出现无法分离的情形,此时要考虑其他方法。
例如:a)(x-1)<loga(x^2/(1+x))b)2x^2-axe+1>0c)(1-x)/(1+x)<a^x2)参变分离后,已知变量的函数解析式是否便于求出最值(或临界值)。
若解析式过于复杂而无法求出最值(或临界值),则也无法用参变分离法解决问题。
二、关于a为4的参变分离假设x为自变量,其范围设为D,f(x)为函数;参数g(a)为其表达式。
根据f(x)的值域,会出现以下情况及处理方法:1、f(x)的值域为[m,M]1)对于所有x∈D,如果g(a)≤f(x),则只需要g(a)≤m;如果g(x)<f(x),则只需要g(a)<m。
2)对于所有x∈D,如果g(a)≥f(x),则只需要g(a)≥M;如果g(x)>f(x),则只需要g(a)>M。
3)存在x∈D,使得g(a)≤f(x),则只需要g(a)≤M;存在x∈D,使得g(a)<f(x),则只需要g(a)<M。
4)存在x∈D,使得g(a)≥f(x),则只需要g(a)≥m;存在x∈D,使得g(a)>f(x),则只需要g(a)>m。
微生物纯种的分离方法

微生物纯种的分离方法自然界中的微生物总是杂居在一起,即使一粒土或一滴水中也生存着多种微生物。
要研究其中的某一种微生物,首先必须将它分离出来。
下面介绍几种纯种微生物的分离方法。
平板划线分离将已经熔化的培养基倒入培养皿中制成平板,用接种环沾取少量待分离的材料,在培养基表面平行或分区划线(图5-5),然后,将培养皿放入恒温箱里培养。
在线的开始部分,微生物往往连在一起生长,随着线的延伸,菌数逐渐减少,最后可能形成纯种的单个菌落。
液体稀释法将待分离的样品经过大量稀释后,取稀释液均匀地涂布在培养皿中的培养基表面,培养后就可能得到单个菌落。
利用选择培养基进行分离不同的微生物对不同的试剂、染料、抗生素等具有不同的抵抗能力,利用这些特点可配制出适合某种微生物生长而限制其他微生物生长的选择培养基。
用这种培养基来培养微生物就可以达到纯种分离的目的。
菌丝尖端切割这种方法适于丝状真菌。
用无菌的解剖刀切取位于菌落边缘的菌丝的尖端,将它们移到合适的培养基上培养后,就能得到新菌落三、细菌的分离与计数(一)背景知识介绍1.细菌的分离与纯化自然界的细菌总是以杂居的方式存在,如土壤、水、空气等都分布着种类繁多的细菌。
我们如何知道这些杂居的细菌是哪种细菌呢?这就需要将这些带菌的材料中混杂的细菌,经过稀释,使其分散成单个存在的菌体,在固体培养基平板上,长成肉眼可见并具有一定特征的菌落。
这些菌落分离出来,进行纯培养。
所谓纯培养即在一个培养物中,所有的细菌都是由一个细菌分裂繁殖而产生的后代。
这种获得单一菌株纯培养的的方法称为细菌的分离。
常用的分离方法有稀释法和划线法。
(二)课题提出:我们的身体和周围的环境有大量的细菌,细菌与我们的生活和健康密切相关。
但是,自然存在的细菌都混杂在一起,我们要想研究和了解各种细菌的形态结构和功能,就要对其进行分离纯化,才能进行深入的研究。
如对一些致病菌的研究,食品卫生的研究,微生物工业的研究等。
在研究过程中,有时需要调查和检测细菌密度,则需要统计细菌的数量。
考点12 光合作用(核心考点讲与练)-2023年高考生物一轮复习讲练测(全国通用)(解析版)

考点12 光合作用(精讲+精练)目录一、知识点精准记忆二、典型例题剖析1、绿叶中色素的提取和分离2、光合作用的过程3、光合作用的影响因素及其应用4、光(CO2)补偿点、饱和点的移动问题三、易混易错辨析四、2022高考真题感悟五、高频考点精练第一部分:知识点精准记忆一、绿叶中色素的提取和分离(1)实验原理(2)实验步骤(3)实验结果色素种类色素颜色色素含量溶解度扩散速度胡萝卜素橙黄色最少最高最快叶黄素黄色较少较高较快叶绿素a 蓝绿色最多较低较慢叶绿素b 黄绿色较多最低最慢(4)实验出现异常现象的原因分析异常现象原因分析收集到的滤液绿色过浅①未加二氧化硅,研磨不充分;②使用放置数天的菠菜叶,滤液色素(叶绿素)太少;③一次加入大量的无水乙醇,提取液浓度太低(正确做法:分次加入少量无水乙醇);④未加碳酸钙或加入过少,色素分子被破坏滤纸条色素带重叠①滤液细线不直;②滤液细线过粗滤纸条无色素带①忘记画滤液细线;②滤液细线接触到层析液,且时间较长,色素全部溶解到层析液中二、光合作用过程(1)光合作用过程图解项目光反应暗反应场所叶绿体类囊体的薄膜叶绿体基质条件 光、色素、酶酶、NADPH 、ATP 等物质变化(1)H 2O ――→光能酶O 2+H +(2)NADP ++H +―→NADPH (3)ADP +Pi ――――→光能色素、酶ATP (1)CO 2+C 5――→酶2C 3(2)2C 3――――――→ATP 、NADPH酶(CH 2O)+C 5 能量变化联系光反应为暗反应提供NADPH 和ATP ,暗反应为光反应提供NADP +、ADP 和Pi 。
①产物为(CH 2O):CO 2+H 2O ――→光能叶绿体(CH 2O)+O 2。
②产物为C 6H 12O 6:6CO 2+12H 2O ――→光能叶绿体C 6H 12O 6+6O 2+6H 2O 。
③元素的转移途径a .H :3H 2O ―――→光反应NADPH ―――→暗反应(C 3H 2O)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
典型例题-计算题1. 已知第一脱甲烷塔的进料组成及操作条件下各组分的相平衡常数如下表所示,要求甲烷的蒸出率为98%,乙烯的回收率为96%,试分别按清晰分割和不清晰分割方法计算馏出液和釜液的组成,解: 取100Kmol 进料为基准,选取甲烷为轻关键组分,乙烯为重关键组分。
按清晰分割的概念,组分1为轻组分,全部从塔顶馏出液在采出,组分4、5、6、7为重组分,全部从塔釜液中采出。
由于甲烷的蒸出率为98%Kmol D 684.598.08.52=⨯=; Kmol B 116.0684.58.52=-=乙烯的回收率为96%Kmol B 872.3196.02.333=⨯=;Kmol D 328.1872.312.333=-=或Kmol B B i i 188.5970.030.050.07.25872.31116.072=+++++==∑=828.0812.408.3311===D D x D ;139.0812.40684.522===D D x D 002.0188.59116.022===B B x B ;538.0188.59872.3133===B B x B 434.0188.5970.2544===B B x B ;008.0188.5950.055===B B x B005.0188.5930.066===B B x B ;012.0188.5970.077===B B x B将计算结果列表如下:不清晰分割物料衡算 由H iiH K K =α由于氢气的相对挥发度很大,该组分全部从塔顶馏出液中采出。
由333B D B D mN i i i α=和i i i B D F +=分别计算组分4、5、6、7的分布。
对组分4:0074.0872.31328.1643.092.333444===B D B D m N α;而447.25B D += 由此计算得189.04=D ;511.254=B 对组分5:00001.0872.31328.1118.092.333555===B D B D mN i α;而555.0B D += 由此计算得0.05≈D ;50.05=B 将计算结果列表如下:2. 要求在常压下分离环己烷a.(沸点80.8℃)和苯b.(沸点80.2℃),它们的恒沸组成为苯(摩尔分数),共沸点77.4℃,现以丙酮为恒沸剂进行恒沸精馏,丙酮与环己烷形成恒沸物,共沸组成为(环己烷摩尔分数),若希望得到几乎纯净的苯,试计算: ①所需恒沸剂量。
②塔顶、塔釜馏出物量各为多少。
(以100kmol/h 进料计)解:以100kmol/h 进料为基准,设丙酮恒沸剂的用量为Skg ,恰好与料液中的环己烷组成恒沸物,进料量和塔顶恒沸物的量和组成分别为Di Fi x x D F ,,,。
对环己烷作物料平衡 11F D Fx Dx =;kmol x Fx D D F 8360.0498.010011=⨯==恒沸剂S 的用量为kmol Dx S D 2.3340.0833=⨯==由于塔釜希望得到几乎纯净的苯,kmol Fx W W F 2.50502.010022=⨯===3. 甲醇丙酮b.在55.7℃时形成恒沸物,其恒沸组成为198.01=x ,水和苯均可作为萃取剂进行萃取精馏以分离甲醇和丙酮,试通过计算确定水c.与苯d.的选择度,并据理说明哪种萃取剂更佳及塔顶馏出液各为何种物质已知:)(8.0mol x S =;2798.012=A ;2634.021=A ;3794.013=A ;2211.031=A ;9709.023=A ;5576.032=A ;8923.014=A ;7494.041=A ;2012.024=A ;1533.042=A解:以水作萃取剂以苯作萃取剂,以苯作为萃取剂进行萃取精馏分离甲醇和丙酮更佳,而水作为萃取剂比不加入萃取剂时的效果更差。
由于甲醇的沸点(64.7℃)高于丙酮(55.7℃),则塔顶馏出物为丙酮,塔釜馏出物为甲醇和苯。
4. 乙酸甲酯a.和甲醇b.混合物在45℃时为恒沸物,今以水为溶剂进行萃取精馏,已知其组成为7.01=x ,8.0=S x ;447.012=A ;411.021=A ;3.113=A ;82.031=A ;36.023=A ;22.032=A 。
试求其选择度,并说明塔顶馏出何物 解:由于甲醇的沸点(64.7℃)低于乙酸甲酯(℃),则塔顶馏出物为甲醇酮,塔釜馏出物为乙酸甲酯和水。
5. 某裂解气组成如下表所示。
现拟以i-C 4H 10馏分作吸收剂,从裂解气中回收99%的乙烯,原料气的处理量为100kmol/h ,塔的操作压力为,塔的平均温度按-14℃计,求: ①为完成此吸收任务所需最小液气比。
②操作液气比若取为最小液气比的倍,试确定为完成吸收任务所需理论板数。
③各个组分的吸收分率和出塔尾气的量和组成。
④塔顶应加入的吸收剂量。
解:选乙烯为关键组分,查得在和-14℃下各组分的相平衡常数列于下表。
a.最小液气比的计算在最小液气比下∞=N ,9.0==关关ϕA 9, b.理论板数的计算 操作液气比()0692.17128.05.15.1min=⨯==V LVL关键组分的吸收因子为485.172.00692.1===关关VK L A理论板数868.81485.1lg 199.0485.199.0lg 1lg 1lg=---=---=AAN ϕϕc.各个组分的吸收分率和出塔尾气的量和组成由iii VK LK K A A ==关关和111--==++N i i N i i i A A A αϕ以及()i N i i v v ,1,11+-=α;∑=i v V ,11;1,1,1V vy i i =进行计算结果见表。
d.吸收剂量塔内气体的平均流率为:hkmol V /056.6921115.38100=+= 塔内液体的平均流率为:944.302)8885.61(000+=++=L L L L由0692.1=V L,得h kmol L /89.420=6. 在一精馏塔中分离苯(B ),甲苯(T ),二甲苯(X )和异丙苯(C )四元混合物。
进料量200mol/h ,进料组成z B =,z T =,z X =(mol)。
塔顶采用全凝器,饱和液体回流。
相对挥发度数据为:BT α=,TT α=,XT α=,CT α=。
规定异丙苯在釜液中的回收率为%,甲苯在馏出液中的回收率为%。
求最少理论板数和全回流操作下的组分分配解:根据题意顶甲苯为轻关键组分,异丙苯为重关键组分,从相对挥发度的大小可以看出,二甲苯为中间组分,在作物料衡算时,初定它在馏出液和釜液中的分配比,并通过计算修正 物料衡算如下组分 进料 馏出液i d 釜液i W B40 40-T 60 ⨯⨯X 202 18 C20080 D 40002.0⨯ W998.080⨯解得D= W=TD x = TW x = CDx =CWx ==⎥⎦⎤⎢⎣⎡=)()()(CT W C T D T C m x x x x N α1lg lg )(21.01lg 0031.08135.00016.05861.0lg ⎥⎦⎤⎢⎣⎡⨯=解得 x d =; x W =组分 进料 i di WB 40 40—T 60 ⨯⨯X 20C 8091.100002.080⨯ 09.99998.080⨯组分 di xwi xB 0 T X C=⎥⎦⎤⎢⎣⎡=)()()(W T C D C T m x x x x N α1lg lg )(21.01lg 0030.08051.00016.05916.0lg ⎥⎦⎤⎢⎣⎡⨯= 7. 某原料气组成如下: 组分CH 4C 2H 6 C 3H 8 i-C 4H 10 n-C 4H 10 i-C 5H 12 n-C 5H 12 n-C 6H 14 y 0(摩尔分率)先拟用不挥发的烃类液体为吸收剂在板式塔吸收塔中进行吸收,平均吸收温度为38℃,压力为,如果要求将i-C 4H 10回收90%。
试求: ①为完成此吸收任务所需的最小液气比。
②操作液气比为组小液气比的倍时,为完成此吸收任务所需理论板数。
③各组分的吸收分率和离塔尾气的组成。
④求塔底的吸收液量解:由题意知,i-C 4H 10为关键组分 由P=,t 平=38℃ 查得K 关= (P-T-K 图)①在最小液气比下 N=∞,A 关=中关=关关)(A K V L ⋅=min = ⨯=②.min 1.1)(V L V L==⨯所以 理论板数为48.9199.0log 9.019.099.0log 1log 1log =---=---=)()(A A N ϕϕ③它组分吸收率公式 i i VK LA =,111--=++N i N i i A A A ϕ以CH4为例: i A =032.04.175544.0==i VK Li φ=32.01032.099.0032.0148.9148.9=--++V1(CH4)=(1-iφ)VN+1=()⨯=④塔内气体平均流率:10.902190.80100=+=v Kmol/h塔内液体平均流率:L=905.9281.19000+=++L L L )(由v l=;∴0L=h8. 乙醇-苯-水系统在,64.86℃形成恒沸物,其组成为%乙醇a.,%苯b.和%水c.,利用恒沸点气相平衡组成与液相组成相等这样有利条件,计算在64.86℃等温分离该恒沸混合液成为三个纯液体产物所需的最小功。
解:在等温等压条件下,将其分离成纯组分时所需最小功为 设为理想溶液,1=Fi γ,若kmol n F 1=9. 含乙烯%的乙烯-乙烷混合物于2Mpa 压力下进行蒸馏,塔顶为纯乙烯,温度为239K ,塔釜为纯乙烷、温度为260K ,正常操作下,塔釜加入热量为8800kJ/kg 乙烯,试计算分离净耗功为多少解:设环境温度K T 2980=,kmol n F 1=,乙烯的量为kg 424.826324.01=⨯⨯= 10.计算题9的热力学效率。
解:∑-=-Fi Fi F T y y RT n W ln min,11.12.将含丙稀80%(摩尔)和丙烷20%的料液在常压下分离为含丙稀%和5%的两股产品,试求分离最小功。
设料液和产品均处于环境温度298K ,料液可以当作理想溶液。
解:设料液量为1kmol ,计算两股产品的量: 联列解得:=1Q n , =2Q n 分离最小功由式(6-15)计算:min w T 0= T 0=Kmol料液13. 一轻烃混合物进行精馏塔的计算,求得最小回流比Rm=,最小理论板数Nm=。
求回流化为R=,全塔平均板效率为n =,所需最小塔板板数。
R =×= 由此图查,得:由于,Nm =所以,N = 实际板数为:==33块14.某厂裂解气组成(摩尔%)如下:%氢、%甲烷、乙烯、%乙烷、% 丙烯、异丁烷、所用的吸收剂中不含所吸收组分。
