非金属卤化物
金属非金属化学方程式整理全

金属+非金属化学方程式整理(全)
一、金属与非金属反应生成卤化物
1.金属与氯气反应:
Mg + Cl2点燃MgCl2
2.金属与溴反应:
2Na + Br2点燃NaBr
3.金属与碘反应:
2K + I2点燃KI
二、金属和非金属反应生成氮化物
4.金属与氮气反应:
Mg + N2点燃Mg3N2
三、金属和非金属反应生成氧化物
5.金属与氧气反应:
4Al + 3O2点燃2Al2O3
四、金属和非金属反应生成硫化物
6.金属与硫反应:
Fe + S点燃FeS
五、金属和非金属反应生成碳化物
7.金属与碳反应:
2Mg + C3MgC
以上仅是一般常见的金属和非金属反应的化学方程式,这些反应具有一些通用的反应特点。
在实际的化学过程中,具体的反应条件和物质性质可能会导致这些反应具有一些特定的差异。
因此,在使用这些化学方程式时,应该根据实际实验条件和要求进行调整。
卤族元素
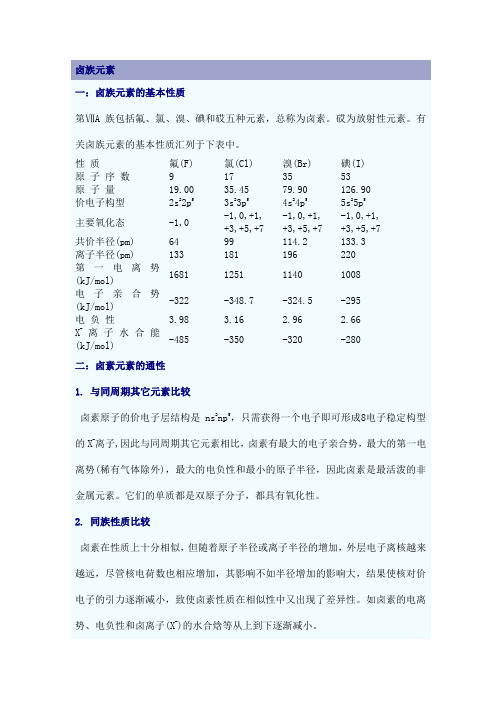
卤族元素一:卤族元素的基本性质第ⅦA族包括氟、氯、溴、碘和砹五种元素,总称为卤素。
砹为放射性元素。
有关卤族元素的基本性质汇列于下表中。
性质氟(F) 氯(Cl) 溴(Br) 碘(I)原子序数9 17 35 53原子量19.00 35.45 79.90 126.90价电子构型2s22p53s23p54s24p55s25p5主要氧化态-1,0 -1,0,+1,+3,+5,+7-1,0,+1,+3,+5,+7-1,0,+1,+3,+5,+7共价半径(pm) 64 99 114.2 133.3离子半径(pm) 133 181 196 220第一电离势(kJ/mol)1681 1251 1140 1008电子亲合势(kJ/mol)-322 -348.7 -324.5 -295电负性 3.98 3.16 2.96 2.66X-离子水合能(kJ/mol)-485 -350 -320 -280二:卤素元素的通性1. 与同周期其它元素比较卤素原子的价电子层结构是ns2np5,只需获得一个电子即可形成8电子稳定构型的X-离子,因此与同周期其它元素相比,卤素有最大的电子亲合势,最大的第一电离势(稀有气体除外),最大的电负性和最小的原子半径,因此卤素是最活泼的非金属元素。
它们的单质都是双原子分子,都具有氧化性。
2. 同族性质比较卤素在性质上十分相似,但随着原子半径或离子半径的增加,外层电子离核越来越远,尽管核电荷数也相应增加,其影响不如半径增加的影响大,结果使核对价电子的引力逐渐减小,致使卤素性质在相似性中又出现了差异性。
如卤素的电离势、电负性和卤离子(X-)的水合焓等从上到下逐渐减小。
虽然卤素的性质具有差异性,但氟与其它卤素间的差异尤为显著。
这是因为氟原子的半径很小造成的。
氟元素的特殊性见氟的性质部分。
三:卤素元素电势图卤素元素标准电极电势值如下所示。
卤素单质一:物理性质卤素单质的一些物理性质列于下表中。
性质氟氯溴碘通常条件聚集状态气气气气颜色淡黄黄绿红棕紫黑毒性剧毒毒性大毒毒性较小熔点(K) 53.38 172.02 265.92 386.5 沸点(K) 84.86 238.95 331.76 457.35 密度(g/cm3) 1.11(l) 1.57(l) 3.12(l) 4.93(s)溶解度(g/100g 水,293K) 分解水(放出O2)0.732(有反应)3.58 0.029离解能(kJ/mol) 154.8 239.7 190.16 148.95 标准电极电势Eθ(V)X 2+2e=2X-2.87 1.36 1.07 0.54卤素单质由双原子分子组成。
卤化物的水解

卤化物水解摘要:卤化物的水解性是卤化物常见且十分重要的化学性质,它与无机物的制备、用途密切相关。
卤化物可以分为金属卤化物和非金属卤化物两种。
实验事实告诉我们,在金属卤化物中,如KCl、NaCl、BaCl2等不发生水解。
有的卤化物可以水解,有的却不能发生水解。
如何解释这些实验现象,深入讨论影响卤化物水解的内在因素,对于进一步认识卤化物水解的本质无疑是有益的。
关键词:卤化物水解空轨道目录:引言(绪论)1.金属卤化物的水解1.1离子极化作用对金属卤化物水解影响2.非金属卤化物水解2.1.SN1和SN2反应2.1.1离解机理2.1.2缔合机理2.1.3交换机理2.2中心原子的空轨道对非金属卤化物水解影响2.3空间效应对非金属卤化物水解影响2.4电负性对非金属卤化物水解影响2.5其他原因对非金属卤化物水解影响3.结论1.金属卤化物的水解金属卤化物的水解主要是金属阳离子的水解,卤阴离子除Fˉ水解外,其它Clˉ、Brˉ、Iˉ离子几乎不水解。
金属卤化物属于无机盐类,它是怎么发生水解的呢?下面从几个方面具体分析。
1.1离子极化作用对金属卤化物水解的影响卤化物溶于水后,阴阳离子发生水合作用,在它们周围各配有一定数目的水分子。
如果离子的极化作用足以使配位水分子中的氢氧键断裂而金属阳离子夺取水分子中的氢氧根离子放出氢离子或阴离子(如Fˉ)夺取水中的氢离子而释放出氢氧根离子,从而破坏水的电离平衡,直到水中建立起弱碱弱酸和水的电离平衡,这个过程成为金属卤化物水解。
如此可见金属卤化物能否水解,取决于组成离子对水分子的极化能力大小。
具有高电荷和较小半径Al)对水分子有较强的极化作用,因此容易水解。
反之,低电荷较大半径的阳离子(如 3则不易水解。
离子的极化能力大小与离子的本性有关。
如果阳离子的电荷、半径、电子层构型不同,那么离子的极化能力就不同。
其卤化物的水解程度也就相应地发生改变。
因此可以说,阳离子本性是决定金属卤化物是否水解的关键,阳离子的电荷数、半径、电子层构型等是影响金属卤化物水解的内在因素。
元素化学 第三章 卤素

卤素的歧化反应(与碱的作用)
卤素的歧化反应与溶液的pH值有关,当氯水溶 液的PH>4时,歧化反应才能发生,pH<4时则Cl-被 HClO氧化生成Cl2。碱性介质有利于氯、溴和碘的歧 化反应。 冷 X2+2OH-===X-+XO-+H2O(X=CI2、Br2)
热 -===5X-+XO -+3H O(X=CI 、Br 3X2+6OH 3 2 2 2、I2)
主要用于制药物 (medication),感光材料sensitization material),汽油抗震的添加剂 (additive) C2H2Br2,镇静 剂安眠药(soporific )(NaBr、KBr、NH4Br)三溴合剂。 4、碘iodine Cl2、Br2 (适量)+2I- ==== I2 + 2Cl-,2Br-
15
电解
H2↑ + Cl2↑ + 2NaOH 2Na + Cl2↑
2NaCl(熔) 电解
举例:氯气的漂白性: 氯气与水生成次氯酸,可使有机色素永久性漂白。
16
17
用饱和食盐水制备氯气的装置图
18
19
3、溴bromine Cl2通入已提纯过NaCl的pH = 3.5的海水 Cl2 + 2Br- = 2Cl- + Br2(e) 用空气吹出液态溴使其溶于Na2CO3 一吨海水可提 0.14公斤Br2
SnCl2 + H2O → Sn(OH)Cl↓ + HCl SbCl3 + H2O → SbOCl ↓ + 2HCl BiCl3 + H2O → BiOCl ↓ + 2HCl 加酸抑制其水解
卤化物的水解规律

卤化物的水解规律卤化物的水解规律是化学领域中一项重要的研究课题。
卤化物是指由卤素与金属或非金属元素组成的化合物。
一般来说,卤化物在水中可发生水解反应,这意味着卤化物会与水分子发生化学反应,产生新的化合物。
卤化物的水解规律与其化学性质和反应条件密切相关。
下面将分别讨论卤化物的水解规律。
首先,我们来看一下氯化物的水解规律。
氯化物是最常见的卤化物之一。
当氯化物溶于水时,会发生水解反应,生成氯离子和氢氧根离子。
这是因为水分子是一个极性分子,可以将氯化物中的氯离子和氢氧根离子解离出来。
水解反应的方程式如下:Cl- + H2O → Cl- + OH-其次,我们来看一下溴化物的水解规律。
溴化物与氯化物类似,也会发生水解反应。
当溴化物溶于水时,会生成溴离子和氢氧根离子。
水解反应的方程式如下:Br- + H2O → Br- + OH-最后,我们来看一下碘化物的水解规律。
碘化物溶于水时,也会发生水解反应,生成碘离子和氢氧根离子。
水解反应的方程式如下:I- + H2O → I- + OH-总结起来,卤化物溶于水后会发生水解反应,生成相应的卤离子和氢氧根离子。
水解规律可以用化学方程式来表达,方便我们理解和预测卤化物的水解情况。
在实际应用中,了解卤化物的水解规律具有广泛的指导意义。
例如,在环境保护领域,我们可以通过研究卤化物的水解规律来评估其对水体的污染程度和对生态系统的影响。
在工业生产中,了解卤化物的水解规律可以帮助我们选择适当的处理方法,有效减少废水中的卤离子含量。
综上所述,卤化物的水解规律对于理解卤化物的化学性质、预测其水解产物以及指导实际应用具有重要意义。
通过深入研究和理解卤化物的水解规律,我们可以更好地应用卤化物,在科学研究和工程技术中发挥其重要作用。
卤化物 多卤化物

❖ 多卤化物中,若有 F 则肯定生成 MF,因为 MF 晶 格能大,稳定性高,而MClFBr不能存在。多卤化 物分解倾向于生成晶格能高的更稳定的物质。
❖ 2) 水解反应 :
❖ 从反应结果可知:高价态的中心原子和 OH结合生成含氧酸,低价态的配体与 H+ 结合生 成氢卤酸。
金属卤化物键型及熔点沸点等性质的 递变规律
同周期卤化物 自左向右随阳离子电
荷数升高
键型从离子型 过渡到的不同卤化物从F到I 随着离子半径的逐渐增大性质的递变规律
❖ 1.极化率逐渐变大
❖ 2.键的离子性逐渐减小
❖ 3.共价性依次增大
卤化钠 熔点/℃ 沸点/℃ 卤化铝 熔点/℃ 沸点/℃
增大而增高; ● 某些低氧化态 d 区金属往往形成含有金属-金属键
并显示金属光泽的卤化物。
非金属卤化物
❖ 非金属硼、碳、硅、氮、磷等都能与卤素形成 各种相应的卤化物,且为共价型卤化物
卤化硅的熔沸点
卤化硅
SiF4 SiCl4
SiBr4 SiI4
熔点/℃ -90.3 -68.8
5.2
120.5
沸点/℃
力学上稳定
卤化物的制备
❖ 1. 金属卤化物的制备:干法和湿法 (1) 卤化氢与相应物质作用 (湿法)
❖ (2) 氧化物的卤化(干法) 通常把这种反应在热力学上称耦合反应。
(3)无水金属卤化物的制备
● 以金属为起始物的反应(干法): 2 Al(l) + 3 Cl2 (g) 600~750 ℃ 2 AlCl3 (s)
SnCl2 246.9 623 SbCl3 73.4 220.3
SnCl4 -33 114.1 SbCl5 3.5
卤化物知识概要

卤化物(2010.3)王振山一、概述周期表中除了He、Ne和Ar外,其它元素几乎都能与X2化合生成卤化物。
1、卤化物的定义:狭义:卤素与电负性较小的元素所形成的化合物才称为卤化物。
广义:卤化物也包括卤素与非金属、氧化值较高的金属所形成的共价型卤化物,如SF6、UF6、SnCl4等。
氟单质具有强氧化性且氟原子半径小,所以元素在氟化物中可以显最高氧化态,如SiF4、SF6、IF7、OsF8,又如银的卤化物一般为AgX,而氟化物可以有AgF2。
按Cl- Br-I的顺序,X -离子的还原性依次增强,所以高氧化态卤化物的稳定性则依次减弱。
在碘化物和溴化物中,元素可以显较低氧化态。
所以元素在形成碘化物时,往往表现较低的氧化态,例如,FeI2、CuI、Hg2I2,而无Cu(II)、Fe(III)的碘化物存在。
2、分类:卤化物一般分为离子型和共价型卤化物,但其间很难有严格的界限。
其离子性随金属氧化数的增高、半径减小而减弱,逐渐由离子型向共价型转化。
卤化物又可分为金属卤化物和非金属卤化物两大类。
⑴、离子型:形成:碱金属元素(除锂外)、碱土金属(除铍外)和若干镧La系元素、锕Ac系元素,它们的电负性小、离子半径大,且基本上是球形对称的离子,所形成的的卤化物是典型的离子型化合物,某些低氧化态的过渡元素的卤化物以离子型为主。
例如CsF,NaCl,BaCl2,LaCl3。
性质:它们有高的熔、沸点和低挥发性,在极性溶剂中易溶解,其溶液具有导电性,熔融状态时也能导电。
*BeCl2是共价化合物,在气态为双聚分子(BeCl2)2(在773~873K下),温度再高时,二聚体解离为单体BeCl2,在1273K完全离解。
固态BeCl2具有无限长链结构。
在BeCl2(g)中Be为sp杂化,直线型。
在双聚体(BeCl2)2(g)中Be为SP2杂化。
在固态BeCl2中Be为SP3杂化。
⑵、共价型卤化物:形成:由非金属元素或高氧化态(≥+Ⅲ)金属元素形成的卤化物,不论气相、液相或固相,往往形成共价型卤化物分子。
无机非金属材料知识点

无机非金属材料知识点一、重要概念1、无机非金属材料①以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料。
②是除有机高分子材料和金属材料以外的所有材料的统称。
2、陶瓷①从制备上开看,陶瓷是由粉状原料成型后在高温作用下硬化而形成的制品。
②从组分上来看,陶瓷是多晶、多相(晶相、玻璃相和气相)的聚集体。
3、玻璃①狭义:熔融物在冷却过程中不发生结晶的无机物质②一般:若某种材料显示出典型的经典玻璃所具有的各种特征性质,则不管其组成如何都可称为玻璃(具有玻璃转变温度Tg)。
玻璃转变温度:热膨胀系数和比热等物理性质的突变温度。
具有Tg的非晶态材料都是玻璃。
4、水泥凡细磨成粉末状,加入适量水后,可成为塑性浆体,既能在空气中硬化,又能在水中硬化,并能将砂、石、钢筋等材料牢固地胶结在一起的水硬性胶凝材料,通称为水泥。
5、耐火材料耐火度不低于1580℃的无机非金属材料6、复合材料复合材料是两种或两种以上物理、化学性质不同的物质组合而成的一种新的多相固体材料。
通过复合效应获得原组分所不具备的性能。
可以通过材料设计使各组分的性能互相补充并彼此关联,从而获得更优秀的性能。
二、陶瓷知识点1、陶瓷制备的工艺步骤原材料的制备→坯料的成型→坯料的干燥→制品的烧成或烧结2、陶瓷的天然原料①可塑性原料:黏土质陶瓷成瓷的基础(高岭石、伊利石、蒙脱石)②弱塑性原料:叶蜡石、滑石③非塑性原料:减塑剂:石英助熔剂:长石3、坯料的成型的目的将坯料加工成一定形状和尺寸的半成品,使坯料具有必要的机械强度和一定的致密度4、陶瓷的成型方法①可塑成型:在坯料中加入水或塑化剂,制成塑性泥料,然后通过手工、挤压或机加工成型;(传统陶瓷)②注浆成型:将浆料浇注到石膏模中成型③压制成型:在金属模具中加较高压力成型;(特种陶瓷)5、烧结将初步定型密集的粉块(生坯)高温烧成具有一定机械强度的致密体。
固相烧结:烧结发生在单纯的固体之间液相烧结:有液相参与,加助溶剂产生液相好处:降低烧结温度,促进烧结6、陶瓷的组织结构:晶相、玻璃相、气相①晶相:陶瓷的主要组成;分为主晶相和次晶相②玻璃相:玻璃相对陶瓷的机械强度、介电性能、耐热性等不利,不能成为陶瓷的主导组成部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主要教学目标:
1.了解卤素及其重要化合物的制备、用途及在性质上 的一些递变规律; 2.氟的一些特殊的性质; 3.掌握卤素单质、氢化物、含氧酸及其盐的结构、性 质、制备和用途; 4.掌握元素电势图,并能较熟练地判断卤素及其化合 物的氧化还原性以及它们之间的相互转化关系。
重点与难点
然是个最强的氧化剂。
1 2
F2(g)
1 2
解离能 78.5 F(g)
电子亲和 -327.9
能F-(g)水-5合07能F-(aq)
78.5-327.9-507=-756.5k J/mol
1 2
1 Cl22
解离能 电 121.3 Cl(g)
子亲和 -348.8
能Cl-(g)水-3合68能
Cl-(aq)
121.3-348.8-368=-595.5k J/mol
12.2 卤素单质及其化合物
§12.2.1 单质物理性质 §12.2.2 单质化学性质 §12.2.3 单质的制备 §12.2.4 卤化氢和氢卤酸 §12.2.5 卤化物和卤素互化物 §12.2.6 卤素的含氧酸及其盐
12.2.1 单质物理性质
室温聚集态 b.p./℃ m.p/℃
颜色 分子间力
F2
氧化性 :
BrO3-/Br2 1.51
卤素及其化合物的氧化还原性以及它们之 间的相互转化关系。
12.1 卤素的通性
一、结构特征和基本性质
氟
氯
原子序数 原子量 价电子层结构 共价半径/pm X-离子半径/pm 电负性(Pauling) 第一电离能/(kJ·mol-1) 电子亲和能/(kJ·mol-1) △fHmΘ(X-,aq)(kJ·mol-1) EΘ(X2 /X-)/ V
IO3
PH 9
2-5 置换反应
根据EF2/F-> E > Cl2/Cl- E > Br2/Br- E I2/I-
2.87 1.36 1.07
0.54
原子序数小的卤素能将原子序数大的卤 素从卤化物中置换出来
例如: 2KI+Cl2 → I2+ 2KCl 2KBr+Cl2 → Br2+ 2KCl Br2+2KI → 2KBr+I2
习题: P558 T4
12.2.2 单质化学性质
2-1 与金属、非金属的反应
F2 ,Cl2 可与所有金属化合 Br2,I2可与除贵金属以外的金属化合 卤素可与所有非金属(除氧、氮、稀有气体)化合
例: 2 S(s) + Cl2(g) == S2Cl2(l) (红黄色液体)
S(s) + Cl2(g)(过量) ==SCl2(l) (深红色发烟液体) 2 P(s) + 3 Cl2(g) == 2 PCl3(l) (无色发烟液体) Xe)(过量) + F2(g== 2XeF2(s) P228
• 另一类是氯、溴与水的反应——歧化反应
X2 +2H2O = H3O + +X- +HXO (X= Cl,Br) 这类反应进行的程度与溶液的pH密切相关。碘
的水溶液是稳定的。
常温
Cl2 PH 4 Br2 PH 6
ClOBrO3
加热 低温
ClO3 ClOBrO3 BrO (0O C)
2-4 与碱的反应
歧化反应
X2 2OH X XO H2O
3X 2
6OH
5X
_
XO
3
3H 2O
常温
加热
低温
Cl2 ClO-
ClO3 ClO-
PH 4
Br2
BrO3
I2
IO3
BrO3 IO3
BrO (0O C) PH 6
结论
2.单质呈双原子分子
氟的特性
氟的原子半径特别小,其核周围电子密 度较大,当它接受外来一个电子或共用 电子对成键时,将引起电子间较大的斥 力,这种斥力部分地抵消了气态氟形成 气态氟离子,或氟形成单质分子时所放 出的能量。所以氟的电子亲合势小于氯.
尽管氟的电子亲合势反常
地小于氯,但因F2的离解 能 较 小 , F- 离 子 的 水 合 能 较大,所以氟在卤素中仍
碘
53 126.904 5s25p5
133 216 2.66 1015 -295 -56.9 0.5355 -1, +1,+3 +5,+7
卤素单质的化学性质:
F2
E (X 2 /X )/V: 2.87
Cl2 Br2
I2
1.36 1.065 0.535
单质氧化性 : 大
小
X- 还原性
小
大
: 1.体现非金属性
Cl2
g
g
-188 -34.5
- 220 -101
浅黄 黄绿
小
Br2 I2
l
s
59 183
-7.3 113
红棕 紫
大
溶解性
在水中的溶解度不大,Br2、I2易溶于有机溶剂 溴的有机溶液随溴浓度的增加颜色加深 在非极性溶剂中(CS2,CCl4,CHCl3),I2以单
质分子存在,溶液显紫色 在极性溶剂中(醇、酮),碘溶液呈棕色或棕红色
I2 与 H2 在催化剂存在并加热的条件下可反应生 成 HI,HI 更易分解。
I2(g) + H2(g) 催化剂,Δ 2 HI(g)
2-3 与水反应
• 卤素与水的反应主要有两种类型: • 一类是氧化反应,放出氧气:
2X2 +2H2O =4H+ +4X- +O2↑ 氟与水的反应属于这一类。 氟与水反应剧烈,发生燃烧。反应不仅生成 氧气,2-2 与氢作用
在低温下,暗处,F2 可与 H2 发生剧烈反应,放出大 量热,导致爆炸。
F2(g) + H2(g) == 2 HF(g) Cl2 在常温下与H2 缓慢反应, 但在紫外光照射下, 可发生爆炸的链鎖反应。
Cl2(g) + H2(g)h=v= 2 HCl(g)
以金属 Pt 为催化剂, 加热到 350℃, Br2 可与 H2 反应。 但高温下 HBr 不稳定, 易分解。 Br2(g) + H2(g) Pt,350℃ 2 HBr(g)
氧化数
9 18.8 2s225 64 136 3.98 1687 -328 -332.6 2.866
-1
17
35.453 3s23p5
99
181
3.16
1257
-349
-167.2 1.3583 -1, +1,+3 +5,+7
溴
35 79.904 4s24p5
114 195 2.96 1146 -325 -121.55 1.0662 -1, +1,+3 +5,+7
