开放周学案铁的化合物
铁的化合物教学设计方案

一、教学目标1. 知识与技能目标:- 学生能够了解铁及其化合物的性质,包括铁的氧化还原性质、酸碱性质、与水反应的性质等。
- 学生能够通过实验操作,观察和记录铁及其化合物的反应现象,并能解释这些现象。
- 学生能够掌握铁的化合物在日常生活和工业中的应用。
2. 过程与方法目标:- 学生能够通过实验探究,培养观察、记录、分析和解决问题的能力。
- 学生能够学会使用实验仪器和化学试剂,掌握实验操作的基本技能。
3. 情感态度与价值观目标:- 学生能够培养对化学学科的兴趣,增强科学探究的欲望。
- 学生能够认识到化学知识在解决实际问题中的重要性,树立科学的态度和价值观。
二、教学内容1. 铁的性质:铁的物理性质、化学性质(氧化还原性、酸碱性质等)。
2. 铁的化合物:氧化铁(Fe2O3、Fe3O4)、氢氧化铁(Fe(OH)3)、硫酸铁(FeSO4)、氯化铁(FeCl3)等。
3. 铁的化合物反应:铁与氧气、酸、碱的反应,铁的氧化还原反应等。
4. 铁的化合物应用:在钢铁工业、农药、染料、医药等领域的应用。
三、教学过程(一)导入1. 展示生活中常见的铁制品,如铁锅、铁钉等,引发学生对铁的兴趣。
2. 提问:铁在日常生活中有哪些用途?铁有什么特殊的性质?3. 引出课题:铁的化合物。
(二)新课讲授1. 铁的性质:- 物理性质:铁的颜色、硬度、密度等。
- 化学性质:铁与氧气、酸、碱的反应。
- 氧化还原性质:铁的氧化还原反应。
2. 铁的化合物:- 氧化铁:Fe2O3、Fe3O4的性质、制备方法、应用。
- 氢氧化铁:Fe(OH)3的性质、制备方法、应用。
- 硫酸铁:FeSO4的性质、制备方法、应用。
- 氯化铁:FeCl3的性质、制备方法、应用。
3. 铁的化合物反应:- 铁与氧气、酸、碱的反应。
- 铁的氧化还原反应。
4. 铁的化合物应用:- 钢铁工业:铁的冶炼、合金制备。
- 农药:农药中的铁化合物。
- 染料:染料中的铁化合物。
- 医药:医药中的铁化合物。
铁及其化合物导学案完整

铁及其化合物导学案完整一、铁的概述铁是一种非常常见的元素,化学符号为Fe,原子序数为26。
它是地壳中含量最丰富的金属元素之一,广泛用于建筑、制造业等领域。
铁具有良好的导电性和导热性,同时也是人体必需的营养元素之一。
二、铁的性质1. 物理性质铁是一种具有银白色的金属,具有较高的密度和强度。
它的熔点为1535°C,沸点为2750°C。
在常温下,铁是固体状态。
2. 化学性质铁在空气中会与氧气反应生成铁的氧化物,形成铁锈。
铁也可以与硫、氮等元素形成化合物。
此外,铁可以与酸反应产生相应的盐。
三、铁的化合物1. 氧化反应铁可以与氧气发生氧化反应,形成两种不同的化合物:FeO和Fe2O3。
其中,FeO为黑色的物质,Fe2O3为红色的物质。
2. 硫化反应铁也可以与硫反应,形成FeS的化合物。
这种化合物在水中会产生硫化氢气味,有较强的臭味。
3. 氯化反应铁和氯气反应会生成FeCl2和FeCl3两种不同的氯化物。
FeCl2为绿色晶体,FeCl3为黄褐色晶体。
四、铁的用途1. 工业领域铁在工业上被广泛应用于制造钢铁、建筑材料、机械设备等。
其中,钢铁是铁与碳以及其他合金元素的混合物,在建筑、制造业中起着重要的作用。
2. 生活用途铁也在我们的日常生活中发挥着重要的作用。
例如,我们常常用铁制的锅、勺子等炊具;铁制的家具、器皿等都是我们生活中常见的物品。
3. 营养需求铁是人体必需的营养元素之一,它参与了血红蛋白和肌红蛋白的合成,对于人体的造血功能至关重要。
缺乏铁元素会引发贫血等健康问题。
五、铁的环境影响由于铁是一种金属元素,大量的铁在自然界中会对环境产生一定的影响。
例如,铁的氧化反应会形成铁锈,导致金属锈蚀。
此外,不适当的铁的排放会对水质等环境因素产生负面影响。
六、结语铁是一种重要的金属元素,具有广泛的应用价值。
我们应该在合理使用铁的同时,注意对环境产生的影响,以保护我们的生活环境。
同时,合理补充铁元素也是保持健康的重要举措之一。
铁及铁的化合物优秀教案

第二节铁和铁的化合物要点巧记精讲一、铁的结构和性质【巧记】1.铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O4 2Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应: 3Fe+4H2O= Fe3O4+4H2↑③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+3.生铁与钢的比较铁的合金生铁钢含碳量2%~4.3% 0.03%~2%其它杂质含硅、锰、硫、磷较多含硅、锰少量,硫和磷几乎没有机械性能硬而脆、无韧性硬而韧、有弹性机械加工可铸不可锻可铸、可锻、可压延炼铁炼钢原料铁矿石、焦炭、石灰石、空气生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂化学原理在高温下用还原剂从铁矿石里还原出来在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去主要反应①还原剂的生成C+O2CO2CO2+C高 温2CO②铁的还原①氧化:2Fe+O2高 温2FeOFeO氧化铁水里的Si、Mn、C等。
如C+FeO高 温Fe+CO【精讲】1.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
铁的重要化合物 导学案

铁的重要化合物导学案铁的重要化合物导学案一、学习目标1、了解铁的重要化合物的性质和分类。
2、掌握常见铁化合物的制备方法和应用领域。
3、理解铁化合物在日常生活和工业生产中的重要作用。
二、知识梳理1、铁的氧化物:1、定义:铁与氧气反应生成的化合物。
2、分类:氧化亚铁(FeO)、氧化铁(Fe2O3)、氧化亚铁(Fe3O4)。
3、性质:不溶于水,呈现不同颜色。
2、铁的氢氧化物:1、定义:铁与氢氧根离子反应生成的化合物。
2、分类:氢氧化亚铁(Fe(OH)2)、氢氧化铁(Fe(OH)3)。
3、性质:难溶于水,呈现不同颜色。
3、硫酸亚铁:1、定义:由硫酸与铁反应生成的化合物。
2、性质:溶于水,呈现绿色。
4、氯化铁:1、定义:由氯气与铁反应生成的化合物。
2、性质:溶于水,呈现黄色。
5、铁盐的反应:1、氢氧化亚铁与氧气反应生成氢氧化铁:4Fe(OH)2 + O2 + 2H2O →4Fe(OH)3。
2、氢氧化铁与硫酸反应生成硫酸铁:Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O。
3、硫酸铁与氢氧化钠反应生成氢氧化铁:Fe2(SO4)3 + 6NaOH →2Fe(OH)3 + 3Na2SO4。
三、问题探究1、为什么氧化亚铁会呈现黑色,而氧化铁会呈现红色?2、氢氧化亚铁和氢氧化铁的性质有何不同?为什么?3、你能列举出硫酸亚铁和氯化铁在生活和工业中的应用吗?4、请设计一个实验,制备硫酸亚铁并观察其溶解性。
四、课堂互动1、请学生走上讲台,讲解自己对于铁的重要化合物及其应用的理解。
2、分小组进行讨论,探讨以下问题:如果你是钢铁厂的工程师,你会如何利用铁的化合物提高钢铁的质量和产量?3、各小组派代表分享讨论成果,全班一起评价和改进方案。
五、课堂小结本节课我们学习了铁的重要化合物及其性质和应用,包括氧化物、氢氧化物、硫酸盐和氯化物等。
这些化合物在生活和工业中有着广泛的应用,比如硫酸亚铁可以用于印染、造纸等行业的染色剂,氯化铁可以用于制作腐蚀剂等。
学案9铁及其化合物及答案
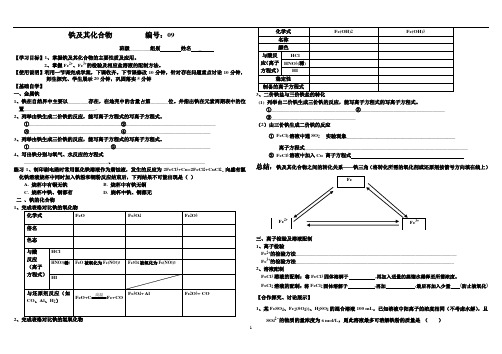
1、铁在自然界中主要以________存在,在地壳中的含量占第_______位。
并指出铁在元素周期表中的位置____________________________.2、列举由铁生成二价铁的反应,能写离子方程式的写离子方程式。
①____________________________________②___________________________________ ③____________________________________④_________________________________ 3、列举由铁生成三价铁的反应,能写离子方程式的写离子方程式。
①________________________________②_____________________________________ 4、写出铁分别与氧气、水反应的方程式_________________________________、____________________________________练习1、制印刷电路时常用氯化铁溶液作为腐蚀液,发生的反应为2FeCl 3+Cu=2FeCl 2+CuCl 2.,向盛有氯化铁溶液烧杯中同时加入铁粉和铜粉反应结束后,下列结果不可能出现是( ) A. 烧杯中有铜无铁 B. 烧杯中有铁无铜 C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无 二 、铁的化合物12、完成表格对比铁的氢氧化物3、二价铁盐与三价铁盐的转化(1) 列举由二价铁生成三价铁的反应,能写离子方程式的写离子方程式。
①_________________________________②_________________________________③_________________________________ (2)由三价铁生成二价铁的反应① FeCl 3溶液中通SO 2实验现象________________________________________________________________离子方程式________________________________________________________________ ② FeCl 3溶液中加入Cu 离子方程式总结: 铁及其化合物之间的转化关系——铁三角(将转化所需的氧化剂或还原剂按箭号方向填在线上)三、离子检验及溶液配制1、离子检验Fe 2+的检验方法_______________________________________________________________ Fe 3+的检验方法______________________________________________________________ 2、溶液配制FeCl 3溶液的配制:将FeCl 3固体溶解于 ,再加入适量的蒸馏水稀释至所需浓度。
铁的重要化合物学案

第二节几种重要的金属化合物第3课时铁的重要化合物课前预习学案一、预习目标1、了解铁在自然界中的含量和存在形式2、了解铁的氧化二、预习内容1、铁在地壳中的含量仅次于、和,居第位,主要以和化合物形式存在。
在Fe2O3中铁的化合价是,FeO中铁的化合价是。
2、铁在空气中容易,因为不能保护内层金属。
三、提出疑惑疑惑点疑惑内容课内探究学案一、学习目标1、掌握铁的氧化物、氢氧化物的主要性质2、掌握Fe3+的检验及氧化性3、Fe(OH)2的制备和Fe、Fe2+、Fe3+之间的相互转化二、学习过程1、课前热身铁在自然界中的含量居第_______位,主要以________存在铁是人体内需要的__________元素。
一般人的体内含铁量为4.2~6.1g,相当于一个小铁钉的重量,约占人体体重的0.004%,____________中的铁是体内氧的输送者。
常见的补铁剂应该补充的是+2还是+3价的铁?2、铁的氧化物名称氧化亚铁四氧化三铁氧化铁化学式俗名——3、铁的氢氧化物【思考空间】1. Fe(OH)2在空气中加热能得到FeO吗?2.能否通过化合反应制得Fe(OH)3?3.制备Fe(OH)2时,需注意哪些问题?4、铁盐和亚铁盐3+____色_______色,可以利用该反应检验Fe3+的存在向FeCl2溶液中加入KSCN溶液溶液的颜色________(2)Fe2+和Fe3+的鉴别方法①颜色:Fe 2+Fe3+.②KSCN法:滴入KSCN溶液,呈______ 色的溶液中含有Fe3+③碱液法:分别加入碱液(或氨水),生成色沉淀的溶液中含有Fe3+,先生成色沉淀,又迅速转变为色,最后变为的溶液中含有Fe2+【小结】(1)Fe3+的检验①试剂:KSCN溶液或NaOH溶液②现象:溶液显红色或产生红褐色沉淀(2)Fe2+和Fe3+的转化①Fe3+Fe2+②Fe2+Fe3+(3)Fe2+的检验①加NaOH溶液②先加入KSCN,没现象,通入Cl2,变红(3)Fe2+,Fe3+,Fe(OH)2,Fe(OH)3之间的相互转化5、明矾和铁盐的净水作用明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成______________沉降下来,使水澄清,可用做____________。
铁的化合物课堂导学案
§4.2 铁的重要化合物(理科) 学习目标:1.掌握铁及其重要化合物的性质和用途; 2、学会Fe 2+、Fe 3+离子的检验方法。
3、掌握Fe 、Fe 2+、Fe 3+铁三角的转化关系 4、积极讨论,踊跃展示,体验学习中的快乐。
重点:1.掌握铁及其重要化合物的性质和用途; 2、学会Fe 2+、Fe 3+离子的检验方法。
难点:掌握Fe 、Fe 2+、Fe 3+铁三角的转化关系一、教材助读(请你从教材中找到下列内容后勾画出来,并加强记忆)铁的化合物:(一)铁的常见氧化物有: 、 、 。
其中黑色的是 ,红棕色的是 。
它们均能被强酸(如盐酸)溶解生成盐和水,请分别写出离子方程式。
铁的氧化物与铝粉混合,都被称为 剂,高温下发生 反应。
(二)铁的氢氧化物1、Fe(OH)2是一种 色不溶物,能溶于酸:Fe(OH)2+ HCl —— ,它不稳定,易于与O 2反应,因而具有较强的 性: Fe(OH)2 + O 2+ H 2O--- 。
【思考1】完成下列化学方程式: Fe(OH)2 + HNO 3(稀)——2、Fe(OH)3是一种 色不溶物,能溶于酸:Fe(OH)3+HCl —— ,受热能分解:Fe(OH)3—— 。
Fe 2O 3呈粉末状,俗名 。
【注:“铁锈”是带有若干结晶水的氧化铁(Fe 2O 3·n H 2O),块状,结构疏松】【思考2】如何制备Fe(OH)2 ?(可供选择的药品有:Fe 、HCl 、FeCl 3、FeSO 4、NaOH 、蒸馏水、苯或植物油等有机溶剂,仪器任选。
) (制备方法及改进方法可参照创新课堂 课时3 本节提升部分 )(三)铁盐与亚铁盐(以FeCl 3、FeSO 4等为例)1、Fe 3+ 的氧化性:Fe 3+ 氧化大多数金属,包括铁单质:FeCl 3溶液遇Fe__________________________, FeCl 3溶液和铜反应_______________________2、Fe 2+ 既有氧化性,Fe 2+与Zn 反应_______________________又有还原性:Fe 2+与Cl 2 反应______________________它们往往带有结晶水,以上盐中,用于缺铁性贫血药物的是 ,由Fe(OH)2的性质可知,Fe 2+容易被空气 ,所以保存亚铁盐的方法是:;FeCl 3等Fe 3+溶液,是常用的氧化剂(其中氧化性:Br 2>Fe 3+>I 2,则其他氧化剂如酸性高锰酸钾、硝酸、浓硫酸、过氧化物、Cl 2等,氧化性Fe 3+),完成化学方程式:FeCl 3+Fe —— FeCl 3+Cu —— / 注:FeCl 2+Cu ——反应吗?【预习案】 【使用说明】1.认真阅读教材79~81页;2.将预习中不能解决的问题标记出来,并填写到后面“我的疑惑”处;3. 建议用“双色笔”完成导学案,以便将来复习之用。
铁及其化合物 导学案 学生版
宜春一中化学学科金属及其化合物——铁及其化合物第一课时导学案学生版审核:高三:化学备课组学生姓名:学号:学习目标:1.了解铁的主要性质及其应用。
2.了解铁的重要化合物的主要性质及其应用。
一.导入:FeCl3、FeCl2、Fe(OH)3和Fe(OH)2是否都可以通过化合反应得到?二.自主学习:1.铁的原子结构及位置铁位于元素周期表中第四周期族,原子结构示意图,最外层有2个电子,在化学反应中易失去2个或3个电子而表现为+2价或+3价。
铁在地壳中的含量占第4位。
自然界中铁元素主要以化合态形式存在。
2.铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质:铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
用化学方程式或离子方程式表示下列变化①与非金属单质的反应:a .与O 2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为 。
点燃时:b .与Cl 2的反应: 。
c .与S 的反应: 。
②与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应: 。
③与酸的反应:a .与非氧化性酸反应的离子方程式为 。
b .与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
④与某些盐溶液的反应:a .与CuSO 4溶液反应的离子方程式为 。
b .与FeCl 3溶液反应的离子方程式为 。
3.铁的应用(1)用途:用途最广泛的是铁合金——钢,用于制造不锈钢、特种钢、钢板、钢管等。
(2)制备:工业上冶炼铁的反应方程式为:3CO +Fe 2O 3=====高温2Fe +3CO 2。
深度思考1. 铁有很强的抗腐蚀能力,为什么日常生活中的铁制品容易生锈?答案 主要因为铁不纯,往往含有碳等杂质,当这些铁制品在潮湿的空气中或接触到电解质溶液(如食盐水)时会发生电化学腐蚀。
2. 铁、铝遇冷的浓硫酸或浓硝酸发生钝化,是物理变化还是化学变化?答案 常温下铁、铝遇冷的浓HNO 3、浓H 2SO 4时表面会生成一层致密的氧化物薄膜,化学上称为钝化,属于化学变化。
铁的重要化合物教案
第三章金属及其化合物第二节几种重要的金属化合物(第3课时)一、教学目标1.知识与技能(1)了解铁的氧化物的性质和应用。
(2)掌握铁的氢氧化物的制备和性质。
2.过程与方法(1)通过学习使学生学会运用观察、实验等手段获取信息,并运用分类、比较、归纳等方法对信息进行加工。
(2)初步学会通过探究性实验,使学生进一步掌握应用实验,探究研究物质性质的科学探究方法。
使学生敢于质疑、勤于思考、逐步形成独立思考的能力。
3.情感态度与价值观(1)在创设的真实教学情境中引导学生把所学知识与课堂以外的现实联系起来,激发学生学习化学的兴趣和探究欲。
(2)通过探究活动,让学生体验成功的喜悦,同时培养学生善于与他人合作的良好心理品质。
(3)提高学生将化学知识应用于生产、生活实践的意识,真正感悟到生命健康与化学的紧密联系树立服务社会的责任感和使命感。
二、教学重难点1.重点:铁的氧化物和氢氧化物的制备、性质及其化学方程式的书写。
2.难点:铁的氢氧化物的制备、性质及其化学方程式的书写。
三、教学过程导入:在我们的生活中,经常会听到缺铁性贫血这种疾病,而治疗贫血常会用到硫酸亚铁缓释片;在超市我们也会看到铁强化的酱油,食品中的经常会用到的脱氧保鲜剂是铁粉,由此可看出铁元素在我们的生活中起着至关重要的作用。
那么今天这节课,我们一起来学习金属铁的重要化合物。
板书:第3课时铁的重要化合物讲述:学习铁的化合物之前,我们首先回顾一下铁元素的存在,请大家观察这张图,可以看到在地壳中含量较多的前四位元素分别是氧、硅、铝、铁,由于铁的化学性质比较活泼,在自然界中均以化合物的形式存在。
在自然界中含铁元素的矿石,比如有赤铁矿、磁铁矿、菱铁矿。
过渡:接下来本节课主要从两个部分学习铁的重要化合物,首先第一部分,铁的氧化物,请大家自主阅读教材P59,小组讨论学习铁的氧化物的物理性质并完成PPT上的表格。
板书:一、铁的氧化物FeO Fe2O3Fe3O41.物理性质学生回答:四氧化三铁中铁元素是+8/3价。
校际公开课:铁的化合物(苏教版必修1)教案
化学1专题3第二单元铁、铜及其化合物的应用Fe2+、Fe3+的性质及相互转化[学情分析]在初中化学《金属与矿物》这章中,学生已知道铁与氧气、酸溶液的反应,铁与硫酸铜之间的反应。
作为高中生,他们了解铁元素在生命活动中的作用,引发他们“对铁元素在人体内如何存在?不同价态铁离子如何转化?”的思考,进而产生探究的欲望。
[教学目标]一、知识与技能1、掌握Fe2+、Fe3+的性质及相互转化。
2、学会用化学方法鉴别Fe2+与Fe3+3、系统掌握铁及其化合物的化学性质。
二、过程与方法1、在“实验--反思--再实验--再反思”的过程中,体验实验探究的方法和技能。
2、通过列表比较和图示联系的方法,在了解、掌握Fe2+、Fe3+的性质的同时,学习科学的思维方法和学习方式。
三、情感态度与价值观1、提高学习化学的兴趣,感受化学世界的奇妙与和谐。
2、培养参与化学科技活动的热情,培养将化学知识应用于生产、生活的意识。
[教学重点]Fe2+、Fe3+的性质与相互转化[教学难点]Fe2+、Fe3+的相互转化[教学方法]实验探究法、讲授法、讨论法[教学过程]【复习】铁元素在化学反应中化合价的变化。
【新课导入】切开的苹果放置久了变成黄褐色,像铁会“生锈”,为什么呢?一、探究Fe2+、Fe3+的性质【学生活动】结论:Fe的检验①含有Fe3+的溶液中加入KSCN溶液,溶液变为血红色。
离子方程式:Fe3++3SCN-=Fe(SCN)3②加入NaOH溶液,立即产生红褐色沉淀离子方程式:Fe3++3OH-=Fe(OH)3↓【学生活动】完成随堂练习。
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁外表包有一层糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效)。
试设计实验验证某硫酸亚铁药片是否已变质。
二、探究Fe2+和Fe3+的转化条件【过渡】不同价态的铁的化合物在一定条件下能够相互转化,让我们共同探究Fe2+和Fe3+的转化条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
往试管中加入少量FeCl3溶液,再逐滴加入NaOH溶液。
II
往试管中加入少量FeSO4溶液,再悬空逐滴加入NaOH溶液,振荡。
III
往试管中加入少量FeSO4溶液,将吸有NaOH溶液的长滴管伸入FeSO4溶液底部,慢慢挤出NaOH溶液。
IV
往试管中加入少量NaOH溶液,在酒精灯上加热至沸,加入植物油,冷却,将吸有FeSO4溶液中的长滴管深入溶液底什么要用新制的硫酸亚铁溶液?
2、怎样才能使Fe2+溶液长时间保存呢?
3、实验中III为什么要将滴管尖嘴插入试管里溶液的底部,且慢慢挤出NaOH溶液?
中学教学开放周学案(化学)
铁的化合物
一、铁的氧化物
FeO
Fe2O3
Fe3O4
化学名
化合价
色态
溶解性
与盐酸反应离子方程式
练习
Fe3O4中铁元素的化合价由+2价和+3价两种价态组成,平均化合价为+8/3,那么在Fe3O4中Fe2+和Fe3+个数比为。
二、铁的氢氧化物
实验探究设计
组别
实验内容
实验现象
反应的离子方程式
