AKP Km值测定
实验一底物浓度对酶促反应的影响
实验一 底物浓度对酶促反应的影响一、实验目的掌握底物浓度对酶活性的影响,了解碱性磷酸酶(Alkaline Phosphatase, AKP )的Km 值的测定原理和方法,理解Km 值的意义。
二、实验原理在温度、pH 及酶浓度等恒定的条件下,底物浓度对酶的催化作用有很大的影响。
当底物浓度较低时,酶促反应速度V 随底物浓度[S]的增高而显著加快,随着底物浓度渐高,反应速度加快程度渐小,当底物浓度增加到一定程度以上时,再增高底物浓度,反应速度亦不再增加,成为该条件下极限最大反应速度Vmax 。
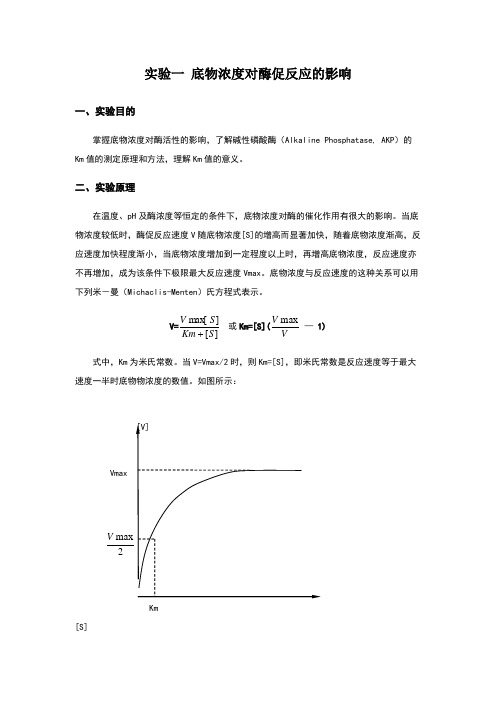
底物浓度与反应速度的这种关系可以用下列米-曼(Michaclis-Menten )氏方程式表示。
V=][]max [S Km S V 或Km=[S](VV max — 1)式中,Km 为米氏常数。
当V=Vmax/2时,则Km=[S],即米氏常数是反应速度等于最大速度一半时底物物浓度的数值。
如图所示:Km[S]图1 底物浓度与酶促反应速度的关系Km 是酶的特征性常数,不同酶的Km 值不同,同一酶作用于不同底物的Km 值亦不同。
大多数纯酶的Km 值在~100mmol/L 之间。
Km 值的测定在酶学研究中有重要的实际意义。
根据实验结果绘制上述直角双曲线,难以准确求出Km 和Vmax 值。
而用米曼氏方程式的下列变换式,则容易求得Km 及Vmax 值。
米曼氏方程式中各项皆采用倒数表示,则成为Lineweaver —Burk 氏方程式:V 1=max V Km ·][1S +max1V 如图所示:图2 Lineweaver —Burk 氏法作图求Km 值这是个上截式直线方程式。
V 1与S1为直线关系,如上图。
直线斜率为max V Km ,纵轴截距为max 1V ,横轴截距为-Km 1.据此可以测定不同浓度底物的反应速度,按V 1与S1关系作图而容易正确得出Km 值。
另有其他变换式,例如把上式两侧皆乘以[S],则转换成Wilkinson 氏方程式。
生物化学大实验-akp的浓度测定与活性检测

用于制备样品和分离细 胞或组织中的不同组分。
用于保持反应温度恒定。
用于精确移取一定量的 样品和试剂。
PART 04
实验步骤与方法
REPORTING
WENKU DESIGN
AKP的浓度测定步骤与方法
准备试剂和设备
01
根据实验要求准备所需的试剂和设备,如AKP标准品、酶标仪、
酶标板等。
配置标准品溶液
改进建议
为了更准确地测定AKP的浓度和活性,建议采取以下措施:首先,确保试剂的纯度,避免使用含有杂质或污染物 的试剂;其次,严格控制实验条件,如温度、pH值等,确保实验条件的一致性和准确性;最后,采用更先进的 检测方法和技术,如色谱法、质谱法等,以提高实验结果的准确性和可靠性。
PART 07
参考文献
数据处理
根据标准品溶液的浓度和光密 度值绘制标准曲线,并计算待
测样本中AKP的浓度。
AKP的活性检测步骤与方法
准备试剂和设备
01 根据实验要求准备所需的试剂
和设备,如底物、终止液、分 光光度计等。
配置反应体系
02 将底物溶解在适当的缓冲液中
,加入待测样本,设置空白对 照。
启动反应
03 将反应体系在恒温条件下孵育
进行AKP的浓度和活性检测。
PART 02
实验原理
REPORTING
WENKU DESIGN
AKP的浓度测定原理
酶联免疫吸附法(ELISA)
利用抗原与抗体的特异性结合,通过酶与底物反应的显色反应,测定AKP的浓 度。
分光光度法
利用特定波长下的吸光度值与AKP浓度的线性关系,通过测定吸光度值计算 AKP的浓度。
掌握AKP的浓度测定 与活性检测方法
碱性磷酸酶(AKP、ALP)的测定及医学意义

碱性磷酸酶(AKP、ALP)的测定及医学意义
1.正常参考值:
①速率法
女性:
1~12岁:<500 U/L
15岁以上:40~150 U/L
男性:
1~12岁:<500 U/L
12~15岁:<750 U/L
25岁以上:40~150 U/L
②比色法:
健康成年人:3-13 金氏单位
儿童:5-28 金氏单位
2.临床意义
碱性磷酸酶活力测定常作为肝胆疾病和骨骼疾病的临床辅助诊断的指标。
血清碱性磷酸活力增高可见于下列疾病:
①肝胆疾病:阻塞性黄疸、急性或慢性黄疸型肝炎、肝癌等。
②骨骼疾病:由于骨的损伤或疾病使成骨细胞内所含高浓度的碱性磷酸酶释放入
血液中,引起血清碱性磷酸酶活力增高。
如纤维性骨炎、成骨不全症、佝偻病、骨软化病、骨转移癌和骨折修复愈合期等。
碱性磷酸酶km值测定实验报告

竭诚为您提供优质文档/双击可除碱性磷酸酶km值测定实验报告篇一:酶促反应动力学实验报告酶促反应动力学实验报告14301050154杨恩原实验目的:1.观察底物浓度对酶促反应速度的影响2.观察抑制剂对酶促反应速度的影响3.掌握用双倒数作图法测定碱性磷酸酶的Km值实验原理:一、底物浓度对酶促反应速度的影响在温度、ph及酶浓度恒定的条件下,底物浓度对酶的催化作用有很大的影响。
在一般情况下,当底物浓度很低时,酶促反应的速度(v)随底物浓度[s]的增加而迅速增加,但当底物浓度继续增加时,反应速度的增加率就比较小,当底物浓度增加到某种程度时反应速度达到一个极限值(即最大速度Vmax)。
底物浓度和反应速度的这种关系可用米氏方程式来表示(michaelis-menten方程)即:式中Vmax为最大反应速度,Km为米氏常数,[s]为底物浓度当v=Vmax/2时,则Km=[s],Km是酶的特征性常数,测定Km是研究酶的一种重要方法。
但是在一般情况下,根据实验结果绘制成的是直角双曲线,难以准确求得Km和Vmax。
若将米氏方程变形为双倒数方程(Lineweaver-burk方程),则此方程为直角方程,即:以1/V和1/[s]分别为横坐标和纵坐标。
将各点连线,在横轴截距为-1/Km,据此可算出Km值。
本实验以碱性磷酸酶为例,测定不同浓度底物时的酶活性,再根据1/v和1/[s]的倒数作图,计算出其Km值。
二、抑制剂对酶促反映的影响凡能降低酶的活性,甚至使酶完全丧失活性的物质,成为酶的抑制剂。
酶的特异性抑制剂大致上分为可逆性和不可逆性两类。
可逆性抑制又可分为竞争性抑制和非竞争性抑制等。
竞争性抑制剂的作用特点是使该酶的Km值增大,但对酶促反映的最大速度Vmax值无影响。
非竞争性抑制剂的作用特点是不影响[s]与酶的结合,故其Km值不变,然而却能降低其最大速度Vmax。
本实验选取na2hpo4作为碱性磷酸酶的抑制物,确定其抑制作用属于哪种类型。
《生物化学与分子生物学》教学大纲

《生物化学与分子生物学》教学大纲课程名称(中文/英文):生物化学与分子生物学/Biochemistry and Molecular Biology课程类别:专业基础课程课程性质:必修适用专业:临床医学、基础医学、口腔医学、麻醉学、预防医学、医学检验技术、医学实验技术学时数:总学时84学时,其中理论72学时、实验12学时学分数: 4.5学分考核方式:考试先修课程:《人体解剖学》、《组织学与胚胎学》、《医学细胞生物学》、《医学遗传学》、《基础化学》、《有机化学》后续课程:《生理学》、《药理学》、《病理生理学》、《医学免疫学》、《医学微生物学》教材:《生物化学与分子生物学(第9版)》,周春燕、药立波主编,人民卫生出版社,2018年8月参考书:《生物化学原理(第3版)》,杨荣武主编,高等教育出版社,2018年10月《分子生物学(第2版)》,杨荣武主编,南京大学出版社,2017年9月《生物化学(第4版)》,朱圣庚、徐长法主编,高等教育出版社,2017年1月《Lehninger Principles of Biochemistry(Seventh Edition)》, David L. Nelson, Michael. Cox. W. H. Freeman and Company, 2017.《Harper's Illustrated Biochemistry (31st, Edition)》,Victor W. Rodwell. McGraw-Hill Education Medical, 2018.开课单位:基础医学院生物化学与分子生物学教研室一、课程简介:(150~500字,宋体、加粗、小四、段前段后各0.5行)《生物化学与分子生物学》是一门临床医学、基础医学、口腔医学、麻醉学、预防医学、医学检验技术、医学实验技术等专业的专业必修课程。
课程内容包括生物大分子的结构与功能、物质代谢及其调节、遗传信息的传递、医学生化专题和医学分子生物学专题等。
测定km值的方法

测定km值的方法KM值(也称为Michaelis-Menten常数)是指在酶催化反应中衡量酶与底物结合紧密程度的常数。
它是酶底物相互作用的一个重要参数,也是评价酶的亲和性和活性的重要指标之一。
测定KM值对于了解酶的特性以及酶催化机理具有重要意义,因此有很多方法能够用来测定KM值,下面将介绍几种常用的方法。
首先,最常见的测定KM值的方法之一是通过酶动力学实验。
在酶动力学实验中,我们可以通过测定不同底物浓度下酶的催化速率来计算KM值。
通过将底物的浓度逐渐增加,然后测定不同浓度下的酶催化速率,然后根据Michaelis-Menten方程进行拟合,就可以得到KM值。
这种方法简单易行,可以在实验室中进行。
其次,还可以利用双底物试验来测定KM值。
在双底物试验中,我们通过在反应体系中同时加入两种底物,然后测定酶的催化速率随着两种底物的浓度变化而变化。
根据双底物试验得到的实验数据,可以利用特定的方程和算法计算出KM 值。
这种方法适用于那些对底物相互作用行为感兴趣的研究者。
另外,还可以利用工程学方法来测定KM值。
工程学方法主要是通过对酶的结构和功能进行分子模拟和计算来预测酶的KM值。
这种方法适合于那些缺乏实验条件或者需要快速筛选大量酶的研究者。
此外,还可以利用进化学方法来测定KM值。
进化学方法是通过构建和筛选突变库来获得具有不同KM值的酶变体,然后通过比较不同变体的KM值来揭示影响KM值的关键位点和基团。
这种方法适合于那些想要了解酶中不同位点对KM值的影响的研究者。
最后,还可以利用光谱学方法来测定KM值。
光谱学方法是通过利用酶与底物结合产生的光谱变化来测定KM值。
这种方法适合于那些想要在不破坏酶的自然状态下测定KM值的研究者。
总的来说,测定KM值的方法有很多种,每种方法都有其独特的优势和局限性。
选择适合的方法取决于研究者研究的具体问题和实验条件。
希望以上介绍的几种方法能够帮助研究者更好地测定KM值,从而深入了解酶的特性和酶催化机理。
碱性磷酸酶Km值的

底物浓度对反应速率影响
在其他因素不变 的情况下,底物浓度 对反应速率的影响呈 矩形双曲线关系。
V
[S]
V= ── K + [S]
m
Vmax[S]
[S]:底物浓度 V:不同[S]时的反应初速度 Vmax:最大反应速度(maximum velocity) Km:米氏常数(Michaelis constant)
双倒数作图法
Vmax[S]
V=
Km+[S]
两边同取倒数
Km 1/V= + 1/Vmax 1/[S] Vmax (林-贝氏方程)
注意事项
• 1 底物和酶取样准确 • 2 保温时间准确
1 2 3 4 5 6 7
加入酶的时 间
加入碱性溶液 终止反应的 时间
9:00:00
9:00:30
9:01:00
9:01:30
9:02:00
9:0230
9:16:00
9:16:30
9:17:00
9:17:30
9:18:00
保证每个试管的反应时间为15分钟
实验报告
• 1 绘制矩形双曲线图 • 2 绘制双倒数图,并通过双倒数图读出碱 性磷酸酶对磷酸本二钠的Km值
注意事项
• 1 做如下表格
1 Abs [S] 1/ABS 1/[S] • 2 可电脑作图 • 3 若人工作图,在坐标轴上禁止出现分数(1/2,1/16) • 4 实验的最终目的是测得Km值,因此实验报告最终 必须得出结论:Km值等于多少 2 3 4 5 6 7
第三节碱性磷酸酶km值的测定碱性磷酸酶?碱性磷酸酶简称alp或akp是广泛分布于人体肝脏骨骼肠肾和胎盘等组织经肝脏向胆外排出的一种酶碱性磷酸酶主要用于阻塞性黄疸原发性肝癌继发性肝癌胆汁淤积性肝炎等的检查
酵母菌碱性磷酸酶的分离及部分性质研究_张晓龙

酵母菌碱性磷酸酶的分离及部分性质研究张晓龙 秦 阳(安徽科技学院,安徽凤阳 233100)摘 要: 提取酵母菌中的碱性磷酸酶,并对其性质做出分析。
结果显示酶促反应最适pH值为10.3,初速度V0=0.01367μmol/L・min,以对硝基苯磷酸二钠(pNPP)为底物测得Km=0.535mmol/L、Vm=0.01429μmol/L。
较低浓度的Mg2+对酶有较强的促进作用,2mmol/L时达到641%,磷酸氢二钠对碱性磷酸酶有竞争性抑制作用。
关键词: 酵母菌;碱性磷酸酶;酶的性质;酶促反应中图分类号Q556 文献标识码B 文章编号1007-7731(2008)08-093-03作者简介:张晓龙(1979~),男,安徽蚌埠人,在读研究生,研究方向为生物化学与分子生物学。
收稿日期:2008-04-14IsolationandcharacterizationofalkalinephosphatasefromyeastZhang Xiaolong Qin Yang(Anhui Science and Technology College,Fengyang 233100)Abstract: Alkaline phosphatase was extracted and purified from yeast which was prepared by the culturing the dusty yeastand the biochemical characterization were investigated. The results showed that the optimum pH was 10.3 for the hydroly-sis of pNPP. The initial velocity is 0.01367μmol/L・min. The Michaelis-Menten constant (Km) is 0.535 mmol/L andthe maximun velocity (Vm) is 0.01429μmol/L at pH10.1 and 37℃. The Mg2+ ion with the concentration of 2mmol/Lcould increase the enzyme activity by 541%, implying that low concentration of Mg2+ could enhance the activity of theenzyme significantly. Na2HPO4 could inhibit the enzyme activity and the inhibition was found to be of competitive type.Key words: Yeast; Alkaline phosphatase; Enzyme activity;Enzymatic reaction碱性磷酸酶(alkaline phosphatase,简称AKP)广泛存在于动物、植物及微生物的体内,是一种对底物专一性较低的磷酸单酯水解酶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【实验操作】
1 2 3 4 5 6 7 管号 底物液 0.05 0.15 0.25 0.30 0.40 0.60 0.80
(0.04M) 碳酸缓 液(pH=10)
8 0.00
0.90 0.90 0.90 0.90 0.90 0.95 0.85 0.75 0.70 0.60
0.90 0.90 0.40 0.20
VMAX
1/2VMAX
1/Vmax
1/[s]
[S] Km
-1/Km
底物浓度与反应速度关系曲线
双倒数曲线
【实验讨论】
比较两个值的大小,分析实验误差产生 的原因 比较两种Km测定方法各自的优缺点
0.90 1.00
蒸馏水
混匀后37℃水浴,预温5分钟左右
酶液
0.1 0.1
0.1
0.1
0.1
0.1 0.1
0.1
加入酶液后立即混匀(保持37℃水浴), 反应开始。
从加入酶液起计时至下一步 加入碱性 溶液停止反应,各管反应时间应准确一 致,为15分钟。
碱性溶液
1.0 1.0
1.0 1.0
1.0
1.0
Vmax•[S] + 1/ Vmax
本实验以碱性磷酸酶为例,用磷酸苯二钠为其 底物,生成酚和磷酸,酚在碱性溶液中与4一氨 基安替比林作用,经铁氰化钾氧化生成红色醌 的衍生物,根据红色的深浅可测出酶活力高低。 其反应式如下:
磷酸苯二钠+H2O AKP OH苯酚
苯酚+4-氨基安替比林 K3Fe(CN)6 醌衍生物 (红色)
碱性磷酸酶Km值 的测定
【实验目的】
1.了解酶的Km值测定原理和方法
2.掌握碱性磷酸酶(AKP)活性测
定的原理和方法
【实验原理】
在温度,PH及酶浓度恒定的条件下,酶促 反应的初速度随底物浓度(S)增大而增加, 但当底物浓度增大到一定极限时,则反应 速度趋于恒定,此最大反应速度Vmax,反 应速度与底物浓度之间的关系可用米氏方 程来表示,即:
Vmax•[S]
V=
Km + [S]
其中Km为米氏常数, Vmax为最大反应速度, 当V=Vmax/2时,则Km=[s]。 Km是酶的特征常数,测定Km是研究酶 的一种方法
将米氏方程变形为双倒数方程,以l/ v -1/[s]作图,将各点连线,在横轴截 距为-/km,据此可算出Km值。
1/V=Km/
1
3
5
6
8
12
16
0
1/[S]
1/OD
1
0.333 0.200
0.167 0.125 0.083 0.063
-
2、作图
以 [s]为横轴,OD510为纵横作图,观 察曲线形状;查Km 值
以1/[s]为横轴,1/OD510为纵轴作 图,观察曲线形状;查Km 值 比较两个值的差异.Fra bibliotekOD510
1/OD510
1.0
1.0
1.0 1.0
1.0 1.0
1.0
1.0
4-氨基安 替比林
1.0 1.0
铁氰化钾
2.0 2.0
2.0
2.0
2.0
2.0 2.0
2.0
混匀,室温放置10分钟左右, 以8号管为 空白,于5l0nm比色,记录各管的光密度
【实验结果】
1、原始数据
结果记录 OD 1 2 3 4 5 6 7 8
底物浓度 mmol/L
