1张图 初中化学专题复习思维导图
最全的初中化学总结:三年知识点全在这8张网络图里,太好记了!

最全的初中化学总结:三年知识点全在这8张网络图里,太好记了!你想中考化学成绩蹭蹭上涨吗?赶紧记住这8张初中化学思维导图!初中化学的知识要点全在这18张图里了,这既是最容易丢分的知识点也是最容易得分的点,家长赶快让孩子记住吧。
/////////------初中化学------------///////////初中化学快速入门/////////------初中化学------------///////////物质_元素_酸碱盐,试验_计算_水溶液,/////////------初中化学------------///////////化学元素之最,认识元素周期表/////////------初中化学------------///////////化学实验35例, 看听做想,多联想/////////------初中化学------------///////////化学元素及术语命名及翻译趣谈/////////------初中化学------------///////////化学计算: +-*/又图表,比例守恒3知识初中基本厚厚的化学书就浓缩成这小小的8张图,是不是很神奇呢?这种方法就是我长给孩子推荐的思维导图学习法,不仅是化学,所有学科都能浓缩成精华变成有趣有逻辑的知识网络图,让孩子学习、记忆更加轻松高效。
我一直坚信没有学不好的学生,只有不会学的学生。
很多孩子学习成绩不好、记忆力不佳、苦学无果都是因为没有掌握正确的学习方法而造成的!我在互联网课堂免费举办《最强大脑》公益课,如果您的孩子记忆力不好、学习靠死记硬背、很努力但成绩不理想,添加微信号:203515982(长按可复制)报名即可免费听课。
世界记忆大师——汤世声领导的强大师资团队,针对所有中小学生的各种问题量身定制课程:思维导图、记忆宫殿、快速阅读,让孩子重燃学习兴趣,开发记忆潜力,提高学习效率,好成绩当然没问题!。
初中化学思维导图—知识点总结—中考必备!!
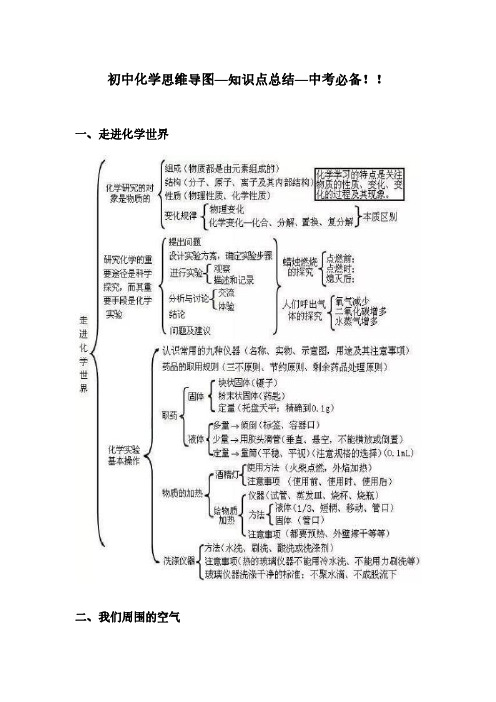
初中化学思维导图—知识点总结—中考必备!!一、走进化学世界二、我们周围的空气三、自然界的水四、物质构成的奥秘五、化学方程式六、碳和碳的氧化物七、燃料及其利用八、金属和金属材料九、溶液十、酸碱盐氧化物、酸、碱和盐的知识点可从以下十个方面掌握:1、化学用语(1)电离方程式(2)物质的俗称和主要成分生石灰:CaO熟石灰、消石灰、石灰水的主要成分:Ca(OH)2食盐的主要成分:NaCl纯碱、口碱:Na 2CO 3烧碱、火碱、苛性钠:NaOH胆矾、蓝矾:CuSO 4·5H 2O碳酸钠晶体:Na 2CO 3·10H 2O氨水:NH 3·H 2O2、化合物的分类3、金属活动性(1)金属活动性顺序(由强减弱):K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au ①金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
②金属活动性顺序的应用:排在氢前的金属能置换出酸里的氢(元素)。
排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
4、酸、碱、盐的溶解性(1)常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜):钾盐、钠盐、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾盐、钠盐、铵盐。
碱类物质溶解性:只有氢氧化钾、氢氧化钠、氢氧化钙、氢氧化钡溶。
(2)八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁。
(3)四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)5、三个不存在的物质所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
初中化学思维导图(精讲版)

第一单元走进化学世界a 学研究的领域:①制造新物质②合成新药物③开发新能源④防止环境污染。
「物理变化:没有生成其他物质的变化。
如:水的沸腾、汽物质的1油挥发、铁水铸成锅、湿衣服晾干。
变化]化学变化:生成其他物质的变化。
如:燃烧反应、铁生、锈、酒的酿制、食物腐败。
'物理性质:物质不需要发生化学变化就表现出来的性质。
如: 物质的 <色、态、味、沸点、熔点、硬度、密度、导电性、导热性。
性京 I 化学性质:物质在化学变化中表现出来的性质。
如:可燃【性、助燃性、氧化性、还原性、酸碱性、稳定性、毒性。
保存:广口瓶固体,取用:药匙、纸槽(粉末状)<一斜二送三直立〉 镶子(块状、金属颗粒)<一横二放三直立)〃保存:细口瓶取用:量多f 倾倒(瓶塞、瓶口、标签)量少一►胶头(垂直、悬空、不能横放或倒置) 定量一量简(平视)7吏用方法:火柴点燃,外焰加热。
注意事项:绝对禁止向燃着的酒精灯里添加酒精, 以免失火;绝对禁止用酒精灯引燃另一只酒精灯; 、用完酒精灯后,必须用灯帽盖灭,不可用嘴吹。
可直接加热的:试管、蒸发皿、燃烧匙 可间接加热的:烧杯、烧瓶方法:保持试管干燥,先预热再用酒精灯的外焰均 匀加热,试管口不可对着人。
液体体积不超过试管<容积的1/3o仪器干净的标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股 、流下。
物质的 变化和《 性质走进化学世界化学是 一门以 实验为《 基础的 科学蜡烛燃 烧的探< 究’点燃前:白色固体,略有气味,质软,不溶于水,密度 不水小。
燃着时:石蜡熔化并发光发热,火焰分三层:外焰、内 焰、焰心,外层最明亮,里层最暗,火柒从中间到两端 逐渐变黑,烧杯内壁出现水珠,石灰水变浑浊。
I 熄灭后:产生白烟,用火柴点燃白烟,蜡烛重新被点燃。
人体呼出气体的探究:与空气中的气体相比,人体呼出的气体中含 有较多的二氧化碳和水蒸气,较少的氧气。
药品的取用规则(三不准原则、节约原则、处理原则、保护原贝D化学实 验的基 以操作仪器]给物质J 加热第二单元我们周囹的空军物理性质:无色无味的气体,密度比空气大,不易溶于水。
(完整版)初中化学思维导图(可编辑修改word版)

身边的化学物质形成悬浊液 乱油液溶解性:在某溫度,压强下,一种物质在另一种物质里溶解能力的大小 槪念饱和溶液,不饱和溶液转化槪念:溶质质量与溶液质量之比 公式计算空气的成分(体R 分数> R 气的ft®及用途MW 气体的11®及用i« 空气、氧气 氣't 空,®量LJB 的主赛》«1容(空气污M «'<-= ^VS, 5气《量纽期、空气®量状况> 史气獨量B 緝 丨什乂gn/G 染IHB 的项冃:MM , co 、NOi.珂吸入_輪物,O >««_与非会《««反应・c . s. r. in• i 、与金属_质氏曲1 Fe ・Al. Ca与化学tt 反fib CH4. CUIMIII| niit <支N«ct.供给柙明) 实W 审 W 法I KMnO4 . KCIO3、HlOl物现矜城1无&.无味.不易番;于•水.»度比g 气大 I 收《枝:分興®态空气&初中似性质组成:电解分解净化:静置沉淀、过滤,吸附、蒸® 硬水与软水区分、危害、转化 用途 保护水资源:节约用水,防治水污染氬气物理性质:无色无味,难溶于水,所有气体密度嚴小的气体 性质 化学性质:可燃性(不纯燸炸)、还原性 用途:氢能源、氢气球、冶金 制取溶液:均一、稳定溶质 溶剂水,溶液 溶液 与浓、稀溶液的关系溶解度固体的溶解度气体的溶解度槪念影晌因素 外因:温度内因:溶质溶剂的性质溶解度曲线槪念彩响因索结晶:固体物质从溶液中析出晶体的过程莰发结晶 冷却热饱和溶液溶液的溶质质■分数无色透明正八面体形状固阼金刚石J 天然物质中最硬的物质 L —可作钻头、装饰品、玻璃刀头 (-深灰色磷片状固阼,不透明,石墨质软—作铅笔芯 S-s 滑鼠感—作润滑剤物理性质 导电性—作电极及用途木炭、活性炭:吸附性—作净水剤、防橐面具滤春剤广①一般愔况下不燃烧也不支持燃烧② 不供给呼吸③ 与水反应:H 2CO 3=H 2O+CO 2H 2O+CO2= H2CO3 化学性质J ④与喊反应:Ca (OH )2+CO 2=CaCO 3 \ +H 20⑤光合作用:6CO 、+6HoO_ 光眩 C 6H 12O 6+6O 2叶妹京、⑥氧化性:CO 2+C=^2CO用途:①灭火②干冰用于人工降雨、作致冷剤③碳酸饮料 ④温室肥料⑤工业原料制法:①CaCO 3+2HCl=CaCl2+H 2O+CO21 (实验室)② CaCO 3=^=CaO+ C021 (工业制法)温室效应:温室气体包括C02、03、CH4、氣氳代烷等、C02在自然界的循环:即产生和消耗的途径物理性质:无色无味气体,密度比空气略小,难滔于水①可燃性:2CO+O 2=^=2CO 2化学性质4 ②还原性:CO+CuO=^=Cu+CO 2③砉性:极易与血红蛋白r _造矽机怍鈸氧 L 用途:①作燃料②冶炼金厘单质: (金刚石、 Ceo:石墨、 C+O 2=^=CO 2 (充分燃烧) 2C+O 2=^=2CO (不充分'鵬)2CuO+C^=2Cu+CO 2t (现象:黒色粉末变成红色,澄潛石灰水变浑浊)物理性质:无色无味气体,密度比空气大,易溶干水,固阼叫 <干冰易JI 化可作燃料CO 2+C=^=2CO可冶炼金厘物理性质:大部分常溫下固体,具有金厲光潘,电和热的良导体,錄 较好的延展性,密度大,熔沸点较S 用途-性质溉念-•混合物硬度: >纯金展合金合金与纯金属性质差异熔点:〈纯金属 抗腐蚀性: >纯金展 常见的合金(含碳量,生铁〉钢)寻找金風®代品金厲材科金属的化学性质金质与金质材料反应类型:置换反应反应类型:置换反应 反应条件:前換后 窻义应用铁的冶炼(CO 还原Fe203)金厲资源在自然界的存在 单质:金矿石:磁铁矿、赤铁矿 金属资源的利用和保护铁的锈蚀与防护•保护金風资源的措施防止金属生锈回收利用废旧金属 有计划合理开采矿物 与氯气反应活泼金属与黢反应与盐溶液的反应金厲活动性顾序表浓盐酸-挥发性浓硫酸-吸水性、强腐蚀性,强氧化性,稀释 指示剂:紫色石S 变红,无色酚酞不变色 +活泼金属~»益+水♦金風组化物■♦益+水 +減>*盐+水♦某些盐"♦新益♦水指示剂:紫色石蕊变蓝,无色酚酞变红+非金展氣化物■♦益+水 +酸-»盐+水+某些盐-♦新盐+水 弦定义:金属离子/NH3++M 根离子 NaCI. Na2CO3、NaHCO3、CaCOMl 质与用途 定义 氮肥:尿素等 磺肥:矿粉等 钾肥:草木灰等复合使!用途 化学肥料常见化肥酸碱性: 蛇碱度用梅示剂检验槪念:定量表示酸碱性 表示方法:pH測定pH 的方法:用干净的玻璃棒程取被測溶液 并滴在pH 试纸上,半分钟后对比试纸与 标准比色卡的顔色 改变溶液pH 的方法通性格动的拥子益及化学肥科通性:阴离子:0H-金風离子/NH3++0H-溶液的黢碱性与酸碱度相0H 性质、俗称,用途 Sa (OH) 2性质、俗秣、 MUH2O混合物纯净物单质化合物分子离子分子是保持物质化学性质的最小粒子性质:质量体积小,不断运动,有间隔,可分割表示方法原子是化学变化中最小的粒子性质:质ft体积小,不断运动,有间隔,可分割表示方法:元紊符号结构带电的原子或原子团分类:阴阳离子表示方法离子与原子的相互转化具有相同核电荷数即核内电子数的一类原子的总数元素的存在形式:单质、化合物元素的表示方法元素与原子的关系:总体和个体元素周期表:7周期16族化学式化合价元素符号和数字组成表示物质组成的式子一种元素一定数目的原子跟其他元素一定数目相化合的性质. 叫做这种元素的化合价表示方法物理变化槪念參加反应的各种物质的质量总和=反应后的各物质的质量总和五个不变物质的变化化学变化物质的变化和性质物质的性质燃烧与灭火遇守质量守恒定律两个一定变两个可能变宏观:反应物.生成物的总量不变;元承的种类不变、微观:原子的种类、数目,质■不变宏观:物质的种决一定变做现:构成物痪的分子种类一定变分子的总数可能变物质的状态可能变化学方程式:写.配,注反应现象:题色的变化,发光,放热,生成气体薄化合反应分解反应置换反应复分解反应有眾参加的反应:ft化还原反应一般反应条件为高湿的反应基本类型相据能量变化吸热反应放热反应物理变化与化学变化的区别和联系判断:在变化中是否有某他物质生成物理性质化学性质物质不W要发生化学变化就表现出来的性质熔点,密度,硬度,气味,状S,賴色等物质在化学变化中表现出来的性珉可燃性,还厍《,S化性,薄性,般味性等物理性班与化学性质的区别和联系燃烧定义:发光,发热的斟烈的氰化反应条件:可燃物,讯气/空气、溫度达到着火点灭火内因:可燃物的性质外囚:与《气榜触的®积灭火原理:破坏燃烧的条件泡沬灭火H党见的灭火器干粉灭火器二氣化砖灭火器缓慢氣化、自燃燸炸J4-W66含杂质的质量应換成纯物质的质量 _时位祕成観密度•体积质■单位代入化学方程式咬囂胃 统一化学方程式中物胰质■单位应统一 比例法 关系式法守恒法差量法平均值法暮本的实tt 技期化学仪a 的识别与《用«■的连罎发生装震幻收集装霣的达择M 学S 究气》的»IB. f?JSK2与净化气<«的Uft 气镡”质的Kii 气体的净化化华球合实tt«««»的分®«质的検嗆与榷醣來兕化学物拓的袷的«质格K 的方法 分A.曲浼的K 本願n相夜的分离与提鲭,物理方法:过»,结«.费»权方法,化气法,济3法,冒换5 ?皆>:川秘.时法"V-/ '.’化««興 化聿与V 康石浪天K 气元素在人体内的ft 在形武0, C 、H, N 、C«、P 、*,5,如,CI, «« M ■光扇 Fe * 加,加,Cr ' 如,r * *• W ■元章 鴻汴薷 太曲廉元薫与人停tt 康&•费富物质 破瀵 化石燃对坏凌的彩_化史,衣灼利环》的影_水汽染2气污» 土®污史环磔?itt 及W 沿 白色穴染化擎与蛘壤 化学与W®*«会食金羼M 愈S合tom 僉成濬K着合鉍科 •精不冏功®和灼鼸的多裨F.戶iXIMtfc **•柃相对®子质最的计算W 念:以一个味-12原子届■的1/12为标准, 其他原子的屏酱跟它的比值化学计算有关化学式的计算 溶液的相关计算相对分子质■ 化学式中各®子的相对傑子的总和 物质组成的元累质量比各元子个败与相对原子质■的番R 之比 物质中某种元素的质■分数该元素的质■与组成物质的各元素总旗■之比 概念溶质质■分数计算公式溶质质■分数与溶解度的换算溶液与化学方程式的综合计算依据一质■守恒定律步现及格式设,写、列、解‘答纯物质的质不纯物质的质量*纯度根据化学方程式的计算方法技巧相时质子ft®。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属的物理性质 金属的冶炼 金属的化学性质(金属活动性顺序) 钢铁的锈蚀与防护
生活中常见的化合物
常见酸的性质和用途 常见碱的性质和用途 溶液的酸碱性与 pH 中和反应及其应用 盐的化学性质及用途 常见化肥分类、区别及其用途 有机物
化学变化的特征
化学反应的基本类型 氧化还原反应 ’ 中和反应
认识几种化学反应
质量守恒定律及其应用 化学方程式的书写与含义
质量守恒定律和化学方程式
燃烧与灭火 能源资源的利用
化学与能源和资源的利用
常见的合成材料 常见合成材料对生活的影响
常见的化学合成材料
食物中的有机物 化学物质与健康
化学与健康
空气污染 节能减排 绿色环保
⑥
化
纯净物的计算
学
含有杂质的计算
计
有关溶液的计算
算
含有表格、图像的计算
综合计算
环境保护
化学实验基本操作 气体的制取和性质 物质的检验、鉴定与推断 物质的分离与提纯
② 物 质 构 成 的 奥 秘
③ 物 质 的 化 学 变 化
④ 化 学 与 社 会 发 展
⑤ 科 学 探 究
初中化学 专题复习
地球周围的空气
①
身
水和常见的溶液
边
的
成及氧气含量 空气的污染与防治 氧气的实验室制法 氧气的性质和用途 二氧化碳的制取和性质 二氧化碳的循环
纯净物和混合物 单质和化合物
酸、碱、盐、氧化物
物质的分类
物质之间的联系
化学物质的多样性
分子、原子、离子的相关知识 原子、离子的结构示意图 及其最外层电子数
微粒构成物质
元素的概念及其符号 元素周期表的应用
认识化学元素
化学式的书写及意义 化合价的概念及应用
物质组成的表示
物理变化和化学变化 物理性质和化学性质
