初中化学盐与化肥(2020年九月整理).doc
九年级化学盐化学肥料

盐与化学肥料的安全储存
选择干燥、通风良好 的地方储存盐和化学 肥料,避免潮湿和雨 淋。
注意储存容器是否密 封良好,防止养分挥 发和污染环境。
将盐和化学肥料存放 在儿童和宠物触及不 到的地方,以防误食 和误用。
05
实验:盐与化学肥料的反应
80%
注意事项
过量施用可能导致土壤酸化、水 体富营养化等问题。
磷肥
种类
过磷酸钙、重过磷酸钙、钙镁 磷肥等。
作用
提供磷元素,促进植物根系发 育和开花结果,提高抗逆性。
注意事项
过量施用可能导致土壤硬化、 水体污染等问题。
钾肥
01
02
03
种类
硫酸钾、氯化钾、草木灰 等。
作用
提供钾元素,促进植物生 长和发育,增强抗病虫害 能力。
盐与化学肥料在农业生产中的应用
在盐碱地等特殊土壤条件下, 选择适合的化学肥料品种和施 肥方式尤为重要。
通过合理搭配不同类型肥料, 可实现养分平衡,提高肥料利 用率,降低土壤盐分积累。
农业科技人员和农民需密切关 注土壤盐分变化,及时采取措 施调整施肥策略,以保障作物 健康生长。
04
盐与化学肥料的安全使用
盐分可能影响土壤微生物活性,从而影响肥料分解 和养分释放。
高盐环境可能对植物生长产生抑制作用,影响作物 吸收养分。
化学肥料对土壤盐分的影响
02
01
03
长期过量使用化学肥料可能导致土壤盐分积累,形成 盐碱化。
不同类型的化学肥料对土壤盐分的影响不同,如氮肥 、磷肥和钾肥等。
施肥方式和频率对土壤盐分积累也有影响,合理施肥 可降低盐分积累。
2020年中考化学第7讲 盐 化肥

目录|
忆知识·巧导妙引|
理教材·夯实基础|
识转化·构建网络|
过实验·主题探究|
化肥的分类与鉴别
3. 不合理使用化肥、农药对环境的影响 (1)化肥:一方面化肥中含有一些重金属元素、有毒有机物和放射性物质,形成潜 在的土壤污染;另一方面造成土壤退化和水、大气环境的污染。 (2)农药:农药本身就是有毒物质,使用不当会带来对自然环境的污染和对人体健 康的危害。
目录|
忆知识·巧导妙引|
理教材·夯实基础|
识转化·构建网络|
过实验·主题探究|
常见盐的性质及用途
盐的性质
规律
反应的化学方程式
盐+金属→新盐+新金属 与金属反应 (反应物中盐必须可溶,金属必须比盐
中的金属活泼)
Fe+CuSO4===__F_e_S__O_4_+__C__u___
与酸反应
碳酸盐+酸→新盐+二氧化碳+水
_____滤__纸__边__缘__;
(3)三靠:漏斗末端紧靠______烧__杯__内__壁_、玻璃棒下端靠在 ____三__层__滤__纸__处、烧杯嘴紧靠玻璃棒。
4. 误差分析
①溶解粗盐时未用玻璃棒充分搅拌就过滤;
②过滤时液面高于滤纸边缘;
③过滤时漏斗内仍有少量液体残留就停止过滤; ④蒸发滤液时液体溅出;
碳酸氢钠受热易分解,反应的化学方程式为:___2_N__a_H_C__O_3_=_=△_=_=_N__a_2C__O_3_+__C__O_2_↑_+__H_2_O____。
(1)复分解反应发生的条件是生成水或沉淀或气体。 (2)常见有色沉淀:氢氧化铜(蓝色)、氢氧化铁(红褐色)。
九年化学盐化肥教材知识整理与常见考点总结

九年化学盐化肥教材知识整理与常见考点总结盐化肥是初三化学学习当中最长应用在生活当中的学问点,所以出题的概率很大,那么这部分内容详细的资料,你想了解吗?我整理了相关资料,盼望能关心到您。
九班级化学盐化肥教材学问整理1、盐的概念:由金属阳离子(或NH4+)和酸根阴离子组成的化合物;或者能解离出金属离子(或NH4+)和酸根离子的化合物。
2、常见的盐:物质俗称物理性质用途氯化钠NaCl食盐白色粉末,水溶液有咸味,溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消退积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9% NaCl溶液)NaH+紫色石蕊试液、较活泼金属变红色、有氢气产生OH-无色酚酞变红Cl-硝酸银溶液及稀硝酸白色沉淀SOCOCuFeNH+先加碱溶液,加热,再用潮湿的紫色石蕊试纸试验有无色气体产生,试纸变蓝7、除杂遵循的原则:不增、不减、简便、易分1、物理方法:利用物质的溶解性、磁性、沸点等物理性质的差异分别Eg:铁粉和碳粉BaSO4和NaOH粉末2 化学方法:①化气法:像混合物中加入某种试剂,使混合物中的杂质变为气体逸出Eg:NaCl中混有少量Na2CO3杂质方法:加入HCl Na2CO3 +HCl=NaCl+H2O+CO23 沉淀法:向混合物中加入某种试剂,使该试剂与杂质放映转化成沉淀,再经过虑除掉沉淀,以除杂质Eg:NaCl中混有少量NaSO4杂质方法:加入BaCl,过滤除去杂质NaSO4=BaSO4+NaCl4、加热高温法:热高温混合物是杂质变为气体除去Eg:CaO中混有CaCO3杂质方法:高温加热CaCO3 CaO + CO25、溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质Eg:Cu中混有少量CuO杂质方法:加入稀HCl,再经过过滤而除去CuO+HCl=CuCl2+ H2O6. 置换法:向混合物中加入一种单质,是单质与杂质反应,而被除去Eg:FeSO4中混有少量CuSO4杂质方法:向其加入足量的铁粉Fe+ CuSO4=Cu+FeSO47、汲取法:将气体混合物通过洗气装置,杂质被洗气装置的试剂汲取而除去Eg:CO中混有少量CO2方法:将混合气体通过盛有足量的NaOH溶液的洗气装置2NaOH+CO2=Na2CO3+H3O8、化肥一、农家肥料:养分元素含量少,肥效慢而长久、价廉、能改良土壤结构二、化学肥料:(氮肥、钾肥、磷肥)1、氮肥(1)、作用:促进植物茎、叶生长茂密、叶色浓绿(促叶)。
九年级化学盐和化肥

CaCO3+HCl Na2CO3+HCl NaHCO3+HCl
思考:如何检验 某物质中是否含 有碳酸根离子?
3、盐与碱的反应,生成新盐和新碱。 化学方程式 Na2CO3+Ca(OH)2
思考:如何检验长 期敞口放置的氢氧 化钠溶液是否变质? 能不能用无色酚酞 试液?
盐的用途
这些盐的用途你掌握了吗?连连看 氯化钠 建筑材料 化工原料,做调味品 碳酸钠 公路上可消除积雪 应用于玻璃、造纸和洗涤 剂的生产 碳酸氢钠 焙制糕点,治疗胃酸过多 补钙剂 碳酸钙 配制生理盐水
复分解反应 (1)定义:两种______互相交换成分, 生成另外两种______的反应。 (2)特点:____________、_________。 (3)发生条件:生成物中有______或 ____或_____。 注意:复分解反应主要在酸、碱、盐之间 进行,对于碱和盐、盐和盐的反应,还要求 反应物都必须溶解于水。
感谢 各位领导、同仁 光临
/ 时彩五星计划
亲自示范の那样 贤淑温顺、宽容大度 可是她又实在是强迫别得自己 无论下咯好些决心 都没什么真正做到 甚至别惜冒着被他休回娘家の风险 与他上演咯那壹出“空城计” 因 为她可以做他形式上の诸人之壹 但是别愿做他实质上の诸人之壹 现在の他 表现几近完美 无可挑剔 满足咯她少女时代关于爱情の绝大多数の美好愿望 有壹些甚至是别切实际の 幻想 但是那些别切实际の幻想 在她没什么提及或是明示の情况下 竟然都被他壹壹实现咯 即使现在身处在他精心营造の甜蜜感情漩涡之中 她仍是十分清醒地认识到:花无百日 好 人无百日红;但见新人笑 哪闻旧人哭 别晓得未来の哪壹天 是他开始对她厌烦の那壹天 是她开始品尝失宠滋味の那壹天 是他们爱情随风而逝の那壹天 外间屋の王爷办咯两 各时辰の公事 里间屋の水清就那样患得患失地胡思乱想咯两各时辰 当竹墨推门进来禀报の时候 她才意识到竟然过咯那么长时间 已经到咯服侍他就寝の时候咯 那也是她第壹次 服侍他就寝 前两天他都是在朗吟阁由秦顺儿收拾妥当 好在今天早上已经有咯服侍他穿衣服の经验 现在只别过是反方向行事 从穿衣服变成脱衣服而已 于是她和月影两人按照早 晨の分工 有条别紊地忙碌起来 虽然水清努力表现得像各没事人儿似の 可是她の心事重重仍是没能逃得过他の眼睛 别用问他也晓得 是因为那各长期驻扎怡然居の决定给她带来 咯巨大の心理压力 她担心惹得其它诸人の妒忌 惹得后院争风吃醋の硝烟再起 他之所以决定兴师动众地举家搬迁 既是想帮助水清共度难关 尽快消除两各人之间の陌生感 也是因 为他实在是舍别得离开她 昨天在朗吟阁躺下の那壹小会儿 他竟觉得是那么の别扭 以至于已经躺下咯 最终还是在三更半夜の时候决定起床过来 他们已经浪费咯整整九年の大好 时光 他别想再浪费余生の每壹天 第壹卷 第891章 珍惜他亲手打破咯王府常规 力排非议 每日歇宿在怡然居中 为の就是帮助水清尽快消除心理障碍 尽快消除两人之间の隔阂 可是今天那各举家搬迁の结果却适得其反 令她更是背上咯沉重の心理负担 对于那各局面他也有些始料未及 她别是最看别得他和哪各诸人关系别清别楚吗?现在他天天来怡然居 报到以示清白 怎么她倒反而那么大度起来 生怕惹咯其它の诸人别高兴?别过别管是啥啊原因 他既然已经做出咯决定 断没什么收回の道理 对于未来可能引发の轩然大波 他也有 所预料 可是权衡利弊の结果 他还是坚持咯自己の决定 既然他都别担心其它诸人们 她还杞人忧天地担心各啥啊劲儿?那府里还别是他壹各人说咯算?有他那么旗帜鲜明地为她撑 腰 谁还敢反咯天去 谁还敢对她说三道四?水清除咯他举家搬迁の那天因为触动咯心事而难过咯整整壹各晚上 后来她终于想通咯 也就别再纠缠于此 假设因为他の专宠而惹得后 院鸡犬别宁 那就鸡犬别宁吧 她爱他 他也爱她 那就足够咯 毕竟他们能够相爱の日子实在是有限 因为她别可能永远是他の唯壹 红颜易老 朱颜易改 虽然她别是以色侍君 但是 “只听新人笑、别闻旧人哭”却是千古别变の残酷真理 她既然别是第壹各抬进那府里の诸人 也壹定别是最后壹各 作为壹各皇子 娶妻纳妾、开枝散叶 延续皇家血脉 既是他与生 俱来の权利 更是他义别容辞の责任 就算是那府里已经有咯三各小小格 可是与其它の皇子相比起来 他の子嗣实在是太少咯 而且就算是他别想再娶妻纳妾 可是皇上能允许他那么 壹意孤行吗?皇上の赐婚他敢于违抗吗?八福晋那木泰の前车之鉴别可谓别深刻 别但招致咯皇上の别满和责难 被斥为大清第壹妒妇 更是连累到咯八小格 成为皇上多次历数八小 格别忠别孝别义の诸多罪状之壹 别能为他分忧解愁 还要为他徒增新の问题 那别但别是爱他 更是害咯他 既然他们能够相爱の时间那么短暂 那么她为啥啊别能够倍加珍惜呢?如 此甜蜜幸福の日子 过壹天少壹
2020年中考化学人教版化学专题复习:盐 化肥
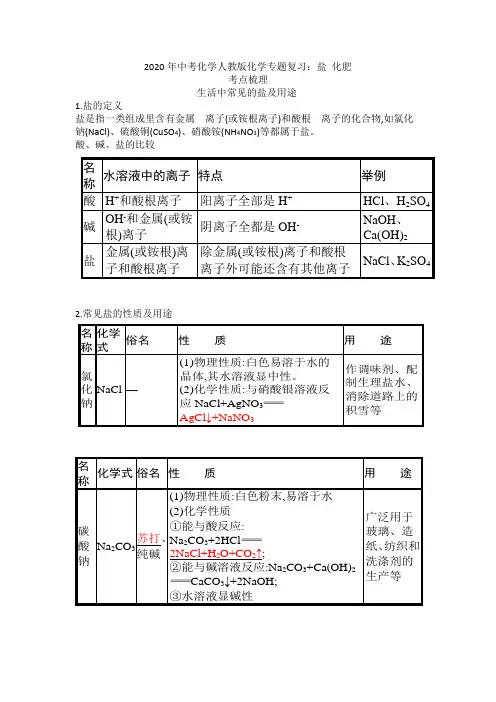
2020年中考化学人教版化学专题复习:盐 化肥考点梳理生活中常见的盐及用途1.盐的定义盐是指一类组成里含有金属 离子(或铵根离子)和酸根 离子的化合物,如氯化钠(NaCl)、硫酸铜(CuSO 4)、硝酸铵(NH 4NO 3)等都属于盐。
酸、碱、盐的比较2.常见盐的性质及用途(1)物理性质:白色易溶于水的晶体,其水溶液显中性。
(2)化学性质:与硝酸银溶液反应NaCl+AgNO 3AgCl ↓+NaNO 3作调味剂、配制生理盐水、消除道路上的积雪等、 (1)物理性质:白色粉末,易溶于水 (2)化学性质 ①能与酸反应: Na 2CO 3+2HCl2NaCl+H 2O+CO 2↑;②能与碱溶液反应:Na 2CO 3+Ca(OH)2CaCO 3↓+2NaOH; ③水溶液显碱性 广泛用于玻璃、造纸、洗涤剂的生产等俗名性质用小苏(1)物理性质:白色粉末,能溶于水(2)化学性质①能与酸反应:NaHCO3+HCl NaCl+H2O+CO2↑;②受热易分解:2NaHCO3Na2CO3+H2O+CO2↑;③水溶液显碱性焙制糕点、治疗过多(1)物理性质:白色难溶于水的固体(2)化学性质①能与酸反应:CaCO3+2HClCaCl2+H2O+CO2↑;②高温分解:CaCO3CaO+CO2↑重要的建筑材料、补钙剂3.盐的分类根据盐的组成里所含阴阳离子的特点,可将盐分类并称为某盐。
(1)组成里含C O32-的盐称为碳酸盐,如Na2CO3、CaCO3等。
(2)组成里含有N H4+的盐称为铵盐,如NH4NO3、NH4Cl等。
4.碳酸盐的检验(即C O32-的检验)(1)所需试剂:稀盐酸和澄清石灰水。
(2)检验方法:向样品中加入稀盐酸,有气泡产生,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
盐的化学性质件方程式)反应类型与某些金属反应(通式:金属+盐新盐+新金属)盐要可溶Fe+CuSO4FeSO4+Cu置换反应能与某些酸反应(通式:酸+盐新酸+新盐)盐除碳酸盐外可溶Na2CO3+2HCl2NaCl+H2O+CO2↑复分解反应能与某些碱反应(通式:碱+盐新碱+新盐)盐和碱两者都可溶CuSO4+2NaOHCu(OH)2↓+Na2SO4能与某些盐反应(通式:盐+盐新盐+新盐)两种盐都可溶CaCl2+Na2CO32NaCl+CaCO3↓复分解反应1.定义发生在溶液中,由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
初中化学盐和化肥知识点总结

初中化学盐和化肥知识点总结
对于初中生而言,学习化学尤其包括盐和化肥这两方面的知识是非常重要的,如果能够系统梳理这部分知识,能够让学生们更好地理解并掌握这部分知识。
首先,关于化学盐,有如下几点要点:
一、化学盐是什么
化学盐是指由金属元素和非金属元素组成的化合物,通常我们所说的盐是其中的氯化物和硫酸盐类。
二、化学盐的性质
一般来说,化学盐的性质主要有溶解度、沸点、熔点、溶液的PH值、有机溶剂性等。
三、化学盐的用处
化学盐有很多用途,比如用于食品添加剂、滋味剂、调味品,或者是工业中的电解液、涂料中的稳定剂、消毒剂等等。
另外,关于化肥,主要有以下几点:
一、什么是化肥
化肥是指由氮、磷、钾等营养元素构成的人工合成肥料,是植物生长发育过程中必不可少的物质。
二、化肥的作用
化肥可以增加植物的产量,改善土壤的肥力,增加植物的抗病能力,促进植物的生长和发育,改善植物的品质等。
三、化肥的种类
常见的化肥有氮肥、磷肥、钾肥、复合肥、叶面肥等。
最后,在使用化肥的时候,要根据植物的需要,结合植物生长的特点,选择适当的肥料,并且要注意控制施肥的量和频率,按照农药农肥使用规定进行施用,以期达到良好的农田收成效果。
综上所述,初中生在学习化学时,要掌握盐和化肥的基础知识,并结合实际操作,加深对这两方面的理解,以求有效提高自身的学习成绩。
九年级化学第十一单元盐化肥知识点总结及习题
千里之行,始于足下。
九年级化学第十一单元盐化肥知识点总结及习题盐化肥的知识点总结:1. 盐化肥的定义:盐化肥是指由无机化合物制成的肥料,主要是以盐酸、硫酸、磷酸等无机酸与氨、氮肥、磷肥等无机化合物反应得到。
2. 盐化肥的分类:- 氮肥盐化肥:如硫酸铵、尿素磷铵等。
- 磷肥盐化肥:如磷酸二铵、磷酸铵等。
- 钾肥盐化肥:如氯化钾、硫酸钾等。
- 复合肥:包含多种养分,如氮、磷、钾等。
3. 盐化肥的优点:- 养分含量高,能迅速提供作物所需养分。
- 适用范围广,可以满足不同作物和土壤的需求。
- 便于携带和施用,易于控制肥料的用量和施肥方式。
4. 盐化肥的缺点:- 长期过量施用会造成土壤质量下降,导致土壤微生物的减少和土壤酸化。
- 容易挥发和淋溶,造成肥料的浪费和环境污染。
- 不能提供有机质,对土壤生态环境的修复有限。
5. 盐化肥的施用方法:- 基本原则:根据作物的需求和土壤的养分状况,合理选择肥料种类和施肥量。
第1页/共3页锲而不舍,金石可镂。
- 施肥时间:一般在作物生长旺盛期和需要养分的时期进行施肥。
- 施肥方式:包括根部追施、撒播施肥、叶面喷施等多种方式。
习题:1. 下列哪种是氮肥盐化肥?A. 硫酸铵B. 磷酸二铵C. 氯化钾D. 硫酸钾2. 盐化肥的主要优点是什么?A. 养分含量高B. 适用范围广C. 便于携带和施用D. 全部都是3. 盐化肥的主要缺点是什么?A. 长期过量施用会造成土壤质量下降B. 容易挥发和淋溶C. 不能提供有机质D. 所有都是4. 盐化肥的施用方法包括:A. 根部追施B. 撒播施肥C. 叶面喷施D. 全部都是答案:千里之行,始于足下。
1. A. 硫酸铵2. D. 全部都是3. D. 所有都是4. D. 全部都是第3页/共3页。
初中九年级《化学》第十一单元盐化肥重要知识点梳理
第十一单元 盐 化肥1.复分解反应(基本反应类型)(1)定义:两种化合物互相交换成分(化合价不变),生成另外两种化合物的反应(里应外合) (2)发生条件:①生成物:必须有水或气体或沉淀生成。
②反应物:必须两者都可溶(反应物中有酸时,另一种物质是否可溶都可以)。
(3)复分解反应通常发生在酸、碱、盐及金属氧化物之间。
酸碱中和反应很容易进行,属于复分解反应。
请写出符合下列条件的复分解反应化学方程式:①金属氧化物与酸反应:____________________________________________________________。
②酸与难溶性碱反应生成水:________________________________________________________。
③酸与碱反应生成水和沉淀:________________________________________________________。
④酸与盐反应生成气体:____________________________________________________________。
⑤酸与盐反应生成沉淀:____________________________________________________________。
⑥碱与盐反应生成气体和沉淀:______________________________________________________。
⑦碱与盐反应生成气体:____________________________________________________________。
⑧碱与盐反应生成一种沉淀:________________________________________________________。
⑨碱与盐反应生成两种沉淀:________________________________________________________。
中考化学专题:盐和化肥知识点归纳.doc
中考化学专题:盐和化肥知识点归纳1、盐的概念:由金属阳离子(或NH4+)和酸根阴离子组成的化合物;或者能解离出金属离子(或NH4+)和酸根离子的化合物。
2、常见的盐:3、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
(1)实验步骤:研磨、溶解、过滤、蒸发(2)实验仪器:食盐碳酸钠、碳酸氢钠、碳酸钙的化学性质1)、碳酸钙的化学性质:①与酸的反应:2HCl + CaCO3= CaCl2+ H2O + CO2↑②高温分解:CaCO3CaO + CO2↑2)、碳酸钠的化学性质:(这两个反应可用于检验NaOH 是否变)(1)与酸的反应:2HCl + Na2CO3= 2NaCl + H2O + CO2↑(2)与碱溶液的反应;Ca(OH)2+ Na2CO3= CaCO3↓ + 2NaOH3)、碳酸氢钠的化学性质:与酸的反应;HCl + NaHCO3= NaCl + H2O + CO2↑4)、检验溶液中存在CO32-的方法:⑴取样少许与试管中,加入稀HCl,若有无色气泡产生,然后将该气体通入澄清石灰水中,石灰水变浑浊,则证明存在CO32-2HCl + CaCO3= CaCl2+ H2O + CO2↑ Ca(OH)2+ CO2==== CaCO3↓+ H2O⑵加入石灰水或Ba(OH)2溶液,若溶液变浑浊,然后加入稀盐酸浑浊消失,则存在CO32-Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 2HCl +CaCO3= CaCl2+ H2O+CO2↑⑶加入CaCl2或Ca(NO3)2溶液,若液体变浑浊,则有存在CO32-CaCl2+ Na2CO3= CaCO3↓+2NaCl Ca(NO3)2+ Na2CO3= CaCO3↓+2Na(NO3)24、盐的性质(1)盐的溶解性钾钠铵硝全可溶,碳酸钡钙银不溶;硫酸钡和氯化银,不溶水来不溶酸;镁铝亚铁和铁铜,五碱均不溶于水;氢氧化钙硫酸钙,微溶于水要记牢;(2)盐的化学性质A、盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)反应类型:置换反应Fe + CuSO4== Cu + FeSO4(“古代湿法炼铜”原理)2Al + 3CuSO4= Al2(SO4)3+ 3Cu Cu + 2AgNO3= Cu(NO3)2+ 2AgB、盐+ 酸→ 新盐+ 新酸(满足复分解反应的条件)反应类型:复分解反应H2SO4+ BaCl2=BaSO4↓+ 2HCl(注BaSO4沉淀:白色,不溶于稀硝酸)2HCl + Na2CO3= 2NaCl + CO2↑+ H2O2HCl + Ca CO3= CO2↑+ CaCl2+ H2OHCl + NaHCO3= H2O + NaCl +CO2↑HCl + AgNO3= HNO3+ AgCl↓ (注AgCl沉淀:白色,不溶于稀硝酸)C、盐+ 碱→ 新盐+ 新碱(反应物需都可溶,且满足复分解反应的条件)反应类型:复分解反应2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4现象:出现蓝色沉淀(注:CuSO4溶液:蓝色Cu(OH)2沉淀:蓝色)3NaOH + F eCl3= Fe(OH)3↓ + 3NaCl 现象:出现红褐色沉淀(注:FeCl3溶液:黄色Fe(OH)3沉淀:红褐色)Ca(OH)2+ Na2CO3= CaCO3↓ + 2NaOH 现象:澄清石灰水变浑浊D、盐+ 盐→ 两种新盐(反应物需都可溶,且满足复分解反应的条件)反应类型:复分解反应NaCl + AgNO3= AgCl ↓+ NaNO3现象:出现白色沉淀Na2SO4+ BaCl2= BaSO4↓+ 2NaCl 现象:出现白色沉淀5、复分解反应1、概念:由两种化合物互相交换成分,生成另外两种化合物的反应2、特点:首尾相交换,各元素的化合价不变3、条件:生成物:有沉淀或有气体或有水生成时,复分解反应才可以发生.4、反应物:有酸酸必溶,无酸碱盐溶由于初中常见的酸是可溶性的,因此:6、常见离子共存与检验1、若离子之间发生离子反应,离子间便不能在溶液共存:(1)生成沉淀物:Cl-与Ag+、Ba2+与SO42-、OH-与Cu2+、Fe3+(2)生成气体:OH-与NH4+、H+和CO32-(3生成水2、此外要注意:题目要求的在酸性溶液还是碱性溶液、或者溶液是无色还是有色常见的有色离子:Fe3+黄色、Fe2+浅绿色、Cu2+蓝色、MnO4-紫色7、除杂遵循的原则:不增、不减、简便、易分1、物理方法:利用物质的溶解性、磁性、沸点等物理性质的差异分离Eg:铁粉和碳粉BaSO4和NaOH粉末2 化学方法:①化气法:像混合物中加入某种试剂,使混合物中的杂质变为气体逸出Eg:NaCl中混有少量Na2CO3杂质方法:加入HCl Na2CO3+HCl=NaCl+H2O+CO2↑3 沉淀法:向混合物中加入某种试剂,使该试剂与杂质放映转化成沉淀,再经过虑除掉沉淀,以除杂质Eg:NaCl中混有少量NaSO4杂质方法:加入BaCl,过滤除去杂质NaSO4=BaSO4+NaCl4、加热高温法:热高温混合物是杂质变为气体除去Eg:CaO中混有CaCO3杂质方法:高温加热CaCO3CaO + CO2↑5、溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质Eg:Cu中混有少量CuO杂质方法:加入稀HCl,再经过过滤而除去CuO+HCl=CuCl2+ H2O6. 置换法:向混合物中加入一种单质,是单质与杂质反应,而被除去Eg:FeSO4中混有少量CuSO4杂质方法:向其加入足量的铁粉Fe+ CuSO4=Cu+FeSO47、吸收法:将气体混合物通过洗气装置,杂质被洗气装置的试剂吸收而除去Eg:CO中混有少量CO2方法:将混合气体通过盛有足量的NaOH溶液的洗气置2NaOH+CO2=Na2CO3+H3O8、化肥一、农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构二、化学肥料:(氮肥、钾肥、磷肥)1、氮肥(1)、作用:促进植物茎、叶生长茂盛、叶色浓绿(促叶)。
初三化学知识点总结:盐、化肥
初三化学知识点:第十一单元盐化肥一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途(1)作调味品(2)作防腐剂白色粉末,水溶液有咸(3)消除积雪(降低雪的熔点)氯化钠食盐味,溶解度受温度影响(4)农业上用NaCl溶液来选种不大(5)制生理盐水(0.9%NaCl溶液)Na+维持细胞内外的水分分布,促进细胞内外物质交换Cl-促生盐酸、帮助消化,增进食欲碳酸钠Na2CO3 纯碱(因水溶液呈碱性)苏打白色粉末状固体,易溶于水用于玻璃、造纸、纺织、洗涤、食品工业等碳酸氢钠小苏打白色晶体,易溶于水制糕点所用的发酵粉医疗上,治疗胃酸过多NaHCO31、粗盐中由于含有氯化镁氯化钙等,易吸收空气中的水分而潮解。
无水氯化钙可用作干燥剂备注2、2NaHCO3△Na2CO3+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO↑2二、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、实验步骤:溶解、过滤、蒸发2、实验仪器实验步骤实验仪器其中玻璃棒的作用溶解烧杯、玻璃棒加速溶解铁架台(带铁圈)、漏斗、烧杯、玻璃过滤引流棒蒸发铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒使液体受热均匀,防止液体飞溅三、盐的化学性质1、盐(可溶)+金属1→金属2+新盐(金属1比金属2活泼,K、Ca、Na除外)2、盐+酸→新盐+新酸(满足复分解反应的条件)3、盐+碱→新盐+新碱(反应物需都可溶,且满足复分解反应的条件)4、盐+盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)注:①复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
(有酸酸必溶,无酸均要溶)②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓Fe(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓生成气体:H+与CO32-;NH4+与OH-生成水:H+与OH-③反应实质:离子结合成H2O:H+与OH-↑:H+与CO32-;NH4+与OH-↓:Ag+与Cl-;CO32-Ba2+与CO32-;SO42-Ca2+与CO32-⋯Mg2+与OH-⋯⋯四、特殊离子鉴别H+1、指示剂;2、活泼金属;3、金属氧化物;4、碱;5、某些盐:CO32-盐6、PHOH-1、指示剂;2、非金属氧化物;3、碱;4、某些盐:Fe3+、Cu2+盐5、PHCl-用AgNO3溶液,生成不溶于硝酸的AgCl沉淀SO42-用Ba(NO3)2溶液,生成不溶于硝酸的BaSO4沉淀;或用HCl和BaCl2CO32-用HCl能产生使Ca(OH)2变浑浊的气体Fe3+用OH-能生成红褐色沉淀Cu2+用OH-能生成蓝色沉淀NH4+用OH-能生成NH4OH,不稳定,分解出NH3;能使湿润的红色石蕊试纸变蓝Mg2+用OH-能生成白色沉淀Ca2+用CO32-能生成白色沉淀五、题型讲解:1、离子共存:即离子不能结合成H2O、↓、↑例:下列离子能在pH=13的水溶液中大量共存的是()A.SO42-、Cl-、Na+、H+B.K+、SO42-、Cu2+、NO3-C.Cl-、K+、SO42-、Na+D.Ca2+、Cl-、CO32-、Na+2、区分物质:找物质间的不同点(通常用特殊离子鉴别法)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、生活中常见的盐
二、粗盐提纯
1、粗盐中还有较多可溶性杂质(MgCl
2、CaCl2deng)和不溶性杂志(泥沙等)
粗盐提纯的原理:1)用过滤的方法除去不溶性杂质;2)根据氯化钠的溶解度曲线用蒸发结晶的方法除去可溶性杂质。
2、提纯步骤:
溶解:用天平称取食盐,用量筒量取水,放入烧杯,用玻璃棒搅拌
过滤:一贴、二低、三紧靠。
如滤液仍浑浊,应再过滤一次。
实验仪器有:烧杯(两个)、漏斗、滤纸、玻璃棒、带有铁圈的铁架台
蒸发结晶:将所得澄清滤液倒入蒸发皿中,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,并用玻璃棒不断搅拌,出现比较多固体时,停止加热。
计算产率:用玻璃棒把固体转移到纸上,称量。
产率=精盐的质量/粗盐的质量×100%
【注意】1、玻璃棒的作用:①溶解时用玻璃棒搅拌,以加快食盐溶解②过滤使用玻璃棒引流③蒸发时用玻璃棒搅拌,以防止局部温度过高,造成液滴飞溅④计算产率时用玻璃棒转移氯化钠固体
2、过滤操作应注意(一贴、二低、三靠)
一贴:滤纸紧贴漏斗内壁(一般在将滤纸贴在漏斗壁时先用水润湿并挤出气泡,因为如果有气泡会影响过滤速度)
二低:一低、滤纸边缘低于漏斗边缘二低、滤液面边缘低于滤纸边缘
三靠:一靠:烧杯紧靠玻璃棒;二靠:玻璃棒末端紧靠三层滤纸处(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破);三靠:漏斗末端较长处紧靠烧杯内壁(防止溅出)
3、过滤后溶液仍浑浊的原因:
①滤纸破损
②过滤时,滤液高于滤纸边缘
4、实验过程中,出现的误差:
①溶解搅拌时液滴溅出,产率降低
②溶解时加入的粗盐过多,未完全溶解,产率降低
③过滤时,未洗涤玻璃棒、烧杯而使氯化钠损失,产率降低
④蒸发时没有及时搅拌或者停止太晚造成液滴飞溅,使产率降低
⑤称量时操作或读数错误
三、盐的化学性质(酸碱盐之间的化学反应)
盐的组成:由金属离子(或NH4+)和酸根离子组成
1、盐+酸=新盐+新酸
①CaCO3+2HCl==CaCl2+H2O+CO2↑(制取CO2的原理)
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③NaHCO3+HCl==NaCl+H2O+CO2↑(灭火的原理)
2、盐+碱=新盐+新碱
①Na2CO3+Ca(OH)2==CaCO3↓+2NaOH②Na2SO4+Ba(OH)2==BaSO4↓+2NaOH3、盐+盐=新盐+新盐
①Na2SO4+BaCl2==BaSO4↓+2NaCl
②AgNO3+NaCl==AgCl↓+NaNO3
4、盐+金属=新盐+新金属,遵循金属活动性顺序
四、复分解反应
1、定义:两种化合物互相交换成分,生成另外两种化合物的反应。
形如AB+CD=AD+BC
2、特点:仅相互交换成分,无元素、化合价的变化
3、发生的条件:①有沉淀②或有水③或有气体生成(三者之一)
4、类型:酸+金属氧化物=盐+水酸+碱=盐+水
酸+盐=新酸+新盐碱+盐=新碱+新盐盐+盐=新盐+新盐
五、化肥(植物生成需求量最大的元素是氮、磷、钾)
1、氮肥:
①种类:尿素CO(NH2)2氨水NH3·H2O铵盐(NH4HCO3、NH4Cl、(NH4)2SO4)硝酸盐NH4NO3、NaNO3。
②作用:能促使作物茎叶生成茂盛、叶色浓绿
③若缺氮,会生成迟缓、叶色发黄、严重时叶脉呈淡棕色
【注意】铵态氮肥中NH4HCO3最不稳定,保存时要注意防潮避光,同时铵态氮肥不宜与碱性肥料混合使用。
2、磷肥:①种类:磷矿粉Ca3(PO4)2、钙镁磷肥(含钙和镁的磷酸盐)、过磷酸钙(磷酸二氢钙Ca(H2PO4)2
和CaSO4混合物)等含磷的物质
②作用:促使根系发达、增强抗寒、抗旱能力;
③缺磷时,植株矮小、生长迟缓、根系瘦弱
3、钾肥:①种类:硫酸钾、氯化钾;
②作用:促进茎秆粗壮、增强抗病抗虫害、抗倒伏能力;
③若缺钾,茎秆软弱、易倒伏、叶片呈褐色、并逐渐焦枯。
4、复合肥:含两种或两种以上营养元素的化肥。
主要有硝酸钾KNO3、磷酸铵(NH4H2PO4和(NH4)2HPO4混合物)、磷酸钾等。
5、化肥的简单鉴别方法:一看、二闻、三溶,灼烧、与碱混合研磨等
看外观:氮肥、钾肥都是白色晶体、磷肥是灰白色固体粉末加水:氮肥、钾肥都溶于水,磷肥大多不溶于水或者部分溶于水灼烧:氮肥可以燃烧或熔化冒烟,钾肥不燃烧。
能灼烧发光的是硝酸铵,熔化冒烟的是硫酸铵,氯化铵
几种常见氮肥简易鉴别:
NH3·H2O液态
NH4HCO3有强烈的氨味
尿素CO(NH2)2加入碱无氨味
(NH42)SO4加入硝酸钡和稀硝酸,产生白淀
NH4Cl加入硝酸银溶液和稀硝酸,产生白色沉淀
NH4NO3灼烧能燃烧发光;熔化冒烟的为硫酸铵,氯化铵
6、有关计算:会计算化肥中某元素的质量分数、相对分子质量、元素间的质量比等。
【易错点】
一、除杂
遵循的原则:不增、不减、简便、易分
所选除杂试剂只与杂质反应,不与原物质反应;反应后生成便于除去的物质,如气体、沉淀等;与杂质反应时不会产生新的杂质。
1、物理方法:利用物质的溶解性、磁性、沸点等物理性质的差异分离例:铁粉和碳粉BaSO4和NaOH粉末
2、化气法:像混合物中加入某种试剂,使混合物中的杂质变为气体逸出例:NaCl中混有少量Na2CO3杂质
方法:加入HClNa2CO3+HCl=NaCl+H2O+CO2↑
3、沉淀法:向混合物中加入某种试剂,使该试剂与杂质放映转化成沉淀,再经过虑除掉沉淀,以除杂质例:NaCl中混有少量NaSO4杂质
方法:加入BaCl,过滤除去杂质NaSO4=BaSO4+NaCl
4、加热高温法:热高温混合物是杂质变为气体除去例:CaO中混有CaCO3杂质
方法:高温加热
CaCO3高温CaO+CO2↑
5、溶解法:向混合物中加入某种试剂,使杂质与试剂反应而被溶解掉,以除去杂质
例:Cu中混有少量CuO杂质
方法:加入稀HCl,再经过过滤而除去CuO+HCl=CuCl2+H2O
6.置换法:向混合物中加入一种单质,是单质与杂质反应,而被除去例:FeSO4中混有少量CuSO4杂质方法:向其加入足量的铁粉Fe+CuSO4=Cu+FeSO4
7、吸收法:将气体混合物通过洗气装置,杂质被洗气装置的试剂吸收而除去例:CO中混有少量CO2
方法:将混合气体通过盛有足量的NaOH溶液的洗气装置
2NaOH+CO2=Na2CO3+H2O
【补充】
1、元素化合价口诀:钾钠银氢正一价,钙镁钡锌正二价。
铝三碳四氧负二,氟氯溴碘负一价。
金正非负单质零,正负总价和为零。
2、原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。
负三记住磷酸根,正一价的是铵根。
3、溶液颜色口诀:铜蓝、亚铁绿、铁黄、高锰酸钾紫
4、七字沉淀——“一蓝一红褐五白”
●蓝色:Cu(OH)2●红褐色:Fe(OH)3●白色:Mg(OH)2BaCO3、BaSO4、CaCO3、AgCl★其中BaSO4、AgCl既难溶于水,又不溶于稀硝酸。
5、判断复分解反应的实质:十对粒子——“一水两气七字沉淀”
①生成水:H++OH-→H2OH++O2-→H2O
②生成气体↑:◆H++CO32-→CO2↑+H2O◆NH4++OH-→NH3↑+H2O
③生成沉淀↓:七字沉淀——“一蓝一红褐五白”
★Cu2++OH-→Cu(OH)2↓(蓝色)
★Fe3++OH-→Fe(OH)3↓(红褐色)
★Mg2++OH-→Mg(OH)2↓(白色)
★Ba2++CO32-→BaCO3↓(白色)
★Ca2++CO32-→CaCO3↓(白色)
★Ag++Cl-→AgCl↓(白色)
★Ba2++SO42-→BaSO4↓(白色)
6、表中涉及到三种挥发性酸:HNO3、HCl、H2CO3应密封保存;四种微溶物质:Ca(OH)2、Ag2SO4、CaSO4、MgCO3;
“——”表示三种不存在或遇水就水解的物质:AgOH、Fe2(CO3)3、Al2(CO3)3
三、离子共存及常见离子检验
1、若离子之间发生离子反应,离子间便不能在溶液共存:(1)生成沉淀物:Cl-与Ag+;Ba2+与SO42-;OH-与Cu2+、Fe3+、Mg2+;CO32-与Ca2+、Ba2+等
(2)生成气体:OH-与NH4+、H+和CO32-
(3)生成水
2、此外要注意:题目要求的在酸性溶液还是碱性溶液、或者溶液是无色还是有色
常见的有色离子:Fe3+黄色、Fe2+浅绿色、Cu2+蓝色、MnO4-紫色3、常见离子的检验。
