届武汉市部分高中高三年级元调考试模拟训练化学试卷
湖北省高三下学期第三次模拟考试化学试卷(附答案与解析)

湖北省高三下学期第三次模拟考试化学试卷(附答案与解析) 学校:___________班级:___________姓名:___________考号:___________一、单选题1.下列说法正确的是 ( )A .利用铝热反应可以冶炼高熔点金属B .我们常用pH 试纸测定新制氯水的pH 值C .食盐的焰色试验是化学变化D .铁盐和铝盐可用作净水剂和消毒剂2.下列对化学用语的描述中,错误的是 ( )A .甲烷的结构式:B .磷原子的结构示意图:C .23592U 和23892U 互为同位素D .NaCl 的电子式:3.乙酰氨基阿维菌素是高效、广谱、低残留的兽用最新一代驱虫药物,其结构如图所示。
下列有关乙酰氨基阿维菌素的说法错误的是 ( )A .属于芳香族化合物B .分子式为10112C H O N C .分子中至少有8个碳原子共面D .能发生取代反应、加成反应 4.已知25℃时二元酸H 2A 的7a1 1.310-=⨯K 和15a27.110-=⨯K ,一元酸HB 的()10a B 6.210K -=⨯。
下列说法错误的是 ( )A .向NaB 溶液中滴加少量H 2A 溶液,发生反应的离子方程式为:2B H A=HB HA --++B .向10.1mol L -⋅的H 2A 溶液中通入HCl 气体(忽略溶液体积的变化)至pH 3=,则2H A 的电离度为0.013%C .1100mL0.1mol L -⋅的HB 溶液与110mL1.0mol L -⋅的HB 溶液中H +的数目,后者多D .中和等浓度、等体积的HB 和盐酸,消耗NaOH 的物质的量相同5.化学与生产、生活、科技和环境等联系密切,下列说法错误的是 ( )A .襄阳大头菜含有氨基酸、维生素、纤维素等高分子有机物,均可被人体吸收利用B .襄阳汉江边的临汉门是木质,包上铁皮订上铜钉可防火攻但是会加快铁皮的腐蚀C .锅炉水垢中含有4CaSO ,可先用23Na CO 溶液处理,后用酸除去D .较低温度更有利于合成氨反应得到较大的平衡转化率6.N A 表示阿伏加德罗常数的值,下列说法中正确的是A .100mL0.1mol/L 氯水中含氯气分子数为0.01N AB .常温常压下,22gCO 2所含有的分子数为0.5N AC .标准状况下,11.2LI 2所含有的碘原子数为N AD .1mol/L 的CaCl 2溶液中含有Cl -的数目为2N A7.下列有关钠及其化合物的叙述错误的是 ( )A .反应①②表明Na 具有还原性B .反应③表明CO 2具有酸性氧化物的性质C .反应④可用于除去NaHCO 3中少量Na 2CO 3D .反应⑤⑥中都存在每消耗1molNa 2O 2转移1mol 电子8.据《化学工程杂志》最近报道,科学家利用BN 和2TiO 创造一种复合光催化剂,可快速分解世界上最难降解污染物M 。
化学丨湖北省武汉市部分学校2022-2023学年高三上学期第一次调研考试化学试卷及答案

2022~2023学年度武汉市部分学校高三年级九月调研考试化学试卷全卷满分100分。
考试用时75分钟。
★祝考试顺利★可能用到的相对原子质量:H1C12N14O16Na23S32Cu64一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.生产精细化学品是当前化学工业结构调整的重点之一、下列不属于精细化学品的是A.医药B.硫酸C.日用化学品D.食品添加剂【答案】B【解析】【分析】精细化工产品(即精细化学品)是指那些具有特定的应用功能,技术密集,商品性强,产品附加值较高的化工产品,根据此定义进行判断;【详解】A.医药应用广泛,具有特定的应用功能,故A符合精细化学品;B.硫酸不属于技术密集的产品,故不属于精细化学品;故B符合题意;C.日用化学品具有特定的应用功能,符合精细化学品,故C不符合题意;D.食品添加剂具有特定应用功能,符合精细化学品,故D不符合题意;故选答案B;【点睛】此题考查信息应用,利用精细化学品的名称及特点进行判断。
2.化学与生活密切相关。
下列说法错误的是A.二氧化硫可用于杀菌和消毒B.超导陶瓷可用于磁悬浮技术C.天然药物可以放心大量使用D.久置的植物油被氧化而变质【答案】C【解析】【详解】A.二氧化硫具有一定的氧化性,可用于杀菌和消毒,A正确;B.超导陶瓷是一种新型材料,可用于磁悬浮技术,B正确;C.天然药物应该在医嘱下合理使用,C错误;D.久置的植物油会被空气中氧气氧化而变质,D正确;故选C 。
3.科研人员研制出由18个碳原子构成的环碳分子(如图所示),下列说法正确的是A.是一种共价化合物B.硬度大、熔点高C.与乙炔互为同系物D.与60C 互为同素异形体【答案】D 【解析】【详解】A .该物质的化学式为C 18,是由C 元素组成的单质,故A 错误;B .该物质由C 18分子构成,硬度小、熔点低,故B 错误;C .该物质是C 元素组成的单质,乙炔是化合物,不是同系物,故C 错误;D .该物质与60C 都是由C 元素组成的不同单质,互为同素异形体,故D 正确;选D 。
届武汉市部分高中高三年级元调考试模拟训练化学试卷审批稿

届武汉市部分高中高三年级元调考试模拟训练化学试卷YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】2018届武汉市部分高中高三年级元调考试模拟训练化 学 试 卷本试卷共300分,考试用时150分钟。
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(必考题和选考题)两部分。
第Ⅰ卷 1 至 5 页,第Ⅱ卷 6至 16页。
本卷共16页。
第Ⅰ卷(选择题 共126分)本卷共21小题,每小题6分,共126分。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 Fe 56 Se 79一、选择题:本大题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、社会发展息息相关。
下列说法不正确...的是 A .用SO 2漂白过的草帽日久会变色 B .用天燃气代替煤作燃料可减少大气污染 C .“84消毒液”杀死病菌是因为蛋白质变性 D .乙醇用作医用消毒剂时,无水乙醇消毒效果最好 8.设N A 为阿伏加德罗常数的值。
下列有关叙述正确的是A .107 g Fe(OH)3胶体中胶体粒子的数目为N AB .2 mol SO 2 与1 mol O 2反应生成的SO 3分子数为2N AC .14 g 分子式为C n H 2n 的链烃中含有的碳碳双键的数目为nN AD . g Na 2O 2与足量水反应转移的电子数为9.已知甲苯的结构简式为,其二氯代物的同分异构体有A .7种B .8种C .9种D .10种 10.下列选用的仪器和药品能达到实验目的的是CH 3分布系数pHH 2C 2O 4各种微粒分布曲线H 2C 2O 4HC 2O 4-C 2O 42-1 2 3 45 6 7 8,,尾气吸收Cl 2吸收CO 2中的HCl 杂质蒸馏时的接收装置乙酸乙酯的收集装置11.碱性硼化钒—空气电池工作时反应为:4VB 2+11O 2===4B 2O 3+2V 2O 5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图。
2022届湖北武汉市高三年级5月第一次模拟考试化学试卷

9.下列说法错误的是(
)
A.石墨晶体中层内导电性强于层间导电性
B.基态 Cr3+的最高能层中成对电子与未成对电子的数目比为 8∶3
C.(CH3COO)2Ni·4H2O 的空间构型为八面体,中心离子的配位数为 6
D.N 元素的电负性比 P 元素的大,可推断 NCl3 分子的极性比 PCl3 的大
10.某电池材料的结构如图,M、W、X、Y、Z 是原子序数依次增大的同周期主族元素,Y 元素原子的价电
②步骤Ⅱ逐次少量地通入稀有气体的目的是___________
③仪器 W 合适的加热方式为___________
A.水浴加热
B.油浴加热
C.酒精灯加热
D.酒精喷灯加热
④写出烧杯中尾气处理的离子方程式;___________,步骤Ⅲ最后将物料加热至 200℃,可能的目的是_______
__
__。
17.
(14 分) 工业上以锌白矿(主要成分为 ZnO,还含有 PbO、FeO、Fe2O3、CuO、SiO2 等杂质)为主要原料
酸性 KMnO4 溶
酸性 KMnO4 溶液
液紫色褪去
பைடு நூலகம்
用蒸馏水溶解 CuCl2 固体,并
溶液由绿色逐
[CuCl4]2-+4H2O
继续加水稀释
渐变为蓝色
正向移动
将 25℃ 0.1 mol·L-1Na2SO3 溶
C
液加热到 40℃,用传感器监
测溶液 pH 变化
将铜与浓硫酸反应产生的气
D
8.
)
体通入 BaCl2 溶液中
B. 向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e- = Cu
C. 向含 0.5mol 溴化亚铁溶液中通入 0.5mol 氯气 2Fe2++Cl2=2Fe3++2ClD. 将少量 SO2 气体通入 Ca(ClO)2 溶液中:SO2+ClO—+H2O = SO42-+Cl—+2H+
2024届湖北省武昌市高三3月份模拟考试化学试题含解析

The Bliss of a Weekend: A Peek into MyPlansThe weekend, a time of rejuvenation and relaxation, arrives with the gentle breath of fresh air on Friday evening. It's a time to escape the hustle and bustle of the weekdays and immerse oneself in activities that nurture the soul. As the sun sets on another workweek, I find myself eagerly anticipating the weekend ahead, filled with a blend of excitement and anticipation.Saturday morning is reserved for a leisurely breakfast and a refreshing walk in the nearby park. The gentle rustle of leaves and the twitter of birds provide a serene backdrop for deep reflection and inner peace. Following this, I indulge in a hobby that I cherish - painting. With every stroke of the brush, I feel a sense of accomplishment and creativity flowing through me. The art studio becomes my sanctuary, a place where I can express myself freely and without restraint.In the afternoon, I embark on a reading journey, delving into the pages of a book that has caught my eye. The escape into another world, whether it's a thrillingadventure or a profound philosophical exploration, is both refreshing and thought-provoking. The quietude of my room and the companionship of my thoughts create a perfect setting for intellectual growth and emotional nourishment. Saturday evening is dedicated to physical activity. Whether it's a game of tennis with friends or a solo run along the river, the exercise serves as a reminder of the importance of maintaining a healthy lifestyle. The endorphins released during exercise leave me feeling invigorated and ready to tackle the next day's adventures. Sunday is reserved for family time. We gather around the breakfast table, sharing stories and laughter over a hearty meal. Later, we might visit a nearby attraction or simply relax at home, watching a movie or playing board games. These simple pleasures remind me of the value of spending quality time with loved ones.In the evening, I indulge in some personal time, catching up on any unfinished tasks or simply enjoying the silence of my room with a cup of coffee. The weekend comes to a close with a sense of fulfillment and contentment, knowing that I have made the most of my free time.As the clock ticks towards midnight, I find myself looking forward to the coming week with renewed energy and enthusiasm. The weekend, although brief, has provided me with a much-needed break, filled with moments of joy, relaxation, and personal growth. I embrace the upcoming weekdays with a newfound zest for life, knowing that the next weekend will bring yet another opportunity to create memories and cherish the simple pleasures of life.**周末的福祉:一窥我的计划**周末,这个充满恢复与放松气息的时光,随着周五晚上清新的空气轻轻到来。
2024届湖北武汉市蔡甸区汉阳一中高三3月份模拟考试化学试题含解析
2024届湖北武汉市蔡甸区汉阳一中高三3月份模拟考试化学试题请考生注意:1.请用2B 铅笔将选择题答案涂填在答题纸相应位置上,请用0.5毫米及以上黑色字迹的钢笔或签字笔将主观题的答案写在答题纸相应的答题区内。
写在试题卷、草稿纸上均无效。
2.答题前,认真阅读答题纸上的《注意事项》,按规定答题。
一、选择题(共包括22个小题。
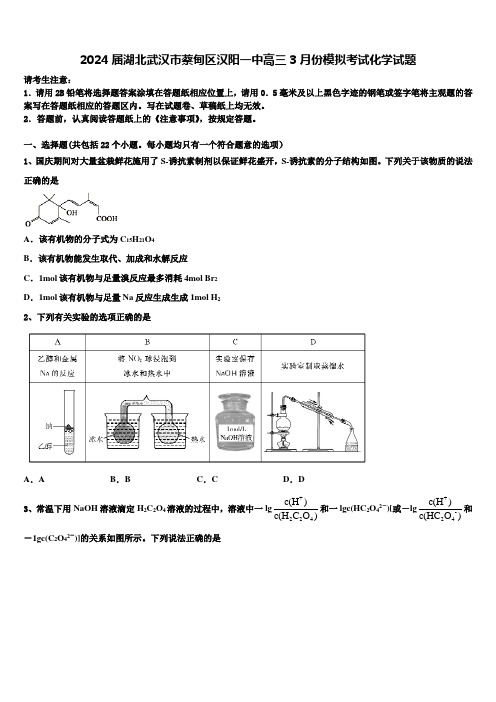
每小题均只有一个符合题意的选项)1、国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,S-诱抗素的分子结构如图。
下列关于该物质的说法正确的是A .该有机物的分子式为C 15H 21O 4B .该有机物能发生取代、加成和水解反应C .1mol 该有机物与足量溴反应最多消耗4mol Br 2D .1mol 该有机物与足量Na 反应生成生成1mol H 2 2、下列有关实验的选项正确的是A .AB .BC .CD .D3、常温下用NaOH 溶液滴定H 2C 2O 4溶液的过程中,溶液中一lg +224c(H )c(H C O )和一lgc(HC 2O 42-)[或-lg +-24c(H )c(HC O )和-1gc(C 2O 42-)]的关系如图所示。
下列说法正确的是A .K a1(H 2C 2O 4)数量级为10-1B .曲线N 表示-lg +224c(H )c(H C O )和-lg c(HC 2O 4-)的关系C .向NaHC 2O 4溶液中加NaOH 至c(HC 2O 4-)和c(C 2O 42-)相等,此时溶液pH 约为5D .在NaHC 2O 4溶液中C(Na +)>c(HC 2O 4-)>c(H 2C 2O 4)>c(C 2O 42-) 4、工业上获得大量乙烯、丙烯、丁二烯的方法是( ) A .卤代烃消除B .煤高温干馏C .炔烃加成D .石油裂解5、周期表中有如图所示的元素,下列叙述正确的是A .47.87是丰度最高的钛原子的相对原子质量B .钛原子的M 层上共有10个电子C .从价电子构型看,钛属于某主族元素D .22为钛原子的质量数 6、可逆反应aX(g)+bY(g)cZ(g)在一定温度下的密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(υ)—时间(t)图象如下图。
湖北省武汉市黄陂区2024届高三下学期模拟考试(三)化学含答案

黄陂2024届高三模拟考试(三)化学试题(答案在最后)命题人:注意事项:1.答卷前,考生务必将自己的姓名、准考证号填涂在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1-O 16-F 19-Na 23-Al 27-S 32-K 39-Fe 56-一、选择题:本题共15小题,每小题3分,共45分。
每小题只有一个选项符合题目要求。
1.下列古诗文中蕴含着一定的化学知识或原理,下列有关说法错误的是()。
A .“日照澄洲江雾开,淘金女伴满江展”中的现象与胶体知识有关B .“有硇水(硝酸)者,剪银块投之,则旋而为水”,该过程涉及氧化还原反应C .“雨过天青云破处,这般颜色做将来”中所描述瓷器的青色不是来自氧化铁D .“借问瘟君欲何往,纸船明烛照天烧”,纸和烛的化学成分相同2.劳动有利于“知行合一”。
下列劳动项目与所述的化学知识没有关联的是()。
选项劳动项目化学知识A 帮厨活动:帮食堂师傅煎鸡蛋准备午餐加热使蛋白质变性B 环保行动:宣传使用聚乳酸制造的包装材料聚乳酸在自然界可生物降解C 家务劳动:擦干已洗净的铁锅,以防生锈铁丝在2O 中燃烧生成34Fe O D学农活动:利用秸秆、厨余垃圾等生产沼气沼气中含有4CH 可作燃料3.下列化学反应表示错误的是()。
A .23Al O 与NaOH 溶液反应:()2324Al O 2NaOH 3H O 2Na Al OH ⎡⎤++===⎣⎦B .碱性锌锰电池的正极反应:()22MnO e H O MnO OH OH--++===+C .向蓝色2CuCl 溶液中加入浓NaCl 溶液,发生反应:()[]222424Cu H O 4Cl CuCl 4H O+--⎡⎤+===+⎣⎦D .苯甲酰胺在盐酸中水解:4.设A N 为阿伏加德罗常数的值,下列说法正确的是()。
2020届武汉市武昌区高三年级元月调研测试高中化学

2020届武汉市武昌区高三年级元月调研测试高中化学化学试卷本试卷分第一卷〔选择题〕和第二卷〔非选择题〕两部分,考试时刻为90分钟第一卷〔选择题48分〕可能用到的相对原子质量:H-1 C-12 O-16 N-14Na-23 Al-27 Fe-56 Cu-64 Zn-65一、选择题〔此题包括16小题,每题3分,共48分,每题只有一个正确答案〕1.以下讲法正确的选项是〔〕A.三聚氰胺〔C3H6N6〕含氮量高,牛奶中加入它能够增加蛋白质的含量B.硫磺蒸熏过的馒头变得更白,这有利于人体健康C.过氧乙酸〔CH3COOOH〕具有强氧化性,可用于杀菌消毒D.福尔马林是一种良好的杀菌剂,可用于消毒饮用水2.以下化合物不能通过化合反应获得的是〔〕A.Na2O2B.FeS C.CuS D.Fe〔OH〕33.以下关于工业生产讲法中,错误的选项是......〔〕A.工业上采纳电解熔融氯化铝的方法制取金属铝B.在氯碱工业中,电解槽被离子交换膜隔成阴极室和阳极室C.在合成氨工业中,采纳循环操作提高原料利用率D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳4.观看以下模型并结合有关信息进行判定,以下讲法错误的选项是......〔〕HCN S8SF6B12结构单元结构模型示意图备注/ 易溶于CS2/ 熔点1873KA .HCN 的结构式为H -C≡NB .固态硫S 8属于原子晶体C .SF 6是由极性键构成的非极性分子D .单质硼属原子晶体,结构单元中含有30个B -B 键,含20个正三角形 5.以下各组离子在指定溶液中能大量共存的是〔 〕A .无色溶液中:K +、Cu 2+、Na +、-24SO B .强酸性溶液中:Al 3+、-3NO 、I -、Cl —C .pH=11的溶液中:Na +、-23CO 、-2AlO 、-3NOD .加入Al 能放出H 2的溶液中:+4NH 、Cl —、-23HCO 、-3NO6.以下反应的离子方程式错误的选项是......〔 〕A .氯化铝溶液中加入过量氨水:Al 3++3NH 3·H 2O =Al 〔OH 〕3↓+3+4NHB .向苯酚钠溶液中通入CO 2:+CO 2+H 2O →+-23HCOC .小苏打溶液中加入少量石灰水:2-23HCO +Ca 2++2OH -=CaCO 3↓+-23CO +2H 2O D .NaHS 水解反应:HS -+H 2OS 2-+H 3O +7.用4种溶液进行实验,下表中〝操作及现象〞与〝溶液〞对应关系错误的选项是......〔 〕 选项 操作及现象溶液A 通入CO 2,溶液变浑浊,再升温至65℃以上,又变澄清. C 6H 5ONa 溶液B 通入CO 2,溶液变浑浊,连续通CO 2至过量,又变澄清. Na 2SiO 3溶液C通入CO 2,溶液变浑浊,再加入少量品红溶液,红色褪去.Ca 〔ClO 〕2溶液D通入CO 2,溶液变浑浊,连续通CO 2至过量,又变澄清.再加入足量NaOH 溶液,又变浑浊.Ca 〔OH 〕2溶液8.N A 表示阿伏加德罗常数的值,以下讲法中正确的选项是〔 〕A .2.8 g 乙烯和丙烯的混合物中所含碳原子数为0.2N AB .4.48 L H 2和O 2的混合物中所含分子数为0.2N AC.4 g重水〔D2O〕中所含质子数为0.2N AD.200 mL 1 mol/L的氨水中含NH3·H2O分子数为0.2N A9.在FeO、Fe2O3和CaCO3的混合物中,铁元素的质量分数为56%,那么CaCO3的质量分数可能是〔〕A.10% B.25% C.30% D.35%10.常温下,0.1 mol/L KCl溶液和0.1 mol/L CH3COOK溶液各100 mL,两溶液中所含离子总数〔〕A.一样多B.KCl溶液中多C.CH3COOK溶液中多D.无法比较11.以下实验差不多操作正确的选项是〔〕A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定B.将氢氧化钠固体放在纸片上称量C.测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量D.用玻璃棒蘸取溶液滴到潮湿的pH试纸上,测其pH12.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平稳:X〔g〕+Y〔g〕2Z〔g〕;△H<0.当改变某一条件并达到新平稳后,以下表达正确的选项是〔〕A.升高温度,X的转化率增大B.缩小容器体积,Z的浓度不变C.保持压强不变,再充入0.1 mol X和0.1 mol Y,X的体积分数增大D.保持容器体积不变,充入一定量的氦气,Y的浓度不变MnO.取一支试管,加入适量PbO2固13.强氧化剂PbO2在酸性溶液中可将Mn2+氧化成-4体和2 mL 6 mol/L H2SO4,然后滴入2 mL 1 mol/L MnSO4溶液.以下讲法错误......的选项是〔〕A.充分振荡后静置,溶液颜色变为紫色B.假设上述实验完全反应,消耗PbO2的物质的量为0.01 molC.上述实验不能用盐酸代替硫酸MnO的氧化性强D.在酸性条件下,PbO2的氧化性比-414.取pH均等于1的盐酸和醋酸各200 mL,分不稀释2倍,再分不加入0.6 g锌粉,在相同的条件下充分反应.有关表达正确的选项是〔〕A.放出氢气一样多B.醋酸与锌反应放出氢气多C.反应速率一样快D.盐酸与锌反应速率快15.按以下图所示装置进行实验〔其中C1、C2均是石墨电极〕,以下讲法中错误的选项是......〔〕A.在标准状况下,Zn极减轻3.25 g时,Cu极上放出气体体积约为1.12 LB.发觉a点邻近显红色C.在C1、C2电极所产动气体的体积比为2∶1D.乙池溶液的pH减小16.向含有1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol/LBa〔OH〕2溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018届武汉市部分高中高三年级元调考试模拟训练化 学 试 卷本试卷共300分,考试用时150分钟。
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(必考题和选考题)两部分。
第Ⅰ卷 1 至 5 页,第Ⅱ卷 6至 16页。
本卷共16页。
第Ⅰ卷(选择题 共126分)本卷共21小题,每小题6分,共126分。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 Fe 56 Se 79一、选择题:本大题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、社会发展息息相关。
下列说法不正确...的是 A .用SO 2漂白过的草帽日久会变色 B .用天燃气代替煤作燃料可减少大气污染 C .“84消毒液”杀死病菌是因为蛋白质变性 D .乙醇用作医用消毒剂时,无水乙醇消毒效果最好 8.设N A 为阿伏加德罗常数的值。
下列有关叙述正确的是A .107 g Fe(OH)3胶体中胶体粒子的数目为N AB .2 mol SO 2 与1 mol O 2反应生成的SO 3分子数为2N AC .14 g 分子式为C n H 2n 的链烃中含有的碳碳双键的数目为nN AD . g Na 2O 2与足量水反应转移的电子数为9.已知甲苯的结构简式为 ,其二氯代物的同分异构体有A .7种B .8种C .9种D .10种 10.下列选用的仪器和药品能达到实验目的的是A BCD尾气吸收Cl 2吸收CO 2中的HCl 杂质蒸馏时的接收装置乙酸乙酯的收集装置11.碱性硼化钒—空气电池工作时反应为:4VB 2+11O 2===4B 2O 3+2V 2O 5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图。
当外电路中通过 mol 电子时,乙装置中溶液的体积为400 mL 。
则下列说法正确的是A .外电路中电子由a 电极流向b 电极B .c 电极上生成气体的体积为 LC .乙装置中溶液的pH 为13D .VB 2电极发生的电极反应为:饱和碳酸钠溶液饱和NaHCO 3NaOH 溶液 —CH 3VB 2电极 aKOH 溶液 空气 甲b c NaCl 溶液 乙分布系数pHH 2C 2O 4各种微粒分布曲线H 2C 2O 4HC 2O 4-C 2O 42-1 2 3 45 6 7 8,,2VB 2+11H 2O―22e -===V 2O 5+2B 2O 3+22H +12.常温下, mol/L 的422O C H 溶液中422O C H 、-42O HC 、-242O C 三者中所占物质的量分数(分布系数)随pH 变化的关系如图所示。
下列表述不正确...的是 A .-42O HC +H +-242O CK =3.4101-⨯ B .将等物质的量的42O NaHC 、422O C Na 溶于 水中,所得溶液pH 恰好为C .常温下HF 的?K a =45.3101-⨯,将少量422O C H溶液加入到足量NaF 溶液中,发生的反应为:422O C H +-F ===HF +-42O HC D .在 mol/L 42O NaHC 溶液中,各离子浓度大小关系为:c (+Na )>c (-42O HC )>c (+H )>c (-242O C )>c (-OH )B13.短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 、X 原子的最外层电子数之比为5∶2,Z 原子比X 原子的核外电子数多5。
下列说法正确的是A .W 、Y 的最高价氧化物都是气体B .Y 、Z 形成的化合物一定为共价化合物C .四种元素中W 元素的非金属性最强D .W 、X 、Y 、Z 的原子半径大小顺序一定是:Z >Y >X >W第Ⅱ卷(共174分)三、本卷包括必考题和选考题两部分。
第22题~第32题为必考题,每个试题考生都应作答。
第33题~第38题为选考题,考生根据要求作答。
须用黑色签字笔在答题卡上规定的区域书写作答,在试题卷上作答无效。
(一)必考题(共11题,计129分) 26.(14分)碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业。
工业上利用锂辉石(Li 2Al 2Si 4O x )制备碳酸锂的流程如下:已知:碳酸锂的溶解度为(g/L )(1)锂辉石(Li 2Al 2Si 4O x )可以用氧化物的形式表示其组成,形式为 。
(2)硫酸化焙烧温度控制在250℃~300℃之间,主要原因是 ;焙烧中硫酸用量控制在理论用量的115%左右,硫酸加入过多的副作用是 。
(3)水浸时,加入CaCO 3粉末充分反应后过滤,滤渣的主要成分除CaCO 3外还有 。
(4)“沉锂”的化学反应方程式为 。
(5)“沉锂”需要在95℃以上进行,主要原因是 。
过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有 和 。
27.(15分)三氯化硼是一种重要的化工原料。
某同学设计的三氯化硼制备装置如下图。
【查阅资料】①BCl 3的熔点为― ℃,沸点为 ℃②2B +6HCl=====△2BCl 3+3H 2③硼与铝的性质相似,也能与氢氧化钠溶液反应请回答下列问题:(1)A 装置可用高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为 。
氢氧化钠溶液ABCD EFG浓硫酸 适量 适量(2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为 。
(3)装置E 中的试剂为 ,如果拆去E 装置,可能的后果是 。
(4)D 装置中发生反应前先通入一段时间的氯气,其目的是 , 该装置中发生反应的化学方程式为 。
(5)三氯化硼与水能剧烈反应生成硼酸(H 3BO 3)和白雾,写出该反应的化学方程式 。
(6)请设计一个简易实验,验证制得的产品中是否含有硼粉 。
28.(14分)“雾霾”成为人们越来越关心的环境问题。
雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。
请回答下列问题:(1)汽车尾气是雾霾形成的原因之一。
尾气治理可用汽油中挥发出来的烃类物质(C x H y )催化还原尾气中的NO 气体,该过程的化学方程式为 。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。
经研究发现将煤炭在O 2/CO 2的气氛下燃烧,能够降低燃煤时NO 的排放,主要反应为:2NO(g)+2CO(g)N 2(g)+2CO 2(g)ΔH已知:①N 2(g)+O 2(g)2NO(g)ΔH 1=+ kJ·mol -1 ②2CO(g)2C(s)+O 2(g)ΔH 2=+221 kJ·mol -1 ③C(s)+O 2(g)CO 2(g)ΔH 3=- kJ·mol -1则ΔH =_____________。
(3)某研究小组用NaOH 溶液吸收尾气中的二氧化硫,将得到的Na 2SO 3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a 表示 离子交换膜(填“阴”或“阳”)。
A ~E 分别代表生产中的原料或产品,其中C 为硫酸,则A 表示 ,E 表示 。
②阳极的电极反应式为 。
图一 图二(4)SO 2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO 2发生催化氧化的反应为:2SO 2(g)+O 2(g)2SO 3(g)。
若在T 1℃、 MPa 条件下,往一密闭容器通入SO 2和O 2[其中n (SO 2) ∶n (O 2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A 点时,SO 2的转化率为 。
A (8,C (30, B (30,T 1T 2p /MPat /minNa 2SO 3溶液ABCE+-②在其他条件不变的情况下,测得T 2℃时压强的变化曲线如图所示,则C 点的正反应速率v c (正)与A 点的逆反应速率v A (逆)的大小关系为v c (正) v A (逆)(填“>”、“<”或“=”)。
③图中B 点的压强平衡常数K p = (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(二)选考题:(每学科15分,共45分)请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题....作答,并用2B 铅笔在答题卡上把所选题目的题号涂黑。
注意所做题目的题号必须与所涂题目的题号一致,在答题卡上的选答区域的指定位置答题。
如果多做,则每学科按所做的第一题计分。
35.【化学──选修3:物质结构与性质】(15分)硒元素(selenium )是第四周期、VIA 族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显着的光电效应,可应用于光电半导体材料。
请回答下列问题:(1)Se 原子的核外电子排布式为[Ar] 。
(2)As 和Se 是同一周期的元素,As 的第一电离能比Se 大,原因是 。
(3) 24SeO 中Se―O 的键角比SeO 3的键角 (填“大”或“小”),原因是。
(4)H 2Se 比H 2S 水溶液的酸性强,原因是 。
(5)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
①螺旋链中Se 原子的杂化方式为 。
②己知正六棱柱的边长为a cm ,高为b cm ,阿伏加德罗常数为N A mol -l ,则该晶胞中含有的Se 原子个数为 ,该晶体的密度为 g/cm 3(用含N A 、a 、b 的式子表示)。
36.【化学──选修5:有机化学基础】(15分)1,6—己二酸(G )是合成尼龙的主要原料之一,可用烃A 氧化制备。
制备G 的合成路线如下:回答下列问题:(1)化合物A 的质谱图如下,则A 的化学名称为 。
BCDFG晶胞俯视图晶胞结构图(2)C→D 的反应类型为 。
(3)F 的结构简式为 。
(4)写出能同时满足下列条件的X 的同分异构体的结构简式 。
①相对分子质量与F 相等 ②烃的含氧衍生物,能发生银镜反应③核磁共振氢谱中有三组峰,面积比为3∶2∶1(5)由G 合成尼龙的化学方程式为 。
(6)由A 通过两步反应制备1,3—环己二烯的合成路线为 。
武昌区2017届高三年级元月调研考试理科综合试卷化学参考答案第Ⅱ卷(共174分)三、(一)必考题 26. (14分)(1)Li 2O·Al 2O 3·4SiO 2 (2分)(2)温度低于250℃,反应速率较慢;温度高于300℃,硫酸挥发较多。
(2分)增加后续药品的耗量2分)(3)CaSO 4、SiO 2、Al(OH)3(2分)(4)Na 2CO 3+Li 2SO 4===Li 2CO 3↓+Na 2SO 4 (2分) (5)温度越高,碳酸锂溶解度越小,可以增加产率 (2分)碳酸钠、碳酸锂(各1分、共2分) 27.(15分)(1)2KMnO 4+16HCl===2MnCl 2+2KCl +8H 2O +5Cl 2↑(2分)(2)a -hi -fg(或gf)-bc(或cb)-de -j (2分) (3)饱和食盐水(1分) 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 (2分)(4)排尽装置中的空气,避免氧气与硼粉反应生成B 2O 3 (2分)2B +3Cl 2 =====△2BCl 3 (2分) (5)BCl 3+3H 2O=== H 3BO 3+3HCl ↑(2分) (6)取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉(2分)28.14分)(1)4C x H y +(8x +2y ) NO=== 4x CO 2+(4x +y ) N 2+2y H 2O (2) kJ·mol -1(2分)(3)①阳(1分) NaOH 溶液(1分 氢气(1分) ②SO 32-―2e -+H 2O =2H ++SO 42-(2分) (4)①45% (2分) ②> (1分)③24300 (MPa)-1 (2分,没写单位扣1分)(二)选考题: 35.(15分)(1)42104p 4s 3d (2分)(2)As 的4p 能级是半充满状态,比较稳定,所以A +相对丰度% 质荷比672082 40546027 8010080 60 40 20 100 3941第一电离能比Se 大(2分)(3)小 (1分) -24SeO 空间构型为正四面体,键角为109o28′,SeO 3空间构型为平面正三角形,键角为120o (2分) (4)Se 原子半径大于S 原子半径,H —Se 共价键更容易断裂(2分)(5)①sp 3杂化(2分) ②9 (2分)A23158N b a ⋅⋅(2分)36.(15分)(1)环己烯(2分)(2)氧化反应(1分)(3)(2分)(4)OHCCH 2C(CH 3)2CH 2CHO 、OHCC(CH 2CH 3)2CHO (4分)(5)(2分)(62分,共4分)COOHCOOHNH 2RNH 2催化剂 + nn OC(CH 2)4CONHRNH HO H n + (2n ―1)H 2O OO O。
