第十二章 s区元素
第十二章 s区元素

5、举例说明铍与铝的相似性。 、举例说明铍与铝的相似性。
答:Be 和Al 单质及化合物性质有许多相似之处,可以从以下 几个方面来理解: (1) Be 和Al 都是两性金属,不仅能溶于酸也都溶于强碱,放 出氢气; (2) Be 和Al 的氢氧化物都是两性化合物,易溶于强碱; (3) Be 和Al 都是共价化合物,易升华,聚合,易溶于有机溶 剂; (4) Be 和Al 常温下不与水作用,与冷的浓硝酸接触时都发生 钝化现象; (5) Be 和Al 的盐都易水解。
12、关于s 区元素的性质下列叙述中不正确的是 A、 由于s 区元素的电负性小,所以都形成典型的离子型化 、 由于 区元素的电负性小, 合物 B、 在s 区元素中,Be、 Mg 因表面形成致密的氧化物保护 膜而对水较稳定 C、 s 区元素的单质都有很强的还原性 D、 除Be、 Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做 焰火材料 13、关于Mg , Ca , Sr , Ba 及其化合物的性质下列叙述中不正确 的是 A、 单质都可以在氮气中燃烧生成氮化物M3N2 B、 单质都易与水、水蒸气反应得到氢气 、 单质都易与水、水蒸气反应得到氢气(p378) C、M(HCO3)2 在水中的溶解度大于MCO3 的溶解度 (p392) D、这些元素几乎总是生成+2 价离子
碳酸盐受热分解的难易程度与阳离子的极化作用 有关。阳离子对CO32-离子的极化作用,使CO32-不稳定 离子的极化作用, 有关。阳离子对 以致分解,极化作用越大越易分解。 质子) 以致分解,极化作用越大越易分解。H+(质子)的极 化作用超过一般金属离子,所以有下列热稳定性顺序: 化作用超过一般金属离子,所以有下列热稳定性顺序: M2CO3>MHCO3>H2CO3 p430另外一种解释 另外一种解释
新312第12章s区元素

Chloride, silicate, phosphate, sulfide, oxide, free element, sulfate, carbonate
氯化物,硅酸盐,磷酸盐, 硫化物, 氧化物, 单质, 硫酸盐,碳酸盐
Occurrences of metals 存在方式
• free elements单质— Au、Ag、Pt、Cu; • binary compounds 二元化合物 — oxides 氧化物、 — sulfides 硫化物、 — halides 卤化物… • oxo-acids 含氧酸盐 — carbonates 碳酸盐、 — silicates 硅酸盐、 — sulfates 硫酸盐…
Cs Ba Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
In engineering, metals can be classified as 按工程技术分
• ferrous metals 黑色金属: 如Fe、Mn、Cr • non-ferrous metals有色金属: • and the non-ferrous metals can be divided as the heavy, light, noble, rare, and radioactive.又分重、轻、贵、稀有、 放射性
The properties of metals性质(1)
Physical properties
• luster光泽: most metal are silvery.金属大多呈银 白色, Au—golden金黄色,Bi—pale red淡红, Cu—紫红色;
• density密度: light metals with the density less than 5gcm3; 按5g.cm3为标准,分为轻金属, 否则 为重金属; • melting point 熔点: the melting points between metals show great difference. 金属熔点差别很 大。 如:Hg (liquid)、W (3380℃);
s区、d区、ds区重要元素及其化合物
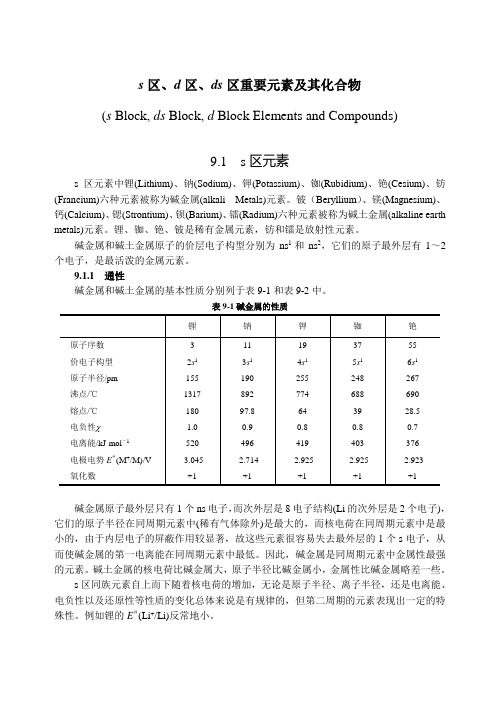
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
s 区 元 素

s 区元素
一、 s区金属
1. s区元素的通性
s区金属又称为成碱金属,包括第Ⅰ A族的碱金属元素Li、Na、K、 Rb、Cs、Fr和第Ⅱ A族的碱土金属元素Be、Mg、Ca、Sr、Ba和Ra。 它们以卤化物、硫酸盐、碳酸盐和硅酸盐存在于地壳中。Rb、Cs在自 然界存在较少,是稀有金属;Fr和Ra是放射性金属,Fr放射性极强,半 衰期极短,在天然放射性衰变和核反应中可形成微量的Fr,而Ra首先被 玛丽·居里(Marie Curie)从沥青油矿中分离出来,其所有的同位素都具 有放射性且寿命最长,如226Ra的半衰期为1602年。
s区元素
成碱金属能与水迅速反应放出氢气,所以不能在水溶 液中用于还原任何物质,但可成为非水介质中有机化学反 应的重要还原剂。同时也是高温条件下从氧化物或氯化物 中制备稀有金属的重要还原剂。当然,这些反应必须在真 空或稀有气体保护下进行。
对比锂和镁的性质,不难发现在它们之间有许多相似 之处,如它们都能与氧或者氮直接化合生成氧化物、氮化 物,它们的氢氧化物、碳酸盐、磷酸盐等都难溶于水。
s 区元素
成碱金属的基本性质列入表8-2中。成碱金属在物理 性质方面表现出金属的外观和良好的导电性,但硬度、熔 点和沸点与其他金属相比很低。这是因为成碱金属成键电 子数少,金属键弱,反映在宏观性质上表现出低熔点、低 沸点和低硬度的特点。第Ⅰ A和第Ⅱ A族元素的电子构型 分别为ns1和ns2,它们能失去1个或2个电子形成氧化数为 +1或+2的离子型化合物。同族中它们的有效核电荷相等, 但自上而下,原子(离子)半径依次增大,电离能、电负 性逐渐降低,金属活泼性增强。
碱金属氢化物中以LiH最稳定,加热到熔点也不分解。其他碱金 属氢化物的稳定性较差。LiH能与AlCl3在无水乙醚中反应生成LiAIH4 (氢配合物):
江苏师范大学《无机化学》习题库及答案第十二章 s区元素

第十二章S区元素一、选择题(每题3分,共30分)( ) 1. 钠在空气中燃烧,得到的产物是(A) Na2O (B) Na2O2(C) NaO2(D) Na2CO3( ) 2. 下列氢氧化物中碱性最强的是(A) LiOH (B) NaOH (C) KOH (D) Mg(OH)2 ( ) 3. 下列氢氧化物中溶解度最小的是(A) LiOH (B) NaOH (B) KOH (D) RbOH( ) 4. 下列哪一个氢氧化物是两性的?(A) Be(OH)2(B) Mg(OH)2(C) Ca(OH)2(D) Sr(OH)2( ) 5. 下列晶体中熔点最高的是(A) BeCl2(B) MgCl2(C) CaCl2(D) SrCl2 (E) BaCl2( ) 6. 下列物质中热稳定性最高的是(A) BeCO3(B) MgCO3(C) CaCO3(D) SrCO3 (E) BaCO3( ) 7.下列成对元素中化学性质最相似的是()(A) Be和Mg (B) Mg和Al (C) Li和Mg (D) Be和B( ) 8. 氢化铷与水反应可放出氢气,则下列叙述正确的是()(A) 氢化铷溶于水显酸性。
(B) 氢化铷中的氢离子被还原为氢气。
(C) 氢化铷与水反应时,水是还原剂。
(D) 氢化铷中的氢离子最外层有两个电子。
( ) 9. 现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L。
这种碱金属可能是( )(A) Na (B) K (C) Rb (D) Cs( ) 10. 我国人民很早就知道用焰色反应来鉴别某些物质。
南北朝时期,著名的炼丹家和医药大师陶弘景在他的《本草经集注》中就有这样的记载:“以火烧之,紫青烟起,云是真硝石也”。
这一记载所鉴别出的物质应该是()(A) NaNO3(B) KNO3(C) KMnO4(D) I2二、填空题(每空1分,共31分)1. 钠与水剧烈作用,生成___和____,易引起燃烧和爆炸,需贮存在_________或_________中,而锂的密度很小,能浮在煤油上,所以将其保存在__________。
S区元素

§10-4 10-
生物学效应及常用药物
钠钾的生物功能 一、调节机体和细胞的渗透压 二.调节体液的酸碱平衡 三.参与体内蛋白质和糖类的代谢 四.维持正常的神经兴奋性和心肌运动
常见的药物
§10-1 101-1 1-2
通性
ⅡAns2。
价电子层结构。 价电子层结构。ⅠA ns1、 成键特征: 成键特征:
易失电子,化学性质活拨。 易失电子,化学性质活拨。 大多数金属可形成离子型化合物 Li、Be、Mg可形成一些共价化合物, Li、Be、Mg可形成一些共价化合物,Na2也具有 可形成一些共价化合物 共价性。 共价性。 1-3 性质
= =
2MgO+Si (高温 高温) 高温 2MgCl2+Ti (高温) 高温)
4、与NH3反应(溶于 、 反应(溶于NH3) 1)Na+NH3(l) = NaNH2+ 1/2 H2 )
§ 10-2 10制备 1 2 3 电解熔融: 电解熔融:2NaCl K2CO3+2C
单质
电解
Na+Cl2 2K+3CO K+3
热还原法(制K、Mg) 热还原法( Mg)
1473 K
金属置换法( 金属置换法(制K、Rb、C) Rb、 KCl+Na 高温 NaCl+K↑
10-3 重要化合物
一、氧化物和氢氧化物
直接反应 普通化合物O2普通化合物O 过氧化物O 过氧化物O22超氧化物O 超氧化物O2臭氧化物O3臭氧化物O 间接反应 Li、Be、Mg、Cs、Sr、Ba (ⅠA、ⅡA) ⅠA、ⅡA) Li、Be、Mg、Cs、Sr、 Na、 Be以外 Na、Ba 除Be以外 Be、Mg、Li以外 (Na)K、Rb、Cs 除Be、Mg、Li以外 Na) Rb、 KO3与水反应生成ROH 与水反应生成ROH
第十二章s区元素
溶解度
MOH易溶于水,放热 碱土金属溶解度(20℃)
氢氧化物
溶解度 /mol·L-1
Be(OH)2 8×10-6
Mg(OH)2 5×10-4
Ca(OH)2 1.8×10-2
Sr(OH)2 6.7×10-2
Ba(OH)2 2×10-1
重要盐类及其性质 重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐
1 晶体类型:绝大多数是离子晶体 但碱土金属卤化物有一定的共价性。
两族元素金属和化合物的重要性可排出如下顺序:
金 属: Na>> Li >K > Cs > Rb Mg >> Ca > Be > Ba > Sr
化合物: Na > K >> Li >> Cs > Rb Ca >> Mg >> Ba >> Sr > Be
顺序大体是按世界年产量大小排列的,表示不出 排序较后元素在某些特定应用领域的重要意义。
菱镁矿: MgCO3
钾长石:
KAlSi3O8
光卤石:
KCl MgCl2 6H2O
明矾石:
石 膏: 大理石:
CaSO4 CaCO3
2H2O
萤 石: 天青石:
CaF2
SrSO4
重晶石: BaSO4
K(AlO) 3(SO4 )2 3H2O
12.2.3 用途概述 Generality of application
CaH2 2H2O
4NaH TiCl 4 Ti 4NaCl 2H 2
(2)剧烈水解:
MH H2O MOH H2 (g)
CaH 2 2H2O Ca(OH) 2 2H2 (g)
3. 形成配位氢化物 4LiH AlCl 3 (无水)乙醚Li[AlH 4 ] 3LiCl
第12章 s区和ds区元素吉林大学无机化学
原 子 半 径 增 大 , 金 属 性 增 强
IA
Li Na K Rb Cs
IIA
Be Mg Ca Sr Ba
原子半径减小,金属性减弱
特殊性:Li 的 E 值负值最大
硫脲
HCl
③ Cu,Ag,Au可溶于氧化性酸
Cu 4HNO 3 (浓) Cu(NO 3 ) 2 2NO 2 2H 2 O Ag 2HNO 3 (浓) AgNO 3 NO 2 H 2 O Cu 2H 2 SO 4 (浓) CuSO 4 SO 2 2H 2 O 2Ag 2H 2 SO 4 (浓) Ag 2 SO 4 (s) SO 2 2H 2 O Au 4HCl( 浓) HNO 3 (浓) H[AuCl 4 ] NO(g) H 2 O
第12章
s区和ds区元素
1.金属单质的物理性质
s区和ds区元素通常仅以s电子参与成键,故熔点、 沸点、气化热等低于其他d区元素。特别是Hg,由 于6s电子的“惰性电子对效应”形成的金属键更弱, 故在温室下为液体。
2. 化学性质-s区元素
s区金属原子半径大、核电荷数小,单质 易失去最外层电子而表现很强的还原性
(4) 锌与OH-,NH3反应
Zn 2OH 2H 2 O Zn(OH) 2 4 H2
Zn 4NH 3 2H 2 O Zn(NH )
2 3 4
H 2 2OH
3.重要化合物
(1 ) 铜的化合物
常见氧化数:+1 (3d10), +2 (3d9)
大学无机化学第十二章S区元素PPT课件
碱土金属的导电性和 导热性良好,其良好 的延展性也使其易于 加工。
碱土金属的密度较大, 且随原子序数增加而 增大。
碱土金属的化学性质
碱土金属的化学性质活泼,有较 强的还原性,容易失去电子成为
正离子。
碱土金属离子具有较强的水合能 力,易与水反应生成氢氧化物。
碱土金属的氧化物大多数为碱性 或两性氧化物,表现出较强的碱
镓的化合物在医药、农业和电子工业等领域也有广泛应用。
镓、铟、铊的性质和用途
铟的性质和用途
铟是一种银白色的软金属,具有较好的延展性和导电性,主要用于制作液晶显示 器和电子元件。
镓、铟、铊的性质和用途
铊的性质和用途 铊是一种银白色的金属,具有较低的熔点和沸点,主要用于制作高温温度计和光电管等器件。
铊的化合物在医药和农业等领域也有一定的应用。
铋的性质和用途
铅是一种青白色的金属,具有较高的密 度和耐腐蚀性,主要用于制作电池、颜 料和涂料等材料。
铅的化合物在医药、农药和染料等领域 也有广泛应用。
THANKS
感谢观看
S区元素在周期表中的位置
总结词
S区元素在周期表中占据第1列和第2 列的位置。
详细描述
在周期表中,S区元素占据第1列和第 2列的位置,这些位置对应于元素周期 表的s区和p区。这些元素具有相似的 电子构型和化学性质,通常表现出强 烈的金属性质。
S区元素的特点和性质
要点一
总结词
S区元素具有低原子序数、小原子半径、高电离能、低电子 亲和能等特点。
大学无机化学第十二章s 区元素ppt课件
• S区元素的概述 •氢 • 碱金属 • 碱土金属 • 其他S区元素
01
S区元素的概述
S区元素的定义
第十二章s区元素
△fHm(M+,aq ) = △sub Hm + I1 +△h Hm (M+,g)
Li Na K Rb Cs
△sub Hm 159.37 107.32 89.24 80.88 76.065
I1
526.41
△h Hm (M+,g) -535.27
△fHm(M+,aq) 150.51
502.04 -420.48 188.88
单质在空气中燃烧,形成相应的氧化物:
Li2O Na2O2 KO2 RbO2 BeO MgO CaO SrO
CsO2 Ba2O2
Li2O
Na2O2
Gc2-706-18.12 KO2
镁
图 C-551-(a)
带
的
燃
烧
2 与水作用 2M + 2H2O → 2MOH + H2(g)
Li
Na
K
Ca
•与液氨的作用
都是活泼金属
1.易与H2直接化合成MH、MH2离子型化合物 2.与O2形成正常氧化物、过氧化物、超氧化物 3.易与H2O反应(除Be、Mg外) 4.与非金属作用形成相应的化合物
注:它们的活泼性有差异
电金原 离属子 能性半 、、径 电还增 负原大 性性 减增 小强
IA
IIA
Li
Be
Na
Mg
K
Ca
Rb
11.2.1 单质的物理性质和化学性质
Gc2-704-18.8
Li
Na
K
Rb Cs
Gc2-711-18.14
图片
Be Mg Ca Sr
Ba
单质的物理性质: 有金属光泽 密度小 硬度小 熔点低 导电、导热性好
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5、举例说明铍与铝的相似性。
答:Be 和Al 单质及化合物性质有许多相似之处,可以从以下 几个方面来理解:
(1) Be 和Al 都是两性金属,不仅能溶于酸也都溶于强碱,放 出氢气;
(2) Be 和Al 的氢氧化物都是两性化合物,易溶于强碱; (3) Be 和Al 都是共价化合物,易升华,聚合,易溶于有机溶 剂; (4) Be 和Al 常温下不与水作用,与冷的浓硝酸接触时都发生 钝化现象; (5) Be 和Al 的盐都易水解。
C、 KO2
D、 BaO2
12、关于s 区元素的性质下列叙述中不正确的是 A、 由于s 区元素的电负性小,所以都形成典型的离子型化
合物 B、 在s 区元素中,Be、 Mg 因表面形成致密的氧化物保护
膜而对水较稳定 C、 s 区元素的单质都有很强的还原性 D、 除Be、 Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做
碱金属的基本性质
元素 性质
Li Na K Rb Cs
原子半径/pm 152 153.7 227.2 247.5 265.4
离子半径/pm 68 97 133 147 167
第一电离势 kJ/ 521 499 421 405 371 第二电离势 mol 7295 4591 3088 2675 2436
9、下列化合物中键的离子性最小的是 (p387)
A、 LiCl
B、 NaCl
C、 KCl
D、 BaCl2
10、下列碳酸盐中热稳定性最差的是(p389---390)
A、 BaCO3
B、CaCO3
C、 K2CO3 D、 Na2CO3
11、下列化合物中具有顺磁性的是(p382 385)
A、 Na2O2
B、 SrO
四、完成并配平下列反应方程式 1、在过氧化钠固体上滴加热水
2Na2O2 + 2H2O(热) = 4NaOH + O2 ↑
2、将二氧化碳通入过氧化钠 2Na2O2 + 2CO2 = 2Na2CO3 + O2 ↑
3、将氮化镁投入水中 Mg3N2 + 6H2O = Mg(OH)2 ↓ + 2NH3
4、向氯化锂溶液中滴加磷酸氢二钠溶液 3Li+ + HPO42- = Li3PO4 ↓ + H+
电负性
0.98 0.93 0.82 0.82 0.79
标准电极电势(酸) -3.045 -2.711 -2.923 -2.925 -2.923
M+(g)水合热 /kJ·mol-1
519 406 322 293 264
碱土金属的基本性质
元素 性质
原子半径/pm 离子半径/pm 第一电离势
第二电离势 kJ/ mol
1921 1577 1443 1305
一、根据标准电极电势,锂的活泼性应比铯更大, 但实际上与水反应不如钠剧烈。这是因为:
(1)锂的熔点较高,反应时产生的热量不能使它熔 化,而钠与水反应时放出的热可以使钠熔化,因而固 体锂与水接触的表面不如液态钠大;
(2)反应产物LiOH的溶解度较小,它覆盖在锂的表 面,阻碍反应的进行。
第三电离势
电负性
标准电极电势(酸) 标准电极电势(碱)
M2+(g)水合热 /kJ·mol-1
Be 111.3
35 905 1768 14939 1.57 -1.85 -2.28
2494
Mg Ca Sr Ba 160 197.3 215.1 217.3 66 99 112 134 742 593 552 564 1460 1152 1070 971 7658 4942 4351 3575 1.31 1.00 0.95 0.89 -2.375 -2.76 -2.89 -2.90 -2.69 -3.02 -2.99 -2.97
A、 Li
B、 Be
C、Na
D、 Mg
6、下列最稳定的氮化物是(p378)
A、 Li3N
B、 Na3N
C、K3N
7、下列水合离子生成时放出热量最少的是
A、Li+
B、 Na+
C、 K+
D、 Ba3N2 D、 Mg2+
8、下列最稳定的过氧化物是
A、Li2O2
B、 Na2O2
C、 K2O2 D、 Rb2O2
M2CO3>MHCO3>H2CO3
p430另外一种解释
三、填空题 1、锂应保存在 液态石蜡 中,钠和钾应保存在 煤油 中。
2、在s 区金属中熔点最高的是 Be ,熔点最低的是 Cs ,密 度最小的是 Li ,硬度最小的是 Cs 。
3、周期表中处于斜线位置的B 与Si、 Be 与Al 、 Li 与Mg 性质十分相似,人们习惯上把这种现象称之为斜线规则或对角线 规则。
3、NaNO3受热分解的产物是(p389)
A、Na2O,NO2,O2
B、NaNO2,O2
C、NaNO2,NO2,O2
D、Na2O,NO,O2
4、下列哪对元素的化学性质最相似 (p395) A、 Be 和Mg B、Mg 和Al C、Li 和Be
Al
D、 Be 和
5、下列元素中第一电离能最小的是 (p373)
二、碱性的变化
当金属离子(R)的电子构型相同时,则1/2值愈
小,金属氢氧化物的碱性愈强。
氢氧化物 1/2 碱性 氢氧化物 1/2 碱性
碱 LiOH 性 NaOH 增 强 KOH ↓ RbOH
3.8 强碱 Be(OH)2 7.6 两性 3.2 强碱 Mg(OH)2 5.5 中强碱 2.7 强碱 Ca(OH)2 4.5 强碱 2.6 强碱 Sr(OH)2 4.2 强碱
二、是非题(判断下列各项叙述是否正确,对的在括号中填“√” 错的填“×”)
1、因为氢可以形成H+,所以可以把它划分为碱金属。 ( √ )
2、铍和其同组元素相比离子半径小极化作用强所以形成键具
有较多共价性。(p374)
(√)
3、在周期表中,处于对角线位置的元素性质相似,这称为对
角线规则。
(×)
4、碱金属是很强的还原剂所以碱金属的水溶液也是很强的还
碱金属和碱土金属
IA族包括锂、钠、钾、铷、铯、钫六种金属元素。它们 的氧化物溶于水呈强碱性,所以称为碱金属。
IIA族包括铍、镁、钙、锶、钡、镭六种金属元素。由于 钙、锶、钡的氧化物在性质上介于“碱性”和“土性”(以前把 粘土的主要成分Al2O3称为“土”)之间,所以称为碱土金属, 现习惯上把铍和镁也包括在内。
5、Be(OH)2 与Mg(OH)2 性质的最大差异是 Be(OH)2 具有两性, 既溶于酸又溶于强碱 ;Mg(OH)2 为碱性,只溶于酸 。
6、电解熔盐法制得的金属钠中一般含有少量的 金属钙 ,其 原因是 电解时加入CaCl2 助溶剂而有少量的钙电解时析出 。
7、熔盐电解法生产金属铍时加入NaCl 的作用是增加熔盐的导 电性。
8、盛Ba(OH)2 的试剂瓶在空气中放置一段时间后, 瓶内出现一 层白膜是 BaCO3 。
9、ⅡA 族元素中性质表现特殊的元素是 Be ,他与p 区元素 中的 Al 性质极相似,如两者的氯化物都是 共价 化合物在有机 溶剂中溶解度较大。
10、碱土金属的氧化物从上至下晶格能依次 减小 ,硬度逐渐 减小 ,熔点依次 降低 。
5、六水合氯化镁受热分解 MgCl2•6H2O = Mg(OH)Cl + HCl ↑ + 5H2O (加热)
6、金属钠和氯化钾共热 Na(s) + K = NaCl + K(g) (加热)
7、金属铍溶于氢氧化钠溶液中 Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 ↑
8、用NaH 还原四氯化钛 TiCl4 + 4NaH = Ti + 2H2 ↑ + NaCl
原剂
(×)
5、碱金属的氢氧化物都是强碱性的(p386) (LiOH中等强度)
(× )
6、氧化数为+2的碱土金属离子在过量碱性溶液中都是以氢氧
化物的形式存在
(×)
(Be(OH)2两性) 7、碱金属和碱土金属很活泼,因此在自然界中没有它们的游
离状态
(√)
8、CaH2便于携带,与水分解放出H2, 故野外常用它来制取氢
4、给出下列物质的化学式 (1) 萤石 CaF2 ;(2) 生石膏 CaSO4·2H2O ;(3) 天青石 SrSO4 ; (4) 方解石 CaCO3 ;(5) 光卤石 KCl·MgCl2·6 H2O ;(6) 智利硝 石 NaNO3 ;(7) 芒硝 Na2SO4·10H2O ;(8) 纯碱 Na2CO3 ;
焰火材料
13、关于Mg , Ca , Sr , Ba 及其化合物的性质下列叙述中不正确 的是
A、 单质都可以在氮气中燃烧生成氮化物M3N2 B、 单质都易与水、水蒸气反应得到氢气(p378) C、M(HCO3)2 在水中的溶解度大于MCO3 的溶解度 (p392) D、这些元素几乎总是生成+2 价离子
答:(1)将三种物质分别加水溶解,能溶于水的是Ba(OH)2。 (2)往不溶于水的两种物质中分别加入HCl,有气体产生的是 MgCO3,无气体产生的是Mg(OH)2。
4、钾要比钠活泼,但可以通过反应Na + KCl = NaCl + K制备 金属钾,请解释原因并分析由此制备金属钾是否切实可行?
答:钾的沸点为759℃, 钠的沸点为881.4℃, 钾的沸点比钠的沸 点低122.4 ℃, 控制温度在钠和钾沸点之间,则生成的钾从反应 体系中挥发出来,有利于平衡向生成钾的方向移动。由于反应 是一个平衡过程,反应不够彻底,同时钾易溶于熔融的氯化物 中,或生成超氧化物等因素,此方法并不切实可行。
