高中有机化学常用反应方程式汇总(免费)
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
(完整版)高中有机化学方程式归纳
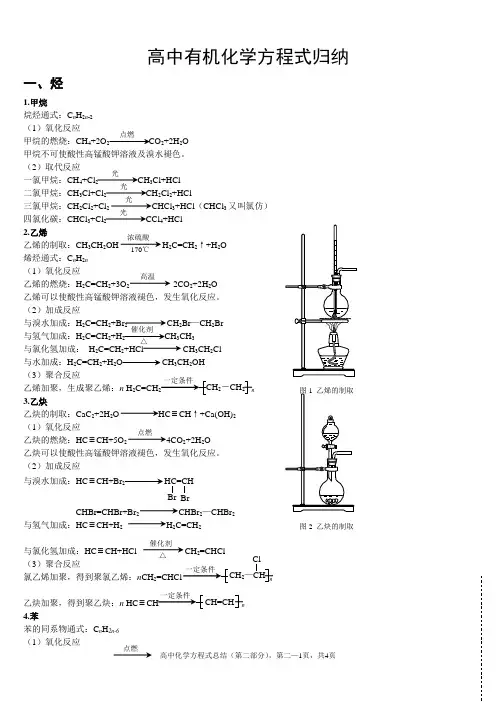
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学反应方程式汇总

高中有机化学反应方程式汇总
1. 烷烃的燃烧反应
烷烃是一类只含有碳和氢元素的有机化合物。
烷烃在氧气存在下燃烧时,产生二氧化碳和水。
以甲烷(CH₄)为例:
CH₄ + 2O₂ -> CO₂ + 2H₂O
2. 单宁酸与金属离子的反应
单宁酸是一类含有羟基和酚羟基的有机酸,能与多种金属离子发生反应。
以单宁酸与铁离子(Fe³⁺)为例:
Fe³⁺ + 3C₇H₅O₅⁻ -> Fe(C₇H₅O₅)₃
3. 醇的脱水反应
醇是一类含有羟基的有机化合物。
醇在加热条件下可以发生脱水反应,生成烯烃。
以乙醇(C₂H₅OH)为例:
C₂H₅OH -> C₂H₄ + H₂O
4. 羧酸与碱的中和反应
羧酸是一类含有羧基的有机酸,能与碱发生中和反应,生成相应的盐和水。
以乙酸(CH₃COOH)与氢氧化钠(NaOH)为例:
CH₃COOH + NaOH -> CH₃COONa + H₂O
5. 醛酮的氧化反应
醛酮是一类含有羰基的有机化合物。
醛酮在氧化剂作用下可以发生氧化反应,生成酸和水。
以乙醛(CH₃CHO)为例:
CH₃CHO + [O] -> CH₃COOH
以上是高中有机化学中常见的反应方程式的汇总。
这些方程式有助于理解有机化学反应的基本原理和机制。
请注意,以上反应方程式仅供参考,实际反应条件可能会有所不同。
使用时请参考相关化学教材和实验指导。
有机化学方程式(70个)

有机化学基础反应方程式汇总 1.甲烷(烷烃通式:C n H 2n +2) 甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 点燃2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+ClCH 3CH 2Cl 2CHCl 3(32.乙烯((1(2(3CH 3CH CH 3CH n CH 2=3.乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br =CHBr CHBr =CHBr+Br 2—CHBr 2与氢气加成:HC ≡CH+H 2催化剂H 2C =CH2图3乙炔的制取与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH2=CHCl催化剂[CH2—]n乙炔加聚,得到聚乙炔:n HC≡CH催化剂[CH=CH]n4.1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2Br-CHBr-CH=CH2与溴5.苯(1(2(制溴苯)+HO—苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。
+HO—(3)加成反应(环己烷)6.甲苯(1(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
CH3CH3BrCH3Br+Br2Fe(或 )+HBr(本反应用纯溴,催化剂时苯环上取代)CH3|+3HNO 浓硫酸O2N—CH3|—NO2|NO2+3H2O3。
有机化学方程式汇总
有机化学方程式汇总有机化学反应方程式汇总1.甲烷与氯气的反应:CH4 + Cl2 → CH3Cl + HClCH3Cl + Cl2 → CH2Cl2 + HClCH2Cl2 + Cl2 → CCl4 + HCl(分步取代)燃烧:CH4 + 2O2 → CO2 + 2H2O2.烷烃的燃烧通式:CnH2n+2 + (3n+1)O2 → nCO2 + (2n+2)H2O3.甲烷的热分解:CH4 高温 C + 2H24.烷烃的热分解:C4H10 → C2H4 + C2H6C4H10 → CH4 + C3H65.乙烯实验室制法:XXX H2SO4 → CH2=CH2 ↑(浓硫酸为催化剂和脱水剂)点燃:CH2=CH2 + 3O2 → 2CO2 + 2H2O6.乙烯的燃烧:CH2=CH2 + 3O2 → 2CO2 + 2H2O7.乙烯通入溴水中:CH2=CH2 + Br2 → CH2BrCH2Br8.乙烯和氢气加成:催化剂:CH3CH=CH2 + H2 → CH3CH2CH39.乙烯和HCl的反应:催化剂:CH2=CH2 + HCl → CH3CH2Cl10.乙烯水化制乙醇:CH2=CH2 + H2O → CH3CH2OH11.乙烯催化氧化制备乙醛:催化剂:2CH2=CH2 + O2 → 2CH3CHO加热加压:CH2―CH2―n―CH2―CH―12.乙烯的加聚反应:催化剂:n CH2=CH2 → (-CH2-CH2-)n13.制取聚丙烯:催化剂:n CH3CH=CH2 → (-CH2-CH(CH3)-)n14.1,3-丁二烯的加成反应:1,2加成:CH2=CH-CH=CH2 + Cl2 → CH2Cl-CH(Cl)-CH=CH2 Cl + Cl2 → Cl21,4加成:Cl完全加成+ 2Cl2 → Cl3CCCl315.1,3-丁二烯的加成反应:n CH2=C-CH=CH2 → (-CH2-C=CH-CH2-)n-CH316.乙炔的制取:CaC2 + 2H2O → C2H2 ↑ + Ca(OH)2点燃:2C2H2 + 5O2 → 4CO2 + 2H2O18.乙炔的燃烧公式为O(l) + 2600 kJ,表示在氧气存在下,乙炔会燃烧并释放出2600千焦的能量。
有机化学常用反应方程式汇总
光照光照 光照光照 高温CaO△ 催化剂 加热、加压催化剂 △催化剂有机化学方程式汇总1. CH 4 + C l2 CH 3Cl + HCl2. CH 3C l + Cl 2 CH 2C l2 + H Cl3. C H2Cl + Cl 2 CHC l3 + HCl 4. C HCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H18 + C 8H167。
CH 3C OO Na + NaOH CH 4↑+ Na 2C O3 8。
CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9。
CH 2 = C CH 3CH 2OH 10. CH 2 CH 3—CH 2Br11. CH 2 = C CH 3—CH 312。
nCH 2 2—CH 2 ] n13。
nCH 2 [CH 2-CH=C H-CH 2] n 14. 2CH2 2C H3CHO 15. C H≡C H + Br 2 CHBr = CH Br 16. CHB r = CHBr + Br 2 CHBr 2-CHBr 217. C H≡CH + HCl H 2C = CHCl 18。
nCH 2 = CH [ CH 2-CH ] n Cl Cl 19。
CH ≡CH + H 2O CH 3C HO20. CaC 2 + 2H 2O CH ≡CH ↑+ C a(OH )2 2 Br + HBr 2 NO 2 +H2O 23 SO 3H+H 2ONaOHH 2O 醇△催化剂 △浓硫酸170℃浓硫酸140℃催化剂△ 24. + 3H 2+3HO +3H 2O 26. 3CH 27。
C H3CH 2Br + H 2O CH 3CH 2OH + HB r28. CH 3CH 2Br + NaO H CH 3CH 2O H + NaBr 29.CH 3CH2Br+ N aOH C H2 = CH 2 + NaB r +H 2O30。
有机化学常用反应方程式汇总
光照光照光照光照 高温CaO△ 催化剂 加热、加压催化剂催化剂 △催化剂△催化剂催化剂催化剂催化剂 △催化剂 催化剂浓硫酸△ △有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 21. + Br 2 Br + HBr 22. + HO -NO 2 NO 2 +H 2O 23. + HO -SO 3H SO 3H+H 2OCH 3 NO 2NO 2 O 2NCH 3催化剂NaOHH 2O醇△ 催化剂 △浓硫酸 170℃浓硫酸140℃ OHBrBr OH催化剂△ 催化剂 △ △△ Br催化剂△24. + 3H 225. +3HO -NO 2 +3H 2O 26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O 35. OH+H 2O O -+H 3O + 36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓+3HBr38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△ 催化剂催化剂催化剂 催化剂 催化剂△催化剂加热、加压 +浓硫酸 △+ 2H 2OO O C — COOCH 2-CH 244. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O 47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O 50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 2 52. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖56.C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CH C 17H 33COO-CH 2 C 17H 35COO-CH 257. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOHCH 2OH COOH1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
(完整版)高中有机化学方程式总结
高中有机化学方程式总结一、烃1. 烷烃 -通式:C n H 2n —2(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O ②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl(CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl (3)分解反应 CH 4 C+2H 2 2。
烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O(1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应乙烯加聚,生成聚乙烯:n H 2n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡(1)氧化反应 ①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2-CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 点燃光光光光浓硫酸 170℃点燃催化剂 △催化剂加热加压 2-CH 2点燃图2 乙炔的制取催化剂 △催化剂Br 催化剂 △高温(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC CH n4. 苯 C 6H 6(1)氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O ②苯不能使溴水和酸性高锰酸钾溶液褪色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光照
光照 光照
光照 高温
CaO
△ 催化剂 加热、加压
催化剂 △
催化剂
高中有機化學方程式匯總
1. CH 4 + Cl 2
CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2
6. C 16H 34 C 8H 18 + C 8H 16
7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3
8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br
9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23
12. nCH 2 = CH 2 ] n
13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2
17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO
20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH
H 2
O 醇 △
催化剂 △
浓硫酸 170℃
浓硫酸
140℃
催化剂
△
24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr
28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr
29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O
30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑
31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O
32. CH 3CH 2OH CH
2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3
37
38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O
41CH 3O
42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
浓硫酸
△
催化剂
催化剂
催化剂
催化剂
催化剂
△
催化剂
加热、加压
+ 浓硫酸
△
+ 2H2O
O O
C —C
O O
CH2-CH2
44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑
45. CH
3
COOH + NaOH CH
3
COONa + H
2
O
46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O
47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O
48. CH
3
COOCH
2
CH
3
+NaOH CH
3
COONa+CH
3
CH
2
OH
49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O
50. C
6
H
12
O
6 (s)
+ 6O
2 (g)
6CO
2 (g)
+ 6H
2
O
(l)
51. C
6
H
12
O
6
2CH
3
CH
2
OH + 2CO
2
52. C
12
H
22
O
11
+H
2
O C
6
H
12
O
6
+ C
6
H
12
O
6
蔗糖葡萄糖果糖
53. C
12
H
22
O
11
+ H
2
O2C
6
H
12
O
6
麦芽唐葡萄糖
54. (C
6
H
10
O
5
)
n
+ nH
2
O n C
6
H
12
O
6
淀粉葡萄糖
55. (C
6
H
10
O
5
)
n
+ nH
2
O n C
6
H
12
O
6
纤维素葡萄糖
56.C17H33COO-CH2 C17H35COO-CH2
C17H33COO-CH +3H2 C17H35COO-CH
C17H33COO-CH2 C17H35COO-CH2
57. C17H35COO-CH2 CH2-OH
C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH
C17H35COO-CH2 CH2-OH
58. CH2OH COOH
CH2OH COOH
1.HCl
Cl
CH
Cl
CH+
−→
−
+
3
2
4
光
HCl
Cl
CH
Cl
Cl
CH+
−→
−
+
2
2
2
3
光
2.
3.
4.
5.
6.
7.
8.
222Br CH CH CH CH +=-=
9.
10.
11.
12. 13.
14.
15.
16.
17.
OH NH Ag CHO CHOH HOCH 2342)(2)(+
O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆
18.
19.
20.
21.
高中有机化学知识点总结 1.需水浴加热的反应有:
(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定
凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:
(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃)
〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na 反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物
(2)含有羟基的化合物如醇和酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)
6.能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)
(2)苯酚等酚类物质(取代)
(3)含醛基物质(氧化)
(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)
(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)
(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)
7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有
卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:
烃、卤代烃、酯、淀粉、纤维素
11.常温下为气体的有机物有:
分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:
苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解
13.能被氧化的物质有:
含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17.能与NaOH溶液发生反应的有机物:
(1)酚:
(2)羧酸:
(3)卤代烃(水溶液:水解;醇溶液:消去)
(4)酯:(水解,不加热反应慢,加热反应快)
(5)蛋白质(水解)
18、有明显颜色变化的有机反应:
1.苯酚与三氯化铁溶液反应呈紫色;
2.KMnO4酸性溶液的褪色;
3.溴水的褪色;
4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色颜色反应
友情提示:本资料代表个人观点,如有帮助请下载,谢谢您的浏览!。
