1983_工程热力学(第四版) 第十二章 制冷循环课后答案
工程热力学思考题及答案 第十二章

沈维道、将智敏、童钧耕《工程热力学》课后思考题答案工程热力学思考题及答案第十二章制冷循环1.压缩蒸汽制冷循环采用节流阀来代替膨胀机,压缩空气制冷循环是否也可以采用这种方法?为什么?答压缩空气制冷循环不能采用节流阀来代替膨胀机。
工质在节流阀中的过程是不可逆绝热过程,不可逆绝热节流熵增大,所以不但减少了制冷量也损失了可逆绝热膨胀可以带来的功量。
而压缩蒸汽制冷循环在膨胀过程中,因为工质的干度很小,所以能得到的膨胀功也极小。
而增加一台膨胀机,既增加了系统的投资,又降低了系统工作的可靠性。
因此,为了装置的简化及运行的可靠性等实际原因采用节流阀作绝热节流。
2.压缩空气制冷循环采用回热措施后是否提高其理论制冷系数?能否提高其实际制冷系数?为什么?答:采用回热后没有提高其理论制冷系数但能够提高其实际制冷系数。
因为采用回热后工质的压缩比减小,使压缩过程和膨胀过程的不可逆损失的影响减小,因此提高实际制冷系数。
3.参看图12-5,若压缩蒸汽制冷循环按1-2-3-4-8-1运行,循环耗功量没有变化,仍为h2-h1,而制冷量却从h1-h5增大到h1-h8,显见是有利的.这种考虑错误何在?答:过程4-8熵减小,必须放热才能实现。
而4点工质温度为环境温度T,要想放热达到温度Tc (8点),必须有温度低于Tc的冷源,这是不存在的。
(如果有,就不必压缩制冷了)。
4.作制冷剂的物质应具备哪些性质?你如何理解限产直至禁用R11、R12这类工质?答:制冷剂应具备的性质:对应于装置的工作温度,要有适中的压力;在工作温度下气化潜热要大;临界温度应高于环境温度;制冷剂在T-s图上的上下界限线要陡峭;工质的三相点温度要低于制冷循环的下限温度;比体积要小;传热特性要好;溶油性好;无毒等。
限产直至禁用R11和R12时十分必要的,因为这类物质进入大气后在紫外线作用下破坏臭氧层使得紫外线直接照射到地面,破坏原有的生态平衡。
5.本章提到的各种制冷循环有否共同点?若有,是什么?答:各种制冷循环都有共同点。
工程热力学课后答案摘要
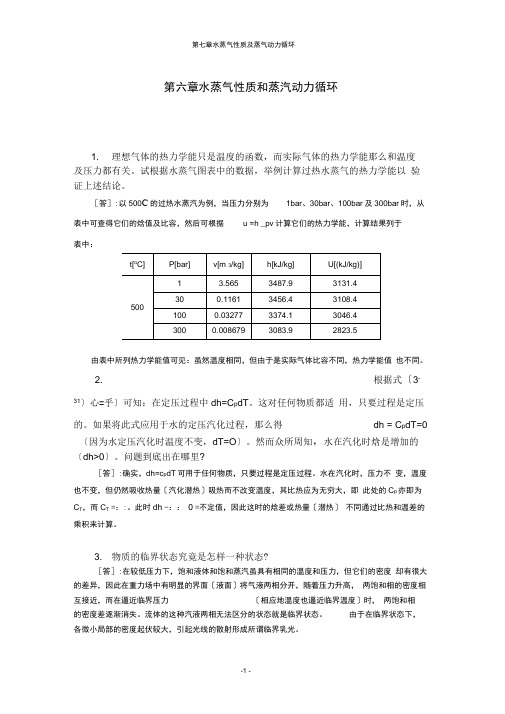
第六章水蒸气性质和蒸汽动力循环1. 理想气体的热力学能只是温度的函数,而实际气体的热力学能那么和温度及压力都有关。
试根据水蒸气图表中的数据,举例计算过热水蒸气的热力学能以验证上述结论。
[答]:以500C的过热水蒸汽为例,当压力分别为1bar、30bar、100bar及300bar时,从表中可查得它们的焓值及比容,然后可根据u =h _pv计算它们的热力学能,计算结果列于表中:由表中所列热力学能值可见:虽然温度相同,但由于是实际气体比容不同,热力学能值也不同。
2. 根据式〔3-31〕心=乎〕可知:在定压过程中dh=C p dT。
这对任何物质都适用,只要过程是定压的。
如果将此式应用于水的定压汽化过程,那么得dh = C p dT=0〔因为水定压汽化时温度不变,dT=O〕。
然而众所周知,水在汽化时焓是增加的〔dh>0〕。
问题到底出在哪里?[答]:确实,dh=c p dT可用于任何物质,只要过程是定压过程。
水在汽化时,压力不变,温度也不变,但仍然吸收热量〔汽化潜热〕吸热而不改变温度,其比热应为无穷大,即此处的C p亦即为C T,而C T=::。
此时dh -::0 =不定值,因此这时的焓差或热量〔潜热〕不同通过比热和温差的乘积来计算。
3. 物质的临界状态究竟是怎样一种状态?[答]:在较低压力下,饱和液体和饱和蒸汽虽具有相同的温度和压力,但它们的密度却有很大的差异,因此在重力场中有明显的界面〔液面〕将气液两相分开,随着压力升高,两饱和相的密度相互接近,而在逼近临界压力〔相应地温度也逼近临界温度〕时,两饱和相的密度差逐渐消失。
流体的这种汽液两相无法区分的状态就是临界状态。
由于在临界状态下,各微小局部的密度起伏较大,引起光线的散射形成所谓临界乳光。
4. 各种气体动力循环和蒸汽动力循环,经过理想化以后可按可逆循环进行计算,但所得理论热效率即使在温度范围相同的条件下也并不相等。
这和卡诺定 理有矛盾吗?[答]:并不矛盾,虽然经过理想化的各种循环都可以按可逆循环计算,但甚至在相同 的温度范围内(指循环最高温度和最低温度之间)也不一定具有相同的热效率。
《工程热力学》(第四版)习题提示及答案12章习题提示与答案

《工程热力学》(第四版)习题提示及答案12章习题提示与答案习题提示与答案第十二章制冷循环12-1 设有一制冷装置按逆向卡诺循环工作,冷库温度为-5 ℃,环境温度为20 ℃,求制冷系数的数值。
又若利用该机器作为热泵,由-5 ℃的环境取热而向20 ℃的室内供热,求其供热系数。
提示:略。
答案:10.72=ε,11.72=ζ。
12-2 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,空气冷却器中冷却水的温度为15 ℃,空气的最高压力为0.5 MPa 、最低压力为0.1 MPa ,试求制冷系数、单位质量工质的制冷量及装置消耗的净功。
提示:空气压缩制冷循环,循环中各过程可逆,制冷系数111)(12-???? ??=-κκp p ε,制冷量q 2=c p 0ΔT ,循环净功εq w 20=。
答案:ε=1.71;q 2=81.49 kJ/kg ;w 0=-47.6 kJ/kg 。
12-3 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,冷却器中冷却水温度为20 ℃,空气的最高压力为0.4 MPa 、最低压力为0.1 MPa 。
若装置的制冷量为150 kW ,试求带动制冷装置所需的功率、冷却水带走的热量、装置中空气的流量以及膨胀机和压气机的功率。
提示:空气压缩制冷循环,制冷系数1)(11)(12-=-κκp p ε,装置所耗功率εQ P 2 =,制冷量q 2=c p 0ΔT ,冷却水带走的热量P Q Q +=21 ,工质流量22q Q q m =,膨胀机功率P T =q m w s =q m c p 0ΔT ,压气机功率P c =q m (w c )s =q m c p 0ΔT 。
答案: P =72.9 8 kW ;=1Q 2 222.89 kW ,q m =8 159 kg/h ,P T =290.84 kW ,P T =218 kW ,P c =290.84 kW 。
12-4 按上题所述条件,若压气机绝热效率为0.8,膨胀机效率为0.85,试求装置消耗的功率及制冷系数。
工程热力学习题提示与答案 (12)

习题提示与答案第十二章 制冷循环12-1 设有一制冷装置按逆向卡诺循环工作,冷库温度为-5 ℃,环境温度为20 ℃,求制冷系数的数值。
又若利用该机器作为热泵,由-5 ℃的环境取热而向20 ℃的室内供热,求其供热系数。
提示:略。
答案: , 。
10.72=ε11.72=ζ12-2 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,空气冷却器中冷却水的温度为15 ℃,空气的最高压力为0.5 MPa 、最低压力为0.1 MPa ,试求制冷系数、单位质量工质的制冷量及装置消耗的净功。
提示:空气压缩制冷循环,循环中各过程可逆,制冷系数111)(12−⎟⎟⎠⎞⎜⎜⎝⎛=−κκp p ε,制冷量q 2=c p 0ΔT ,循环净功εq w 20=。
答案:ε=1.71;q 2=81.49 kJ/kg ;w 0=-47.6 kJ/kg 。
12-3 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,冷却器中冷却水温度为20 ℃,空气的最高压力为0.4 MPa 、最低压力为0.1 MPa 。
若装置的制冷量为150 kW ,试求带动制冷装置所需的功率、冷却水带走的热量、装置中空气的流量以及膨胀机和压气机的功率。
提示:空气压缩制冷循环,制冷系数1)(11)(12−=−κκp p ε,装置所耗功率εQ P 2&=,制冷量q 2=c p 0ΔT ,冷却水带走的热量,工质流量P Q Q +=21&&22q Q q m =,膨胀机功率P T =q m w s =q m c p 0ΔT ,压气机功率P c =q m (w c )s =q m c p 0ΔT 。
答案: P =72.9 8 kW ; 2 222.89 kW ,q =1Q &m =8 159 kg/h ,P T =290.84 kW ,P T =218 kW ,P c =290.84 kW 。
12-4 按上题所述条件,若压气机绝热效率为0.8,膨胀机效率为0.85,试求装置消耗的功率及制冷系数。
《工程热力学》(第四版)习题提示及答案12章习题提示与答案

习题提示与答案第十二章 制冷循环12-1 设有一制冷装置按逆向卡诺循环工作,冷库温度为-5 ℃,环境温度为20 ℃,求制冷系数的数值。
又若利用该机器作为热泵,由-5 ℃的环境取热而向20 ℃的室内供热,求其供热系数。
提示:略。
答案: 10.72=ε, 11.72=ζ。
12-2 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,空气冷却器中冷却水的温度为15 ℃,空气的最高压力为0.5 MPa 、最低压力为0.1 MPa ,试求制冷系数、单位质量工质的制冷量及装置消耗的净功。
提示:空气压缩制冷循环,循环中各过程可逆,制冷系数111)(12-⎪⎪⎭⎫ ⎝⎛=-κκp p ε,制冷量q 2=c p 0ΔT ,循环净功εq w 20=。
答案:ε=1.71;q 2=81.49 kJ/kg ;w 0=-47.6 kJ/kg 。
12-3 有一台空气压缩制冷装置,冷藏库温度为-10 ℃,冷却器中冷却水温度为20 ℃,空气的最高压力为0.4 MPa 、最低压力为0.1 MPa 。
若装置的制冷量为150 kW ,试求带动制冷装置所需的功率、冷却水带走的热量、装置中空气的流量以及膨胀机和压气机的功率。
提示:空气压缩制冷循环,制冷系数1)(11)(12-=-κκp p ε,装置所耗功率εQ P 2 =,制冷量q 2=c p 0ΔT ,冷却水带走的热量P Q Q +=21 ,工质流量22q Q q m =,膨胀机功率P T =q m w s =q m c p 0ΔT ,压气机功率P c =q m (w c )s =q m c p 0ΔT 。
答案: P =72.9 8 kW ;=1Q 2 222.89 kW ,q m =8 159 kg/h ,P T =290.84 kW ,P T =218 kW ,P c =290.84 kW 。
12-4 按上题所述条件,若压气机绝热效率为0.8,膨胀机效率为0.85,试求装置消耗的功率及制冷系数。
12第四版工程热力学总结第12章18页PPT文档

(3)可求得烟气中水蒸气的分压力:
pH 2 OH 2 O p0 .0 8 0 .10 .0M 08P17 a
谢谢!
18
9
12-7 湿空气过程及其应用
三、冷却过程—冷却去湿过程
当湿空气被冷却到露点温度时达到饱和状态,若继续冷 却,则将有水蒸气凝结析出,实现去湿的目的。
四、加湿过程
1 喷水加湿过程
工程上可近似地把喷水加湿过 程按定焓过程处理。
d
t
2 喷蒸汽加湿过程
按定温过程处理。
d h
10
选择最合适的一个答案:
(2)各组元的质量分数:
16
(2)各组元的质量分数:
w C2O C2O M M C e2 q O0.1 224.1 942 1% 8
wN2
N2
MN2 0.8 287% 7
Meq
2.912
w H 2 O 1 w C 2 O w N 2 1 1 % 8 7 % 7 5 %
,用Td表示。即在一定的Pv下未饱和湿空气冷却到饱和湿空
气时(将结出露珠)的温度。
5
第12章 内容回顾
四、湿空气的状态参数
1. 绝对湿度:每1m3湿空气中所含的 水蒸气的质量。
v
mv V
Pv RgvT
2. 相对湿度:即为湿空气中水蒸汽的分 压力与相同温度的饱和湿空气中水蒸汽分 压力之比。
12第四版工程热力学总结第12章工程热力学第四版工程热力学第四版答案工程热力学第四版pdf工程热力学第四版视频工程热力学第四版课件工程热力学总结工程热力学章学来答案热力学第一定律总结化工热力学第六章
第12章 理想气体混合物和湿空气
工程热力学-课后思考题答案

第一章基本概念与定义1.答:不一定。
稳定流动开口系统内质量也可以保持恒定2.答:这种说法是不对的。
工质在越过边界时,其热力学能也越过了边界。
但热力学能不是热量,只要系统和外界没有热量地交换就是绝热系。
3.答:只有在没有外界影响的条件下,工质的状态不随时间变化,这种状态称之为平衡状态。
稳定状态只要其工质的状态不随时间变化,就称之为稳定状态,不考虑是否在外界的影响下,这是他们的本质区别。
平衡状态并非稳定状态之必要条件。
物系内部各处的性质均匀一致的状态为均匀状态。
平衡状态不一定为均匀状态,均匀并非系统处于平衡状态之必要条件。
4.答:压力表的读数可能会改变,根据压力仪表所处的环境压力的改变而改变。
当地大气压不一定是环境大气压。
环境大气压是指压力仪表所处的环境的压力。
5.答:温度计随物体的冷热程度不同有显著的变化。
6.答:任何一种经验温标不能作为度量温度的标准。
由于经验温标依赖于测温物质的性质,当选用不同测温物质的温度计、采用不同的物理量作为温度的标志来测量温度时,除选定为基准点的温度,其他温度的测定值可能有微小的差异。
7.答:系统内部各部分之间的传热和位移或系统与外界之间的热量的交换与功的交换都是促使系统状态变化的原因。
8.答:(1)第一种情况如图1-1(a),不作功(2)第二种情况如图1-1(b),作功(3)第一种情况为不可逆过程不可以在p-v图上表示出来,第二种情况为可逆过程可以在p-v图上表示出来。
9.答:经历一个不可逆过程后系统可以恢复为原来状态。
系统和外界整个系统不能恢复原来状态。
10.答:系统经历一可逆正向循环及其逆向可逆循环后,系统恢复到原来状态,外界没有变化;若存在不可逆因素,系统恢复到原状态,外界产生变化。
11.答:不一定。
主要看输出功的主要作用是什么,排斥大气功是否有用。
第二章 热力学第一定律1.答:将隔板抽去,根据热力学第一定律w u q +∆=其中0,0==w q 所以容器中空气的热力学能不变。
第十二章课后习题答案

第四篇 气体动理论 热力学基础求解气体动理论和热力学问题的基本思路和方法热运动包含气体动理论和热力学基础两部分. 气体动理论从物质的微观 结构出发, 运用统计方法研究气体的热现象, 通过寻求宏观量与微观量之间 的关系, 阐明气体的一些宏观性质和规律. 而热力学基础是从宏观角度通过 实验现象研究热运动规律. 在求解这两章习题时要注意它们处理问题方法的 差异.气体动理论主要研究对象是理想气体, 求解这部分习题主要围绕以下三个方面: (1) 理想气体物态方程和能量均分定理的应用;率分布率的应用; (3)有关分子碰撞平均自由程和平均碰撞频率.热力学基 础方面的习题则是围绕第一定律对理想气体的四个特殊过程 和一个绝热过程 )和循环过程的应用,以及计算热力学过程的熵变,并用熵 增定理判别过程的方向.1.近似计算的应用一般气体在温度不太低、压强不太大时,可近似当作理想气体,故理想 气体也是一个理想模型. 气体动理论是以理想气体为模型建立起来的, 因此, 气体动理论所述的定律、 定理和公式只能在一定条件下使用. 我们在求解气 体动理论中有关问题时必须明确这一点. 然而, 这种从理想模型得出的结果 在理论和实践上是有意义的. 例如理想气体的内能公式以及由此得出的理想气体的摩尔定容热容 C V ,m iR/2和摩尔定压热容 C P ,mi 2 R/2都是近似公式, 它们与在通常温度下的实验值相差不大, 因此, 除了在低温情况 下以外, 它们还都是可以使用的. 在实际工作时如果要求精度较高, 摩尔定 容热容和摩尔定压热容应采用实验值. 本书习题中有少数题给出了在某种条 件下C v,m 和C p,m 的实验值就是这个道理.如习题中不给出实验值,可以采 用近似的理论公式计算.(2) 麦克斯韦速(三个等值过程2 .热力学第一定律解题过程及注意事项v2热力学第一定律Q W △,其中功W pv,内能增量V iAE #护.本章习题主要是第一定律对理想气体的四个特殊过程(等体、过程:等压、等温、绝热)以及由它们组成的循环过程的应用.解题的主要(1)明确研究对象是什么气体(单原子还是双原子),气体的质量或物质的量是多少?(2 )弄清系统经历的是些什么过程,并掌握这些过程的特征.(3 )画出各过程相应的P-V图.应当知道准确作出热力学过程的PV图,可以给出一个比较清晰的物理图像. (4 )根据各过程的方程和状态方程确定各状态的参量,由各过程的特点和热力学第一定律就可计算出理想气体在各过程中的功、内能增量和吸放热了.在计算中要注意Q和W的正、负取法.3 .关于内能的计算理想气体的内能是温度的单值函数,是状态量,与过程无关,而功和热量是过程量,在两个确定的初、末状态之间经历不同的过程,功和热量一般是不一样的,但内能的变化是相同的,且均等于△E M C v,m T2 T i.因此,对理想气体来说,不论其经历什么过程都可用上述公式计算内能的增量.同样,我们在计算某一系统熵变的时候,由于熵是状态量,以无论在始、末状态之间系统经历了什么过程,始、末两个状态间的熵变是相同的. 所以, 要计算始末两状态之间经历的不可逆过程的熵变,就可通过计算两状态之间可逆过程熵变来求得,就是这个道理.4 .麦克斯韦速率分布律的应用和分子碰撞的有关讨论深刻理解麦克斯韦速率分布律的物理意义,掌握速率分布函数f(v)和三种统计速率公式及物理意义是求解这部分习题的关键.三种速率为V p V2RT/M , V J8RT/的,府VsRT/M .注意它们的共同点都正比于J T / M,而在物理意义上和用途上又有区别. V p用于讨论分子速率分布图.V用于讨论分子的碰撞;J v2用于讨论分子的平均平动动能.解题中只要抓住这些特点就比较方便. 根据教学基本要求,有关分子碰撞内容的习题求解比较简单,往往只要记住平均碰撞频率公式Z J2d2nv和平均自由程X V/Z 1/42 nd2n ,甚至只要知道1 / n及V J T/M这种比值关系就可求解许多有关习题.章 气体动理论12 - 1处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,均平动动能也相同,则它们此当氦气和氮气的平均平动动能相同时,温度也相同.又由物态方程P nkT ,当两者分子数密度n 相同时,它们压强也相同.故选(C).12 - 2三个容器A 、B 、C 中装有同种理想气体,其分子数密度 n 相同,1/2 2 1/2 2 1/2:v B : v C 1:2:4 ,则其压强之比P A : P B : P c 为( )4T 0,则平均速率变为 2v 0 ;又平均碰撞频率 Z J 2 nd 2nv ,由于容器体分子的平(A)温度,压强均不相同 (B)温度相同,但氦气压强大于氮气的压强 (C)温度,压强都相同(D)温度相同,但氦气压强小于氮气的压强分析与解理想气体分子的平均平动动能k3kT /2,仅与温度有关.因方均根速率之比v A(A) 1 : 2 : 4 (B) 1 : 4 : 8 (D) 4 : 2 : 1(C) 1 : 4 : 16分析与解 分子的方均根速率为 府 J3RT/M ,因此对同种理想气体有J v A : J v ;: J v C J T I : \汀2 : J T 3,又由物态方程 pkT ,当三个容器中分子数密度n 相同时,得P 1: P 2 :P 3 T 1 : T 2 : T 31:4:16.故选(C). 12 - 3在一个体积不变的容器中, 储有一定量的某种理想气体,温度为T 0时,气体分子的平均速率为v 0,分子平均碰撞次数为 Z 0,平均自由程为0 ,当气体温度升高为4T 0时, 气体分子的平均速率 v 、平均碰撞频率Z和平均自由程 分别为((A) v 4V 0,Z4Z 0,入 (B) 2V 0,Z 2Z 0,(C) v2v 0 ,Z2Z 0,-(D)分析与解理想气体分子的平均速率J8RT/ nM ,温度由T 0升至积不变,即分子数密度 n 不变,则平均碰撞频率变为 2Z 0;而平均自由程11迈nd 2n , n 不变,则珔 迪不变•因此正确答案为(B )•-4已知n 为单位体积的分子数,f v 为麦克斯韦速率分布函数,则-5 一打足气的自行车内胎,在t 1 7.0O C 时,轮胎中空气的压强为4.0 105Pa ,则当温度变为t 2 37.0o C 时,轮胎内空气的压强 p 2 P 2为多少?(设内胎容积不变)正比.由此即可求出末态的压强.p 2 T 2 p 1 / T 1 4.43 105 Pa可见当温度升高时, 轮胎内气体压强变大, 因此,夏季外出时自行车的车胎 不宜充气太足,以免爆胎.12 - 6 有一个体积为1.0 105 m 3的空气泡由水面下 50.0 m 深的湖底处 (温度为4° C )升到湖面上来•若湖面的温度为17.0oC ,求气泡到达湖面的体积.(取大气压强为p 0 1.013 105Pa )分析将气泡看成是一定量的理想气体,它位于湖底和上升至湖面代表两个12nf v dv 表示()(A) 速率v 附近,d v 区间内的分子数(B) 单位体积内速率在 v ~ v dv 区间内的分子数(C) 速率v 附近,d v区间内分子数占总分子数的比率(D) 单位时间内碰到单位器壁上,速率在dv 区间内的分子数 分析与解麦克斯韦速率分布函数 fv dN/Ndv ,而n N /v ,则有 nf v dv dN/V .即表示单位体积内速率在v ~ v dv 区间内的分子数. 正确答案为(B ) •12 P i分析 胎内空气可视为一定量的理想气体, 其始末状态均为平衡态,由于气体的体积不变,由理想气体物态方程 pVM mRT 可知,压强p 与温度T 成解 由分析可知,当T 2273.15 37.0 310.15 K ,轮胎内空气压强为不同的平衡状态.利用理想气体物态方程即可求解本题. 位于湖底时,气泡内的压强可用公式P P 0gh 求出, 其中P 为水的密度(常取331.0 103 kg m 3).解 设气泡在湖底和湖面的状态参量分别为 (P i ,V i ,T i )和(p 2 ,V 2 ,T 2 ).由可得空气泡到达湖面的体积为型吹玻璃车间,平均每天用去0.40 m 3压强为1.01 105Pa 的氧气,问一瓶氧气能用多少天?(设使用过程中温度不变)分析 由于使用条件的限制, 瓶中氧气不可能完全被使用. 为此,可通过两条不同的思路进行分析和求解: (1)从氧气质量的角度来分析.利用理想气体物态方程pV^RT 可以分别计算出每天使用氧气的质量m 3和可供使用的氧气总质量(即原瓶中氧气的总质量 m 1和需充气时瓶中剩余氧气的质量m 2之差),从而可求得使用天数n m, m 2 / m 3. (2)从容积角度来分析.利用等温膨胀条件将原瓶中氧气由初态(P J 1.30 107Pa ,V i 3.2 10 2m 3)膨胀到需充气条件下的终态 (P 2 1.00 106Pa N2待求),比较可得P 2状态下实际使用掉的氧气的体积为 V 2 V i .同样将每天使 用的氧气由初态(P 3 1.01 105Pa ,V 3 0.40 m 3)等温压缩到压强为 p 2的终态,并算出此时的体积V'2 ,由此可得使用天数应为 n V 2 V 1 /V 2 . 解1根据分析有m i MpM / RT ;m 2 MP 2V 2 / RT; m 3 MP 3V 3 / RT分析知湖底处压强为 P ,P 2 ph p 0 ph ,利用理想气体的物态方程 P i V iT TP 2V 2"T TV 2 PM / P 2T 1P opgh T 2V 1 / pj 6.11 10 5 m 312 - 7氧气瓶的容积为3.210 2 m 3,其中氧气的压强为1.3 107 Pa , 氧气厂规定压强降到 1.0 106Pa 时,就应重新充气,以免经常洗瓶.某小则一瓶氧气可用天数n m 1 m 2 /m 3 P 1 p 2V 1/ P 3V 3 9.5解2根据分析中所述,由理想气体物态方程得等温膨胀后瓶内氧气在压强 为p 21.00 106 Pa 时的体积为每天用去相同状态的氧气容积V 2则瓶内氧气可用天数为12 -8设想太阳是由氢原子组成的理想气体,其密度可当作是均匀的.若 此理想气体的压强为1.35 1014Pa •试估计太阳的温度.(已知氢原子的质量m H 1.67 1027Pa ,太阳半径E H 1.67 10 27kg ,太阳质量30m s 1.99 10 kg )分析 本题可直接运用物态方程 P nkT 进行计算. 解氢原子的数密度可表示为n m s / E H V S4 3m S / m H - nR S3根据题给条件,由 P nkT 可得太阳的温度为T p/nk 4n)m H R 3/ 3m s k1.16 107K太阳温度与实际的温度相差较大.估算太阳 (或星体)表面温度的几种较实用的方法在教材第十五章有所介绍.12 - 9 一容器内储有氧气,其压强为1.01 105 Pa ,温度为27(1)气体分子的数密度;(2)氧气的密度;(3)分子的平均平动动能; 子间的平均距离.(设分子间均匀等距排列)分析 在题中压强和温度的条件下, 氧气可视为理想气体. 因此, 气体的物态方程、密度的定义以及分子的平均平动动能与温度的关系等求V 2P l V1/ p2n V 2 V 1 /V 2P i P 2 V i / pV 9.5说明实际上太阳结构并非本题中所设想的理想化模型,因此,计算所得的C,求:可由理想解.又因可将分子看成是均匀等距排列的,故每个分子占有的体积为(1)单位体积分子数氧气的密度氧气分子的平均平动动能氧气分子的平均距离通过对本题的求解,我们可以对通常状态下理想气体的分子数密度、 动动能、分子间平均距离等物理量的数量级有所了解.12 — 10 2.0 X0 2 kg 氢气装在4.0 W-3m 3的容器内,当容器内的压强为 3.90 105Pa时,氢气分子的平均平动动能为多大?分析 理想气体的温度是由分子的平均平动动能决定的,即k3kT/2 •因此,根据题中给出的条件,通过物态方程pV = m/MRT , 求出容器内氢气的温度即可得3kT /2 3pVMk 2mR 3.8912 — 11温度为0 C 和100 C 时理想气体分子的平均平动动能各为多少?欲使分子的平均平动动能等于 1eV ,气体的温度需多高? 解 分子在0 C 和100 C 时平均平动动能分别为由于1e V=1.6>10—19J,因此,分子具有1eV 平均平动动能时,气体温度为—3T 2 k / 3k 7.73 103 KV od 3,由数密度的含意可知 V 01/ n , d 即可求出.n p/ kT2.44 1025m 3m/V pM/ RT31.30 kg m -k3kT/26.21 10 21 Jd V r /n 3.4510 9m平均平解由分析知氢气的温度TMPV,则氢气分子的平均平动动能为mR13kT 1 /2 5.65 10 21J23kT 2 / 2 7.72 10 21JV31.69 10-1s 扫RT2\ M1.83 103 m s-1这个温度约为7.5 X03 C.12 —12某些恒星的温度可达到约1.0 1)08K,这是发生聚变反应(也称热核反应)所需的温度.通常在此温度下恒星可视为由质子组成.求:(1)质子的平均动能是多少?(2)质子的方均根速率为多大?分析将组成恒星的大量质子视为理想气体,质子可作为质点,其自由度i = 3,因此,质子的平均动能就等于平均平动动能与温度的关系mV2/2 3kT/2,可得方均根速率(1)由分析可得质子的平均动能为质子的方均根速率为气体温度T2= 2.7K时,有•此外,由平均平动动能后.& 3mv2 /2 3kT/2 2.07 1015 J12 率、厅2厝“8 106m s-1—13 试求温度为300.0 K和2.7 K(星际空间温度方均根速率及最概然速率)的氢分子的平均速分析分清平均速率v、方均根速率J v2及最概然速率V p的物理意义,并利用三种速率相应的公式即可求解解氢气的摩尔质量M = 2 >10 3kg mol 1,气体温度T i = 300.0K,则有1.78 103 m s-1J v23町1.93 10 3 -1V p 1.58 103s-1V p H 2]2RT{一2-0MH2._3110 m s3-11.50 10 m s M12 -14如图所示,i 、n 两条曲线分别是氢气和氧气在同一温度下的麦克斯韦分子速率分布曲线•试由图中数据求:(1)氢气分子和氧气分子的最概它们的最概然速率V p 也就不同.因 M H 2 M O 2,故氢气比氧气的V P 要大, 由此可判定图中曲线n 所标V p = 2.0 X103 m-s ^1应是对应于氢气分子的最概然速率.从而可求出该曲线所对应的温度 .又因曲线I 、n 所处的温度相同,而曲线n 对应的V p 较大,因而代表 气体温度较高状态. 解(1)由分析知氢气分子的最概然速率为故曲线i 中氧气的最概然速率也可按上式求得 /2RT.同样,由V p 冷可知, 如果是同种气体,当温度不同时,最概然速率V p 也不同.温度越高,V P 越大.然速率;(2)两种气体所处的温度;(3)若图中i 、n 分别表示氢气在不同12 — 17温度相同的氢气和氧气, 若氢气分子的平均平动动能为 6.21 W 21J ,利用M O 2 / M H 2 = 16可得氧气分子最概然速率为V po 2 V p J 450102 ms 1T V 2M /2R 4.81 102 Kpn 代表气体温度较高状态—15日冕的温度为2.0 W 6K ,所喷出的电子气可视为理想气体.试求其中电子的方均根速率和热运动平均动能 解方均根速率好j 竺9.5 106 m s 1V m.平均动能兄 3kT / 24.1 10 17 J12 — 16在容积为2.03m 3的容器中,有内能为6.75 102J 的刚性双原子分子某理想气体.(1)求气体的压强;(2)设分子总数为5.4 X1022个,求分子的平均平动动能及气体的温度pV = mM RT 可解出气体的压强.(2)求得压强后,再依据题给数据可求得分子数密度, 则由公式P = nkT 可求气体温度.气体分子的平均平动动能可由 乙 3kT /2求出.解⑴由E捺护T和卩―mM RT可得气体压强气体分子的平均平动动能为由V p得气体温度V M12 分析 (1) 一定量理想气体的内能Em?RT,对刚性双原子分子而言,i = 5.由上述内能公式和理想气体物态方程(2)分子数密度n = N/V ,T p/ 2E/iV 1.35则该气体的温度nk pV / nk105 Pa3.62 105Pa3kT/2 7.49 1021 J12 —17温度相同的氢气和氧气,若氢气分子的平均平动动能为 6.21 W 21J,试求(1)氧气分子的平均平动动能及温度;(2)氧气分子的最概然速率.分析(1)理想气体分子的平均平动动能I 3kT / 2 ,是温度的单值函数,213kT/2 6.21 10 J,则氧气的温度为:T 2工/3k 300 K氧气的摩尔质量M = 3.2 10 2kg mol 1V p 3.95 102p V M想气体并具有相同的温度分析由题意声波速率U与气体分子的方均根速率成正比,即u J V2;而在一定温度下,气体分子的方均根速率W2J1/M,式中M为气体的摩尔质量.因此,在一定温度下声波速率U 71/ M .解依据分析可设声速U A J1/ M,式中A为比例常量.则声波通过氧气与氢气的速率之比为12 - 19已知质点离开地球引力作用所需的逃逸速率为V J2gr,其中r为地球半径.(1)若使氢气分子和氧气分子的平均速率分别与逃逸速率相等,它们各自应有多高的温度;(2)说明大气层中为什么氢气比氧气要少.(取r=6.40 X06m) 分析气体分子热运动的平均速率V』8RT,对于摩尔质量M不同的气与气体种类无关.因此, 氧气和氢气在相同温度下具有相同的平均平动动能, 从而可以求出氧气的温度.(2)知道温度后再由最概然速率公式V p 崔即可求解V M V p .(1)由分析知氧气分子的平均平动动能为则有12 -18 声波在理想气体中传播的速率正比于气体分子的方均根速率•问声波通过氧气的速率与通过氢气的速率之比为多少? 设这两种气体都是理U H20.25U02 Y M O2V TT M体分子,为使V等于逃逸速率V,所需的温度是不同的;如果环境温度相同, 则摩尔质量M 较小的就容易达到逃逸速率解(1)由题意逃逸速率V J2gr ,而分子热运动的平均速率V J-8-RTY T Mv V时,有T鬻当由于氢气的摩尔质量M H2 2.0 10 3 kg mol 1,氧气的摩尔质量M O2 3.2 10 2 kg mol 1,则它们达到逃逸速率时所需的温度分别为T H2 1.18 104 K, T O2 1.89 105 K(2)根据上述分析,当温度相同时,氢气的平均速率比氧气的要大(约为4倍),因此达到逃逸速率的氢气分子比氧气分子多.按大爆炸理论,宇宙在形成过程中经历了一个极高温过程.在地球形成的初期,虽然温度已大大降低,但温度值还是很高.因而,在气体分子产生过程中就开始有分子逃逸地球,其中氢气分子比氧气分子更易逃逸.另外,虽然目前的大气层温度不可能达到上述计算结果中逃逸速率所需的温度,但由麦克斯韦分子速率分布曲线可知,在任一温度下,总有一些气体分子的运动速率大于逃逸速率线也可知道.从分布曲在相同温度下氢气分子能达到逃逸速率的可能性大于氧气分子故大气层中氢气比氧气要少12 —20容积为1m3的容器储有1mol氧气,以v= 10m • 1的速度运动, 设容器突然停止,其中氧气的80%的机械运动动能转化为气体分子热运动动能.试求气体的温度及压强各升高了多少分析容器作匀速直线运动时,容器内分子除了相对容器作杂乱无章的热运动外,还和容器一起作定向运动.其定向运动动能(即机械能)为mv2/2.按照题意,当容器突然停止后,80%定向运动动能转为系统的内能.对一定量理想气体内能是温度的单值函数,则有关系式:m 5R AT 成立,从而可求AT.再利用理想气体物态方M 2当容器体积不变时,由 pV = mRT/M 得12 - 21 有N 个质量均为 m 的同种气体分子,⑵由N 和Vo求a值;(3)2△E mv 80%程,可求压强的增量 解由分析知AE 20.8mv /2 m 5A T,其中m为容器内氧气质量.又氧气的摩尔质量为M 3.22 110 kg mol ,解得AT =6.16 10: 2KAP 黑 AT 0.51Pa它们的速率分布如图所示.(1)说明曲线与横坐标所包围的面积的含义;分析 处理与气体分子速率分布曲线有关的问题时,关键要理解分布函数f V的物理意义.f V dN/Ndv,题中纵坐标Nf v dN/dv,即处于速率V附近单位速率区间内的分子数.同时要掌握fv的归一化条件,即0 f vdv 1.在此基础上,根据分布函数并运用数学方法(如函数求平均值或极值等),即可求解本题.解(1)由于分子所允许的速率在0到2 V o的范围内,由归一化条件可知图中曲线下的面积of vdv即曲线下面积表示系统分子总数 N.速率在V o /2到3V o /2间隔内的分子数为分子速率平方的平均值按定义为(2 )从图中可知,在o 到v o 区间内,Nf v av/v 0 ;而在0到2 V o 区间,Nf v a 则利用归一化条件有voav J——2v oadvv oA N:空dvv o vo3v o /2adv 7N/12v 2ov 2dN/N v 2f v dv故分子的平均平动动能为V o2voa 2 I 31 2 —v dv ——mv o vN 3612 - 22试用麦克斯韦分子速率分布定律导出方均根速率和最概然速率分析麦克斯韦分子速率分布函数为3/22「, m 2 mvf v 4 n ----- v exp -------采用数学中对连续函数求自变量平均值的方法,求解分子速率平方的平均_2v 2dN值,即v -------- ,从而得出方均根速率.由于分布函数较复杂,在积分dN过程中需作适当的数学代换 .另外,最概然速率是指麦克斯韦分子速率分布函数极大值所对应的速率,因而可采用求函数极值的方法求得解(1)根据分析可得分子的方均根速率为r —N1/2J v 2 v 2dN/N3/2x m 4 4 n ---- v exp1/22mv , dv2kTmv F /2.■^齐表示在v附近单位速率区间的粒子数占总粒子数的百分比f v dv 0 f v dv ,因此根据题给条件可得令 mv2/2kT x 2,则有 J v 24 2kT /n m"dx1/23kT1/2 1.73 巴m1/212 令df v dv 0,即3/24 n2k uT2vex p2mv 2kT 2kT 1/2V p2 mv 2v 2—— 2kT exp2mv 2kTRT 1/2 1.41 —— m-23导体中自由电子的运动可看作类似于气体分子的运动(故称电子 气)•设导体中共有N 个自由电子,其中电子的最大速率为 V F(称为费米速率).v ~ v dv 之 间 的dN4 nA 2 . --- v dv N 0V Fv 0,A(1)画出分布函数图; (2)用 N 、v F定出常数A ;电子气中电子的平均动能飞37/5 ,其中分析理解速率分布函数的物理意义,就不难求解本题.速率分布函数它应满足归一化条件Vf v 〜v 的函数关系,由此可作出解析图和求出A .在f v 〜V 函数关系确的速率分布函数3N /4 n F,C 2V F4 nn 2 , 3V Fc --- v dv ---- 0N 5;mv 2/23乍/5后压强降为8.11 104Pa .设大气的温度均为27.0 C .问此时飞机距地面的高度为多少?(设空气的摩尔质量为2.89 X0-2kg mol -1 )分析 当温度不变时,大气压强随高度的变化主要是因为分子数密度的改变 而造成.气体分子在重力场中的分布满足玻耳兹曼分布.利用地球表面附近气压公式P P o exp mgh/kT ,即可求得飞机的高度h.式中p o 是地面的大 气压强. 解飞机高度为RT 3ln p 0/ p 1.93 10 m Mg12 — 25 在压强为1.01 105Pa 下,氮气分子的平均自由程为 6.0 X06cm,当温度不变时,在多大压强下,其平均自由程为— 1分析气体分子热运动的平均自由程入一—,其中分子数密度n 由物定的情况下,由 v2f v dv 可以求出v2,从而求出飞mv 2/2.4 T A 2--- v v NV Fv V F利用分析中所述归一化条件,有,其分布函数图如图所示V F 4 T A 0N v 2dV 1得12 -24一飞机在地面时,机舱中的压力计指示为1.01 105 Pa ,到高空(1)由—2vV 2 f vdvkTh ——ln P 0/Pmg1.0mm 。
