有机化学 第十一 章
有机化学 第十一章 醛酮(1)

E1
E2
19
四. 化学性质(C.P.)
结构分析 讨论1: 比较苯酚C-O与醛酮C=O的结构? C杂化形式 苯酚 醛酮 sp2 sp2 O杂化形式 sp2 sp2(国外)
H H
C O
H
C O
H
20
结构分析 讨论1: 比较苯酚C-O与醛酮C=O的结构?
H
H
C O
H
+
-
C O
H
C
H
O
H
O O CH3 C CH2 C CH3
14
2. 命名
普通命名法
醛:αβγδ… 标记取代基位置
CH3CHCH2CHO CH3 CH3OCH2CH2CH2CHO CH=CHCHO
-甲基丁醛
γ-甲氧基丁醛
-苯基丙烯醛
酮:某某基酮(与醚相似)
O CH 3 C HC CH 3
O CH2 CH C CH3
O C CH3
CH3
甲基异丙基酮
甲基乙烯基酮
苯基甲基酮 15
2. 命名
系统命名法
脂肪醛酮:选含羰基(位次小)的最长C链为母体,称某醛(酮);
O CH3CH2CHCH2C CH2CH3 CH3
5-甲基-3-庚酮
当主链中有 C=C 时,称烯醛或烯酮;
O CH2 CH C CH3
O (CH3)2CHCHCH=CHCCH3 Cl 6-甲基-5-氯-3-庚烯-2-酮
加酸反应速率减小,加入大量酸,放许多天也不反应。
● 反应条件:碱催化
● 增碳的反应:制备增1个C的羧酸
● 范围: 醛、大多数甲基酮
28
(一) 羰基的亲核加成 1. 与氢氰酸加成
大学有机化学第十一章杂环化合物

环状有机化合物中,构成环的原子除碳原 子外还有其他类型的原子时,这类环状有 机化合物叫做杂环化合物。非碳原子称为 杂原子。最常见的杂原子有O、S、N 。 杂环根据其性质可分为脂杂环和芳杂环。 杂环化合物在自然界中分布广泛,是重要 的、也是最大的一类有机化合物。
一、分类和命名
N HN (in d o le ) H (in d o le ) 吲哚 吲哚
N NH N (p u rin e ) H (p u rin e ) 嘌呤 嘌呤
⑵系统命名法:根据相应的碳环母体命名, 命名时在相应的碳环母体名称前面加上杂原 子的名称。
N H
茂
S S
N H
氮茂 O O
N H
N H
S S O
4γ β 5 α 6 3β 2α
1-硫-3-氮茂 (噻唑) β α
N H N
1,3-二氮苯 (嘧啶)
CH3
O
β α
N
1
一些多杂原子的杂环,有其固定编号。
6 1 5
N N
3
N
7 5 8 6
2 4
N9 H
1,3,7,9-四氮茚 (嘌呤)
当环上连有烃基时,一般以环作为母体。 如连有官能团时,则以环作为取代基。
1.分类: 单杂环:五元杂环和六元杂环 稠杂环:苯环和单杂环稠合、单杂环和单 杂环稠合 2.命名: ⑴音译法:根据杂环的英文名称译音,带 “口”字旁的同音汉字表示。
N NH (pH le ) yrro (p yrro le ) 吡咯 吡咯 N
N N N (p yrim id in e ) (p yrim id in e ) 嘧啶 嘧啶
CH3 N
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
O C
羰基
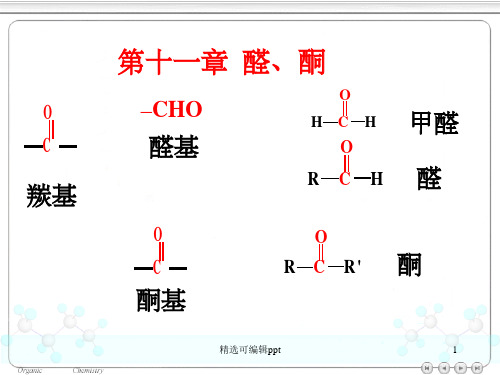
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学--第十一章 醛 和 酮

等氧化剂所氧化,例如:
常把次卤酸钠的碱溶液与醛或酮作用生成三卤甲烷的 反应称为卤仿反应。
52
如果用次碘酸钠(碘加氢氧化钠)作试剂,产生具有特殊气味的黄
色结晶的碘仿(CHI3),这个反应称为碘仿反应。可通过碘仿反应来 鉴定具有 构的醛和酮,以及 结构的醇,因为次
碘酸钠又是一个氧化剂,能将
结构的醛或酮:
结构的醇氧化成含
53
生成α-羟基腈,此法优点是可避免使用有毒的氰化氢,
而且其产率也较高。例如:
33
3.与醇加成
在干燥氯化氢或浓硫酸的作用下,一分子醛或酮与
一分子醇发生加成反应,生成的化合物分别称为半缩醛
或半缩酮。
34
半缩醛(酮)一般是不稳定的,它易分解成原来的醛
(酮),因此不易分离出来,但环状的半缩醛较稳定,能
够分离得到。例如:
当醛、酮进行加成反应时,一般是试剂带负电荷
(亲核)的部分先向羰基碳原子进攻,然后是带正电荷
(亲电)的部分加到羰基氧原子上。决定反应速率的是第 一步,即亲核的一步,所以称为亲核加成反应。
18
亲核加成反应的难易取决于羰基碳原子的亲电性的
强弱、亲核试剂亲核性的强弱,以及电子效应和空间效
应等因素。芳香族羰基化合物进行亲核加成反应困难的 原因是羰基与芳环共轭;同时芳环有较大的体积,能产
14
脂肪醛及芳醛分子中,与羰基相连接的氢在核磁共振谱中的特
征吸收峰出现在极低的低场,化学位移值δ=9~10。醛基质子的化学 位移值是很特征的,这一区域内的吸收峰可用来证实醛基(—CHO)的
存在。
15
与其它吸电基一样,羰基对于与其直接相连的碳原子上的质 子也产生一定的去屏蔽效应。
16
有机化学 第11章 羧酸

C O C
2.两个羧基相隔2~3个碳原子的二元酸,不需要任 何脱水剂,加热就能脱水生成五元或六元环酐。
O H H C C C OH C OH O 150℃ H H C C O C O C O + H2 O
(三)酯的生成
酯化是可逆反应。为了提高酯的产率,通常采用加 过量的酸或醇。
§11-1 羧酸的分类和命名法
分子中含有羧基 一、分类
按照与羧基所连的烃基: (—COOH)的化合物。 脂肪酸和芳香酸。 通式:RCOOH和 按照分子中所含羧基数目: ArCOOH表示。
一元羧酸和多元羧酸。
二、命名
(一)脂肪酸
CH3 CH3CHCH2COOH 3-甲基丁酸 β-甲基丁酸
_ H3 O+
CH3(CH2)3CHCHO CH2CH3
KMnO4,OHH 2O
CH3(CH2)3CHCOO CH2CH3
CH3(CH2)3CHCOOH CH2CH3 (78%)
二、腈水解
HOCH2CH2Cl NaCN HOCH2CH2CN (1)OH-,H2O (2)H3O
+
HOCH2CH2COOH
α-C有强吸电子基时容易脱羧,二元羧酸也较容易 发生脱羧反应。芳基作为拉电子基,使芳酸的脱羧 比脂肪酸容易。
COOH O2N NO2 NO2 ~100℃ H2O O2N NO2 NO2 + CO2
五、烃基上的反应
(一)α-H卤化 羧基与羰基类似,能使α-H活化。但羧基的致活作 用比羰基小得多,必须在碘、硫或红磷等催化剂存 在下α-H才能被卤原子取代。
《有机化学》第十一章 羧酸及其衍生物的结构与性质
第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。
有机化学第11章 醛和酮
O H3C C CH3
NaCN H2S O4
CH3 CH2=C-COOCH3
(CH3)2CCN OH
H2O
CH3 CH2=C-CN
CH3OH
CH3
H
CH2=C-COOCH3
α-甲基丙烯酸甲酯
2、与格氏试剂的加成反应
δ C
δ O
+ δR δMgX
无水乙醚
OMgX H2O C
R C OH + HOMgX
R
C H (R )
O
+ CH3-CH-CH3 ( i - Pr -O-)3Al
R CH OH
OH
H (R )
+ CH3-C-CH3 O
可逆反应,正反应称为麦尔外因-庞多夫-维尔莱还原反应, 其逆反应称为奥本奥尔氧化反应。 反应的专一性高,只使羰基与醇羟基互变而不影响其它基团, 故为一级醇、二级醇与醛酮对应转变的重要方法。
4-甲基-3-乙基己醛
2-甲基-3-戊酮
2-苯丙醛
例如:
CH3-C=CHCH 2CH2-CH-CH 2CHO
CH3
CH3
3,7 二甲基 6 辛烯醛
H3C O
3 甲基环戊酮
O
O
O
C-CH 2CH3
C-CH 3
2 环己烯酮
1 环己基 1 丙酮
1 苯基 1 乙酮
多元醛酮:称某二醛或酮
当酮羰基和醛羰基共存时,酮羰基称羰基、酰基或氧代;
醛的异构现象是碳链异构。 酮的异构现象是碳链异构和羰基的位置异构。
三、醛酮的命名
1、IUPAC命名法
选择含羰基的最长链为主链;从近羰基的一端开始编号, 醛基总在链端;取代基位次和名称写于母体名称之前。
有机化学 第十一章 醛酮
O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
有机化学 第十一章 杂环化合物和生物碱
第十一章杂环化合物和生物碱杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。
本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。
第一节杂环化合物环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。
组成杂环的原子,除碳以外的都叫做杂原子。
常见的杂原子有氧、硫、氮等。
前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。
杂环化合物种类繁多,在自然界中分布很广。
具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。
例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。
一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。
杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
一、杂环化合物的分类和命名为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。
最常见的单杂环有五元环和六元环。
稠杂环有芳环并杂环和杂环并杂环两种。
另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。
杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。
译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。
例如:呋喃 咪唑 吡啶 嘌呤furan imidazole pyridine purine杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。
含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。
