第二节吸附法2
第09章吸附

一、吸附分离操作的分类 1、物理吸附:吸附质与吸附剂之间由于范德华力而 产生的吸附,也称为范德华吸附。 物理吸附仅仅是一种物理作用,没有电子转移,没 有化学键的生成与破坏,也没有原子重排等。 2、化学吸附:又称活性吸附,是由吸附质和吸附剂 分子间的化学键作用而引起的吸附。 化学吸附相当于吸附剂表面分子与吸附质分子发生 了化学反应,形成牢固的吸附化学键和表面络合物, 在红外、紫外-可见光谱中会出现新的特征吸收带。 化学吸附在催化反应中起重要作用,分离过程中极 少应用。
其吸附能力比一般活性炭要高1~10倍。
表面化学特性同活性炭。
3、硅胶 是一种坚硬无定形链状或网状结构的硅酸聚合物颗 粒,化学式:SiO2 · nH2O。
用硫酸处理硅酸钠水溶液,生成凝胶,水洗除去硫 酸钠后经干燥,便可得到玻璃状的硅胶。 硅胶是极性吸附剂,难于吸附非极性物质,易于吸 附极性物质(如水、甲醇等)。 吸湿,高湿度气体的干燥。
上式为线性表达式,可以表述吸附规律! 事实上:在温度一定的条件下,如V、C0一定,改变 活性炭投加量,则发现水中剩余溶质浓度Ce及qe也随 之改变——说明?? 吸附量与剩余浓度不是线性关系!如何描述之? 一、单组分气体吸附平衡 1、吸附等温线 五种类型的纯气体物理吸附等温线
I型微孔吸附特征,Ce没有极限值,qe却有极限值,可理 解为吸附剂内表面发生单分子层吸附,Langmuir型。 II、III型大孔吸附特征;Ⅱ型前半段多分子层吸附,后 半段发生毛细凝聚现象, Ce有极限值Cs(饱和浓度),qe 却无极限值,BET型。Ⅲ型Ce与qe无极限值,吸附热等 于或小于纯吸附质的溶解热,Freundlich型。 Ⅳ型与Ⅱ型比较,V型与Ⅲ型比较,低压下大体相同; 区别在高比压下出现吸附饱和现象,说明吸附剂孔径有 一定范围,在高压时易达到饱和。
第二节 吸附平衡

第二节吸附平衡§9.2.1 、概念1、吸附平衡:在一定温度和压力下,当流体(气体或液体)与固体吸附剂经长时间充分接触后,吸附质在流体相和固体相中的浓度达到平衡状态,称为吸附平衡。
2、吸附过程的方向和极限:吸附平衡关系决定了吸附过程的方向和极限,是吸附过程的基本依据。
若流体中吸附质浓度高于平衡浓度,则吸附质将被吸附,若流体中吸附质浓度低于平衡浓度,则吸附质将被解吸,最终达吸附平衡,过程停止。
3、吸附平衡的影响因素:单位质量吸附剂的平衡吸附量受到许多因素的影响,如吸附剂的物理结构(尤其是表面结构)和化学组成,吸附质在流体相中的浓度,操作温度等。
§9.2.2 、吸附等温线1、吸附平衡关系表示方法,通常用等温下单位质量吸附剂的吸附容量(或浓度C)间的关系表示,称为吸附等与;流体相中吸附质的分压温线。
由于吸附剂和吸附质分子间作用力的不同,形成了不同形状的吸附等温线。
对相对压力作图(为该温度下吸附质的饱和蒸汽压),2、以所得曲线为等温线。
3、Brunsucr等将典型的吸附等温线归纳成五类,如书p347图9—1所示。
其中Ⅰ、Ⅱ、Ⅳ型对吸附量坐标方向凸出的吸附等温线,称为优惠等温线,它有利于吸附的完全分离,因为当吸附质的分压很低时,吸附剂的吸附量仍保持在较高水平,从而保证痕量吸附质的脱除。
Ⅲ、V型曲线在开始一段曲线向吸附量坐标方向下凹,属非优惠吸附等温线。
4、经验方程:吸附作用是固体表面力作用的结果,但这种表面力的性质至今未被充分了解。
为了说明吸附作用,许多学者提出了多种假设或理论,但只能解释有限的吸附现象,可靠的吸附等温线只能依靠实验测定。
至今,尚未得到一个通用的半经验方程。
下面介绍几种常用的经验方程。
⑴、Langmuir方程a)、朗格缪尔吸附模型假定条件为:①、吸附是单分子层的,即一个吸附位置只吸附一个分子;②、被吸附分子之间没有相互作用力;③、吸附剂表面是均匀的。
上述假定条件下的吸附称为理想吸附。
第一章 第二节 原子及分子的吸附

鋁
E o (eV) 0.06 0.17 0.03 0.09 0.12 0.13
58
薄膜工程
周麗新
表十五 離子晶體表面上不同位置的吸附能計算值
表中以斜體字表示的計算值為各系統的優選吸附位置
0.35eV,銀為 0.28eV 而銅為 0.12eV,此三種原子在氯化鈉及雲母(mica) 基板上的吸附能見表十六、十七等。 2.2 化學吸附
薄膜工程
周麗新
圖六十八 氫原子在金表面的吸附位能曲線圖
進行的能量交換量,因吸附體-固體表面組合的不同而有不同的值,停 留時間的長短也將影響原子的吸附量,針對前述各值,可定義一些係數 以描述吸附原子的吸附量 、 停留時間及與固體表面的能量交換量 , 此外, 在任一溫度下,原子在固體表面的吸附量與固體表面的壓力值有關,其 關係式稱為吸附等溫線 (adsorption isotherm) , 以下將依序介紹。 2.3.1 生命期與脫離率(escape rate) 考慮下圖之位能井,深度為 Ea ,原子在位能井中之振動頻率為 νo, 振動時間τo = 1/ νo ≅ 10 秒,則原子在固體表面之生命期τa 為 τa = τo exp (Ea / kT), 若固體表面吸附之原子密度為 Ns,則脫 離率 R 為 R=
薄膜工程
周麗新
圖六十一 氫原子在鎢薄膜上的化學吸附熱 (1eV/atom=23.1Kcal/mole)
吸附作用所牽涉的力與一般原子及分子間的交互作用無異,一般情 況下的弱凡得瓦交互作用是目前發展最完全的表面力理論,因此,此段 吸附力將只討論物理吸附,物理吸附時,吸附體在表面平衡位置上,同 時感受吸力及斥力,但此二力恰達成平衡。 先由兩個隔離原子(isolated atom)的交互作用討論起,此交互作用可 以原子間位能表示,一般以半經驗(semi-empirical)的方程式密位能(Mie potential)φ (r)表示:
水污染控制工程课件——吸附
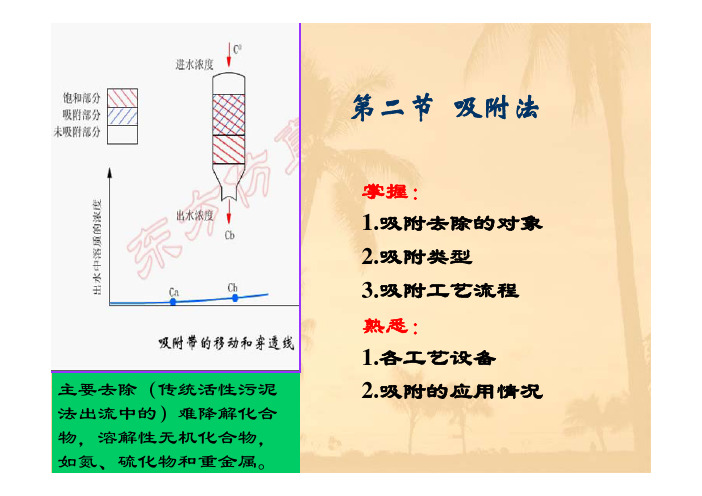
第二节 吸附法
掌握: 1.吸附去除的对象 2.吸附类型 3.吸附工艺流程 熟悉: 1.各工艺设备 2.吸附的应用情况
主要去除(传统活性污泥 法出流中的)难降解化合 物,溶解性无机化合物, 如氮、硫化物和重金属。
吸
2.吸附设备
(2)活性炭的再生
附
2)化学再生法
工
无机溶剂再生法 无机酸或碱脱附(反应转化为
艺
易溶于水的物质)例:吸附高
浓度酚的饱和炭,用NaOH再
和
生,脱附下来的为酚钠盐,可
设
回收利用 有机溶剂再生法 有机溶剂萃取有机物 例:含
备
二硝基氯苯的燃料废水的活性
炭,用有机溶剂氯苯脱附后,
再用热蒸汽吹扫炭上残留的氯
附
工
a——穿透点 当吸附带移到填
艺
充层下端时,出水中 便开始出现吸附质。
和
b——穿透终点
a至b期间,随着
设
继续通水,出水中吸
附质浓度增大,直到
备
为原水值C0.但当到
规定值Cb时实际上应
为吸附终点。
吸
2.吸附设备
(1)吸附装置——固定床
附
工
艺
和
设
备
吸
2.吸附设备
(1)吸附装置——移动床
附
工
艺
和
设
备
第二节 吸附法
一、吸附原理 二、吸附剂 三、吸附工艺和设备 四、应用
1.定义
吸
具有一定吸附能力的多孔物质都可以作吸附
附
剂。有活性炭、活化煤、焦炭、煤渣。
剂
7气态污染物的治理吸附法PPT课件

2、吸附净化法的特点
(1)适用范围 ①常用于浓度低,毒性大的有害气体的净化; ②对有机溶剂蒸汽具有较高的净化效率; ③当处理的气体量较小时,用吸附法灵活方便。 (2)优点:净化效率高,可回收有用组分,设备简 单,易实现自动化控制。 (3)缺点:吸附容量小,设备体积大;吸附剂容量 往往有限,需频繁再生,间歇吸附过程的再生操作麻 烦且设备利用率低。
常用吸附剂特性
吸附剂类 型
堆积密度 /kg·m-3
热
容
/kJ(kg·K)
-1
操作温度
上限/K
平均孔径 /Å
再生温度 /K
比表面积 /㎡·g-1
活性炭
200~ 600 0.836 ~ 14.22534
15~25
373~ 413 600~ 1600
活性氧 化铝
750~ 1000 0.836
~ 17.07435
发展趋势:由电厂到石油化工、硫酸及肥料工业等领 域。
能否应用该方法的关键: ①解决副产物稀硫酸的应用市场; ②提高活性炭的吸附性能;
活性炭脱硫的主要特点: ①过程比较简单,再生过程中副反应很少; ②吸附容量有限,常需在低气速(0.3-1.0m/s) 下进行,因而吸附器体积较大; ③活性炭易被废气中O2氧化而导致损耗; ④长期使用后,活性会产生磨损,并因微孔堵塞 丧失活性。
吸附剂的活已性所 吸用 附吸 吸附 附剂 质量 的 10质 % 0 量
吸附剂的活性:
静活性:是指在一定温度下,与气相中被吸附物质的初 始浓度平衡时的最大吸附量,即在该条件下,吸附达到 饱和时的吸附量。
动活性:气体通过吸附层时,当流出吸附层的气体中刚 刚出现被吸附物质时即认为此吸附层已失效。这时单位 吸附剂所吸附的吸附质的量称为~。
污水的吸附法、离子交换法、萃取法和膜析法ppt

一. 离子交换剂
水处理中用的离子交换剂有磺化媒和离子交换树脂。磺化媒利用天然 媒为原粒,经浓硫酸磺化处理后制成,但交换容量低,机械强度差,化学 稳定性较差已逐渐为离子交换树脂所取代。
离子交换树脂按树脂的类型和孔结构的不同可分为:凝胶型树脂、大 孔型树脂、多孔凝胶型树脂、巨孔型(MR型)树脂和高巨孔型(超MR型) 树脂等。
VIP专享文档下载特权自VIP生效起每月发放一次, 每次发放的特权有效期为1个月,发放数量由您购买 的VIP类型决定。
每月专享9次VIP专享文档下载特权, 自VIP生效起每月发放一次,持续有 效不清零。自动续费,前往我的账号 -我的设置随时取消。
服务特 权
共享文档下载特权
VIP用户有效期内可使用共享文档下载特权下载任意下载券标价的文档(不含付费文档和VIP专享文档),每下载一篇共享文
沉降式固定层吸附塔的构造
五、吸附法在污水处理中的应用
1. 吸附法除汞 活性炭有吸附汞和汞化合物的性能,但因其吸附能力有限,只适 宜于处理含汞量低的废水。 2.炼油厂、印染厂废水的深度处理 某炼油厂含油废水,经隔油,气浮和生物处理后,再经砂滤和活 性炭过滤深度处理
第二节 离子交换法
离子交换法是水处理中软化和除盐的主要方法之一。在废水处理中主 要用于去除废水中的金属离子。离子交换的实质是不溶液中的其它同性离 子的交换反应,是一种特殊的吸附过程成,通常是可逆性化学吸附。
吸附法的分类

吸附法的分类
吸附法主要可以分为物理吸附、化学吸附和离子交换吸附三类。
1. 物理吸附:基于吸附剂与溶质之间的分子间作用力即范德华力。
溶质在吸附剂上吸附与否或吸附量的多少主要取决于溶质与吸附剂极性的相似性和溶剂的极性。
一般物理吸附发生在吸附剂的整个自由表面,被吸附的溶质可通过改变温度、PH和盐浓度等物理条件脱附。
2. 化学吸附:会释放大量的热,吸附热高于物理吸附。
化学吸附一般为单分子层吸附,吸附稳定,不易脱附,故洗脱化学吸附质一般需采用破坏化学结合的化学试剂为洗脱剂。
化学吸附具有高选择性。
3. 离子交换吸附:所用吸附剂为离子交换剂。
离子交换剂表面含有离子基团或可离子化基团,通过静电引力吸附带有相反电荷的离子,吸附过程发生电荷转移。
离子交换的吸附质可以通过调节PH或提高离子强度的方法洗脱。
以上信息仅供参考,如有需要,建议查阅相关文献或咨询专业人士。
第09章吸附

★ 吸附是动态的,平衡时吸附速率=脱附速率; ★ 吸附过程类似气体凝结过程,脱附类似液体的蒸 发过程; ★ 吸附剂表面与吸附质分子间无作用力,无吸附质转 移运动。
Langmuir方程表达式:
k1qm p q 1 k1 p
p——吸附质的平衡分压,Pa; q, qm——分别为吸附量和单分子层吸附容量,L/kg; k1——Langmuir常数,与吸附剂和吸附质性质和温 度有关,值越大表示吸附剂的吸附能力越强。
二、吸附分离操作的应用 吸附分离操作的应用范围很广,既可以对气体或 液体混合物中的某些组分进行大吸附量分离,也可以 去除混合物中的痕量杂质。 日常生活:木炭吸湿、吸臭;防腐剂;吸湿剂(硅胶) 化工领域:产品的分离提纯,如制糖工业,用活性炭 吸附糖液中杂质,得到洁白产品。 环境领域:水:脱色除臭,有害有机物的去除,金属 离子,氮、磷; 空气:脱湿,有害气体,除臭。 特别适合于低浓度混合物的分离
如何求解Langmuir公式参数?
1 1 1 1 1/q 公式变换: q k1qm p qm
或
p p 1 q qm k1qm
1/(k1qm) 1/qm 1/p
尽管与 Langmuir 方程完全吻合的物系相当少, 但有大量的物系近似符合。该模型在低浓度范围就 简化为亨利定律。 Langmuir 模型被公认为定性或半 定量研究变压吸附系统的基础。
第一节 吸附分离操作的基本概念
本节思考题
(1) 吸附分离操作的基本概念。
(2) 简要说明吸附根据不同的分类方法可以分为哪
些类型。
(3) 吸附在环境工程领域有哪些应用,举例说明。
第二节 吸附剂
主要内容
一、常用吸附剂的主要特性
二、几种常用的吸附剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 化学吸附:由化学键力引起的吸附,涉及分子中化学键的 化学吸附:由化学键力引起的吸附, 破坏和重新组合,吸能形成单分子吸附层,并具有选择性, 破坏和重新组合,吸能形成单分子吸附层,并具有选择性,同时 是不可逆的,在高温下才能吸附。 是不可逆的,在高温下才能吸附。 化学吸附过程的吸附热较物理吸附过程大, 化学吸附过程的吸附热较物理吸附过程大,其吸附需要一定 的活化能,数量相当于化学反应热,一般为84—417kj/mol。化学 的活化能,数量相当于化学反应热,一般为 。 吸付的速率随温度升高而显著增加,宜在较高温度下进行。 吸付的速率随温度升高而显著增加,宜在较高温度下进行。化学 吸附具有很低强的选择性,仅能吸附参与化学反应的某些气体, 吸附具有很低强的选择性,仅能吸附参与化学反应的某些气体, 且吸附质与吸附剂结合比较牢固,一般必须在高温下才能脱附。 且吸附质与吸附剂结合比较牢固,一般必须在高温下才能脱附。 从吸附层厚度来看,化学吸附是单分子层或单原子层吸附。 从吸附层厚度来看,化学吸附是单分子层或单原子层吸附。 化学吸附的主要特征是: 化学吸附的主要特征是: 吸附有很强的选择性,吸附不可逆; (1)吸附有很强的选择性,吸附不可逆; 吸附速率较慢,达到吸附平衡需要相当长的时间; (2)吸附速率较慢,达到吸附平衡需要相当长的时间; 升高温度可提高吸附速率。 (3)升高温度可提高吸附速率。
吸附
吸附: 吸附:是利用多孔性固体吸附剂处理气体混 合物,使其所含一种或数种组分吸附于固体表面上, 合物,使其所含一种或数种组分吸附于固体表面上, 从而达到分离的目的.在相界面上, 从而达到分离的目的.在相界面上,物质的浓度自 动发生累积或浓集。 动发生累积或浓集。 固—液界面上的吸附: 液界面上的吸附: 液界面上的吸附 吸附剂:具有吸附能力的多孔性固体物质。 吸附剂:具有吸附能力的多孔性固体物质。 吸附质:废水或空气中被吸附的物质。 吸附质:废水或空气中被吸附的物质。
上面二种吸附往往是相伴发生,而不能严格分开, 上面二种吸附往往是相伴发生,而不能严格分开, 是几种吸附综合作用的结果, 是几种吸附综合作用的结果,可能存在以某种吸附为 同一污染物可能在较低温度下发生物理吸附, 主。同一污染物可能在较低温度下发生物理吸附,而 在较高温度下发生化学吸附,即物吸在化吸之前, 在较高温度下发生化学吸附,即物吸在化吸之前,当 吸附剂逐渐具备足够高的活化能后,才发生化学吸附。 吸附剂逐渐具备足够高的活化能后,才发生化学吸附。 也可能两种吸附同时发生。 也可能两种吸附同时发生。
(1)吸附质与吸附剂 之间不发生化学反应 吸附质与吸附剂 之间不发生化学反应; (2)对吸附的气体没有选择性 可吸附一切气体 对吸附的气体没有选择性,可吸附一切气体 对吸附的气体没有选择性 可吸附一切气体; (3)吸附过程极快 参与吸附的各相间常常瞬间达到平衡 吸附过程极快,参与吸附的各相间常常瞬间达到平衡 吸附过程极快 参与吸附的各相间常常瞬间达到平衡; ( 4)吸附过程为低放热反应过程 , 放热量与相应气体的液化 ) 吸附过程为低放热反应过程, 热相近,因此物理吸附可看成是气体组分在因体表面上的凝聚; 热相近,因此物理吸附可看成是气体组分在因体表面上的凝聚; (5)吸附剂与吸附质间的吸附力不强,当气体中吸附质分压 )吸附剂与吸附质间的吸附力不强, 降低或温度升高时,被子吸附气体很容易从因体表面逸出, 降低或温度升高时,被子吸附气体很容易从因体表面逸出,而不 改变气体原来的性状。 改变气体原来的性状。
3.吸附等温线 吸附等温线
吸附等温线:在一定T下,q(吸附质 浓度)随平衡浓度C变化的曲线
q0c (q=f(C))叫吸附等温线。用数学公 K+c 式描述液中溶质 是经验常数,c 浓度
吸附过程一般分为3个阶段: 吸附过程一般分为 个阶段: 个阶段 1.液膜扩散(颗粒外部扩散)阶段 液膜扩散(颗粒外部扩散) 液膜扩散 2.颗粒内部扩散阶段 颗粒内部扩散阶段 3. 吸附反应阶段 3.吸附反应阶段: 吸附质被吸附在细孔内 吸附反应阶段: 表面上。 表面上。 吸附反应速度非常快, 主要取决于第 主要取决于第I、 吸附反应速度非常快,V主要取决于第 、 II阶段速度,而颗粒外部扩散速度(液 阶段速度, 阶段速度 而颗粒外部扩散速度( 膜扩散) 膜扩散)U=f(c、d、搅动 、 、搅动)
一、吸附的分类
1. 物理吸附:靠分子间力产生的吸附,可吸附多 物理吸附:靠分子间力产生的吸附, 种吸附质,可形成多分子吸附层。吸附━ 种吸附质 , 可形成多分子吸附层 。 吸附 ━ 解吸是可逆 过程, 过程,在低温下就能吸附。 当系统的温度升高或被吸附气体的压力降低时,被 当系统的温度升高或被吸附气体的压力降低时 被 子吸附的气体将从固体表面逸出,而并不改变吸附剂 子吸附的气体将从固体表面逸出 而并不改变吸附剂 与 吸附质分子原来的性状.在低压下 在低压下,物理吸附一般是单分 吸附质分子原来的性状 在低压下 物理吸附一般是单分 子吸附;当吸附质的气压增大时 也会变成多分子层吸附. 当吸附质的气压增大时,也会变成多分子层吸附 子吸附 当吸附质的气压增大时 也会变成多分子层吸附 物理吸附的特征可归纳为: 物理吸附的特征可归纳为:
2)、分子之间相互吸附的作用力 、
也叫“凡德瓦引力”。 虽然分子运动 速度受温度和材质等原因的影响,但它 在微环境下始终是不停运动的。由于分 子之间拥有相互吸引的作用力,当一个 分子被活性炭内孔捕捉进入到活性炭内 孔隙中后,由于分子之间相互吸引的原 因,会导致更多的分子不断被吸引,直 到添满活性炭内孔隙为止。
