ⅵ 物质的标准摩尔生成焓、标准摩尔生成吉
标准摩尔焓变与标准摩尔生成焓的关系

标准摩尔焓变与标准摩尔生成焓的关系
标准摩尔焓变是指在常压常温下,物质在化学反应中释放或吸收的热量,表示为ΔH。
标准摩尔生成焓是指在标准状态下,一个摩尔化合物由其组成元素在标准状态下生成的过程中释放的热量,表示为ΔH^⁰_formation。
两者之间的关系可以通过以下公式表示:
ΔH = ∑(ΔH^⁰_formation产物 - ΔH^⁰_formation反应物)
也就是说,标准摩尔焓变可以通过反应物和产物的标准摩尔生成焓之差求得。
这是因为焓是一个状态函数,它只依赖于起始和终止的状态,所以在反应过程中,每个产生或消耗的化学键的生成焓之和等于反应的焓变。
标准摩尔焓变和标准摩尔生成焓

标准摩尔焓变和标准摩尔生成焓
标准摩尔焓变和标准摩尔生成焓是化学中常用的概念,它们用于描述化学反应的热力学特征。
标准摩尔焓变指在标准状态下,1摩尔物质从一种物态转化为另一种物态所伴随的焓变化。
标准状态是指温度为298K、压力为1 atm 的状态。
标准摩尔生成焓指在标准状态下,1摩尔化合物从其构成元素在标准状态下的状态转化为该化合物的生成反应所伴随的焓变化。
标准摩尔生成焓是化合物的稳定性指标,它越低表示该化合物越稳定。
标准摩尔焓变和标准摩尔生成焓都可以通过测量反应热进行实
验测定。
它们的值可以用于计算化学反应的热力学参数,例如反应焓、反应熵和反应自由能等。
需要注意的是,在实际化学反应中,反应物和产物的物态、温度和压力等条件可能与标准状态不同,因此需要进行修正计算。
- 1 -。
附录Ⅵ 物质的标准摩尔生成焓、标准摩尔生成吉
62.783
267.05
63.89
C3H6(g), 丙烷
-103.847
-23.391
270.02
73.51
C4H6(g), 1,3-丁二烯
110.16
150.74
278.85
79.54
C4H8(g), 1-丁烯
-0.13
71.60
305.71
85.65
C4H8(g), 顺-2-丁烯
-6.99
20.80
H2(g)
0
0
130.695
28.83
D2(g)
0
0
144.884
29.20
HBr(g)
-36.24
-53.22
198.60
29.12
HBr(aq)
-120.92
-102.80
80.71
HCl(g)
-92.311
-95.265
186.786
29.12
HCl(aq)
-167.44
-131.17
81.55
103.62
220.10
38.70
N2O4(g)
9.660
98.39
304.42
79.0
N2O5(g)
2ቤተ መጻሕፍቲ ባይዱ51
110.5
342.4
108.0
O(g)
247.521
230.095
161.063
21.93
O2(g)
0
0
205.138
29.37
O3(g)
142.3
163.45
237.7
38.15
-395.18
物质的标准摩尔生成焓

物质的标准摩尔生成焓物质的标准摩尔生成焓是指在标准状态下,1摩尔物质生成的焓变化量。
它是描述化学反应过程中物质生成或消耗热量的重要物理量,也是研究化学反应热力学性质的重要参数之一。
首先,我们来了解一下摩尔生成焓的概念。
摩尔生成焓是指在标准状态下,1摩尔物质生成时所吸收或释放的热量。
在化学反应中,物质的生成焓可以通过化学方程式中反应物和生成物的生成焓之差来计算。
生成焓为负值表示放热反应,反之为吸热反应。
摩尔生成焓的计算通常需要考虑反应物和生成物的物态、温度、压强等因素。
在标准状态下,摩尔生成焓的计算更为简单,因为标准状态下的物质状态已经确定,压强为1大气,温度为25摄氏度。
对于气体的标准摩尔生成焓,通常以气态的生成焓为基准。
例如,氧气的标准生成焓为0,氢气的标准生成焓也为0。
而对于液体和固体的标准摩尔生成焓,通常以元素的稳定形态为基准。
例如,钻石的标准生成焓为0,液态水的标准生成焓也为0。
在化学反应中,摩尔生成焓的大小可以反映出反应的放热或吸热程度。
放热反应的摩尔生成焓为负值,表示反应放出热量;吸热反应的摩尔生成焓为正值,表示反应吸收热量。
这对于工业生产和实验室研究都有重要意义。
在实际应用中,我们可以通过实验测定化学反应的放热或吸热量,从而计算出摩尔生成焓。
这对于确定化学反应的热力学性质、优化工艺条件等都具有重要意义。
总之,物质的标准摩尔生成焓是描述化学反应热力学性质的重要物理量,它可以反映出反应的放热或吸热程度,对于工业生产和实验室研究都具有重要意义。
通过实验测定和计算,我们可以准确地确定化学反应的热力学性质,为工程技术和科学研究提供重要参考。
希望本文对您了解物质的标准摩尔生成焓有所帮助,谢谢阅读!。
物质的标准摩尔生成焓

物质的标准摩尔生成焓在化学领域中,摩尔生成焓是一个重要的概念,它用来描述在标准状态下,1摩尔物质在生成过程中吸收或释放的热量。
摩尔生成焓是一个与化学反应相关的热力学量,它可以帮助我们理解化学反应的热力学性质,以及预测反应的热效应。
本文将对物质的标准摩尔生成焓进行详细的介绍和解释。
首先,我们需要了解什么是标准状态。
在化学中,标准状态是指物质的温度为298K(25摄氏度),压强为1个大气压时的状态。
在标准状态下,物质的摩尔生成焓通常用ΔH°表示。
ΔH°的正负值表示了反应是吸热还是放热的,正值表示吸热,负值表示放热。
摩尔生成焓可以通过实验测定得到,也可以通过热力学数据计算得到。
实验测定摩尔生成焓通常需要进行燃烧实验或者溶解实验,通过测定反应前后的温度变化和压强变化,再结合热容和热容量的数据,可以计算出摩尔生成焓的数值。
而通过热力学数据计算摩尔生成焓,则需要使用标准生成焓的数据,结合反应的化学方程式,利用热力学公式进行计算。
摩尔生成焓的数值对于化学反应的研究和应用具有重要意义。
它可以帮助我们预测反应的热效应,判断反应是放热还是吸热的,从而指导工业生产和化学实验的进行。
在工业生产中,了解反应的热效应可以帮助我们设计反应装置,控制反应条件,提高反应的效率和产率。
在化学实验中,摩尔生成焓的数值可以帮助我们理解反应的特性,指导实验的进行,以及解释实验现象。
除了对化学反应有着重要的意义之外,摩尔生成焓还可以帮助我们理解物质的热力学性质。
通过比较不同物质的摩尔生成焓,我们可以了解它们在化学反应中的活性和稳定性,从而为物质的应用提供参考。
同时,摩尔生成焓也可以帮助我们理解物质的结构和键合特性,揭示物质内部的微观过程和规律。
总之,物质的标准摩尔生成焓是一个重要的热力学量,它可以帮助我们理解化学反应的热力学性质,预测反应的热效应,指导工业生产和化学实验的进行,以及揭示物质的热力学性质和微观规律。
通过对摩尔生成焓的研究和应用,我们可以更好地认识和理解化学世界,为化学领域的发展和应用提供重要的支持和指导。
标准摩尔生成焓和反应的标准摩尔焓变

标准摩尔生成焓和反应的标准摩尔焓变标准摩尔生成焓和反应的标准摩尔焓变摩尔生成焓是化学反应中产生1摩尔物质所释放或吸收的热量。
标准状况下,摩尔生成焓又称为标准摩尔生成焓,表示在标准温度和压力下,1摩尔物质在其稳定态产生的热量变化。
而反应的标准摩尔焓变则表示化学反应1摩尔物质参与反应时的热量变化。
这两个概念在化学热力学中具有重要意义。
【主要概念】1. 标准摩尔生成焓:在标准状况下,1摩尔物质从其元素标准状态形成的热量变化。
2. 反应的标准摩尔焓变:在标准状况下,1摩尔反应物参与反应时的热量变化。
【深度探讨】1. 标准摩尔生成焓的计算方法标准摩尔生成焓可以通过实验测定得到,也可以通过化学反应焓的推导来计算。
标准状况下,摩尔生成焓的计算通常基于热力学性质和反应的热平衡条件。
对于气体物质,可以利用热力学数据手册中提供的标准生成焓值进行计算。
而对于固体或液体物质,则需要通过实验测定反应热量得出。
2. 反应的标准摩尔焓变的影响因素反应的标准摩尔焓变受到多种因素的影响,例如反应的类型、反应物的物态和温度等。
在化学反应中,放热反应的标准摩尔焓变为负值,表示反应放出热量;而吸热反应的标准摩尔焓变为正值,表示反应吸收热量。
3. 标准摩尔生成焓和反应的意义和应用标准摩尔生成焓和反应的标准摩尔焓变是研究化学反应热力学性质的重要工具,有着广泛的应用。
在工业生产和实验室研究中,常常需要通过这些参数来评价反应的热力学稳定性,优化反应条件,设计催化剂和控制反应过程。
【总结回顾】在化学反应中,标准摩尔生成焓和反应的标准摩尔焓变是化学热力学重要的概念。
通过对这两个概念的深入理解,我们可以更好地理解化学反应的热力学性质,提高生产和研究中反应条件的控制和设计能力。
在实际应用中,标准摩尔生成焓和反应的标准摩尔焓变也为化学工程带来了许多便利和创新。
【个人观点】对于化学热力学感兴趣的我来说,学习和掌握标准摩尔生成焓和反应的标准摩尔焓变是非常重要的。
附录Ⅵ物质的规范标准摩尔生成焓,规范标准摩尔生成吉
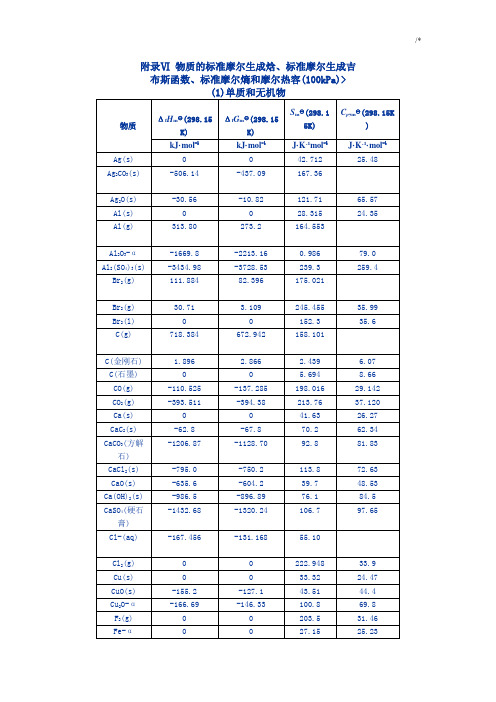
110.244
247.36
183.7
含 氧 化 合 物
HCOH(g), 甲醛
-115.90
-110.0
220.2
35.36
HCOOH(g), 甲酸
-362.63
-335.69
251.1
54.4
HCOOH(l), 甲酸
-409.20
-345.9
128.95
99.04
CH3OH(g), 甲醇
-381.5
293.4
72.4
C2H5OH(l), 乙醇
-277.63
-174.36
160.7
111.46
C2HOH(g), 乙醇
-235.31
-168.54
282.1
71.1
CH3COCH3(l),丙酮
-248.283
-155.33
200.0
124.73
CH3COCH3(g),丙酮
-216.69
-152.2
82.29
H2S(g)
-20.146
-33.040
205.75
33.97
H2SO4(l)
-811.35
(-866.4)
156.85
137.57
H2SO4(aq)
-811.32
HSO4(aq)
-885.75
-752.99
126.86
l2(g)
0
0
116.7
55.97
I2(g)
62.242
19.34
260.60
-201.17
-161.83
237.8
49.4
CH3OH(l), 甲醇
物质的标准摩尔生成焓

物质的标准摩尔生成焓
标准摩尔生成焓是指在标准状态下,将1摩尔物质从其元素的稳定形态生成所需的焓变化。
标准状态指的是25℃(298K)
和1个大气压下。
由于不同物质的生成焓与反应过程有关,因此标准摩尔生成焓的值也因物质而异。
在化学反应中,物质的生成或分解通常与能量变化有关,根据热力学第一定律,焓变化可以表示为反应物的焓减少与产物的焓增加的和。
标准摩尔生成焓可以通过实验测量或计算方法来确定。
例如,对于氧气(O2)的生成焓,可以通过以下反应来计算:1/2 O2(g) → O(g) ΔH° = ΔHf°(O(g))
在该反应中,氧气分解为氧原子,生成焓即为氧原子的标准摩尔生成焓。
该值通常通过实验测量得出,并被定义为0。
因此,氧气的标准摩尔生成焓为0。
对于其他物质的生成焓,可以通过类似的方法进行测量或计算,以确定其标准摩尔生成焓的值。
这些值对于理解和预测化学反应的能量变化非常重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C4H8(g), 2-甲基两烯
C4H10(g), 正丁烷
C4H10(g), 异丁烷
C6H6(g), 苯
C6H6(l), 苯
C6H12(g), 环己烷
C6H14(g), 正己烷
C6H14(l), 正己烷
C6H5CH3(g),甲苯
C6H5CH3(l),甲苯
C6H4(CH2)(g) 邻二甲苯
F2(g)
0
0
Fe-α
0
0
FeCO3(s)
FeO(s)
Fe2O3(s)
Fe3O4(s)
H(g)
H2(g)
0
0
D2(g)
0
0
HBr(g)
HBr(aq)
HCl(g)
HCl(aq)
H2CO3(aq)
Hl(g)
H2O(g)
H2O(l)
H2O(s)
)
)
H2O2(l)
H2S(g)
H2SO4(l)
)
H2SO4(aq)
C6H5NO2,(l)硝基苯
本附录数据主要取自Handbook of Chemistry and Physics, 70 th Ed., 1990; Editor John ,Lange's Handbook of Chemistry, 1967。
卤 代 烃
CH3Cl(g), 氯甲烷
CH2Cl2(g), 二氯甲烷
-88
-59
CHCl3(l), 氯仿
CHCl3(g), 氯仿
-100
-67
CCl4(l), 四氯化碳
CCl4(g), 甲氯化碳
C6H5Cl(l), 氯苯
含 氮 化 合 物
NH(CH3)2(g), 二甲胺
C5H5N(l), 吡啶
C6H5NH2(l), 苯胺
HSO4(aq)
l2(g)
0
0
I2(g)
N2(g)
0
0
NH3(g)
NO(g)
NO2(g)
N2O(g)
N2O4(g)
N2O5(g)
O(g)
O2(g)
0
0
O3(g)
OH-(aq)
S(单斜)
S(斜方)
0
0
(g)
S(g)
SO2(g)
SO3(g)
SO42-(aq)
(2)有机化合物
物质
ΔfHmy
ΔfGmy
Smy
Cp,my
kJ·mol-1
kJ·mol-1
J·K-1mol-1
J·K-1·mol-1
烃 类
CH4(g), 甲烷
C2H2(g), 乙炔
C2H4(g), 乙烯
C2H6(g), 乙烷
C3H6(g), 丙烯
C3H6(g), 丙烷
C4H6(g), 1,3-丁二烯
C4H8(g), 1-丁烯
C4H8(g), 顺-2-丁烯
C6H4(CH3)2(l), 邻二甲苯
C6H4(CH3)2(g), 间二甲苯
C6H(CH3)2(l), 间二甲苯
C6H4(CH3)2(g), 对二甲苯
C6H4(CH3)2(l), 对二甲苯
含 氧 化 合 物
HCOH(g), 甲醛
HCOOH(g), 甲酸
HCOOH(l), 甲酸
CH3OH(g), 甲醇
Al2(SO4)3(s)
Br2(g)
Br2(g)
Br2(l)
0
0
C(g)
C(金刚石)
C(石墨)
0
0
CO(g)
CO2(g)
Ca(s)
0
0
CaC2(s)
CaCO3(方解石)
CaCl2(s)
CaO(s)
Ca(OH)2(s)
CaSO4(硬石膏)
Cl-(aq)
Cl2(g)
0
0
Cu(s)
0
0
CuO(s)
Cu2O-α
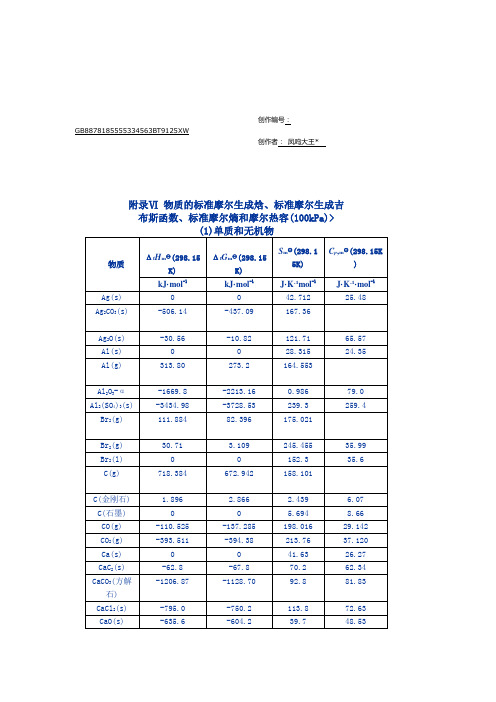
附录Ⅵ 物质的标准摩尔生成焓、标准摩尔生成吉
布斯函数、标准摩尔1)单质和无机物
物质
ΔfHm
ΔfGmy
Smy
Cp,my
kJ·mol-1
kJ·mol-1
J·K-1mol-1
J·K-1·mol-1
Ag(s)
0
0
Ag2CO3(s)
Ag2O(s)
Al(s)
0
0
Al(g)
Al2O3-α
CH3OH(l), 甲醇
CH2COH(g), 乙醛
CH3COOH(l), 乙酸
CH3COOH(g), 乙酸
C2H5OH(l), 乙醇
C2HOH(g), 乙醇
CH3COCH3(l),丙酮
CH3COCH3(g),丙酮
C2H5OC2H5(l),乙醚
CH3COOC2H5(l), 乙酸乙酯
259
C6H5COOH(s), 苯甲酸
