产品初始污染菌检测记录
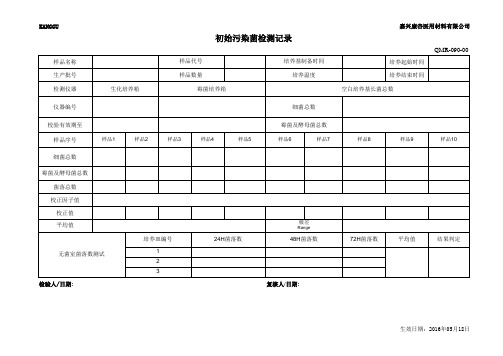
初始污染菌检测记录
样品7
样品8
样品9
样品10
细菌总数 霉菌及酵母菌总数
菌落总数 校正因子值
校正值 平均值
无菌室菌落数测试
检验人/日期:
培养皿编号
1 2 3
24H菌落数
极差
Range
48H菌落数
72H菌落数
平均值
结果判定
复核人/日期:
生效日期:2016年05月18日
KANGGU
样品名称 生产批号 检测仪器
生化培养箱
初始污染菌检测记录
样品代号 样品数量
霉菌培养箱
培养基制备时间 培养温度
嘉兴康谷医用材料有限公司
QMR-090-00 培养起始时间 培养结束时间 空白培养基长菌总数
仪器编号
细菌总数
校验有效期至 样品序号
样品1
ห้องสมุดไป่ตู้
样品2
样品3
样品4
样品5
霉菌及酵母菌总数
样品6
初始污染回收率及检测记录
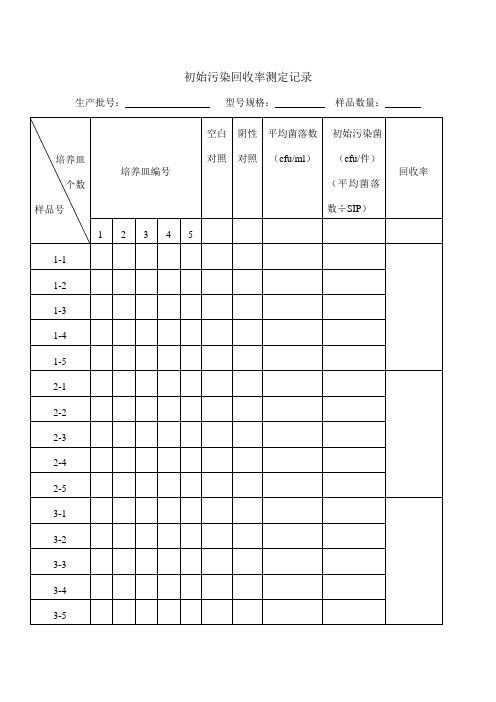
初始污染回收率测定记录生产批号:型号规格:样品数量:培养皿个数样品号培养皿编号空白对照阴性对照平均菌落数(cfu/ml)初始污染菌(cfu/件)(平均菌落数÷SIP)回收率1 2 3 4 51-1 1-2 1-3 1-4 1-5 2-1 2-2 2-3 2-4 2-5 3-1 3-2 3-3 3-4 3-54-14-24-34-44-55-15-25-35-45-5平均回收率修正系数初始污染菌检测原始记录生产批号:型号规格:样品数量:培养皿个数样品号培养皿编号阴性对照空白对照平均菌落数(cfu/SIP)初始污染菌(cfu/件)1 2 3 4 51 2 3 4 5 6 7 8 91011121314151617181920平均初始污染菌各样品平均菌落——————数总和÷样品数校正后初始污染菌————(平均初始污染菌*校正因子)注:1、在对照的平板中,“+”表示长菌,“-”表示不长菌,“±”表示可疑长菌2、阳性对照管应生长良好,阴性对照管不得有菌生长。
否则,试验无效。
初始污染检测记录文件编号:样品名称:生产批号:型号规格:样品数量:培养皿个数样品号空白对照阳性对照培养皿编号平均菌落数(cfu/SIP)初始污染菌(cfu/件)1 2 3 4 512345678910平均初始污染菌(cfu/件)校正后初始污染菌注:1、在对照的平板中,“+”表示长菌,“-”表示不长菌,“±”表示可疑长菌2、阳性对照管应生长良好,阴性对照管不得有菌生长。
否则,试验无效。
初始污染菌数检测

2
3
4
5
结论
细菌:
标准要求:
产品初始污染菌数:灭菌产品管道类内腔≤10cfu/件次;外部≤100 cfu/件次;非管道类≤100 cfu/件次;敷料类≤100 cfu/g
采样数量:各类产品每批随机抽取10件样品。
计算方法:菌数/件次=平均菌数×稀释倍数/件次
批准:检验:复核:
初始污染菌数检测
QSR-6003-08-2017 No.
样品名称
检测日期/批号
检测数量
报告日期
检测依据
GB15980-1995
培养基
普通琼脂培养基
内腔
外部
标准
≤10cfu/件次
标准
≤100cfu/件次
序号
平皿上菌数
菌数
结果
序号
平皿上菌数
菌数
结果
1#
2#
平均
1#
2#
平均
1
1
2
2
3
3
4
4
5
5
6
6
7
7
计算方法:菌数/件次=平均菌数×稀释倍数/件次
批准:检验:复核:
批准:检验:复核:
初始污染菌数检测
QSR-6003-08-2017 No.
样品名称
规格型号
进货批号
检验日期
检验依据
GB15980-1995
报告日期
培养基名称
营养琼脂培养基
培养
温度
30℃-35℃
稀释
倍数
1:10
1:100
1:1000
阴性
对照
碟号
1
2
接种量(ml)
初始污染菌校正因子的测定报告(模板)

初始污染菌校正因子确认报告1.概述公司制定的《初始污染菌检验规程》是用于描述产品中的活微生物群体。
但准确地确定初始污染菌是不可能的,因此,在实践中,采用校正因子将活菌计数转换成产品中初始污染菌评估,此因子用于补偿洗脱效率。
2.检验依据ISO 11737.1-2006医疗器械的灭菌微生物方法第1部分:产品上微生物总数的测定方法进行测定。
中国药典2015版第四部 1105 非无菌产品微生物限度3.实验过程3.1 洗脱液的制备:分别选取三支新制备的样品,在净化工作台上,用无菌医用钳将每支样品剪碎,称重10g,放入事先灭菌的具塞三角瓶中,加入约(样品重量×10)ml的pH7.0 氯化钠-蛋白胨灭菌洗脱液,加塞,充分震荡,使样品得到充分的洗脱,然后将洗脱液转移到另一个无菌的具塞三角瓶中,立即盖好备用。
3.2 营养琼脂培养基的制备:将营养琼脂培养基按说明书要求进行配制,在121℃高压蒸气灭菌锅内灭菌15min,放入50℃左右的水浴中备用。
3.3 接种:在净化工作台上,用移液管吸取1ml上述制备的洗脱液注入经过灭菌的平皿内,将约15-20ml已融化的45℃左右的营养琼脂培养基倾注到平皿中,并立即旋摇平皿,使水样与培养基充分混匀。
同样方法每组洗脱液做10个平行试验,同时另用一个平皿只倾注1ml灭菌洗脱液于营养琼脂培养基内作为空白对照。
3.4 培养:待上述培养基冷却凝固后,翻转平皿,使低面朝上,置于36±1℃恒温箱中培养48±2h。
3.5 菌落计数:记录各平皿中的菌落数,取平均值,然后再乘以洗脱液总体积数(ml),即得到洗脱液中的全部菌落数。
重复3.1-3.5步,分别进行第二次、第三次、第四次、第五次洗脱,其中第五次洗脱为直接将四次洗脱后的产品接种于培养基内,将五次洗脱后所得的菌落数分别填入数据表1、表2。
4.校正因子的计算用第一次洗脱液得到的菌落数除以五次洗脱得到的总菌落数,得到第一次冲洗去除率,取三个样品的第一次冲洗去除率的平均值,平均值的倒数即为校正因子。
初始污染菌检测

生长量在[0.5,2]之间为合格
初始污染菌检测
①供试品+培养基(TSA和SDB) ②供试品+1ml含小于100cfu各菌液+适合菌生长的培养基 ③1ml含小于100cfu各菌液+适合菌生长的培养基
②-③ 0.5 ①
抑菌性可接受范围
初始污染菌检测
①去灭菌的样品5个,在每个产品表面均匀加入1ml的小于100cfu的 芽孢(ATCC 9372),自然风干。 ②对1中的产品进行浸润,把菌洗脱,薄膜过滤后平板培养,计数 ③取两个平皿,分别接种1中小于100cfu的芽孢(ATCC 9372)1ml, 培养计数。
②菌落平均数 回收率 ③菌落平均数
1 校正因子 回收率
初始污染菌检测
初始污染菌检测
初始污染菌检测
菌液梯度稀释
初始污染菌检测
菌落计数基本规则
⑤如各稀释级平均菌落数均无菌落生长或最低稀释级平均菌落数小 于1时,应报告菌数为<10个/g或ml。 ⑥如有3个稀释级平均菌落数均在30~300之间,则以后2级计算级 间比值报告。 ⑦菌落计数的报告,菌落数在10以内时,按实有数值报告。大于 100时,采用二位有效数字,在两位有效数值后面,应以四舍五入 法计算。在报告菌落数为“不可计”时,应表明样品的稀释度
初始污染菌检测
目前使用标准GB 15980(一次性使用医疗卫生标准)。本标规定了 一次性使用医疗用品灭菌、消毒前后的卫生标准。本标准对一次性 使用医疗用品(包括灭菌的和消毒的一次性使用医疗用品)生产、 装配,包括车间等生产过程和生产工人手提出卫生的质量控制。
初始污染菌检测
初始污染菌检测ห้องสมุดไป่ตู้
市售培养基 生长量 = 对照培养基
初始污染菌校验因子及初始污染菌检测记录

样品序号
菌落计数(cfu/皿)
样品平均菌落数
(cfu/皿)
取样克重(g)
单片/㎡
样品总克重(g)
细菌
霉菌及酵母菌
菌落总数
1
10
0
10
8
41.6
233.8
2
8
0
8
3
6
0
6
所有样品平均菌落数(cfu/件次)
233.8/41.6*8=44.9
校正后实际值
产品名称
心血管介入包
规格/型号
321C-ⅡB型
批号
1801092
包装日期
2018.01.09
检测日期
2018.01.10
抽样数量
3件
洗脱液体积ml
200ml
报告日期
2018.01.15
培养基
营养琼脂培养基
配制批号
20180105
培养温度
35℃
培养时间
3d
玫瑰红钠琼脂培养基
20180105
25℃
5d
检测依据
44.9*1.22=55
标准要求
≤100cfu/件次
结果判断
符合要求
检测人:李明宇 复核人:郑海云
校正后实际值
79.8*1.22=97
标准要求
≤100cfu/件次
结果判断
符合要求
检测人:李明宇 复核人:郑海云
产品初始污染菌检测记录
编号:(HY)-JL-8.2-45/A产品名称心血管介入包
规格/型号
321C-ⅡB型
批号
1801091
包装日期
医疗器械初始污染菌检验

起草人/日期 审核人/日期批准人/日期 分发部门 品质部1、目的检测产品灭菌前实际带菌(活的微生物群)的数目。
2、适用范围适用于本公司产品初始污染菌的检测。
3、职责由品管部负责执行实施。
4、检测程序4.1检验频次:车间生产的产品三个月做一次初始污染菌检验,至少抽取3个批次进行检测,对不同车间和材质的产品进行轮流循环抽样。
标准作业规程标准要求4.2取样方法4.3试验方法4.3.1配制洗脱液4.3.1.1称量4.3.1.2溶解4.3.1.3洗脱液分装用电子太平准确称取9gNaCl 。
用灭菌镊子于同一个批次三个大包装(三个以上员工的产品)中至少随机抽取90g 或抽取12个最小销售包装样品,1/3样品用于检测,1/3样品用于留样,另1/3样品(可就地封存)必要时用于复检。
装入无菌的塑料袋中,立即密封好(塑料袋上应标示产品的生产日期、定单编号、规格、生产车间、员工姓名、产品代号)并立即送检,送检中不得打开塑料袋,三分之一用于测试,三分之一用于留样,三分之一必要复试。
样品最小包装不应有破损,检验前不得开启。
将已称好9gNaCl 溶于1000ml 蒸馏水中,充分搅拌直至完全溶解。
4.3.1.4洗脱液灭菌4.3.2样品处理4.3.2.1样品制备4.3.2.2 样品混匀4.3.2.3吸取样液4.3.2.4平板倾注法称取9gNaCl溶于1000ml蒸馏水中,然后用锥形瓶分装,每瓶100ml(可以根据实验的需要分装不同体积的液体)。
在 100 级净化工作台条件下用无菌方法打开用于检测的至少3个包装,从每个包装中随机取样,准确称取l0g土1g样品.用灭菌剪刀和镊子把样品剪碎.样品剪碎后用灭菌镊子加入到100ml的洗脱溶液中,将装有样品的锥形瓶靠压在旋涡混合器上的施转垫上振荡(2800次/min)2min。
如被检样品是吸水量较高的材料而导致不能吸出足够样液时,洗脱液量可按每次50ml,递增,直至能吸出足够测试在无菌操作台中,待上述生理盐水样液自然沉降后取上清液,用灭菌移液管从锥形瓶中吸取1ml样品的洗脱液转移到无菌平皿。
产品初始污染菌数检验方法

文件编号
版号
A.0
产品初始污染菌数检验方法
页次
生效日期
2020/01/02
1.目的
制订产品初始污染菌数检验方法,对从事测试的工作人员进行培训指导,规范检验方法及操作。
2.适用范围:
本方法适用于一次性使用无菌医疗器械灭菌前染菌量的检测。
3.职责
质检部对本检验方法实施负责。
4.程序
4.1仪器
分析天平、干燥箱、净化工作台、压力蒸汽消毒器、电热恒温水浴锅、生化低温培养箱
6.5手提式压力蒸汽消毒器操作规程
6.6净化工作台操作规程
7.参考文件
7.1《一次性使用医疗用品卫生标准》GB 15979-2002
编制:
日期:
审核:
日期:
批准:
日期:
菌落总数≤100cfu/g。
4.6.2阴性对照试验平板有菌生长,供试品的检验无效。
5.相关记录及保存:
5.1产品初始污染菌数检验记录QP27-QR-17
5.2质检部保管5年。
6.相关操作规程
6.1电子分析天平操作规程
6.2电热鼓风干燥箱操作规程
6.3电热恒温水浴锅操作规程
6.4生化低温培养箱操作规程
4.5.4.2结果报告
菌落呈片状生长的平板不宜采用;计数符合要求的平板上的菌落,按式(B1)计算结果:
式中:X1――细菌菌落总数,cfu/g或cfu/mL;
A――5块营养琼脂培养基平板上的细菌菌落总数;
K――稀释度。
当菌落数在100以内,按实有数报告,大于100时采用二位有效数字。
如果样品菌落总≥20数进行复检和结果报告。
有限公司
文件编号
版号
A.0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
培养皿号
1#
2#
3#
洁净台 菌落数
48h 菌落 数
平均菌落
数
检验结果
培养基名称
营养琼脂培养基
培养温度
37℃48h
细 菌
平 皿
1:10
平
数 号 1#
2#
行样
Ⅰ
1:100
1#
2#
空白对照
Ⅱ
Ⅲ
Ⅳ
Ⅴ
菌落均值
菌落总数(cfu/件)
检验结论
检定标准:菌落计数的报告,菌落数在 100 以内时,按实有数值报告。 在报告菌落数为“不可记”时,应表明样品的稀释度。参考标准:菌
2.取营养琼脂培养基个加 ml0.9%无菌氯化钠溶液做空白对照(阴性对照)。
3.转动平皿,使供试液与培养基充分混匀。将已经凝固的平板倒置于 37℃培养箱 中,一般培养 48±2h。
计算平板上的菌落数。
培养基预培养:营养琼脂培养基:月日时至月日时(16-18h)
紫外线消毒时间:实验前:时分至时分(0.5h)实验后:时分至时分(0.5h)
产
品
初
始
污
染
菌
检
测
记
录
试样名称
生产批号
ISM-QR-0075-A/0 规格型号
抽样数量
检验依据
检验日期
供试液制备:取待测试产品,根据产品物性的大小,分别采用直接浸入法或棉拭子擦洗法或 冲洗法收集洗脱液,制取 1:10 供试液。保温于 45℃水浴中 5~10min,不时振摇。
试验操作:1.取营养琼脂培养基个,分别接各种供试品各 ml。
落总数≤10cfu/件
检定结果:
备注
