高考化学复习金属氧化物知识点
2024届高考一轮复习化学课件(人教版):金属及其化合物-铁及其氧化物和氢氧化物

2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是_①__②__④___(填序号)。
①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢 气的保护中; ④中液面加苯阻止了空气进入; ③由于带入空气中的氧气,能迅速将 Fe(OH)2氧化,因而不能较长时间看到白色 沉淀。
返回
<
>
铁的氢氧化物
必备知识
1.氢氧化铁和氢氧化亚铁的比较
化学式 色、态 与盐酸反应
Fe(OH)2 白 色固体 _F__e(_O__H_)_2+__2_H__+_=_=_=_F_e_2_+_+__2_H__2O__
受热分解
Fe(OH)3 红褐 色固体 _F_e_(_O_H__)3_+__3_H_+__=_=_=_F_e_3_+_+__3_H_2_O__
回答下列问题: (1)仪器a的名称是__恒__压__滴__液__漏__斗__,B中长 玻璃管的作用是_平__衡__气__压__,__辅__助__排__出__装___ _置__B_中__的__空__气___。 (2)装置A中金属离子的检验方法是_取__少___ _量__装__置__A_烧__瓶__中__的__液__体__于__洁__净__试__管__中__,__滴__加__几__滴__K__S_C_N__溶__液__,__无__红__色__出__现__,__再__滴__加__ _H_2_O__2,__溶__液__变__为__红__色__,__则__证__明__存__在__F_e_2_+__。 (3)步骤Ⅲ 装置B中的现象是__白__色__沉__淀__逐__渐__变__为__灰__绿__色__,__最__后__变__为__红__褐__色__,其发生 反应的化学方程式为_4_F_e_(_O_H__)2_+__O__2+__2_H__2O__=_=_=_4_F_e_(_O_H__)3_。
新高考化学第二轮专题复习四常见金属及其化合物教师版

常见金属元素(如Na 、Mg 、Al 、Fe 、Cu 等)和非金属元素(如Cl 、N 、S 、Si )。
(1)了解常见金属的活动顺序。
(2)了解常见元素及其重要化合物的主要性质及其应用。
(3)了解合金的概念及其重要应用。
(4)以上各部分知识的综合应用。
Ⅰ.客观题(1)考查元素及其化合物的重要性质和应用。
(2)以元素及其化合物为载体考查离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等。
Ⅰ.主观题(1)以“铁三角”“铝三角”的转化关系为载体,考查分析图像能力和计算能力。
(2)以化工流程的形式,考查金属矿物的冶炼和工业废液的提纯。
一、常见金属及化合物的主要性质1.钠及其化合物(1)等物质的量的金属钠被氧化成Na 2O 和Na 2O 2时转移的电子数相同。
(2)钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
(3)向Na 2CO 3溶液中逐滴滴入盐酸,反应是分步进行的。
反应的离子方程式依次为:CO 2-3+H +===HCO -3、HCO -3+H +===H 2O+CO 2↑。
2.镁、铝及其化合物(1)镁在空气中燃烧主要发生反应:2Mg+O 2=====点燃22MgO ,此外还发生反应:3Mg+N 2=====点燃2Mg 3N 2、2Mg+CO 2====△2MgO+C 。
(2)铝与NaOH 溶液、非氧化性强酸反应生成H 2。
常温下,浓硝酸、浓硫酸使铝发生钝化。
命题趋势考点清单专题 四 ××常见金属及其化合物(3)Al2O3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中不溶)。
(4)Al3+、AlO-2只能分别存在于酸性、碱性溶液中。
Al3+与下列离子不能大量共存:OH-、CO2-3、HCO-3、SO2-3、S2-、ClO-、AlO-2,其中OH-是因为直接反应,其余均是因为发生了剧烈的双水解反应。
AlO-2与下列离子不能大量共存:H+、HCO-3、Al3+、Fe2+、Fe3+,其中H+和HCO-3是因为与AlO-2直接反应(AlO-2+HCO-3 +H2O===Al(OH)3↓+CO2-3),其余也是因为发生了剧烈的双水解反应。
高考化学专题复习之氧化还原反应知识点总结
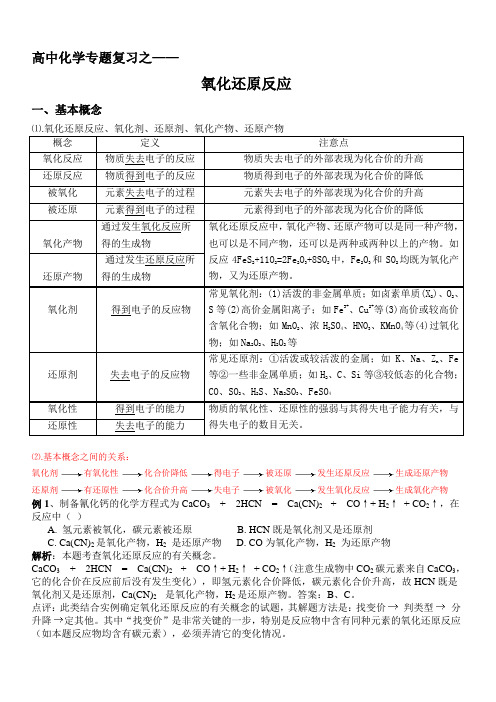
高中化学专题复习之——氧化还原反应一、基本概念⑴.氧化还原反应、氧化剂、还原剂、氧化产物、还原产物概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力⑵.基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中()A. 氢元素被氧化,碳元素被还原B. HCN既是氧化剂又是还原剂C. Ca(CN)2是氧化产物,H2是还原产物D. CO为氧化产物,H2为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。
《几种重要的金属化合物》

• 金属氧化物 • 金属氢氧化物 • 金属盐 • 金属碳化物 • 金属氮化物
01
金属氧化物
定义与性质
定义
金属氧化物是由金属元素和氧元素通 过共价键结合形成的化合物。
性质
金属氧化物通常是固体,具有不同的 颜色和熔点。它们通常是电的绝缘体 或半导体,但在某些条件下可以导电。
部分金属氮化物具有特殊的光学性能,可用于制造高精度光学仪器 和激光器。
耐磨材料
部分金属氮化物具有较高的硬度和耐磨性,可用于制造耐磨耐高温 的机械零件。
THANKS
感谢观看
常见的金属氧化物
氧化铁(Fe2O3)
氧化镁(MgO)
通常称为铁锈,是铁的氧化物,呈红 棕色。
白色粉末,是镁的氧化物,广泛用于 耐火材料和建筑材料。
氧化锌(ZnO)
白色粉末,是锌的氧化物,常用于制 造涂料和防晒霜。
金属氧化物的应用
颜料与涂料
陶瓷与玻璃
一些金属氧化物具有特殊的颜色和稳定性 ,可用于制造颜料和涂料。
金属氢氧化物的应用
化工原料
金属氢氧化物是许多化学 反应的重要原料,如合成 有机物、无机物等。
污水处理
金属氢氧化物可用于中和 酸性废水,处理重金属离 子等污染物。
制药行业
在制药行业中,金属氢氧 化物可用于合成药物中间 体和原料药。
03
金属溶解性
颜色
酸碱性
金属盐是由金属阳离子 和酸根阴离子构成的化 合物。
金属盐具有与相应金属 氧化物或氢氧化物性质 相似,如溶解性、颜色 、酸碱性等。
金属盐的溶解性取决于 金属的活跃度和酸根的 溶解性。一般来说,钾 、钠、铵盐等易溶于水 ,而钙、镁、钡等碱土 金属盐的溶解度则相对 较低。
化学高二金属的性质及其应用知识点

化学高二金属的性质及其应用知识点
1、Al易拉罐的主要成分
(1)与氧气常温下生成氧化膜抗腐蚀能力
(2)与CuSO4反应2Al+3CuSO4==Al2(SO4)3+3Cu
(3)与碱反应2Al+2NaOH+2H2O==NaAlO2+3H2↑
(4)常温下与浓硫酸或浓硝酸钝化
二、合金
1、定义:将两种或多种金属(或金属与非金属)熔合而成的具有金属活性的物质
2、具有较好的物理化学性能
纯铝和纯铁质地软,强度小无法制造承载负荷的结构零件
三、金属腐蚀
1、化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的腐蚀
2、电化学腐蚀:不纯的金属或合金与电解质溶液接触,会发生原电池反应,比较活泼的金属失电子被氧化的腐蚀
3、Fe-2e-→Fe2+→Fe(OH)2→Fe(OH)3→Fe2O3?XH2O
4、金属防护的几种重要方法
①在金属表面覆盖保护层。
(烤蓝、油漆等)
②改变金属内部的组织结构,制成合金。
(不锈钢)
③电化学保护法,即将金属作为原电池的正极或与电源负极相连。
金属氧化物分类

金属氧化物分类
金属氧化物,即由金属元素与氧元素结合形成的化合物,是化学领域中的一个重要类别。
它们广泛存在于自然界,也可以通过人工合成得到。
金属氧化物的性质多样,根据金属元素的性质,金属氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、过氧化物、超氧化物、臭氧化物等。
酸性氧化物是指那些与水反应只生成相应金属的酸,或与碱反应只生成盐和水的金属氧化物。
例如,三氧化硫(SO₃)就是一种酸性氧化物,它与水反应生成硫酸。
碱性氧化物则是指那些与水反应只生成相应金属的碱,或与酸反应只生成盐和水的金属氧化物。
例如,氧化钠(Na₂O)就是一种碱性氧化物,它与水反应生成氢氧化钠。
两性氧化物是指既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
例如,氧化铝(Al₂O₃)就是一种两性氧化物,它既可以与酸反应,也可以与碱反应。
此外,还有过氧化物、超氧化物和臭氧化物等特殊的金属氧化物。
过氧化物是指含有过氧基(-O-O-)的化合物,如过氧化钠(Na₂O₂)。
超氧化物含有超氧基(-O-O-O-),而臭氧化物则含有臭氧基。
金属氧化物的分类不仅有助于我们理解它们的化学性质,还有助于我们在实际生产和科学研究中合理利用这些化合物。
例如,碱性氧化物常用于制备金属盐,酸性氧化物可用于制备酸,而两性氧化物则在一些特殊的化学反应中发挥着重要作用。
(人教版)2020高考总复习 化学: 过氧化物(H2O2、金属过氧化物)与O3的性质和用途

素养说明:化学核心素养要求考生能从物质结构与性质,物质性质与应用的关系,分析物质性质,合理利用物质。
H 2O 2与O 3作为绿色氧化剂和消毒剂,在日常生活中发挥着巨大的作用。
1.氧气的同素异形体臭氧(O 3)(1)化学性质①不稳定性:2O 3=====一定条件3O 2②强氧化性:Ag 、Hg 等金属在臭氧中可以被氧化,O 3能使湿润的淀粉-KI 试纸变蓝,其反应的化学方程式如下:O 3+2KI +H 2O===I 2+2KOH +O 2③漂白和消毒:许多染料受到臭氧的强烈氧化会褪色,臭氧还能杀死许多细菌。
(2)生产方式:3O 2=====放电2O 3(3)臭氧层:能吸收来自太阳的大部分紫外线,是人类和其他生物的保护伞。
氟氯烃是破坏臭氧层的“元凶”。
(4)臭氧的用途:脱色剂、消毒剂等。
2.过氧化物(1)过氧化氢①结构化学式:H 2O 2电子式:结构式:H —O —O —H ,H 、O 原子个数比为1∶1,H 2O 2是既含极性键,又含非极性键的共价化合物。
②化学性质Ⅰ.不稳定性:2H 2O 2=====MnO 22H 2O +O 2↑。
Ⅱ.还原性:遇强氧化剂时,显还原性,如:2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O。
Ⅲ.氧化性:遇较强还原剂时,显氧化性,如H2O2+2HI===I2+2H2O。
(2)金属过氧化物①金属过氧化物都是强氧化剂,过氧化钠、过氧化钾可以和水反应,生成相应的氢氧化物和氧气,另外还存在带结晶水的金属过氧化物。
如:过氧化钡、过氧化钙。
②过氧化物和稀酸反应生成过氧化氢。
BaO2+H2SO4===H2O2+BaSO4。
过氧化钠与空气中的二氧化碳作用放出氧气:2Na2O2+2CO2===2Na2CO3+O2。
[题型专练]1.(2019·郑州一中高三月考)臭氧(O3)可应用于游泳池、生活用水、污水的杀菌和消毒,大气中的臭氧层能有效阻挡紫外线。
高考化学一轮复习第章金属及其重要化合物第讲铁及其重要化合物课件新人教版

1.判断正误(正确的打“√”,错误的打“×”)。 (1)(2020·高考江苏卷)室温下,Fe 与浓 H2SO4 反应生成 FeSO4。( × ) (2)铁元素位于元素周期表中第四周期ⅧB 族。( × ) (3)铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在。( × ) (4)在给定条件下,Fe―点C―燃l2→FeCl2Na―O―H→(aq)Fe(OH)2 所表示的物质间转化能 实现。( × )
演练一 铁及其氧化物的性质与计算 1.铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是 () A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏、贮运浓硫酸 B.铁是较活泼的金属,它与卤素单质(X2)反应的生成物均为 FeX3
√C.Fe(OH)2 易被氧化成 Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
稳定
与 H+反应 F__e_O_+__2_H__+_=_=_=__ _F_e_2_O_3_+__6_H_+__=_=_=_ Fe3O4+8H+===Fe2+ 的离子方程式 F__e_2+__+__H_2_O_____ _2_F_e_3_+_+__3_H__2O____ +2Fe3++4H2O
四、铁的氢氧化物
(2)与水反应 常温下铁与水不反应,高温下与水蒸气反应:_3_F_e_+__4_H_2_O_(_g_)_=_高=_=_温=_=_F_e_3_O__4+__4_H。2
(3)与酸反应 ①与非氧化性酸反应(离子方程式):__F_e_+__2_H__+_=_=_=_F_e_2_+_+__H__2↑____。 ②与氧化性酸反应:遇冷的浓硫酸或浓硝酸发生_钝__化___,属于_化__学___变化; 与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应,但无 H2 产生。 a.Fe 与过量稀硝酸反应(离子方程式): ____F_e_+__N_O__- 3_+__4_H__+_=_=_=_F_e_3_+_+__N_O__↑__+__2_H_2_O_____________; b.Fe 与少量稀硝酸反应(离子方程式): ____3_F_e_+__8_H__+_+__2_N_O__- 3 _=_=_=_3_F_e_2_+_+__2_N_O__↑__+__4_H_2_O________。
