《元素周期表》
九年级上册初中化学《元素周期表》_1

《元素周期表》(第一课时)一、教材分析《元素周期表》是高一化学必修2第一节内容,所有的化学知识都会用到元素周期表,是化学学科的基石。
本章以元素周期表和元素周期律为框架,首先介绍元素周期表,再通过一些事实和实验归纳元素周期律。
本节从化学史引入,直接表现元素周期表的结构。
在学生了解一些元素性质和原子结构示意图的基础上,以元素周期表的纵向结构为线索,以碱金属和卤素元素为代表,通过比较原子结构(电子层数,最外层电子数)的异同,突出最外层电子数的相同;并通过实验和事实来表现主族族元素性质的相似性和递变性。
协助学生理解元素性质与原子核外电子数的关系。
本节内容要达到“能结合相关数据和实验事实理解元素周期律,了解原子结构与元素性质的关系;能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律”。
本课是时内容要求达到“能结合相关数据和实验事实理解元素周期律,初步了解原子结构与元素性的关系;能描述元素周期表的结构”。
一、学情分析学生在初三对1-20号元素的原子结构和元素周期表都有初步了解,但在学习中较多是用机械记忆的方法,对知识的理解不够深刻,易遗忘,解决实际问题的水平较低。
这个节课是新学期的第一堂化学课,同时这部分内容又比较枯燥,如何激发学生的学习兴趣,如何引导学生从方法的高度来重新审视这个内容应成为教学设计的关键。
三、教学目标1、知识与技能使学生初步掌握元素周期表的结构,以及周期、族等概念。
2、过程与方法(1)通过学生亲自动手编排元素周期表培养学生的抽象思维水平和逻辑思维水平;(2)通过抢答对身边元素有所了解和重视,分组画曲线培养理性思维水平;(3)观察元素原子结构,揭示元素周期律,培养学生的分析和推理水平。
3、情感、态度与价值观(1)通过对元素周期表的编排和理解,渗透使用辩证唯物主义观点分析现象和本质的关系,并且使学生理解化学美。
(2)通过学生亲自编排元素周期表培养学生的求实、严谨和创新的优良品质;提升学生的学习兴趣。
高一化学《元素周期表》
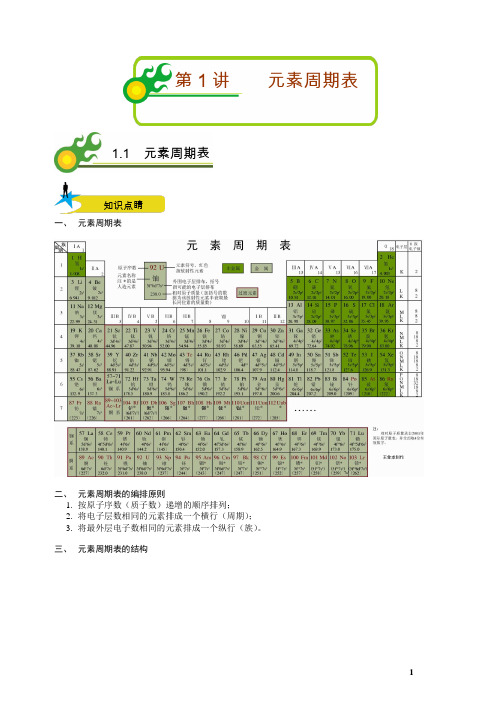
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。
《元素周期表》(核素)

PPT学习交流
5
3.原子的表示方法 质量数
质子数 即AZX 代表一个___质__量__数_______为 A、_____质__子__数_______为 Z 的 X 原子。 例如:2113Na 表示质量数为____2_3_____、质子数为___11________ 的一种钠原子。
PPT学习交流
6
自我测评
PPT学习交流
15
2.已知 R2+核外有 a 个电子,b 个中子,表示 R 原子符号正确
的是( C ) A.baR C.a+a+b+22R
B.a+a-b-22R D.aa+-b2R
解析:阳离子中:质子数=电子数+电荷数,则R的质子
数=a+2,质量数=a+2+b。
PPT学A,含 N 个中子,它与 1H 原子构 成 HmX 分子。在 a g HmX 中所含质子的物质的量是( A ) A.A+a m(A-N+m)mol B.Aa (A-N)mol C.A+a m(A-N)mol D.Aa (A-N+m)mol
PPT学习交流
3
构成原子的粒子及其性质
构成原子的粒 子
电性和电量
质量/Kg
电子
1个电子带1个 单位负电荷 9.109ͯ10-31
质子
1个质子带1个 单位正电荷 1.673ͯ10-27
中子 不显电性 1.675ͯ10-27
相对质量
1/1836(电子 与质子质量之
比)
1.007
1.008
问 从表格中的数据得出原子的质量主要取决于哪种粒子?
PPT学习交流
12
[典例剖析]
(2015·山东泰安高一检测)15331I 是常规核裂变产物之一, 可以通过测定大气或水中15331I 的含量变化来检测核电站是否发
中职化学《元素周期表和元素周期律》课件

同主族(从上到下) 依__次__递__增__ _依__次__增__加_
相__同__(He除外)
1.抓住重点
原子半径
_逐__渐__减__小_
逐__渐__增__大__
主要化合价
最高正价由+__1_到+__7_ 价 (O、F除外)
最低负价由-__4_到_-__1 价
一般相同
顺序从上到下排成一纵行,共有__1_8_纵行。
1.抓住重点
(2)周期
短周期
长周期
不完全周期
序号
123456
7
元素种数 2
0族元素原 子序数
2
8 8 18 18 32 最多容纳32种元
10 18 ห้องสมุดไป่ตู้6
54 86
素,目前排了26 种元素
(3)族
①主族:由__短__周__期_元素和_长__周__期_元素共同组成的族(第18列除外)
2.突破考点
考点1 元素金属性和非金属性的比较方法
1.金属性比较
本 质
原子越易失去电子,金属性就越强
(1)同周期从左到右金属性减弱;同主族从上到下金属性增
金 强。
属 性
判
(2)在金属活动性顺序表中越靠前,金属性越强
比 断 (3)单质与水或与非氧化性酸反应置换出氢气越剧烈,金属
较 依 性越强
据 (4)单质还原性越强或离子氧化性越弱,金属性越强
(5)元素周期表中的特殊位置 ①过渡元素:元素周期表中部从_Ⅲ__B__族到_Ⅱ__B_族10个纵列共 六十多种元素,这些元素都是金属元素。
②镧系:元素周期表第_6__周期中,57号元素镧到71号元素镥 共15种元素。
③锕系:元素周期表第__周期中,89号元素锕到103号元素铹 共15种元素。 ④超铀元素:在锕系元素中92号元素轴(U)以后的各种元素。
《元素周期表》(元素周期表的结构)

自我测评————(做一做)
2.思考: (1)最外层电子数是2的元素一定为ⅡA族的元素吗?
提示:不一定。可能是第ⅡA族元素,可能是稀有气体元素
He,也可能是过渡元素。 (2)元素周期表中同主族相邻两元素的原子序数相差多少? 提示:根据元素周期表可知,同主族相邻两元素的原子序数 相差2或8或18或32。
+
,则 X 元素在元素周期表中位 B.第四周期第ⅠA 族 D.第三周期第ⅦA 族
解析:X+带一个单位正电荷,故X 原子 的最外层 电子数 为1,X为19号元素钾,该元素原子的核外电子层数为4, 所以X元素位于第四周期第ⅠA族。
9.元素周期表是一座开放的元素大厦,元素大厦尚未客满。 请在元素大厦中为119号元素安排好它的房间( A ) A.第八周期第ⅠA族 B.第七周期第ⅦA族
(1)一个横行即是一个周期,一个纵行即是一个族。( × )
分析:元素周期表有7个横行,即7个周期;有18个纵行,但 有16个族,第Ⅷ族占据三个纵行。 (2)对于原子或离子都有以下关系式:原子序数=核电荷数= 核外电子数。( × )
分析:对于原子,该关系式成立,但对于离子,核电荷数不
等于其核外电子数。
把电子层数目相同的元素,按原子序数递增的顺序从左 到右排成横行,再把不同横行中最外层电子数相同的元素, 按电子层数递增的顺序由上而下排成纵行。
周期
把电子 层数相 同的元 素,按 原子序 数递增 的顺序 从左到 右排成 的横行
周期 序数 1 2 3 4 5 6 7
元素 种类数 2 8 短周期(3个) 8 18 18 32
Ⅷ
ⅠB ⅡB
阅读教材第四、五页,思考并填空:
二、现行元素周期表
1.原子序数
元素周期表 中的顺序给元素的编号。 (1)含义:按照元素在___________ (2)原子序数与原子结构的关系 质子数 核外电子数 核电荷数 =___________ 原子序数=__________ =
《元素周期表》PPT课件

63 95
64 96
65 97
元素周期表的整体结构
短周期(3个):第1.2.3 周期 周期 (7个) 元素周期表 主族(7个)ⅠA ~ ⅦA 族 副族(7个)ⅠB ~ ⅦB 过 渡 元 素
长周期(3个):第4.5.6周期
不完全周期(1个):第7 周期
(16个) Ⅷ族 第8 9 10 三个纵列 零族 稀有气体元素
练习:
1、已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
电子层数 最外层电子数
决定 决定
周期序数 主族序数
4、下列各表为周期表的一部分(表 中为原子序数),其中正确的是( D ) (A)
2 3 11 19 4
(B)
2 10 11 18 19
(C)
6 11 12 13 24
(D)
2)卤素单质与碱反应
X2+ 2NaOH = NaX+ NaXO+H2O
元素非金属性强弱判断依据:
1、单质与氢气生成气态氢化物的难易程度,化 合越容易,非金属性越强 2 形成气态氢化物的稳定性,气态氢化物越稳定,非 金属越强。 3、最高价氧化物的水化物的酸性强弱,酸性越强, 非金属性越强
4 非金属性强的元素可以把非金属性弱的元素从其盐 溶液中置换出来
长周期(3个):第4.5.6周期
不完全周期(1个):第7 周期
类别
周期序 数 1 2 3 4
起止元 素 H—He Li—Ne Na—Ar K—Kr Rb—Xe
包括元素 种数 2 8 8 18 18
核外电子 层数 1 2 3 4 5
短周期
长周期
5
6
不完全 周期 7
Cs—Rn
人教版化学必修二《元素周期表》授课教学课件

族
共 7 个副族,只包括在长周期中
(16个) 副族 表示方法:在族序数后面标一“B”字
如ⅠB ⅡB ⅢB ……ⅦB
第3、4、5、6、7、11、12纵列
第VIII族 包括第8、9、10 纵列
0族
稀有气体元素
人教版化学必修二《元素周期表》授 课课件
人教版化学必修二《元素周期表》授 课课件
元素周期表
名词解释 ①过渡元素: 副族,Ⅷ族 ②放射性元素: 84号之后 (也包括43、
元素周期表
元素周期表的结构
问题三:元素周期表共有几个周期?其 中有几个周期元素种类较少?
七个
第一周期最少,只有2种元素 二、三周期也较少,各有8种元素
短周期:前三个周期 长周期:后四个周期
元素周期表
元素周期表的结构
第一周期 短周期 第二周期
周期
(7个) 长周期
第三周期 第四周期
第五周期 第六周期 第七周期
7 副族:_______个 1 第Ⅷ族:_______个
0______族:1个
(稀有气体)
人教版化学必修二《元素周期表》授 课课件
人教版化学必修二《元素周期表》授 课课件
随堂检测
2.19世纪中叶,门捷列夫的突出贡献 是(B) A.提出了原子学说 B.发现了元素周
期律 C.提出了分子学说 D.制定了科学完
周期
主族
副族
第八族
零族
人教版化学必修二《元素周期表》授 课课件
人教版化学必修二《元素周期表》授 课课件
元素周期表
元素周期表的结构
主族序数=最外层电子数
共 7 个主族,包括短周期和长周期元素
主族 表示方法:在族序数后面标一“A”字
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(247)
97Bk
锫*péi
(247)
98Cf
锎*kāi
(251)
99Es
锿*āi
(252)
100Fm
镄*fèi
(257)
101Md
钔*mén
(258)
102No
锘*nuò
(259)
103Lr
铹*láo
(260)
注:
1.原子量录自1999年国际原子量表,以12C=12为基准。原子量的末位数的准确度加注在其后括弧内。
族
周期
I A
元素周期表
0
电子层
0族电子数
1
1 H
氢qīnɡ
1.00794(7)
2 He
氦hài
4.002602(2)
K
2
II A
III A
IV A
V A
VI A
VII A
2
3 Li
锂lǐ
6.941(2)
4 Be
铍pí
9.012182(3)
5 B
硼pénɡ
10.811(7)
6 C
碳tàn
12.0107(8)
108Hs
钅黑*hēi
(265)
109Mt
钅麦*mài
(268)
110Uun
*
(269)
111Uuu
*
(272)
112Uub
*
(277)
……
镧系
57 La
镧lán
138.9055(2)
58 Ce
铈shì
140.116(1)
59 Pr
镨pǔ
140.90765(2)
60 Nd
钕nǚ
144.24(3)
61Pm
76 Os
锇é
190.23(3)
77 Ir
铱yī
192.217(3)
78 Pt
铂bó
195.078(2)
79 Au
金jīn
196.96655(2)
80 Hg
汞ɡǒnɡ
200.59(2)
81 Tl
铊tā
204.3833(2)
82 Pb
铅qiān
207.2(1)
83 Bi
铋bì
208.98038(2)
84Po
7 N
氮dàn
14.00674
8 O
氧yǎnɡ
15.9994(3)
9 F
氟fú
18.9984032(5)
10 Ne
氖nǎi
20.1797(6)
L
K
8
2
3
11 Na
钠nà
22.989770(2)
12 Mg
镁měi
24.3050(6)
13 Al
铝lǚ
26.981538(2)
14 Si
硅ɡuī
28.0855(3)
102.90550(2)
46 Pd
钯bǎ
106.42(1)
47 Ag
银yín
107.8682(2)
48 Cd
镉ɡé
112.411(8)
49 In
铟yīn
114.818(3)
50 Sn
锡xī
118.710(7)
51 Sb
锑tī
121.760(1)
52 Te
碲dì
127.60(3)
53 I
碘diǎn
126.90447(3)
15 P
磷lín
30.973761(2)
16 S
硫liú
32.065(5)
17 Cl
氯lǜ
35.453(2)
18 Ar
氩yà
39.948(1)
M
L
K
8
8
2
III B
IV B
V B
VI B
VII B
VIII
I B
II B
4
19 K
钾jiǎ
39.0983(1)
20 Ca
钙ɡài
40.078(4)
21 Sc
2.括弧内数据是天然放射性元素较重要的同位素的质量数或人造元素半衰期最长的同位素的质量数。
钪kànɡ
44.955910(8)
22 Ti
钛tài
47.867(1)
23 V
钒fán
50.9415(1)
24 Cr
铬ɡè
51.9961(6)
25 Mn
锰měnɡ
54.938049(9)
26 Fe
铁tiě
55.845(2)
27 Co
钴ɡǔ
58.933200(9)
28 Ni
镍niè
58.6934(2)
29 Cu
铜tónɡ
63.546(3)
30 Zn
锌xīn
65.39(2)
31 Ga
镓jiā
69.723(1)
32 Ge
锗zhě
72.64(1)
33 As
砷shēn
74.92160(2)
34 Se
硒xī
78.96(3)
35 Br
溴xiù
79.904(1)
36 Kr
氪kè
83.80(1)
N
M
L
K
8
18
8
2
5
37 Rb
铷rú
85.4678(3)
38 Sr
锶sī
87.62(1)
39 Y
钇yǐ
88.90585(2)
40 Zr
锆gào
91.224(2)
41 Nb
铌ní
92.90638(2)
42 Mo
钼mù
95.94(1)
43 Tc
锝dé
(97.99)
44 Ru
钌liǎo
101.07(2)
45 Rh
铑lǎo
钷*pǒ
(147)
663 Eu
铕yǒu
151.964(1)
64 Gd
钆ɡá
157.25(3)
65 Tb
铽tè
158.92534(2)
66 Dy
镝dī
162.50(3)
67 Ho
钬huǒ
164.93032(2)
68 Er
铒ěr
167.259(3)
69 Tm
铥diū
168.93421(2)
钋pō
(209,210)
85At
砹ài
(210)
86Rn
氡dōnɡ
(222)
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫fānɡ
(223)
88Ra
镭léi
(226)
89—103
Ac–Lr
锕系
104Rf
钅卢*lú
(261)
105Db
钅杜*dù
(262)
106Sg
钅喜*xǐ
(263)
107Bh
钅波*bō
(264)
54 Xe
氙xiān
131.293(6)
O
N
M
L
K
8
18
18
8
2
6
55 Cs
铯sè
132.90545(2)
56 Ba
钡bèi
137.327(7)
57—71
La–Lu
镧系
72 Hf
铪hā
178.49(2)
73 Ta
钽tǎn
180.9479(1)
74 W
钨wū
183.84(1)
75 Re
铼lái
186.207(1)
70 Yb
镱yì
173.04(3)
71 Lu
镥lǔ
174.967(1)
锕系
89Ac
锕ā
(227)
90Th
钍tǔ
232.0381(1)
91Pa
镤pú
231.03588(2)
92U
铀yóu
238.02891(3)
93Np
镎ná
(237)
94Pu
钚bù
(239,244)
95Am
镅*méi
(243)
96Cm
