物质共存和除杂
物质的共存,检验与除杂
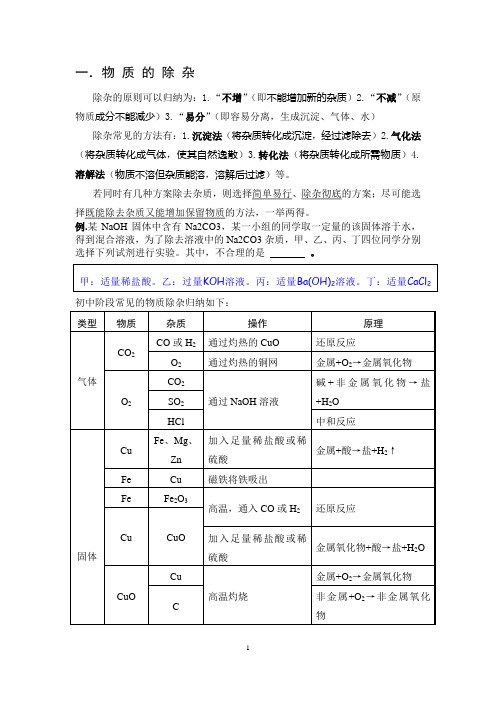
一.物质的除杂除杂的原则可以归纳为:1.“不增”(即不能增加新的杂质)2.“不减”(原物质成分不能减少)3.“易分”(即容易分离,生成沉淀、气体、水)除杂常见的方法有:1.沉淀法(将杂质转化成沉淀,经过滤除去)2.气化法(将杂质转化成气体,使其自然逸散)3.转化法(将杂质转化成所需物质)4.溶解法(物质不溶但杂质能溶,溶解后过滤)等。
若同时有几种方案除去杂质,则选择简单易行、除杂彻底的方案;尽可能选择既能除去杂质又能增加保留物质的方法,一举两得。
例.某NaOH固体中含有Na2CO3,某一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验。
其中,不合理的是。
甲:适量稀盐酸。
乙:过量KOH溶液。
丙:适量Ba(OH)2溶液。
丁:适量CaCl2初中阶段常见的物质除杂归纳如下:若对气体既要干燥又要除杂的话,先除杂,后干燥。
1.现有以下几项操作:①加适量盐酸②加适量水溶解③过滤④高温或加热灼烧⑤蒸发,请选择合适操作,以除去下列各物质中含有的少量杂质,并将其标号按操作的先后顺序填在横线上。
A.除去氯化钾晶体中的碳酸钾,应先再。
B.除去生石灰中的碳酸钙,应。
C.除去铜粉中的氧化铜,应先再。
D.除去碳酸钙中的碳酸钠,应先再。
2.要除去稀盐酸中混有少量硫酸,某同学设计了以下几种方法:请你评价下列方法(1)加锌粒(2)加烧碱(3)加硝酸钡(4)加氯化钡方案对或错原因1、Zn2、NaOH3、Ba(NO3)24、BaCl23.快速判断下列除杂方法是否正确?请判断:1、NaCl ( Na2CO3) 用稀硫酸2、CO2(CO)用石灰水3、Na2SO4 (CuSO4)用Ba(OH)2溶液4、NaOH (Na2CO3) 用稀盐酸(HCl )5、Cu (Fe) 用稀盐酸HCl6、CaO (CaCO3) 用稀盐酸HCl5.在横线上填写所选的试剂1、HNO3 ( HCl)2、NaOH ( Ca(OH) 2)3、NaNO3 (Na2SO4)4、Cu (CuO)5、KNO3 (CuSO4) 5、NaCl (CaCO3)固体6、KNO3 (NaCl) 分离方法:7、NaCl (KNO3)分离方法:跟踪练习1、NaCl溶液中溶有少量Na2CO3,下列物质中可用来除去Na2CO3的是()A、锌粉B、Ca(OH)2溶液C、盐酸D、硫酸2、下列除杂质的方法中,正确的是()A、用NaOH溶液除去CO2气体中混有的HClB、用Ba(NO3)2溶液除去NaCl溶液中混有的MgSO4C、用稀H2SO4除去CuO粉末中混有的Cu(OH)2D、用浓H2SO4除去H2中混有的水蒸气4、下列括号中的物质是除去杂质所用的药品,其中错误的是()A、氧化钙中含有杂质碳酸钙(盐酸)B、二氧化碳中含有少量的一氧化碳(灼热的氧化铜)C、氯化钠溶液中含有少量的氯化铁(苛性钠溶液)D、硫酸亚铁溶液中含有少量的硫酸铜(铁粉)5、下列括号中的物质是除去杂质所用的药品,其中错误的是()A、铜粉中含有少量铁粉(硫酸铜溶液)B、生石灰中少量的碳酸钙(硫酸)C、氧气中的二氧化碳(氢氧化钠溶液)D、稀硝酸中的少量硫酸(硝酸钡溶液)6、下列措施能达到目的的是()A、用氢氧化钠溶液除去二氧化碳气体中混有的HCl气体B、用点燃的方法除去二氧化碳气体中混有的一氧化碳C、用稀盐酸除去热水瓶中的水垢(主要成分是碳酸钙和氢氧化镁)D、用氯化钡溶液除去硝酸钾中混有的少量硫酸钾7、除去N2中混有的少量H2、CO2、水蒸气时,采用的正确的操作顺序是()①通过浓硫酸②通过灼热CuO ③通过NaOH溶液④通过浓盐酸A、③②①B、①②③C、②③④D、④①③8、除去下列各组物质中的杂质时,按如下步骤进行操作:①加入过量稀硫酸;②加入适量的氢氧化钾溶液;③蒸发、结晶,能达到实验目的的是()。
中考化学 物质的共存、检验、鉴别及除杂
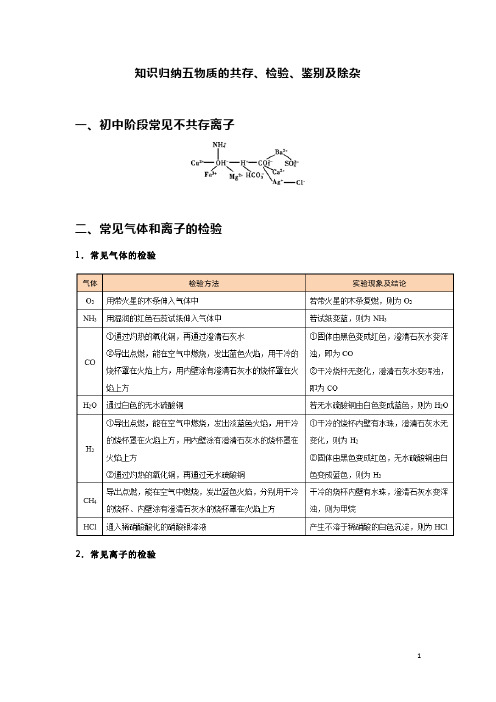
知识归纳五物质的共存、检验、鉴别及除杂一、初中阶段常见不共存离子
二、常见气体和离子的检验
1.常见气体的检验
2.常见离子的检验
三、常见物质的鉴别
四、常见物质的除杂
1.除杂原则——“不增、不减、易分离”
(1)除杂过程中不能引入新杂质,即“不增”。
(2)加入的试剂不能与所需要的物质反应,所需物质可增多但不可减少,即“不减”。
(3)杂质应转化为原物质或沉淀、气体、水等易分离的物质,即“易分离”。
2.酸、碱、盐溶液除杂技巧
(1)被提纯物与杂质阳离子相同(如NaCl中含杂质NaOH),选取与杂质中的阴离子(OH-)不共存的阳离子(H+),再与被提纯物中的阴离子(Cl-)组合成除杂试剂(HCl)。
发生反应:NaOH+HCl=NaCl+H2O。
(2)被提纯物与杂质阴离子相同(如NaCl中含杂质BaCl2),选取与杂质中的阳离子(Ba2+)不共存的阴离子(SO42-),再与被提纯物中的阳离子(Na+)组合成除杂试剂(Na2SO4)。
发生反应:BaCl2+Na2SO4=BaSO4↓+2NaCl。
(3)被提纯物与杂质阴、阳离子都不相同(如NaNO3中含杂质CuSO4),选取与杂质中的阴离子(SO42-)、阳离子(Cu2+)都不共存的阳离子(Ba2+)、阴离子(OH-)组合成的除杂试剂[Ba(OH)2]。
发生反应:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓。
3.气体除杂
4.固体除杂
5.液体除杂。
初中化学共存、除杂、鉴别

共存、除杂、鉴别
一、溶液相关的不共存:
1、生成水:H+与OH—(包括不溶性碱)
2、生成气体:H+与CO32—(包括不溶性碳酸盐),H+与HCO3—,H+与活泼金属,OH—与NH4+
3、生成沉淀:背熟溶解性表
4、置换:较活泼金属单质与不活泼金属离子或H+(如:Fe与Cu2+,Fe与H+)
注意:1、H+或OH—有时用pH表示
2、有相同离子的物质,相互间一般不发生复分解反应
二、除杂的原则
1、显然要能除去杂质(一般用溶液反应,否则不能保证杂质充分反应而除尽)
2、不能生成或引入新杂质
3、允许生成需保留的物质,尽量不消耗需保留的物质
三、物质鉴别的思考顺序
1、本身有颜色
2、可相互反应且有明显现象(颜色、气泡、沉淀)
3、发生第一次反应后的生成物还可发生别的反应
4、有时明显放热或吸热、气味等也可作为鉴别的依据
四、鉴别SO42—
1、加入BaCl2,生成白色沉淀
2、加入稀硝酸,沉淀不消失,即可确认是SO42—
3、若沉淀消失且有气泡产生,则为CO32—
五、鉴别Cl—
1、加入AgNO3,生成白色沉淀
2、加入稀硝酸,沉淀不消失,即可确认是Cl—。
微专题6 物质的共存、检验与鉴别、除杂

微专题6 物质的共存、检验与鉴别、除杂
跟踪训练
1. 在含有大量Na+、OH-、SO42-的溶液中,还可能大量存在的是( D )
A. NH4+
B. Ba2+
C. Cu2+
D. K+
2. (2019南京)下列各组离子在水中能大量共存的是( B )
A. K+、H+、CO32-、Cl-
B. Na+、NH4+、Cl-、NO3-
微专题6 物质的共存、检验与鉴别、除杂
OH-
__H__+__+OH- ===H2O __N_H__4+__+OH-===NH3↑+H2O __C__u_2+___+2OH- ===__C_u_(_O_H__)_2 _↓(蓝色沉淀) __F_e_3_+__+3OH-=== _F__e(_O__H_)_3_↓(红褐色沉淀) __M__g_2_+__+2OH- ===Mg(OH)2↓(白色沉淀 )
C. Cu2+、Na+、OH-、SO42-
D. K+、H+、OH-、SO42-
微专题6 物质的共存、检验与鉴别、除杂
3. (2019十堰)在无色溶液中,下列各组物质能大量共存的是( C ) A. 氯化钠、氢氧化钙、稀盐酸 B. 硝酸钾、氯化铜、氢氧化钠 C. 硝酸钠、氢氧化钾、氯化钡 D. 碳酸氢钠、氯化钾、稀硫酸 4. (2019凉山州)下列离子能在pH=10的无色溶液中共存的是( B ) A. Fe3+、Mg2+、Cl-、SO42- B. K+、Na+、SO42-、NO3- C. Na+、NH4+、NO3-、Cl- D. H+、Cl-、K+、NO3-
NaOH
(1)原白色粉末中一定不含________B_a(Cl填2+化N学a2式CO,3=下=同= B)a,CO可3↓能+含2N__a_C_l____。
复分解反应发生条件—共存、除杂、转化、鉴别

复分解反应发生条件—共存、除杂、转化、鉴别二、复分解反应的应用应用一:判断物质能否在溶液中共存物质相互间不反应就能在溶液中大量共存。
比如:H+与CO32-、OH-不能共存,OH- 与NH4+、H+、Fe3+、Cu2+不能共存,Ag+与Cl-、OH-不能共存,Ba2+与CO32-、SO42-不能共存。
例题:下列各组物质在溶液中能大量共存的是()A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3C.MgSO4、NaNO3、KOH D.Na2CO3 、KNO3、HCl【分析】此类题目可用排除法来选择。
B组中NaOH和HNO3可以反应,C组中MgSO4和KOH 可以反应,D组中Na2CO3 和HCl可以反应,故选A。
【中考链接】1、【11年连云港】将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是()A.CaCl2 HCl NaNO3 B.KOH HCl (NH4)2SO4C.K2CO3 Ba(NO3)2 NaOH D.FeCl3 NaCl KNO32、【11年南京】下列各组离子在溶液中一定能大量共存的是()A.H+、C1—、OH— B.H+、SO42—、HCO3—;C.Ba2+、H+、SO42— D.Cu2+、C1—、NO3—3、【11年黄冈】下列各组物质能在同一溶液中大量共存的是()A.NaCl HCl MgSO4Cu(NO3)2B.AgNO3 NaCl Mg(NO3)2NaOHC.Ca(OH)2 NaNO3Na2CO3 NH4ClD.HCl K2SO4 NaOH NaNO34、【11年佛山】下列物质能共存于同一溶液中,且无色透明的是()A.NaOH、NaNO3、K2SO4 B.CuSO4、MgSO4、KClC.Ba(OH)2、H2SO4、NaCl D.NaCl、AgNO3、HNO35、【11年贵港】分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是() A.H2SO4 Ba(OH)2 HNO3 B.H2SO4 NaNO3 Na2SO4C.H2SO4 NaNO3 FeSO4 D.CaCl2 Na2SO4 BaCl26、【11年眉山】下列离子能在PH=12的水溶液中大量共存的是()A、SO42-、NO3-、K+、H+B、Na+、Cl-、OH-、Al3+C、Cl-、NO3-、K+、Na+D、Ag+、Cl-、CO32-、K+应用二、除杂除杂质遵循的原则:选用的试剂只和杂质反应,且不带入新杂质。
物质的检验与鉴别、分离与除杂和共存

物质的检验与鉴别、分离与除杂和共存物质的检验与鉴别是化学分析中至关重要的一步。
在分析物质时,我们需要对它的成分进行鉴别和检验,以确保分析结果的准确性和可靠性。
物质的检验与鉴别质的分析质的分析是检验物质的一种方法,我们可以通过观察物质的外观,进行某些化学试验或测量物质的物理特性来进行质的分析。
例如,在进行无机分析时,如果我们需要鉴别一种钠盐,可以用硝酸银试剂进行检验。
硝酸银试剂可以与钠盐中的氯离子反应,形成白色不溶性沉淀,这样我们就可以确定这个物质中含有氯离子。
量的分析量的分析是另外一种检验物质的方法。
这种方法可以精确地测定物质中各种元素或化合物的含量,实现对物质的全面检验。
量的分析需要使用各种化学分析方法和先进的仪器设备,包括光谱分析、质谱分析、分析化学、生化分析等。
物质的分离与除杂在进行物质分析时,有时会遇到复杂的混合体系,我们需要对混合物进行分离和除杂。
这种方法可以提高物质分析的准确度和精确度。
蒸馏法蒸馏法是物质分离和纯化的一种有效方法。
该方法适用于混杂物中有较大沸点差异的组分的分离。
例如,我们可以通过蒸馏法将含水的甲醇分离成无水甲醇。
在蒸馏过程中,如果甲醇和水组成的混合物被加热,水先沸腾,先蒸发出去。
此时,蒸馏出的气体中含有更多的甲醇,从而实现甲醇的分离和除杂。
萃取法萃取法是另外一种常用的物质分离方法。
该方法通常适用于混杂物中有易于溶解的有机组分和不易溶解的其他成分的分离。
例如,我们可以使用苯作为萃取剂来分离含有茶碱和咖啡因的混合物。
茶碱和咖啡因在苯中有较高的溶解度,而其他组分则不容易溶解在苯中,因此可以通过多次萃取的方法实现茶碱和咖啡因的分离和除杂。
物质的共存物质的共存是指存在多种不同化合物或元素在一个样品中的情况。
在化学分析中,我们需要对这些化合物或元素进行检验和鉴别,以确保分析结果的准确和可靠。
填充分析法填充分析法是一种常用的分析方法,可以用于寻找和测定样品中不同元素或化合物的存在量。
中考化学第二轮复习:专题三物质的分离、除杂和共存

(2)两种物质均溶于水,但两种物质的溶解度一种受温度变化影响大,另一种受 温度变化影响不大时,可考虑降温结晶法,即用冷却热饱和溶液的方法加以分离, 如 NaCl 和 KNO3 的混合物的分离。
(3)两种物质均溶于水时,可考虑用化学方法分离,如 BaCl2 和 NaCl 的混合物, 可将混合物先溶于水,加入适量的 Na2CO3 溶液,得到 BaCO3 沉淀和 NaCl 溶液。将 沉淀过滤出,洗净后在沉淀中加入适量稀盐酸,CO2 气体逸出,得到 BaCl2 溶液。再 分别把 NaCl 溶液和 BaCl2 溶液蒸发,分别得到纯净的 NaCl 和 BaCl2 固体。
第6页
3.明确几个优化原则 (1)若同时有几种方法能除去杂质,则选用步骤简单、操作简便、除杂最干净的 方法。 (2)应尽量选择既可除去杂质,又可增加保留物质量的方法,即“化腐朽为神 秘”。 (3)先考虑物理方法(如过滤、蒸发结晶、蒸馏、升华等),再用化学方法(如沉淀 法、吸取法、转化法等)。
第7页
第 16 页
例2 (202X·四川乐山)除去下列各组物质中的少量杂质,选用的试剂或操作方 法不合理的是( )
选项
物质
杂质
除去杂质的方法或步骤
A
Cu
Fe
加稀盐酸(足量)、 过滤、洗涤、干燥
B
CO
CO2
C
KCl
MnO2
D
NaNO3 溶液
NaCl
通入足量的 NaOH 溶液 加水溶解、过滤、蒸发结晶 加入过量的硝酸银溶液、过滤
第3页
例 1 把 CaCO3、NaCl、MgCl2 三种固体物质组成的混合物逐一分离所需要的
试剂依次是(Leabharlann )A.H2O、NaOH、HCl
专题二物质的共存、检验与鉴别、除杂

专题二物质的共存、检验与鉴别、除杂类型1 物质的共存(A 卷:2016.12, 2015.15; B 卷:2016.9, 2014.15)卡类型精讲1. 物质共存的条件(1)组内物质均可溶。
(2)在同一溶液中,物质(即所含离子)之间不发生反应,即不会生成______ 、__________ 或___________ 。
2.常见的不能相互共存的离子对(1)结合生成沉淀①Cl-- Ag+(AgCl)②SO;——Ba2+(BaSO4)③CO]——Ba2+(BaCO3)④CO2-—Ca2+(CaCO3)⑤OH-- Mg2+[Mg(OH)2]⑥OH-- Cu2+[Cu(OH)2,蓝色]⑦OH-- Fe3+[Fe(OH)3,红褐色](2)结合生成气体或水① OH--H+(H2O)②CO2-—H+、HCO--H+(CO2+H2O)③OH-- NH+(NH3+H2O)3.物质共存中的隐含条件(1)溶液为电中性,即溶液中既含阳离子也含阴离子。
(2)酸性溶液、pH=2(pH<7)、能使紫色石蕊溶液变红的溶液:溶液中一定存在H+。
(3)碱性溶液、pH=10(pH>7)、能使紫色石蕊溶液变蓝或能使无色酚欧溶液变红的溶液:溶液中一定存在OH-。
(4)溶液无色:溶液中不含Cu2+、Fe2+、Fe3+、KMnO4o等针对训练1.(2018齐齐哈尔)下列离子在水中能大量共存,并形成无色溶液的是( )A.Fe3+、Na+、NO3-、Cl-B.K+、Na+、Al3+、SO24-C.H+、K+、SO42-、OH-D.Mg2+、NO3-、OH-、Cl-2. (2018贺州)下列各组离子在pH=2的溶液中能大量共存的是()A.Na+、Ca2+、Cl-、OH-B.K+、Mg2+、NO3-、SO24-C.K+、Ba2+、NO3-、SO24-D.NH4+、Na+、CO32-、Cl-3.某溶液中存在有大量的Ba2+、Ag+、Na+,还会存在的一种离子是()A. CO32-B. Cl-C. Fe3+D. NO3-4.(2018天水)下列每组离子相互反应,一定有白色沉淀生成的是()A.Cu2+、Na+、NO3-、OH-B.H+、Ca2+、CO32-、SO42-C.NH4+、K+、CO23-、OH-D.Mg2+、Ba2+、SO42-、H+5.(2017河池)下列各组物质在水溶液中能够大量共存,且加入紫色石蕊溶液后显红色的是()A.NaCl Ba(NO3)2 HClB.NaOH CuSO4 H2SO4C.NH4NO3 NaOH K2SO4D.NaNO3 Na2so4 NH3 • H2O6.下列离子组在强酸性和强碱性溶液中都能大量共存的是()A. Ca2+、Cu2+、NO-3、Cl-B. Na+、Mg2+、sO24-、Cl-C. Na+、K+、CO23-、sO24-D. Na+、Ba2+、Cl-、NO3-类型2 物质的检验与鉴别(A卷6年5考;B卷6年3考)等类型精讲1.常见液体鉴别的思路和方法(A卷6年4考;B卷6年2考)2.常见气体的检验(B卷:2017.15B)3.常见其他物质的鉴别[A卷:2018.17(3); B卷:2015.18(2)]♦针对训练重庆真题1. (2016重庆B卷)用下列方法鉴别物质不能达到实验目的的是()2.(2015重庆A卷)区别下列各组物质,选择的实验方法不能达到目的的是()A. CO2和CO:闻气味B.黄铜片和铜片:相互刻画C.浓盐酸和浓硫酸:分别用玻璃棒蘸取点在滤纸上D. BaCl2溶液和KNO3溶液:分别加入Na2SO4溶液3.(2014重庆A卷)某矿物质水标签上的部分内容如图所示,若要检验其中含MgSO4,需要的试剂之一是()第3题图A.稀硫酸B. AgNO3溶液C. BaCl2溶液D.金属镁4.(2016重庆A卷)下列鉴别SO2和CO2的方法正确是____ (填序号)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、物质共存练习1、下列各组物质,能够在溶液中大量共存的是()A、NaNO3、Na2CO3、NaClB、Ca(OH)2、K2CO3、NaNO3C、NaOH、(NH4)2CO3、HClD、BaCl2、Na2SO4、NaOH2、下列各组物质,能够在溶液中大量共存的是()A、NaOH、HNO3、BaCl2B、Na2SO4、MgCl2、KOHC、Na2CO3、K2SO4、HClD、H2SO4、NaCl、Cu(NO3)23、下列各组物质能大量共存,且形成无色溶液的是()A、NaCl、KOH、MgSO4B、K2SO4、FeCl3、NaNO3C、KCl、NaOH、Ba(NO3)2D、Na2CO3、K2SO4、HNO34、下列各组物质在溶液中能够大量共存的是()A、NaOH、HNO3、BaCl2B、Na2SO4、MgCl2、KOHC、Na2CO3、K2SO4、HClD、H2SO4、NaCl、Cu(NO3)25、下列各组物质能在pH=1的溶液中大量共存且得到无色透明溶液的是()A、BaCl2、NaNO3、KOH、MgCl2B、Cu(NO3)2、NaCl、H2SO4、KNO3C、Na2CO3、NaCl、KNO3、NH4ClD、ZnSO4、Mg(NO3)2、NaNO3、KCl6、在鉴定某无色溶液时,四位实验者对该溶液的组成得出了不同的结论,其中可能正确的是()A、Na2CO3、NaCl、HClB、NaOH、KCl、Ba(NO3)2C、AgNO3、NaCl、HNO3D、H2SO4、NaNO3、FeCl37、下列各组物质能在pH=1的溶液中大量共存,且得到无色透明溶液的是()A、BaCl2、NaNO3、KOH、MgCl2B、Cu(NO3)2、NaCl、H2SO4、KNO3C、Na2CO3、NaCl、KNO3、NH4ClD、ZnSO4、Mg(NO3)2、NaNO3、KCl8、分别将下列各组物质同时加到足量水中,能得到无色透明溶液的是()A、HNO3、KOH、FeCl3B、K2SO4、KCl、HClC、AgNO3、HCl、KClD、Na2CO3、KCl、BaCl29、下列各组物质在pH=14的某无色溶液中,能大量共存的是()A、FeCl3、NaCl、KNO3B、NaCl、NaOH、NaNO3C、CaCl2、NaNO3、Na2CO3D、KNO3、H2SO4、NaCl10、下列各组内的离子,在溶液中不能大量共存的是()A、H+、SO2━4、Ba2+、NO━3B、Ca2+、H+、NO━3、Cl━C、Mg2+、K+、NO━3、Cl━D、K+、Na+、Mg2+、SO2━411、下列各组离子中,能大量共存的是()A、H+、SO2━4、OH━、Ba2+B、K+、Mg2+、NO━3、OH━C、Na+、H+、NO━3、CO2━3D、Na+、K+、H+、SO2━412、已知某无色溶液中,可能含有H+、Ag+、Cu2+、Na+、OH━、Cl━、NO━3、CO2━3八种离子中的几种,取该溶液少许,滴入几滴紫色石蕊试液,溶液变红色,则原溶液中可能大量共存的离子是____________________ _______________________________________________________________。
二、物质鉴别、分离练习1、下列各组中所选鉴别试剂正确的是()待鉴别物质鉴别试剂待鉴别物质鉴别试剂A Zn Fe MgCl2溶液B HCl溶液H2SO4溶液ZnC KOH溶液Ba(OH)2溶液Na2SO4溶液 C K2SO4溶液BaCl2溶液Cu(OH)2溶液2、鉴别BaCl2、AgNO3、Na2CO3三种无色溶液时,应选用的试剂是()A、盐酸B、硫酸C、NaOH溶液D、NaCl溶液3、今有NaCl、CuCl2、NaOH、Mg(NO3)2四种失去标签的溶液,在不外加试剂的条件下,如何把它们鉴别出来。
4、利用无色酚酞试液可以鉴别的一组溶液是()A、BaCl2、H2SO4、HClB、NaOH、KOH、HClC、K2CO3、Na2CO3、HClD、NaCl、NaOH、HCl5、只用一种试剂来鉴别氢氧化钠、氢氧化钡、稀盐酸三种溶液,这种试剂是()A、碳酸钠溶液B、氯化钡溶液C、无色酚酞试液D、紫色石蕊试液6、用水作试剂,不可能区分开的一组物质是()A、生石灰、食盐、烧碱B、汽油、酒精、浓硫酸C、无水硫酸铜、碳酸钙、碳酸钠D、氯化钾、硝酸钠、硫酸钾7、为了检验某氢氧化钠样品中是否含有氯化钠,进行下列操作:(1)取样,用_________溶解样品,配成溶液。
(2)往溶液中逐滴滴入适量的______________(填化学式),目的是_____________________________。
(3)再往溶液中滴入几滴硝酸银溶液,目的是________________________________________________。
8、能将Na2CO3、NaNO3、Ba(NO3)2三种溶液一次性鉴别出来的试剂是()A、石蕊试液B、稀盐酸C、稀硫酸D、氯化钙溶液9、有四瓶失去标签的溶液,它们分别是①Ba(OH)2溶液②K2CO3溶液③KCl溶液④FeCl3溶液。
不用其他任何试剂将它们鉴别开来的合理顺序是()A、④①②③B、②③①④C、④②①③D、③②④①10、下列各组物质中,中用稀H2SO4一种试剂就可以鉴别的是()。
A、Ba(NO3)2、K2SO4、Na2CO3B、KCl、K2CO3、K2SO4C、NaOH、NaNO3、NaClD、BaCl2、KOH、MgSO411、下列各组溶液中,不加其他试剂就可区分开的是()A、Na2CO3、HCl、H2SO4、NaNO3B、K2CO3、H2SO4、HNO3、BaCl2C、HCl、AgNO3、HNO3、NaClD、NaOH、FeCl3、MgCl2、BaCl212、下列各组溶液,不加其他试剂就能鉴别出来的是()A、Na2SO4、BaCl2、KNO3、NaClB、Na2SO4、K2CO3、BaCl2、HClC、NaOH、Na2SO4、FeCl3、BaCl2D、CuCl2、AgNO3、NaNO3、HCl13、下列各组溶液中不用其他试剂,仅用组内物质相互反应就能区别开来的是()A、NaOH、CuSO4、MgCl2B、Na2SO4、BaCl2、Na2CO3C、KNO3、CuSO4、NaClD、NaNO3、BaCl2、KCl14、下列各组物质中,只用组内溶液相互混合的方法就能鉴别的是()A、KOH、Na2SO4、CuSO4、MgCl2B、K2CO3、BaCl2、Na2CO3、HClC、Na2SO4、BaCl2、KNO3、NaClD、NaNO3、AgNO3、KNO3、NaCl15、下列各组溶液中不用其他试剂,仅用组内物质相互反应就能区别开来的是()。
A、NaCl、Na2CO3、KNO3、HClB、Na2SO4、K2CO3、KNO3、Ba(NO3)2C、CuSO4、NaOH、NaCl、Ba(NO3)2D、FeCl3、NaOH、KCl、Na2SO416、下列各组物质中,仅用一种试剂不能鉴别的一组是()A、Cu粉Fe粉Fe2O3粉B、Na2CO3BaCl2 KNO3C、NaCl固体CuSO4固体CaCO3固体D、(NH4)2SO4KNO3NaNO317、用化学方法鉴别下列各组物质时,所需试剂最少的是()A、稀盐酸、稀硫酸、稀硝酸B、氢氧化钠溶液、氢氧化钡溶液、硝酸钙溶液C、氯化钠溶液、碳酸钠溶液、氯化钙溶液D、碳酸钠稀溶液、稀盐酸、氢氧化钡溶液一、除杂专题练习1、NaCl溶液中溶有少量Na2CO3,下列物质中可用来除去Na2CO3的是()A、锌粉B、Ca(OH)2溶液C、盐酸D、硫酸2、下列除杂质的方法中,正确的是()A、用NaOH溶液除去CO2气体中混有的HClB、用Ba(NO3)2溶液除去NaCl溶液中混有的MgSO4C、用稀H2SO4除去CuO粉末中混有的Cu(OH)2D、用浓H2SO4除去H2中混有的水蒸气4、下列括号中的物质是除去杂质所用的药品,其中错误的是()A、氧化钙中含有杂质碳酸钙(盐酸)B、二氧化碳中含有少量的一氧化碳(灼热的氧化铜)C、氯化钠溶液中含有少量的氯化铁(苛性钠溶液)D、硫酸亚铁溶液中含有少量的硫酸铜(铁粉)5、下列括号中的物质是除去杂质所用的药品,其中错误的是()A、铜粉中含有少量铁粉(硫酸铜溶液)B、生石灰中少量的碳酸钙(硫酸)C、氧气中的二氧化碳(氢氧化钠溶液)D、稀硝酸中的少量硫酸(硝酸钡溶液)6、下列措施能达到目的的是()A、用氢氧化钠溶液除去二氧化碳气体中混有的HCl气体B、用点燃的方法除去二氧化碳气体中混有的一氧化碳C、用稀盐酸除去热水瓶中的水垢(主要成分是碳酸钙和氢氧化镁)D、用氯化钡溶液除去硝酸钾中混有的少量硫酸钾7、除去N2中混有的少量H2、CO2、水蒸气时,采用的正确的操作顺序是()①通过浓硫酸②通过灼热CuO ③通过NaOH溶液④通过浓盐酸A、③②①B、①②③C、②③④D、④①③8、除去下列各组物质中的杂质(括号内为杂质)时,按如下步骤进行操作:①加入过量稀硫酸;②加入适量的氢氧化钾溶液;③蒸发、结晶,能达到实验目的的是()。
A、K2SO4(K2CO3)B、铁粉(Fe2O3)C、NaCl(Na2CO3)D、银粉(铜粉)9、从A━D中选择正确的序号,填充(1)━(4)题.A、加适量稀盐酸、搅拌、蒸发、结晶B、加适量稀盐酸、搅拌、过滤、洗涤C、加适量水、溶解、过滤、蒸发、结晶D、加适水、溶解、过滤、洗涤(1)提纯含有少量泥沙的粗盐___ __。
(2)从草木灰中提取碳酸钾____ ___。
(3)除去氯化钠中的少量碳酸钠_____ ____。
(4)实验室常用加热氯酸钾与二氧化锰的混合物来制取氧气,若要从反应后的残渣中回收二氧化锰可以Na 2CO 3 10、怎样除去下列混合物中的杂质?写出主要分离过程。
(1)硫酸亚铁溶液中混有少量硫酸铜:____________________________________________。
(2)硝酸钾中混有少量食盐:________________________________________________。
(3)食盐中混有少量硝酸钾:__________________________________________________。
(4)除去KCl 中混有的少量MnO 2:______________________________________________________。
(5)除去AgCl 中混有的少量NaCl :________________________________________________。
