华南农业大学2010物理化学期末考试试卷
华农物化第二学期期末试卷及答案

(2)当c=0.200mol·dm-3时,表面吸附量Γ为: + 准
装 订 线
h
t 准 t
(3) bc ≫
t h遨r h ………………………………………...……………3分
准 ⸲ + 准
t
t tt t t t tt
t
⸲ +
t t
准
t
t
t 准
t
t 准
t
t h遨r h …………………….…3分 t
线 装 订
3
得分
三、问答题(本大题共3小题,每小题5分,共15分)
1. 在水平放置的玻璃毛细管中分别加入少量的纯水和汞,毛细管中液体两端 的液体分别呈什么形状?如果分别在管外的右端液体处微微加热,管中的 液体将向哪一方移动?在无重力状态下将一根短毛细管接触水滴,会发生 什么现象?
4
2. 已知平行反应A 施?
华南农业大学期末考试试卷(A 卷)
2011 学年第 学号
装 订 线
一 学期 姓名 一 二
考试科目: 考试时间: 年级专业 三 四
物化学 120 分钟
考试类型: (闭卷)考试
题号 得分 评阅人
总分
得分
一、选择题(本大题共12小题,每小题2分,共24分)
( )1.某反应速率常数的量纲为(浓度)-1·(时间)-1,则该反应为: A.一级反应 B.二级反应 C.三级反应 D.零级反应 ( )2.若电池反应Fe + Cu2+ →Cu + Fe2+ 是热力学自发过程,则:
A.反应一定是放热反应 B. Fe电极是正极,Cu电极是负极 C. Fe2+的活度大于Cu2+的活度 D.φ(Cu2+|Cu) >φ(Fe2+|Fe) ( )3.活化能为零的反应是: A. A·+BC→AB+C· C. A2+M→2A·+M
华南农业大学期中考试试卷

华南农业大学期中考试试卷2010学年第二学期 考试科目: 物理化学考试类型:(闭卷) 考试时间: 120 分钟学号年级专业 2009级材化应化题号一二三四总分得分评阅人一.选择题:(10×2分)( )1. 二氧化碳的临界温度是304.16K,在装有足够数量的二氧化碳的钢瓶中,25℃时二氧化碳是什么状态?(A) 液态及气态 (B) 超临界状态(C) 临界状态 (D) 都可能( )2. 实际气体经节流膨胀, 状态函数的变化何者为零?(A) ΔU = 0 (B) ΔH = 0(C) ΔS = 0 (D) ΔG = 0( )3. 在下列哪种情况下, 实际气体的性质与理想气体相近?(A) 低温和高压 (B) 低温和低压(C) 高温和高压 (D) 高温和低压( )4. 理想气体从状态(P1 V1 T)恒温膨胀到(P2 V2 T).此过程的ΔG 与ΔA有什么关系?(A) ΔG = ΔA (B) ΔG > ΔA(C) ΔG < ΔA (D) 无确定关系( )5. ΔU = Q + W 适用于什么系统?(A) 敞开系统 (B) 封闭系统(C) 隔离系统 (D) 三种系统都适用( )6. 在一定T , P下, 某实际气体的V m大于理想气体的V m , 则该气体的压缩因子Z(A) 大于1 (B) 小于1(C) 等于1 (D) 小于零( )7. 氢气在298.15K的标准摩尔燃烧焓为-285.8 kJ·mol-1, 则氢气在298.15K燃烧时的标准摩尔反应焓为:(A) 142.9 kJ·mol-1 (B) -142.9 kJ·mol-1(C) 285.8 kJ·mol-1 (D) -285.8 kJ·mol-1( )8.在一简单的(单组分,单相,各向同性)封闭体系中,恒外压只做膨胀功的条件下,吉布斯自由能值随温度升高如何变化?(A) (∂G/∂T )p> 0(B) (∂G/∂T )p< 0(C) (∂G/∂T )p= 0(D) 视具体体系而定( )9.在系统温度恒定的变化中,体系与环境之间:(A)一定有热交换(B)一定没有热交换(C)不一定有热交换(D)温度恒定与热交换无关( )10.关于热机的效率, 以下结论正确的是:(A) 可逆热机的效率可以等于1, 但不能大于1(B) 可逆热机的效率与工作物质的种类有关(C) 可逆热机的效率与工作物质的种类无关(D) 任意热机的效率均可表示为η=1-T2/T1二.填空题:(20×1分)1. 从微观角度而言,熵具有统计意义,它是系统_______________的度量.2. 纯物质完美晶体_________时熵值为零.3. 亥姆霍兹能的定义式为 A = ____________.4. 假设氮气为理想气体,在0℃和5×105 Pa下,用2 dm3氮气作定温可逆膨胀到压力为105 Pa.此过程的Q = _______________,W =_______________,ΔU = _______________,ΔH = _______________.5. 气体常数的单位是_________________.6. 热力学基本公式dU = _______________, 所以(∂U/∂V)S=_________.7. 标准压力下, 1mol 0℃的水结成0℃的冰, 过程的ΔS =________________, ΔG = ________________.(已知Δfus H mΘ=334.7J·g-1 )8. 某实际气体在400K , 1700kPa时的对比温度T r = 0.9589, 对比压力p r = 0.2208. 该气体的临界温度T c =___________K , 临界压力p c=___________kPa.9. 吉布斯能属于_______性质, 具有加和性. 摩尔体积属于________性质.10. 焦耳实验的结论是________________________________________________.11. 热化学方程式H2 + I2 === 2HI ; Δr H m = -13.85 kJ·mol-1, 指出其中的错误:(1)____________________________;(2)____________________________;12. 在定温定容条件下,系统亥姆霍兹能的减少等于__________________________________.三.问答题:(5×4分)1. 一定温度下,过饱和的NaCl溶液中析出具有一定对称性的晶体的过程是自发过程,晶体在过程中的熵变小于零, 这与熵增加原理有矛盾吗?为什么?2. 热力学的可逆过程有什么特征?3. 用ΔG<0判断过程的方向, 条件是什么?4. 下列说法是否正确?并说明理由(a) 系统的焓等于定压热(b) 系统的焓变等于定压热(c) 系统的焓等于系统的热量5.指出在下列两过程中,系统的ΔU,ΔH,ΔS,ΔA及ΔG何者为零?(1)非理想气体卡诺循环;(2)氢气和氧气在绝热定容容器中反应生成水.四.计算及证明题.(4×10分)1. 1摩尔H2在25℃,105 Pa下经绝热可逆过程压缩到体积为5 dm3 ,试求:(1)终态温度T2;(2)终态压力p2;(3)过程的W,ΔU和ΔH.(H2视为理想气体)2. 已知水在100℃及标准压力下蒸发热为2259 J·g-1,求1 mol 100℃及标准压力的水蒸发变为100℃,5×104 Pa的水蒸气的ΔU,ΔH,ΔA以及ΔG.3. 设O2 (g) 为理想气体,求下列各过程中1摩尔O2 (g) 的ΔS(1) 定温可逆膨胀V→2V ;(2) 定温向真空膨胀V→2V ;(3) 绝热可逆膨胀V→2V ;(4) 绝热向真空膨胀V→2V .4. 证明: (1) (∂U/∂T)p=C p- p(∂V/∂T)p(2) 对理想气体绝热可逆过程dG=(C p-S)dT。
华南农业大学 大学物理 2010年试卷答案

Jω = (J + m l 2 ) v
2分
2l
在滑动过程中,根据动能定理
− m gµs = 0 − 1 ( m )v2
2分
2
22
解上面三个方程得,物体滑过的距离是
s
=
6l 25µ
2分
39、解:
(1)从图中知,波的振幅 A = 0.10m ,波长 λ = 20.0m ,波速 u = λν = 5.0 ×103m / s 。
t = 0 时, P 运动方向向上,可知波沿 x 轴负方向传播,并判定此时位于原点处的质点
将沿 y 轴负方向运动。利用旋转矢量法可得其初相φ = π / 3
2分
故该波的波函数为
y = Acos[ω(t + x) + ϕ0 ] u
= 0.10cos[500π (t + x ) + π ] (m)
2分
5000 3
装 订 线
1.5CM
华南农业大学期末考试试卷(A 卷)答案
2010-2011 学年第 2 学期 考试类型:(闭卷)考试
考试科目: 大学物理 AI 考试时间: 120 分钟
一、填空题(本大题共12小题,每小题2分,共24分)
1.
v a
(t
)
=
v 24 t i
−
π
2
sin(
πt)
v j
2. 18
3. 0.8m / s 2
四、计算题(本大题共5小题,每小题8分,共40分)
37、解: 以地面飞机滑行方向为坐标正方向,由牛顿定律及初始条件,有:
F = ma = m dv = −αt
dt
∫ ∫ v dv = t − αt dt
物化期末试卷样题及答案
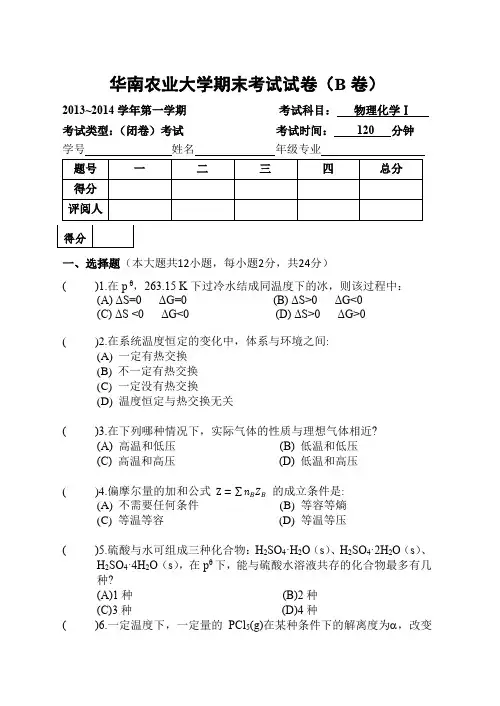
华南农业大学期末考试试卷(B卷)2013~2014学年第一学期考试科目:物理化学Ⅰ考试类型:(闭卷)考试考试时间:120 分钟学号姓名年级专业一、选择题(本大题共12小题,每小题2分,共24分)( )1.在p θ,263.15 K下过冷水结成同温度下的冰,则该过程中:(A) ΔS=0 ΔG=0 (B) ΔS>0 ΔG<0(C) ΔS <0 ΔG<0 (D) ΔS>0 ΔG>0( )2.在系统温度恒定的变化中,体系与环境之间:(A) 一定有热交换(B) 不一定有热交换(C) 一定没有热交换(D) 温度恒定与热交换无关( )3.在下列哪种情况下,实际气体的性质与理想气体相近?(A) 高温和低压(B) 低温和低压(C) 高温和高压(D) 低温和高压( )4.偏摩尔量的加和公式Z=∑n B Z B的成立条件是:(A) 不需要任何条件(B) 等容等熵(C) 等温等容(D) 等温等压( )5.硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在pθ下,能与硫酸水溶液共存的化合物最多有几种?(A)1种(B)2种(C)3种(D)4种( )6.一定温度下,一定量的PCl5(g)在某种条件下的解离度为 ,改变下列条件,何者可使 增大?(A) 增加压力使体积缩小一倍(B) 体积不变,通入N2气使压力增大一倍(C) 压力不变,通入N2气使体积增大一倍(D) 体积不变,通入Cl2气使压力增大一倍( )7.在一定T,p下,某实际气体的V m大于理想气体的V m,则该气体的压缩因子Z:(A) 等于1 (B) 小于1(C) 大于1 (D) 小于零( )8.在隔离体系中发生一个自发过程,则ΔG应为:(A) ΔG < 0 (B) ΔG > 0(C) ΔG =0 (D) 不能确定( )9.A、B两组分的气液平衡T-x图上,有一最低恒沸点,恒沸物组成为x A=0.7。
2010物理化学(上)考试题A卷答案
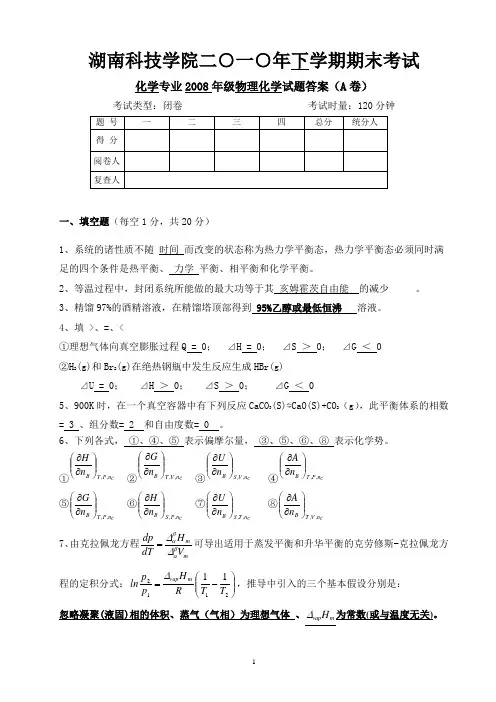
湖南科技学院二○一○年下学期期末考试化学专业2008年级物理化学试题答案(A 卷)一、填空题(每空1分,共20分)1、系统的诸性质不随 时间 而改变的状态称为热力学平衡态,热力学平衡态必须同时满足的四个条件是热平衡、 力学 平衡、相平衡和化学平衡。
2、等温过程中,封闭系统所能做的最大功等于其 亥姆霍茨自由能 的减少 。
3、精馏97%的酒精溶液,在精馏塔顶部得到 95%乙醇或最低恒沸 溶液。
4、填 >、=、<①理想气体向真空膨胀过程Q = 0; ⊿H = 0; ⊿S > 0; ⊿G < 0 ②H 2(g)和Br 2(g)在绝热钢瓶中发生反应生成HBr(g)⊿U = 0; ⊿H > 0; ⊿S > 0; ⊿G < 05、900K 时,在一个真空容器中有下列反应CaCO 3(S)⇋CaO(S)+CO 2(g ),此平衡体系的相数= 3 、组分数= 2 和自由度数= 0 。
6、下列各式, ①、④、⑤ 表示偏摩尔量, ③、⑤、⑥、⑧ 表示化学势。
①C n ,P ,T B n H ⎪⎪⎭⎫⎝⎛∂∂ ②C n ,V ,T Bn G ⎪⎪⎭⎫ ⎝⎛∂∂ ③C n ,V ,S Bn U⎪⎪⎭⎫ ⎝⎛∂∂ ④C n ,P ,T B n A⎪⎪⎭⎫⎝⎛∂∂ ⑤C n ,P ,T Bn G ⎪⎪⎭⎫ ⎝⎛∂∂ ⑥C n ,P ,S Bn H ⎪⎪⎭⎫ ⎝⎛∂∂ ⑦Cn ,T ,S Bn U ⎪⎪⎭⎫⎝⎛∂∂ ⑧Cn ,V ,T B n A ⎪⎪⎭⎫ ⎝⎛∂∂ 7、由克拉佩龙方程mm V H dT dp βαβα∆∆=可导出适用于蒸发平衡和升华平衡的克劳修斯-克拉佩龙方程的定积分式:⎪⎪⎭⎫⎝⎛-=211211T T RH p p ln mvap ∆,推导中引入的三个基本假设分别是:忽略凝聚(液固)相的体积、蒸气(气相)为理想气体 、m vap H ∆为常数(或与温度无关)。
二、单项选择题(每小题2分,共16分) 8、理想气体的卡诺循环过程中[D] A 、功和热都可以完全互相转换;B 、功不能完全转换为热,而热却可以完全转变为功;C 、功与热都不能完全互相转换;D 、功可以完全转化为热,而热却不能完全转变为功; 9、理想气体的节流膨胀过程,满足[B]A 、0P T H <⎪⎭⎫ ⎝⎛∂∂B 、0P T H =⎪⎭⎫ ⎝⎛∂∂C 、0P T H >⎪⎭⎫ ⎝⎛∂∂D 、上述三种情况都有可能10、∆H =Q p 适用于哪一个过程[B]A 、理想气体从101325Pa 反抗恒定的10132.5Pa 膨胀到10132.5PaB 、在0℃、101325Pa 下,冰融化成水C 、电解CuSO 4的水溶液D 、气体从(298K ,101325Pa)可逆变化到(373K ,10132.5Pa )11、理想气体与温度为T 的大热源接触作等温膨胀吸热Q ,所作的功是变到相同状态的最大功的20%,则体系的熵变为[C]A 、T QB 、 0C 、TQ 5 D 、T Q -12、合成氨反应N 2(g)+3H 2(g)⇋2NH 3(g)达平衡后加入惰性气体,且保持体系温度、总压不变(气体为理想气体),则:[D] A 、2N n 减少,2H n 减少,3NH n 增加,θp K 不变。
2010-2011学年二学期物理化学期末考试试卷(B卷)2

攀枝花学院2010-2011学年二学期物理化学期末考试试卷(B 卷)班级:___________学号:___________姓名:___________得分:___________ 题号 一 二 三 四 五 六 七 八 九 十 成绩复核 得分阅卷题目部分,(卷面共有28题,100.0分,各大题标有题量和总分)一、填作图(1小题,共5.0分) [5.0分]1. 水的相图如下: 试分别说明图中(1),(2),(3)三个区,OA ,OB ,OC ,三条线和O 点各有哪些相平衡共存。
存。
二、填空(13小题,共24.0分) [2.0分]1. 对理想气体的p ,V ,T 变化,公式d U = n C nC V ,m d T 适用于 过程;过程; 对实际气体的p ,V ,T 变化,公式d U = n C nC V ,m d T 适用于 过程。
[3.0分]2. 产物产物T 1,p 1,V 2 反应物 T 1,p 1,V 1等温,等压,D H 1=Q p Ⅰ II 等温等容 IIID U II =Q V ;D H II 等温 D U III ,D H III 在图中,途径Ⅲ是等温过程,对理想气体而言,过程Ⅲ的D U Ⅲ 0,D H Ⅲ 0。
(选填 >、=、< 号)号)[2.0分]3. 已知在25 ℃ S(正交) + O 2(g) == SO 2(g), D f H (SO 2 ,g) =-296.83 kJ ·mol -1 ; S(正交) + O 2(g) == SO 3(g), D f H (SO 3 ,g) =-395.7 kJ ·mol -1 ; 则反应 SO 2(g) + O 2(g) == SO 3(g) 在25 ℃时的 D f H = = 。
[2.0分]4. 25℃时H 2O(l)及H 2O(g)的标准摩尔生成焓分别为-286 286 kJ kJ ·mol-1及-242 kJ ·mol -1。
物理化学期末考试卷
物理化学期末考试卷题目:物理化学期末考试卷一、选择题1. 下列不是物理化学分支的是()。
A. 热力学B. 动力学C. 量子力学D. 有机化学答案:D. 有机化学2. 下列哪个不是物理化学实验室常用的仪器?()A. 分光光度计B. 电子显微镜C. 紫外分光光度计D. 液相层析仪答案:B. 电子显微镜3. 以下哪个单位不属于物理化学中的浓度单位?A. mol/LB. g/LC. mol/m3D. M答案:B. g/L4. 在化学反应中,起催化作用的物质被称为()。
A. 试剂B. 基物C. 催化剂D. 中间体答案:C. 催化剂5. 下列计量关系中,与化学平衡没有直接关系的是()。
A. 反应速率B. 反应热力学C. 反应机理D. 反应动力学答案:A. 反应速率二、填空题1. 理想气体状态方程为P = nRT中,P表示______,V表示______,T表示______,n表示______,R表示______。
答案:压强,体积,温度,物质的量,气体常数2. 氧气在标准条件下的摩尔体积为________。
答案:22.4 L/mol3. 化学反应速率的单位为________。
答案:mol/(L·s)4. 溶液中溶质的摩尔浓度为0.5 mol/L,溶液的体积为2 L,则溶质的物质的量为________mol。
答案:1 mol5. 以下不是弱酸的是________。
答案:HCl三、简答题1. 什么是物理化学?简要介绍物理化学的研究内容和意义。
答案:物理化学是研究物质的物理性质与化学性质及二者之间关系的一门学科。
它研究物质变化的机理和规律,涉及热力学、动力学、电化学等内容,对于认识和控制化学反应、设计新材料等具有重要意义。
2. 请简要说明物理化学实验室中常用的仪器及其作用。
答案:常用仪器包括分光光度计(用于测量物质的吸光度)、紫外分光光度计(用于分析化合物结构和含量)、液相层析仪(用于分离化合物混合物)、pH计(用于测定溶液酸碱性)等。
《物理化学》期未试卷A答案
2009 — 2010 学年 第 一 学期化学与材料学院2007级应化、材料专业 《物理化学》期末试卷(A )答案题号 分数 一 二 三 四(1) 四(2) 四(3) 四(4)总分 评卷人复核人考生考试诚信承诺书在我填写考生信息后,表示我已阅读和理解《龙岩学院考试纪律与违纪处分办法》的有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供的个人信息是真实、准确的。
考生签名:试卷类别:开卷( )闭卷( √) 考试用时: 120 分钟考试时间: 2010 年 1 月 9 日 下 午 考试地点: 文(202)注意事项1、学生的院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定的位置。
2、学生在考试之前必须填写考试时间和地点。
3、答题字迹要清楚,并保持卷面清洁。
息考 生信栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………一、选择题(每小题1分,共20分;填上正确答案)1.对于一定量的理想气体,有可能发生的过程是 ( A ,C ) (A) 对外做功且放出热量 (B) 恒容绝热升温,无非膨胀功 (C) 恒压绝热膨胀 (D) 恒温绝热膨胀2.某气体的状态方程为pV m =RT +bp (b 为大于零的常数),此气体向真空绝热膨胀后的温度将( A ) (A) 不变 (B) 上升 (C) 下降 (D) 不确定3.有一容器四壁导热,上部有一可移动的活塞,在这容器中同时放入锌粒和盐酸,发生化学反应后活塞将上移一定距离,以锌粒和盐酸为系统,则 ( A ) (A) Q < 0,W< 0,ΔU < 0 (B) Q < 0,W= 0,ΔU > 0 (C) Q = 0,W< 0,ΔU < 0 (D) Q = 0,W< 0,ΔU= 04.使气体致冷的节流膨胀,其焦耳-汤姆逊系数μJ-T 必须 ( A ) (A) > 0 (B) < 0 (C) = 0 (D) 难判断5.下列哪个关系式既是化学势又是偏摩尔量 ( B )6.1 mol A 与n mol B 组成的溶液,体积为0.65 dm 3,当x B = 0.8时,A 的偏摩尔体积V A,m = 0.090 dm 3·mol -1,那么B 的偏摩尔V B,m为 ( A ) (A) 0.140 dm 3·mol-1(B) 0.072 dm 3·mol -1 (C) 0.028 dm 3·mol -1(D) 0.010 dm 3·mol -17.下列过程中能适用方程 的是 ( A )(A) I 2(s)I 2(g) (B) Hg 2Cl 2(s)2HgCl(s) (C) C(石墨)C(金刚石) (D) N 2(g,T 1,p 1)N 2(g,T 2,p 2)8.有四杯含有不同溶质相同质量摩尔浓度(m=1.0mol ·kg -1)的水溶液,分别测定其沸点,沸点升高最多的是 ( A ) (A) Al 2(SO 4)3 (B) MgSO 4 (C) K 2SO 4 (D) C 6H 5SO 3H9.可逆机的效率为η,冷冻机的冷冻系数为β,则η和β的数值满足 ( D ) (A) η<1,β<1 (B) η≤1,β≤1 (C) η<1,β>1 (D) η<1,β≤1或β>110.下图中哪个是理想气体卡诺循环的T-S 图? ( A )11.按下图的路线循环一周,哪种情况环境做的功W 为最大。
物理化学期末考试习题及答案.doc
(B)>, <(D)>, =(A)33.83kJ mol (B)50.81kJ mol (C)-38.83kJ mol (D)-50.81kJ mo0.015K, 已知水的凝固点降(B) 150g m·ol-1(D)200g ·m ol-1NH HCO (s) =NH (g) + CO (g) + H O(g)(B) A 内压力大于 B 内压力(C) B 内压力大于 A 内压力15. 理想气体反应平衡常数K 与K 的关系是∶(C) K x= K c(RT/p ) (D) K x= k c (V/16. 根据某一反应的G 值,下列何者不能确定?(C)在标准状态下系统所能做的最大非膨胀功(D)提高温度与反应速率的变化趋势17. 理想气体CO(g)+2H2 = CH3OH(g)的G 与温度T 的关系G = -21330+52.92T,若要使反应的平衡常数K >1,则应控制的反应温度:(A)必须低于409.3(C)必须低于409.3K18. PCl5 的分解反应是PCl (g) PCl ( g) Cl ( g) ,在473K 达到平衡时,PCl5-(1) lim a (2) lim a_________ ,自由度数为____ ;在25℃时测得体系达到平衡时的压力为66.66 kPa,若此温度时NH3 的分压为13.33 kPa;要使NH3 和H2S 的混合气体系统中不形成NH HS 固体,则应将H S 的分压控制在知此反应在617℃时的平衡常数K = 0.278。
(2) 欲使10 g A g2S 全部被H2 还原,试问最少需要617℃,1.013×10 Pa知识改变命运19. k B/ p B, k B/ p B23 [答] (1) μ(E)-μ(F)=RTln[p (E)/p (F)]W f,max=△G=n△μ=-5.38kJ(2) 物质B 在溶解前后化学势的变化为μ+RTln[p /p ]- μ= RTln[p /p ]W =△G=n△μ=-16.47kJ25. [答] (1)K = x(H2S)/[1-x(H2S)] = 0.278V = nRT/p = 1.356 1 0×m26. Δr G = (-166 732 + 63.01×873.2) Jm·ol = -111 22 Jmol·。
华南农业大学期末考试试卷
华南农业大学期末考试试卷-----------------------作者:-----------------------日期:华南农业大学期末考试试卷(A 卷)一、 填空题(每题2分,10题共20分)1. 通常取晶闸管的断态重复峰值电压 UDRM 和反向重复峰值电压 URRM 中 较小的标值作为该器件的额定电压。
选用时,额定电压要留有一点裕量,一般取额定电压为正常工作时的晶闸管所承受峰值电压的2~3倍。
2. 晶闸管额定电流为100A ,通过半波交流电时,电流的波形系数为K f =1.57,电流的有效值计算为/2m I ,则通过电流最大值m I 为 314 A 。
3. 单相全波可控整流电路中,晶闸管承受的最大反向电压为 1.41 U 2 。
三相半波可控整流电路中,晶闸管承受的最大反向电压为 2.45U 2 。
(电源相电压为U 2)4. 要使三相全控桥式整流电路正常工作,对晶闸管触发方法有两种,一是用 宽脉冲 触发;二是用 双窄脉冲 触发。
5. 单相交流调压电阻性负载电路的移相范围在 0度~ 180度 内,在阻感性负载时移相范围在 功率因素角 ~ 180度 内。
6. 交流调压电路和交流调功电路异同点: 电路结构相同,控制方式不同,(交流调压电路采用移相触发对一个周期内导通角控制,调功电路对导通周波数与阻断周波数的比值进行控制) 。
7. 电压型逆变电路中的反馈二极管的作用是 给交流侧向直流侧反馈的无功能量提供通道 。
8. 变流电路的换流方式有 器件换流 、 电网换流 、 负载换流 、 强迫换流 等四种。
9. 180°导电型三相桥式逆变电路,晶闸管换相是在 同一相上下两个桥臂 元件之间进行;而120º导电型三相桥式逆变电路,晶闸管换相是在 上桥臂或者下桥臂组内 上的元件之间进行的。
10. PWM 逆变电路的控制方法有 计算法 、调制法和 规则采样法 三种。
其中调制法又可分为 同步调制法 、 异步调制法 两种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南农业大学期末考试试卷(A 卷)
学年第一学期 考试科目: 物理化学
考试类型:(闭卷) 考试时间: 120 分钟
学号 姓名 年级专业
一.选择题:(选择一个正确的答案,10×2分)
( )1.对于理想气体,下列关系中哪个是不正确的?
A . 0=⎪⎭⎫ ⎝⎛∂∂T
V U B .
0=⎪⎪⎭⎫
⎝⎛∂∂T p U C . 0=⎪⎭⎫
⎝⎛∂∂V T U D .
0=⎪⎪⎭⎫ ⎝⎛∂∂T
p H
( )2.已知放热反应 H 2 (g) +
2
1
O 2 (g) === H 2O (g) 的△r H m ,下列说法中不正确的是:
A . △r H m 是H 2 (g)的燃烧焓
B . △r H m 与反应的△r U m 数值不等
C . △r H m 是H 2O (g)的生成焓
D . △r H m 是负值
( )3.已知下列反应的平衡常数
H 2 (g) + S (s) === H 2S (g) K 1θ
S (s) +O 2 (g) === SO 2 (g) K 2θ
则反应H 2 (g) +SO 2 (g) === O 2 (g) + H 2S (g) 的平衡常数为: A . K 2θ/K 1θ B . K 1θ-K 2θ C . K 1θ·K 2θ D . K 1θ/K 2θ
( )4.已知反应N2O4 (g) === 2NO2 (g)是吸热反应,反应达平衡时,欲使平衡向右移动以获得更多的NO
2
,应采取的措施是:
A . 升高温度
B . 缩短反应时间
C . 降低温度
D . 延长反应时间
( )5.沸点升高说明在溶剂中加入非挥发性溶质后,该溶剂的化学势比加入溶质前:
A . 升高
B . 降低
C . 相等
D . 不一定
( )6.在273K,封闭的热力学系统,下列关系正确的是:
A . G>A
B . G<A
C . G=A
D . G和A大小不能确定
( )7.一定压反应系统,若产物和反应物的ΔC P>0,则此反应的热效应:
A . 吸热
B . 放热
C . 不一定
D . 无热效应
( )8.非理想气体进行绝热可逆膨胀,正确的是:
A . ΔS>0
B . ΔS=0
C . ΔS<0
D . 不一定
( )9.当实际气体温度低于波义耳温度时,只要压力不太大,则有:
A . PV < nRT
B . PV > nRT
C . PV = nRT
D . PV →0
( )10.由A ,B二组分形成具有最大正偏差液态混合物时,其恒沸点混合
物的组成为x
B =0.45.当对组成为x
B
=0.35的A ,B混合物进行精馏时,
下列说法正确的是:
A . 塔顶产物为B,釜底残液为恒沸点混合物
B . 塔顶产物为A,釜底残液为恒沸点混合物
C . 塔顶产物为恒沸点混合物,釜底残液为B
D . 塔顶产物为恒沸点混合物,釜底残液为A
二.填空题:(25×1分)
1.克劳修斯-克拉佩龙方程的表达式为 , 它是热力学对单组分系统 及 两相平衡的应用. 它忽略凝聚相体积,把蒸气看成 .
2.只有系统的 性质才有偏摩尔量,而偏摩尔量本身是 性质.
3.某气体μ=(∂T/∂p )H <0,经节流膨胀后该气体温度将 .
4.μB α>μB β,则 可以自发地从 相转移到 相.
5.热力学第一定律ΔU=Q+W 的适用条件是 , 热力学第二定律ΔS ≥0作判据时的适用条件是 , 热力学第三定律S m (0K)=0的适用条件是 .
6.理想气体定温可逆膨胀过程:W 0 , Q 0 , △U 0, △H 0, △S 0, △G 0.(填入: > 、= 、< 号)
7.一定温度和压力下,在一定的浓度范围内,溶剂遵守 , 溶质遵守 的溶液称为稀溶液.
8.混合理想气体中任一组分B 的化学势表达式为 ; 理想溶液中任一组分B 的化学势的表达式为 . 9.工业上用乙苯脱氢制苯乙烯)()()(22563256g H g CHCH H C g CH CH H C +⇔ 在900K 及标准压力时转化率为77.4% , 增加压力,则转化率 ; 通入一定量的水蒸气转化率 .( 填入:升高、降低、不变)
三.问答题:(5×5分)
1.由CaCO 3(s),CaO(s),BaCO 3(s),BaO(s)及CO 2(g)构成的平衡系统的自由度为 多少?说明理由.
2.任一封闭系统在终态和始态之间可以设计多个不同的途径,各具体途径的热和功皆不相等,但每个途径的热和功的代数和都相等,原因何在?
3.在绝热,密闭,坚固的容器中发生化学反应,ΔU一定为零,ΔH不一定为零,对吗?说明理由.
4.平衡常数值改变了,平衡一定会移动;反之,平衡移动了,平衡常数值也一定改变,这种说法是否正确?说明理由.
5.某溶液中物质B的偏摩尔体积是否一定等于1mol纯B的体积?为什么?
四.计算题:(10×3分)
1.反应 NH
4HS (s) ==== NH
3
(g) + H
2
S (g) △
r
H
m
θ = 94 KJ·mol-1,(假
设△rH
m θ不随温度而变化),在298K时,NH
4
HS (s)分解后的平衡总压力为0.6
×105 Pa ,
(1)计算298K时,反应的K
p
θ;
(2)计算308K时,NH
4
HS(s)在抽空容器中分解达平衡时,容器中的总压力为多大?
2.Sn 和Pb 的二组分系统有一最低共熔点456K ,最低共熔混合物组成为 W Pb /%=38,Sn 熔点505K ,Pb 的熔点为600K . (1)说明a,b,c,d 各区存在的相态
(1)画出W Pb /%=60,温度为600K 的混合物的步冷曲线;
(2)W Pb /%=60,温度为600K 的混合物100g 冷却,先析出什么物质,最多能析出多少这种纯物质.
Sn Pb W Pb /%→ 0 100 38 600
3.在373.15 K和101325 Pa条件下1mol水气化 , 已知水在此条件下的气化热为40.66 KJ·mol-1 .假定水蒸气可视为理想气体 .试求此过程的Q ,W , ΔU ,ΔH ,ΔS ,ΔA和ΔG.。
