物理化学期末考试试题(1)
物理化学1期末考试试题---样题
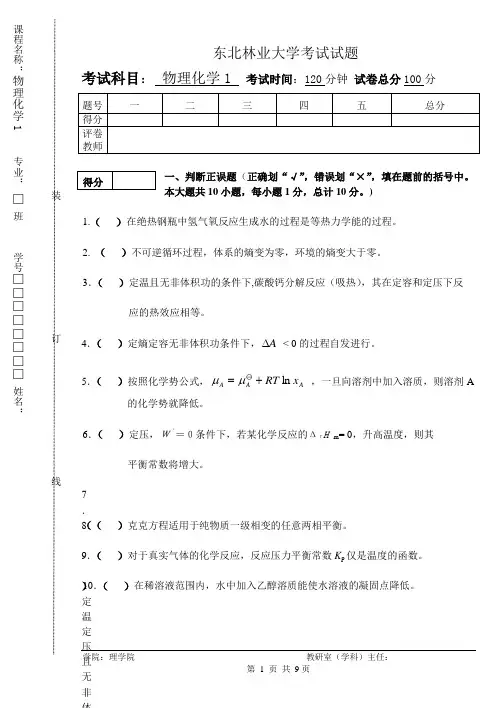
东北林业大学考试试题考试科目: 物理化学1 考试时间:120分钟 试卷总分100分一、判断正误题(正确划“√”,错误划“×”,填在题前的括号中。
本大题共10小题,每小题1分,总计10分。
)1.( )在绝热钢瓶中氢气氧反应生成水的过程是等热力学能的过程。
2. ( )不可逆循环过程,体系的熵变为零,环境的熵变大于零。
3.( )定温且无非体积功的条件下,碳酸钙分解反应(吸热),其在定容和定压下反应的热效应相等。
4.( )定熵定容无非体积功条件下,A ∆ < 0的过程自发进行。
5.( )按照化学势公式,A A A x RT ln +=μμ ,一旦向溶剂中加入溶质,则溶剂A的化学势就降低。
6.( )定压,W‘=0条件下,若某化学反应的ΔrHm = 0,升高温度,则其平衡常数将增大。
7.( )定温定压且无非体积功条件下, 若反应的K 〇 /J 〇< 时,反应向右进行。
8.( )克克方程适用于纯物质一级相变的任意两相平衡。
9.( )对于真实气体的化学反应,反应压力平衡常数K p 仅是温度的函数。
10.( )在稀溶液范围内,水中加入乙醇溶质能使水溶液的凝固点降低。
二、选择题(在每个小题四个备选答案中选出一个正确答案,填在题前的括号中;本大题共10小题,每小题1分,总计10分)1.()下列说法正确的是A.△U S,P<0的过程自发 B. △G >0的过程自发C. △S总>0的过程自发D. △S >0的过程自发2.()克拉佩龙方程适用于A. 任意两相平衡B. 纯物质任意两相平衡C. 纯物质一级相变的任意两相平衡D. 固-气或液气两相平衡3. ()实际气体节流膨胀是A.等焓过程B.等G过程C.等容过程D.等熵过程4.()下列物质在同等条件下,所列熵值的关系,何者正确?A. S(纯铁)> S(碳钢)B. S(纯铁)< S(碳钢)C. S(纯铁)= S(碳钢)D. 不确定5.()25℃时,有一份糖水溶液和一份食盐水溶液,其渗透压分别为Π1和Π2,且Π1=Π2,则糖水溶液浓度c糖和食盐水溶液浓度c盐的关系应为A. c糖>c盐B. c糖<c盐C. c糖=c盐D. 不确定6.()若蒸馏与水完全不互溶的高沸点有机液体,宜采用的方法是:A. 减压蒸馏B.精馏C. 水蒸汽蒸馏D. 萃取2.对于一定量单组份均相系统,由热力学基本方程pdV SdT dA --=可知, ()=∂∂VTA ( ); =⎪⎭⎫⎝⎛∂∂VT p ( )。
《物理化学》期末考试试题及答案(上册)

《物理化学》期末考试试题及答案(上册)《物理化学》练习题⼀、填空题1.理想⽓体经过节流膨胀后,焓____(升⾼,降低,不变)。
2.()0T dH dV =,说明焓只能是温度的函数,与_____⽆关。
3.1molH 2(g )的燃烧焓等于1mol_______的⽣成焓。
4. 物理量Q 、T 、V 、W ,其中属于状态函数的是;与过程有关的量是;状态函数中属于⼴度量的是;属于强度量的是。
5.焦⽿汤姆逊系数J-T µ= ,J-T 0µ>表⽰节流膨胀后温度节流膨胀前温度。
6.V Q U =?的应⽤条件是。
7.热⼒学第⼆定律可表达为:“功可全部变为热,但热不能全部变为功⽽。
8.⽤ΔG ≤0判断过程的⽅向和限度的条件是_________。
9. 热⼒学第三定律的表述为。
10. 写出热⼒学基本⽅程d G = 。
11. 卡诺热机在T 1=600K 的⾼温热源和T 2=300K 的低温热源间⼯作,其热机效率η=___。
12. ⾼温热源温度T 1=600K ,低温热源温度T 2=300K 。
今有120KJ 的热直接从⾼温热源传给低温热源,此过程ΔS =________。
13. 1mol 理想⽓体由298K ,100kpa 作等温可逆膨胀,若过程ΔG =-2983J ,则终态压⼒为。
14. 25°C 时,0.5molA 与0.5molB 形成理想液态混合物,则混合过程的ΔS= 。
15. ⼀定量的理想⽓体经历某种过程变化到终态,若变化过程中pV γ不变,则状态函数(ΔS 、ΔH 、ΔU 、ΔG 、ΔA )中,不变。
16. 在⼀定的温度及压⼒下,溶液中任⼀组分在任意浓度范围均遵守拉乌尔定律的溶液称为___________。
17. 25°C 时,10g 某溶质溶于1dm 3溶剂中,测出该溶液的渗透压Π=0.4000kpa ,该溶质的相对分⼦质量为________18. 氧⽓和⼄炔⽓溶于⽔中的享利系数分别是717.2010Pa kg mol -和811.3310Pa kg mol -,由享利定律系数可知,在相同条件下,在⽔中的溶解度⼤于在⽔中的溶解度。
物化试卷1

物理化学期末考试卷一、选择题1.下列说法中不正确的是……………………………………………………(C)。
(A)生成的新鲜液面都有表面张力(B)平面液体没有附加压力(C)弯曲液面的表面张力的方向指向曲率中心(D)弯曲液面的附加压力指向曲率中心2.同一固体, 大块颗粒和粉状颗粒, 其溶解度哪个大……………………(B)。
(A)大块颗粒大(B)粉状颗粒大(C)一样大(D)无法比较3.当一反应物的初始浓度为0.04 mol·dm-3时,反应的半衰期为360 s,初始浓度为0.024 mol·dm-3时,半衰期为600 s,此反应为…………………………( C )。
(A)零级(B)1.5级(C)2级(D)1 级4. 有一放射性元素,其质量等于8g,已知它的半衰期1/210dt ,则经过40d后,其剩余的重量为………………………………………………………………(C )。
(A)4g (B)2g (C)1g (D)0.5g5. 在300K时,某基元反应的阀能E c=83.68 kJ·mol-1,则有效碰撞的分数值等于………………………………………………………………………………( D )。
(A)3.719×10-14(B)6.17×10-15(C)2.69×10-11(D)2.69×10-156. 某一反应在一定条件下的平衡转化率为25.3%,当有催化剂存在时,其转化率应当是…………………………………………………………………………(C )。
(A)大于25.3% (B)小于25.3% (C)等于25.3% (D)不确定7. 把玻璃毛细管插入水中,凹面下液体所受的压力 p 与平面液体所受的压力 p0相比…………………………………………………………………………( B )。
(A ) p = p0 (B )p < p0 (C )p > p0 (D )不确定8. 298K 时,苯蒸汽在石墨上的吸附符合吸附Langmuir 吸附等温式,苯蒸汽的压力为40Pa ,石墨表面的覆盖度θ=0.05。
物理化学期末考试题及答案pdf

物理化学期末考试题及答案pdf一、选择题(每题2分,共20分)1. 以下哪种物质的摩尔质量与水(H2O)的摩尔质量相同?A. 氢气(H2)B. 二氧化碳(CO2)C. 氨气(NH3)D. 甲烷(CH4)答案:D2. 根据理想气体定律,当温度和压力保持不变时,气体体积与摩尔数的关系是:A. 成正比B. 成反比C. 无关D. 不确定答案:A3. 以下哪种类型的晶体在熔化时不吸收热量?A. 离子晶体B. 分子晶体C. 金属晶体D. 共价晶体答案:D4. 根据吉布斯自由能变化公式,当ΔG < 0时,反应是否自发进行?A. 是B. 否C. 不确定D. 只在特定条件下自发答案:A5. 以下哪种物质在标准状态下不是气体?A. 氧气(O2)B. 氮气(N2)C. 氦气(He)D. 水(H2O)答案:D6. 以下哪种物质的溶解度随温度升高而降低?A. 氯化钠(NaCl)B. 糖(蔗糖)C. 氢氧化钙(Ca(OH)2)D. 硝酸钾(KNO3)答案:C7. 以下哪种类型的电池是可充电电池?A. 干电池B. 铅酸电池C. 锂电池D. 碱性电池答案:B8. 以下哪种物质的pH值小于7?A. 纯水B. 柠檬水C. 牛奶D. 肥皂水答案:B9. 以下哪种物质的导电性最好?A. 玻璃B. 橡胶C. 铜D. 陶瓷答案:C10. 以下哪种物质的比热容最大?A. 水B. 空气C. 铁D. 铝答案:A二、填空题(每题2分,共20分)11. 阿伏伽德罗常数的近似值是 ________ mol^-1。
答案:6.022 x 10^2312. 物质的量浓度(M)的单位是 ________。
答案:mol/L13. 标准大气压(1 atm)的值是 ________ Pa。
答案:1.01325 x 10^514. 理想气体定律的公式是 ________。
答案:PV = nRT15. 热力学第一定律的公式是 ________。
答案:ΔU = Q - W16. 电化学电池的电动势(E)公式是 ________。
《物理化学》下册期末考试试卷A

a 化学专业《物理化学》下册期末考试试卷(1)一、单项选择题(每小题2分,共30分)1、0.001 mol ·kg -1K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3mol ·kg -1(B) 5.0×10-3mol ·kg -1(C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg-12、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( )(A)求难溶盐的溶解度 (B)求弱电解质的解离度(C)求平均活度系数 (D)测电解质溶液的浓度3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1的 NaAc 溶液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( )(A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1≥ γ ±,24、金属与溶液间电势差的大小和符号主要取决于: ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度(C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( )(A) φθ(Na +/ Na) < φ θ(H +/ H 2)(B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ()K O H m291,2∞=4.89×10-2-12mol m S ⋅⋅,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8mol ·kg -1,则该温度下纯水的电导率为( ) (A)3.81×10-9S ·m -1(B )3.81×10-6S ·m -1(C)7.63×10-9S ·m -1(D )7.63×10-6S ·m -17、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ;(C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。
物理化学期末考试题库(上下册)

46、不可逆过程的熵变是不可求的。(×)
47、热不可能从低温物体传向高温物体.(×)
48、单组分体系的偏摩尔量即为摩尔量。
49、热力学温度为0度时,任何纯物质的熵值都等于0.
50、理想溶液混合前后,熵变为0。(×)
51、根据定义,所有体系的广度性质都有加和性质。(×)
A.a点 B.b点 C。c点 D.d点
28、在下,当过冷水蒸气凝结为同温度的水,在该过程中正、负
号无法确定的是( D )
A.B。 C。 D。
29、实际气体的化学势表达式为,其中标准态
化学势为( A )
A.逸度的实际气体的化学势
B.压力的实际气体的化学势
C.压力的理想气体的化学势
D.逸度的理想气体的化学势
79、功可以全部转化为热,但热不能全部转化为功.(×)
80、不可逆过程的熵变是不可求的。(×)
81、某一过程的热效应与温度相除,可以得到该过程的熵变.(×)
82、在孤立体系中,一自发过程由A→B,但体系永远回不到原来状态.(√)
83、绝热过程Q= 0,即,所以dS= 0。(×)
84、可以用一过程的熵变与热温熵的大小关系判断其自发性。(√)
90、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q= 0,所以S=0。×
91、克拉佩龙方程适用于纯物质的任何两相平衡。( )
92、克—克方程比克拉佩龙方程的精确度高.( )
93、 一定温度下的乙醇水溶液,可应用克—克方程式计算其饱和蒸气压。( )
1—2 选择题
1、273K,时,冰融化为水的过程中,下列关系是正确的有(B)
45、理想气体的状态改变了,其内能值:( C )
《物理化学》下册期末考试试卷
《物理化学》下册期末考试试卷a 化学专业《物理化学》下册期末考试试卷(1)⼀、单项选择题(每⼩题2分,共30分)1、0.001 mol ·kg -1K 3[Fe(CN) 6] ⽔溶液的离⼦强度为:() (A) 6.0×10-3mol ·kg -1(B) 5.0×10-3mol ·kg -1(C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg-12、电导测定应⽤⼴泛,但下列问题中哪个是不能⽤电导测定来解决的()(A)求难溶盐的溶解度 (B)求弱电解质的解离度(C)求平均活度系数 (D)测电解质溶液的浓度3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1的 NaAc 溶液的离⼦平均活度系数分别为γ ±,1和γ ±,2,则有 ( )(A) γ ±,1= γ ±,2 (B) γ ±,1>γ ±,2 (C) γ ±,1<γ ±,2 (D) γ ±,1≥ γ ±,24、⾦属与溶液间电势差的⼤⼩和符号主要取决于: ( ) (A) ⾦属的表⾯性质 (B) 溶液中⾦属离⼦的浓度(C)⾦属与溶液的接触⾯积 (D)⾦属的本性和溶液中原有的⾦属离⼦浓度5、⾦属活性排在H 2之前的⾦属离⼦,如Na + 能优先H +在汞阴极上析出,这是由于:()(A) φθ(Na +/ Na) < φθ(H +/ H 2)(B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很⼤的超电势, 以⾄于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ()K O H m291,2∞=4.89×10-2-12mol m S ??,此时(291K)纯⽔中的m (H +) =m (OH -) =7.8×10-8mol ·kg -1,则该温度下纯⽔的电导率为() (A)3.81×10-9S ·m -1(B )3.81×10-6S ·m -1(C)7.63×10-9S ·m -1(D )7.63×10-6S ·m -17、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ;(C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。
《物理化学》期末试卷(一)(附答案)
《物理化学》期末试卷(一)(附答案)物理化学课程考核试卷学年第一学期级专业考核科目物理化学课程类别必修考核类型考试考核方式闭卷卷别 A 一、选择题( 共8题14分) 1. 2 分(0123) 体系的压力p(体系)与环境的压力p(环境)有何关系?()(A) 相等(B) 无关系(C) p(体系)>p(环境)(D) 可逆变化途径中p(体系)=p(环境) 2. 2 分(1232) 关于偏摩尔量,下面的叙述中不正确的是:(A) 偏摩尔量的数值可以是正数、负数和零(B) 溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量(C) 除偏摩尔吉布斯自能外,其他偏摩尔量都不等于化学势(D) 溶液中各组分的偏摩尔量之间符合吉布斯-杜亥姆关系式 3.1 分(0739) 对实际气体的节流膨胀过程,有()(A) ΔH = 0(B) ΔS = 0(C) ΔG = 0(D) ΔU = 04. 2 分(0891) 在kPa下,110℃的水变为110℃水蒸气,吸热Qp,在该相变过程中下列哪个关系式不成立? ()(A) ?S体> 0(B) ?S环不确定(C) ?S体+?S环> 0(D) ?S环 5. 1 分(2842) 2842 在等温等压下,当反应的ΔrG m= 5 kJ?mol-1时,该反应能否进行?()(A) 能正向自发进行(B) 能逆向自发进行(C) 不能判断(D) 不能进行 6.2 分(0392) 某化学反应在恒压、绝热和只作体积功的条件下进行,体系的温度T1升高到T2, 则此过程的焓变ΔH:()$(A) 小于零(B) 等于零(C) 大于零(D) 不能确定7. 2 分(0459) 石墨(C)和金刚石(C)在25℃, 101 325 Pa下的标准燃烧焓分别为- kJ·mol-1和- kJ·mol-1,则金刚石的标准生成焓ΔfHm(金刚石, 298 K)为:()(A) - kJ·mol-1 (B) - kJ·mol-1(C) - kJ·mol-1(D) kJ·mol-18.2 分(2640) 恒沸混合物在气、液两相平衡共存时的自度为:()(A)0(B)1(C)2(D)3二、填空题( 共12题26分) 9. 5 分(3310) 按照Stevenson 等人的工作,异构化反应:环己烷(l) =甲基环戊烷(l)的平衡常数可以用如下的方程式表示:$lnK p$= - 2059 K/T= _________ J?mol-1 $则25℃的Δ$rHmΔrS m= _________ J?K-1?mol-110. 2 分(0079) 0079 10 mol单原子理想气体,在恒外压?下400 K,2p?等温膨胀至?,物体对环境作功kJ。
物理化学期末考试试卷
一、选择题1. CaCl 2摩尔电导率 Λm 与其离子的摩尔电导率 λm 关系为(D )(A)Λm (CaCl 2)= λm (Ca 2+)+λm (Cl -) (B) Λm (CaCl 2)=1/2λm (Ca 2+)+λm (Cl -)(C) Λm (CaCl 2)= λm (1/2Ca 2+)+λm (Cl -) (D) Λm (CaCl 2)= 2[λm (1/2Ca 2+)+λm (Cl -)] 2.下列示意图描述了原电池和电解池中电极的极化规律,其中表示原电池阳极的是(A )A 曲线1B 曲线2C 曲线3D 曲线43.某反应进行时,反应物浓度与时间成线性关系,则次反映之半衰期与反应物最初浓度有何关系(C ) A 无关 B 成正比 C 成反比 D 平方成反比4. 浓度为m B 的H 3PO 4溶液,其平均离子活度系数为γ±,则H 3PO 4的表现活度a B 可表示为(D )(A)a B =4γ±(m B /m θ)4 (B) a B =4γ±(m B /m θ) (C) a B =27γ±(m B /m θ) (D) a B =27γ4±(m B /m θ)45.对峙反应A B ,当温度一定时,由纯A 开始反应,有下列几 种说法:1)、达到平衡时。
正向速率常数等于逆向速率常数。
2)、达到平衡时,正向速率常数与逆向速率常数之比为一确定的常数。
3)、反应进行的净速率是正、逆反应速率之差。
4)、反应的总速率是正逆反应速率之和。
其中准确的是:(B.C) 6. 下列反应AgCl(s)+I -→AgI(s)+ Cl -其可逆电池表达式为( D )A AgI(s)| I -| Cl - |AgCl(s)∥B AgI(s)| I -∥Cl -|AgCl(s)C Ag (s),AgCl(s)| Cl -∥I - |AgI(s), Ag (s)D Ag (s),AgI(s)| I -∥Cl -AgCl(s), Ag (s) 7、某反应的活化能是33 kJ/mol ,当T=300K 时,温度增加1k ,反应速率常数增加的百分数约为:A). (A)4.5% (B)9.4% (C) 11% (D) 50%。
物理化学期末考试试题
物理化学期末考试试题一、选择题(每题2分,共20分)1. 在物理化学中,下列哪个量是状态函数?A. 热量B. 功C. 熵D. 温度2. 根据热力学第一定律,下列哪个表达式是正确的?A. ΔU = Q + WB. ΔH = Q - WC. ΔG = ΔH - TΔSD. ΔS = Q/T3. 理想气体状态方程是:A. PV = nRTB. PV = nRC. PV = RTD. PV = nT4. 一个化学反应在恒温恒压下进行,其反应焓变与反应熵变的关系是:A. ΔH = ΔG + TΔSB. ΔG = ΔH - TΔSC. ΔS = ΔH/TD. ΔG = ΔS - TΔH5. 根据范特霍夫方程,下列哪个描述是错误的?A. ΔG = ΔH - TΔSB. ΔG = ΔG° + RT ln(Q)C. ΔG° = -RT ln(K)D. ΔH° = ΔG° + RT ln(K)二、简答题(每题10分,共30分)6. 简述理想气体的微观模型,并解释其基本假设。
7. 解释什么是化学平衡常数,并说明它如何随温度变化。
8. 描述吉布斯自由能的概念,并解释它在化学反应中的应用。
三、计算题(每题25分,共50分)9. 已知一个理想气体在298K时的摩尔体积为22.4L/mol,求其在1atm压力下的摩尔数。
10. 假设一个化学反应在298K下进行,其标准生成焓ΔH°为-50kJ/mol,标准生成熵ΔS°为0.02kJ/(mol·K),求该反应在1atm 和1M浓度下的吉布斯自由能变化ΔG。
四、论述题(共30分)11. 论述温度对化学反应速率的影响,并给出一个具体的化学反应例子来解释这一现象。
12. 讨论在实际工业过程中,如何通过控制反应条件来优化化学反应的产率和选择性。
五、实验题(共30分)13. 设计一个实验来测定某一固体物质的热容,并说明实验步骤、所需设备和预期结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学期末考试试题(1)《物理化学》上册期末试卷本卷共 8 页第1页 《物理化学》上册期末试卷本卷共 8 页第2页化学专业《物理化学》上册期末考试试卷(1)(时间120分钟)一、单项选择题(每小题2分,共30分)1、对于内能是体系状态的单值函数概念,错误理解是( ) A 体系处于一定的状态,具有一定的内能B 对应于某一状态,内能只能有一数值不能有两个以上的数值C 状态发生变化,内能也一定跟着变化D 对应于一个内能值,可以有多个状态2、在一个绝热刚瓶中,发生一个放热的分子数增加的化学反应,那么( ) A Q > 0,W > 0,∆U > 0 B Q = 0,W = 0,∆U < 0C Q = 0,W = 0,∆U = 0D Q < 0,W > 0,∆U < 03、一种实际气体,其状态方程为PVm=RT+αP (α<0),该气体经节流膨胀后,温度将( )A 、升高B 、下降C 、不变D 、不能确定4、在隔离体系中发生一个自发过程,则ΔG 应为( )A. ΔG < 0B. ΔG > 0C. ΔG =0D. 不能确定5、理想气体在绝热条件下,在恒外压下被压缩到终态,则体系与环境的熵变( )A 、ΔS 体>0 ΔS 环>0B 、ΔS 体<0 ΔS 环<0C 、ΔS 体>0 ΔS 环<0D 、ΔS 体>0 ΔS 环=06、下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关( )(A ). S 、G 、F 、C V (B) U 、H 、P 、C V (C) G 、F 、H 、U (D) S 、U 、H 、G7、在N 个独立可别粒子组成体系中,最可几分布的微观状态数t m与配分函数q 之间的关系为 ( )(A) t m = 1/N ! ·q N (B) t m = 1/N ! ·q N ·e U /kT (C) t m = q N ·e U /kT (D) t m = N ! q N ·e U /kT8、挥发性溶质溶于溶剂形成的稀溶液,溶液的沸点会( )A 、降低B 、升高C 、不变D 、可能升高或降低9、盐碱地的农作物长势不良,甚至枯萎,其主要原因是( )A 、天气太热B 、很少下雨C 、水分倒流D 、肥料不足 10、在恒温密封容器中有A 、B 两杯稀盐水溶液,盐的浓度分别为c A 和c B (c A > c B ),放置足够长的时间后( )(A) A 杯盐的浓度降低,B 杯盐的浓度增加 ; (B) A 杯液体量减少,B 杯液体量增加 ; (C) A 杯盐的浓度增加,B 杯盐的浓度降低 ; (D) A 、B 两杯中盐的浓度会同时增大 。
11、298K 、101.325kPa 下,将50ml 与100ml 浓度均为1mol·dm -3 萘的苯溶液混合,混合液的化学势μ为:( ) (A) μ = μ1 + μ2 ; (B) μ = μ1 + 2μ2 ; (C) μ = μ1 = μ2 ; (D) μ = ⅓μ1 + ⅔μ2 。
12、硫酸与水可组成三种化合物:H 2SO 4·H 2O (s )、H 2SO 4·2H 2O (s )、H 2SO 4·4H 2O(s ),在P θ下,能与硫酸水溶液共存的化合物最多有几种( ) A 、1种 B 、2种 C 、3种 D 、4种13、A 与B 可以构成2种稳定化合物与1种不稳定化合物,那么A 与B 的体系可以形成几种低共熔混合物( )A 、5种B 、4种C 、3种D 、2种14、对反应CO(g)+H 2O(g)=H 2(g)+CO 2(g) ( )(A) K p $=1 (B) K p $=K c (C) K p $>K c (D) K p $<K c15、 一定温度下,一定量的 PCl 5(g)在某种条件下的解离度为α,改变下列条件,何者可使α增大?( )题号 一 二 三 四五 六 七 八 得分得分得分评卷人 复核人学院: 年级/班级: 姓名: 学号:装 订 线 内 不 要 答 题(A) 增加压力使体积缩小一倍(B) 体积不变,通入N2气使压力增大一倍(C) 压力不变,通入N2气使体积增大一倍(D) 体积不变,通入Cl2气使压力增大一倍《物理化学》上册期末试卷本卷共 8 页第1页《物理化学》上册期末试卷本卷共 8 页第2页《物理化学》上册期末试卷本卷共 8 页第7页 《物理化学》上册期末试卷本卷共 8 页第8页二、填空题(每空1分,共10分)1、理想气体在定温条件下向真空膨胀,△H 0,△S 0。
(填>,=,<)2、1mol 理想气体体积由V 变到2V ,若经等温自由膨胀,△S 1= J ·K -1,若经绝热可逆膨胀△S 2= J ·K -1。
3、对于理想气体, 0,TV U ⎪⎭⎫ ⎝⎛∂∂ 0。
4、298 K 时,A ,B 和C 彼此不发生化学反应。
三者所成的溶液与固相A 和由B 和C 组成的气相同时平衡,则该体系的自由度f 为 ,平衡共存的最大相数Φ为 ,在恒温条件下如果向溶液中加组分A ,则体系的压力将 。
若向溶液中加入B ,则体系的压力将 。
一、单项选择题(共30分,每小题2分) 1、C 2、C 3、B 4、D 5、D 6、B7、C 8、D 9、C10、A 11、C 12、B 13、C 14、B15、C二、填空题(共10分,每空1分)1、=,>2、5.76,03、<,=4、2,5, 不变,升高三、证明题(共10分)证明:由于P 、V 、T 恒是正值,故0)(<∂∂H PS。
三、证明题(共10分)分分7)(,)(;)()(,0)()()(3..........1)()()(),(V PT S H dP P H dS S H dH TVSHPPSSP P S P S f S P S P P S H P S H =∂H∂=∂∂∂∂+∂∂=<-=∂∂∂H ∂-=∂∂∴-=∂H ∂H ∂∂⋅∂∂∴=H ΘΘ得分 评卷人 复核人得分 评卷人 复核人Tp S ⎪⎪⎭⎫ ⎝⎛∂∂四、绘图题(共10分)AgCl与LiCl体系不形成化合物,属于固态部分互溶体系。
在480℃时,熔融体与分别含15%及30%AgCl的固熔体成平衡;AgCl与LiCl的熔点分别为455℃和610℃。
(1)绘制该体系的相图(以t℃--w%表示)(2)标出相图中各相区的相态。
1--l2—а+l3--а4--а+β--β—β+l五、计算题(共40分)1、(10分)298.15K,Pθ下,C金刚石和C石墨的摩尔熵分别为2.45和5.71 J·K-1·mol-1,其燃烧焓分别为-395.40和-393.51 KJ·mol-1,其密度分别为3513和2260 ㎏·m-3。
求①在298.15K,Pθ下,石墨→金刚石的ΔrGmθ,并判断哪一种晶形稳定;②若用增加压力使石墨变成金刚石,则需要加多大压力?1、(10分)①C石墨→C金刚石ΔrHmθ=-∑γBΔcHmθ=1.89 KJ·mol-1ΔrGmθ=ΔrHmθ-TΔrSmθ=2.862 得分评卷人复核人《物理化学》上册期末试卷本卷共 8 页第7页《物理化学》上册期末试卷本卷共 8 页第8页《物理化学》上册期末试卷本卷共 8 页第7页 《物理化学》上册期末试卷本卷共 8 页第8页KJ ·mol -1 ∵ΔrGm θ>0 ∴石墨稳定(5分) ② ∵V PG T ∆=∂∆∂)( ∴ΔrGmθ(2)=ΔrGmθ(1)+ΔV (P 2-P 1)ΔrGm θ(2)=2862+(12×10-3/3513-12×10-3/2260)(P 2-101325)解得P 2>1.52×109Pa (15000 Pθ)(5分)2、(10分)一个含有N A 个独立可别的粒子体系,每一粒子都可处于能量分别为ε0和ε1的两个最低相邻的能级之一上,设两个能级皆为非简并的。
若ε0=0时,求:①粒子的配分函数;②体系能量的表达式;③讨论在极高温度和极低温度下,体系能量的极限值。
2、(10分)① q=∑exp (-εi /kT )=110///1kT kT kTe e e εεε---+=+ (2分)② U=NV A TnqkT N .2)(∂∂λ=⎥⎦⎤⎢⎣⎡⋅⋅+--21/21111kT e e kT N kTkTA εεε=)1(//11kTkTA e e N εε--+ε1 (4分)③ 极高温度:kT 》ε1 即1/kT e ε-→1 ∴U=1/2N A ε1极低温度:kT 《ε1即1/kT eε-→0∴ U=0 (4分)3、(10分)1molCH 3C 6H 5在其沸点383.15K 时蒸发为气,求该过程的Q 、W 、Δvpa U m θ、Δvap H m θ、Δvap G m θ、Δvap F m θ和Δvap S m θ。
已知该温度下CH 3C 6H 5的气化热为362kJ ·kg -1。
3、(10分)公式正确、结果错误给一半分,没有注单位共扣1分甲苯的摩尔质量M = 0.09214kg ·mol -1。
Q p=0.09214×362=33.35kJ1分Δvap H mθ= Q p /n = 33.35kJ ·mol -11分W = p(V g -V l )≈pV g = nRT = 8.314×383.2 = 3186J =3.186kJ2分 Δvpa U m θ= Q -W = 33.35-3.186 = 30.16kJ ·mol -11分 Δvap G mθ= 0《物理化学》上册期末试卷本卷共 8 页第7页 《物理化学》上册期末试卷本卷共 8 页第8页1分Δvap F mθ= -W R = - 3.186 kJ ·mol -12分Δvap S m θ= Q R /nT = Q p /nT = 33.35×103/383.2 = 87.03 J ·K -1·mol -12分4、(10分)25℃时,溴(2) 在CCl 4(1) 中的浓度为x 2 = 0.00599时,测得溴的蒸气压p 2 = 0.319kPa ,巳知同温下纯溴的蒸气压为28.40kPa ,求:⑴ 以纯溴为标准态,溶液中溴的活度与活度系数是多少; ⑵ 以无限稀CCl 4溶液中x 2→1符合亨利定律的状态为标准态,求溶液中溴的活度与活度系数,巳知亨利常数为K x = 53.86 kPa 。
